Верхние югулярные лимфоузлы это

Журнал “SonoAce Ultrasound”
Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.
Введение
Одним из нерешенных вопросов клинической медицины является оценка состояния различных групп лимфатических узлов. Это относится как к лимфатическим узлам, расположенным в брюшной полости и забрюшинном пространстве, так и группам лимфатических узлов, имеющих поверхностное расположение и доступных пальпаторной оценке. Согласно данным Gritcman, при выявлении метастазов в лимфатические узлы шеи показатели чувствительности, специфичности и точности метода пальпации составляют 69, 87 и 80%. При УЗИ эти показатели состаляют 92, 84 и 89% соответственно [1]. Для сравнения – чувствительность КТ в диагностике метастатического поражения шейных лимфатических узлов составляет 75-85%, МРТ – 84-85% [2-4]. Улучшить диагностические возможности эхографии позволило сочетание ее с тонкоигольной биопсией. При этом показатели чувствительности составили 96%, специфичности 94% и точности – 88% [5]. Данная работа посвящена проблеме диагностики доброкачественных аденопатий шеи – зоны цервикальных (глубоких яремных, югулярных) лимфатических узлов.
Лимфатические узлы представляют собой коллекторные органы, которые принимают участие в процессах обеззараживания организма и расположены в местах слияния нескольких лимфатических сосудов. Лимфатические узлы претерпевают структурные изменения на протяжении всей жизни человека. С момента рождения и до 12 лет лимфатические узлы находятся в стадии своего формирования. Затем наступает длительный период функциональной активности, который в старости заканчивается инволюцией лимфатического узла. При активизации лимфатического узла на фоне воспаления либо за счет других процессов происходит перестройка его внутренней структуры, увеличение размеров, при этом лимфатические узлы становятся пальпируемыми. Данное состояние лимфатических узлов клинически трактуется как аденопатия (лимфадениты). Доброкачественные аденопатий могут сопровождаться повышенной выработкой нормальных лимфоцитов, усилением васкуляризации, отеком либо замещением структур лимфатического узла на соединительную или жировую ткань [6].
Для того чтобы правильно определить тактику лечения больных с аденопатиями необходимо знать природу процесса – доброкачественная или злокачественная. При этом необходимо знать варианты эхографического изображения различных доброкачественных изменений лимфатических узлов.
Материалы и методы
Для изучения эхографической картины доброкачественных процессов в лимфатических узлах нами обследовано 326 пациентов с клинически определяемыми аденопатиями (в возрасте от 18 до 36 лет). Из них были выделена группа в 100 человек с доброкачественными изменениями в лимфатических узлах (в группу оценки умышленно не включались доброкачественные аденопатии при туберкулезном поражении и другой специфической инфекции лимфатических узлов).
После пальпаторного выявления измененных лимфатических узлов их дальнейший анализ осуществлялся на основании данных ультразвукового и морфологического (цитологического и гистологического) заключения. Пальпаторную оценку проводил врач-онколог. Морфологическое заключение было получено на основании цитодиагностики после тонкоигольной биопсии (45 случаев). У остальных пациентов подтверждение доброкачественности процесса было клиническим (динамическое наблюдение сроком 1-3 месяца).
Ультразвуковое исследование проводили на различных ультразвуковых аппаратах среднего и высокого класса. Эхографическое заключение давал специально обученный диагност.
За основу УЗ оценки были приняты следующие критерии:
- форма лимфатического узла (овальная, шаровидная, неправильная);
- дифференциация области ворот лимфатического узла (есть/нет изображение);
- состояние коры лимфатического узла (кортикальный слой узкий/широкий гипоэхогенный);
- общая эхогенность лимфатического узла (повышенная, средняя, низкая);
- дифференциация составных частей лимфатического узла (есть/нет);
- соотношение поперечного и переднезаднего диаметров лимфатического узла (более 1, менее 1, равно 1) (J.N. Bruneton 1995) [7].
Из группы лиц с доброкачественной аденопатией визуализировано 217 лимфатических узлов. При этом как правило выявлялось более двух лимфатических узлов на одной из сторон шеи.
Практически во всех случаях дифференцировали лимфатический узел Кютнера (югулодигастральный), расположенный на границе средней и верхней трети шеи. Выявляемые лимфатические узлы имели размеры от 0,5 х 0,2 см до 2,3 х 0,8 см. УЗ-оценку производили после полипозиционного осмотра и нахождения самой длинной горизонтальной оси, что и принимали за максимальный поперечный диаметр. Большая часть лимфатических узлов (187) имели овальную форму с соотношением поперечного/переднезаднего более 1 (рис. 1 – 3). Тенденцию к округлению имели 30 лимфатических узлов, соотношение поперечного/переднезаднего приближалось к 1.


Рис. 1. УЗ-томограмма увеличенного реактивно измененного лимфатического узла: а – на фоне аденовирусной инфекции, б – после проведения противовоспалительного лечения

Рис. 2. Эхографическое изображение непальпируемого югулярного лимфатического узла на фоне остаточных явлений после перенесенного фарингита.

Рис. 3. Эхографическое изображение непальпируемого югулярного лимфатического узла без четкой клинической симптоматики воспалительного процесса в области головы и шеи.
Мы установили, что, как правило, более округлая конфигурация лимфатического узла при его размерах, превышавших 10 мм, сопровождалась небольшими болевыми ощущениями, и более выраженной простудной (воспалительного характера) симптоматикой. Лимфатические узлы менее 10 мм чаще всего плохо пальпировались, либо вообще не выявлялись пальпаторно. Во всех случаях эхографически хорошо дифференцировался гипоэхогенный кортикальный слой и широкое, средней или чуть ниже средней эхогенности изображение области ворот лимфатических узлов. Четкость дифференциации составных частей лимфатического узла была снижена при размерах менее 5 мм. Мы отмечали различную толщину гипоэхогенного изображения области коры лимфатического узла: от очень широкой – при выраженности или прогрессировании воспалительного процесса, до узкой – на фоне положительной динамики.
В группе доброкачественных аденопатий во всех случаях при УЗ-контроле через 1 месяц выявлявшиеся ранее лимфатические узлы не дифференцировались. При этом у 20 человек с выявленной аденопатией не было симптоматики простудных заболеваний, у 70 человек с доброкачественной аденопатией в момент обследования были установлены небольшие простудные явления (35 человек с ощущением першения в горле, 17 с небольшим насморком, у 18 человек остаточные явления перенесенного ранее острого респираторного заболевания). Большинство пациентов не проводили никакого специального противовоспалительного лечения, в то же время 16 человек принимали различные антибиотики широкого спектра действия. Независимо от проведения либо отсутствия, какой либо терапии лимфатические узлы переставали дифференцироваться при УЗИ в течение 5-7 дней с момента начала наблюдения. При этом нами отмечено, что на фоне медикаментозной терапии лимфатические узлы становились невидимыми при эхографии раньше (на 3-5 день с момента начала лечения).
Особую группу доброкачественных аденопатий составили 10 пациентов с воспалением легких, протекавшем на фоне ВИЧ инфекции.
Мы выявили совершенно другую УЗ-картину состояния пальпируемых лимфатических узлов при динамической оценке у больных с синдромом иммунодефицита. Оцениваемые лимфатические узлы имели эхографические признаки доброкачественного процесса, в большинстве наблюдений их размеры превышали 2-2,5 см. При этом во всех случаях дифференцировались составные части лимфатического узла. Определялся узкий кортикальный слой и широкая гиперэхогенная сердцевина при сохранении овальной конфигурации и соотношении поперечного/переднезаднего более 1.
При повторных УЗ осмотрах на фоне массированной противовоспатительной терапии было отмечено увеличение числа лимфатических узлов вовлеченных в процесс активизации. При этом заметной перестройки эхоструктуры и уменьшения размеров в наблюдаемых лимфатических узлах отмечено не было (рис 4).


Рис. 4. Варианты изображения увеличенного лимфатического узла с УЗ-признаками доброкачественной аденопатии у больного с синдромом иммунодефицита.
Таким образом, на основании полученных данных можно сделать следующие выводы:
- в ответ на воспалительные (микробной или вирусной этиологии) процессы лимфатические узлы отвечают изменением эхоструктуры в виде улучшения четкости дифференциации лимфатических узлов на фоне окружающих тканей. При этом отмечается увеличение толщины гипоэхогенного изображения коры лимфатического узла. Гиперэхогенное изображение области ворот сужено. Процесс выздоровления (возвращение лимфатического узла в состояние покоя на фоне медикаментозной терапии или за счет собственных защитных сил) характеризуется сначала уменьшением толщины корковой части и общих размеров лимфатического узла, а затем практически полным отсутствием его дифференциации с окружающими тканями;
- у больных с воспалительными процессами на фоне синдрома иммунодефицита не было отмечено УЗ признаков активизации коры, что в контрольной группе проявлялось увеличением толщины области ворот и тенденцией к округлой конфигурации. При динамическом наблюдении УЗ-картина свидетельствовала о вовлечении в процесс все новых лимфатических узлов. “Старые” же лимфатические узлы на фоне проводимой терапии не имели УЗ признаков положительной динамики.
Следовательно, эхография позволяет не только выявлять доброкачественные изменения лимфатических узлов, но и оценивать положительную или отрицательную динамику изменения эхоструктуры лимфатического узла в ответ на медикаментозную терапию или собственную сопротивляемость организма.
Литература
- Greetzman W., Chembirek H., Hajek P. et al. Sonographische hals anatomie und betendung beim lymphkoten staging von Koph-Hals-Malignomen. Stuttgart; N.Y.; S.G. Thieme Verlag. 1987. p.146.
- Feinmesser R., Freedman I.L., Noyek A.M., et al. Metastatic neck disease: a clinical radiographic patologic correlative study. Arch. Otolaryngol.Head Neck Surg. 113:1307-1310, 1987.
- Stem W.B.R, Silver C.E., Zeifen B.A. et al. Computed tomography of the clinically negative neck. Head Neck 12:109-113, 1990.
- Van den Brekel M.W.M., Casteliging I.A., Croll G.A. et al. Magnetic resonance imaging US. Palpation of cervical lymph node metastasis. Arch. Otolaryngol.Head Neck Surg. 117:666-673, 1991
- Takashima Sh., Sone S., Nomura W. et al. Nonpalpable lymphatic nodes of the neck: assessment with US and US-guided fine-needle aspiration biopsy. J. of clinical ultrasound V.25.N6, July/August 1997.
- Заболотская Н.В. Ультразвуковая томография при заболеваниях лимфатической системы/Ультразвуковая диагностика в акушерстве, гинекологии и педиатрии. – 1993. – N2. С.133-142.
- Brunetone L., Rubaltelli., Solbiati L. Lunph nodes. In:Ultrasound of superficial structures. Ed by Solbiati L., Rizzetto G. p.279-303.

Журнал “SonoAce Ultrasound”
Содержит актуальную клиническую информацию по ультрасонографии и ориентирован на врачей ультразвуковой диагностики, выходит с 1996 года.
Источник
Шейные лимфатические узлы являются частым местом метастазирования злокачественных опухолей, первичный очаг которых располагается в области головы и шеи. К ним, например, относятся плоскоклеточный рак верхних отделов дыхательных путей, а также метастазы рака слюнных желез и щитовидной железы.
Наиболее распространенным клиническим признаком является увеличивающееся образование шеи, которое обычно обнаруживается пациентом или его врачом. При подозрении на метастатическое поражения лимфатических узлов шеи для диагностики и определения наилучшей тактики лечения потребуется осмотр врачом-онкологом, инструментальные методы и биопсия.
Иногда новообразования вне области головы и шеи могут неожиданно метастазировать в шейные лимфатические узлы, что требует особенно тщательной диагностики для выявления первичного очага.
Лечение будет зависеть от типа и локализации первичной опухоли, которая распространилась в лимфатические узлы шеи, и, скорее всего, будет включать в себя комбинацию хирургического вмешательства, лучевой терапии и/или химиотерапии.
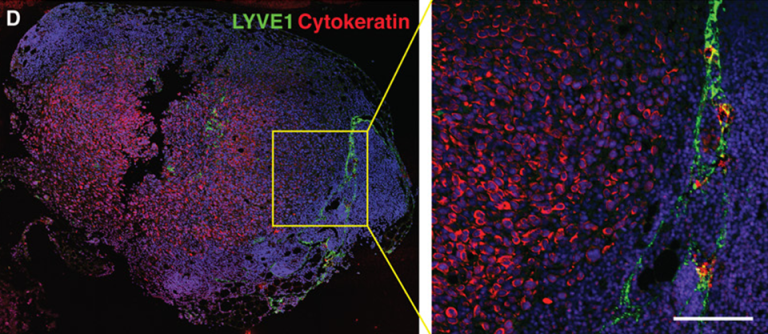
Иммунофлюоресцентная визуализация метастатических клеток меланомы (красные) внутри лимфатических сосудов (зеленые). Масштабная линейка: 100 мкм
(Science Advances/Michael Detmar Group ©)
Из чего состоит лимфатическая система шеи
Лимфатическая система шеи включает в себя сосуды и узлы.
Сосуды:
Лимфатические капилляры — это тонкостенные структуры, состоящие из одного слоя эндотелиальных клеток. Они находятся во всех тканях организма и, объединяясь друг с другом, способствуют оттоку лимфатической жидкости в более крупные лимфатические сосуды.
Стенка лимфатических сосудов состоит из трех слоев: внутреннего слоя эндотелиальных клеток, среднего мышечного слоя и внешнего слоя соединительной ткани. В лимфатических сосудах гораздо больше клапанов, чем в венозных, при этом циркуляция лимфы полностью зависит от сжатия сосудов окружающими мышцами. Лимфатические сосуды дренируют лимфу в лимфатические узлы.
Узлы:
В среднем на каждой стороне шеи расположено до 75 лимфатических узлов. Снаружи узел покрывает капсула, под которой располагается субкапсулярные синусы – место куда попадает лимфатическая жидкость из приносящих лимфатических сосудов. Жидкость проходит сквозь ткань лимфатического узла, которая состоит из коркового и мозгового вещества, а затем выходит через ворота лимфатического узла и попадает в отводящие лимфатические сосуды. В итоге лимфа попадает в венозную систему в месте соустья внутренней яремной и подключичной вены.
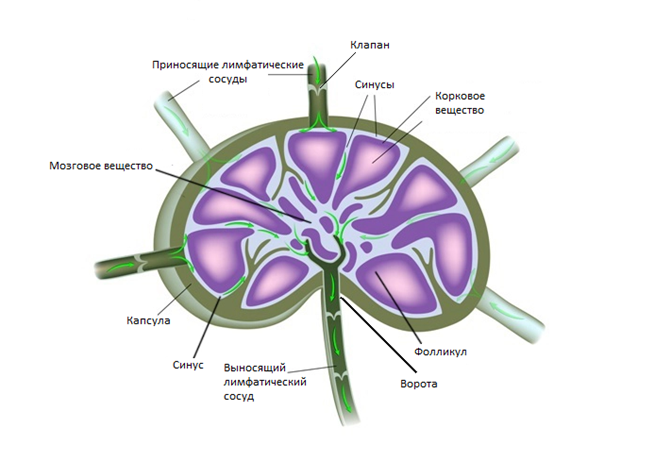
Анатомическая структура лимфатического узла (Alila Medical Media/ Shutterstock ©)
Классификация лимфатических узлов шеи
На данный момент во всем мире рекомендована к использованию классификация Американского объединенного комитета по раку (American Joint Committee on Cancer (AJCC)) 8 издания от 2018 года:
- Уровень I (IA и IB): подбородочные и поднижнечелюстные лимфатические узлы;
- Уровень II (IIA и IIB): верхняя яремная группа (делится на 2 подуровня, границей между которыми является добавочный нерв);
- Уровень III: средняя яремная группа;
- Уровень IV: нижняя яремная группа;
- Уровень V (VА и VB): лимфатические узлы заднего треугольника шеи;
- Уровень VI: передние шейные лимфатические узлы;
- Уровень VII: верхние медиастинальные лимфатические узлы.

Уровни лимфатических узлов шеи (Tenese Winslow LLC ©)
Диагностика
Осмотр
При пальпации шеи врач обращает внимание на расположение, размер, плотность и подвижность каждого узла. Особое внимание уделяется узлам, которые кажутся фиксированными к подлежащим сосудисто-нервным структурам и внутренним органам. Описание каждого узла становится важной частью медицинской документации, которая в дальнейшем может использоваться для оценки эффекта лечения.
Лучевые методы
- Ультразвуковое исследование
Преимуществами УЗИ перед другими методами визуализации являются цена, скорость исследования и низкая лучевая нагрузка на пациента.
Ультразвуковыми признаками метастатического поражения лимфатических узлов может быть образование сферической формы, нарушение структуры, нечеткие границы, наличие центрального некроза и др.
Поскольку не всегда по УЗИ можно с уверенностью сказать является лимфатический узел пораженным или нет, иногда одновременно выполняют тонкоигольную аспирационную биопсию под ультразвуковым контролем с последующим цитологическим исследованием материала из этого узла. Результат цитологического исследования зависит от навыков врача УЗИ и качества образца (т.е. наличия достаточного количества репрезентативных клеток).
- Компьютерная томография
С появлением систем высокого разрешения и специальных контрастных веществ КТ позволяет обнаруживать лимфатические узлы, которые могли быть пропущены при иных методах диагностики.
- Магнитно-резонансная томография
Ценность МРТ – превосходная детализация мягких тканей. МРТ превосходит КТ в качестве предпочтительного исследования при оценке ряда новообразований головы и шеи, таких как основание языка и слюнные железы. Размер, наличие нескольких увеличенных узлов и центральный некроз – критерии, общие для протоколов исследования КТ и МРТ.
- Позитронно-эмиссионная томография
Этот новый метод визуализации все чаще используется для определения стадии опухолей головы и шеи. Метод основан на поглощении 2-фтор-2-дезокси-D-глюкозы (ФДГ) метаболически активными тканями. Исследование также может быть объединено с КТ, чтобы улучшить разрешение получаемого изображения и более точно определить расположение образования.
Биопсия
Биопсия — это удаление небольшого кусочка ткани для исследования под микроскопом или для тестирования в лаборатории на предмет наличия признаков злокачественности. В подавляющем большинстве случаев проводится тонкоигольная аспирационная биопсия. Врач, выполняющий биопсию, может использовать УЗИ или КТ для выполнения процедуры. Иногда тонкоигольная аспирационная биопсия не позволяет поставить окончательный диагноз, и требуются другие виды биопсии, такие как трепан-биопсия или эксцизионная биопсия.
План лечения
После определения диагноза и проведения всех диагностических исследований врач порекомендует оптимальный для пациента курс лечения. В конечном итоге лечение метастатического поражения лимфатических узлов зависит от типа и локализации первичной опухоли.
Существует три различных варианта лечения, которые могут быть использованы отдельно или в комбинации:
- хирургическое вмешательство,
- лучевая терапия,
- химиотерапия.
Хирургическое лечение
Хирургическое лечение обычно включает удаление лимфатических узлов шеи (лимфодиссекция) и последующее гистологическое исследование для точного определения стадии, так как это может существенно повлиять на дальнейшую тактику лечения. Хоть и не всегда, но чаще всего лимфодиссекция выполняется одновременно с удалением первичной опухоли.
Существуют различные виды лимфодиссекций:
- радикальная лимфодиссекция: удаление всех лимфоузлов, удаление внутренней яремной вены, удаление мышц и нервов;
- модифицированная радикальная лимфодиссекция: удаление всех лимфоузлов с сохранением мышц. Нервы и/или внутренняя яремная вена могут быть удалены;
- селективная лимфодиссекция: удаление только определенных групп лимфоузлов.
Лучевая терапия
Лучевая терапия может быть назначена в качестве самостоятельного метода лечения в послеоперационном периоде, чтобы снизить вероятность рецидива либо в комбинации с химиотерапией в качестве самостоятельного или адъювантного лечения. Обычно адъювантная лучевая терапия необходима, если по результатам гистологического исследования обнаруживается несколько пораженных лимфатических узлов.
Химиотерапия
Химиотерапия обычно добавляется к лучевой терапии в качестве самостоятельного или адъювантного (послеоперационного) лечения. В некоторых случаях может использоваться индукционная химиотерапия с целью уменьшения объема образования и последующего хирургического вмешательства.

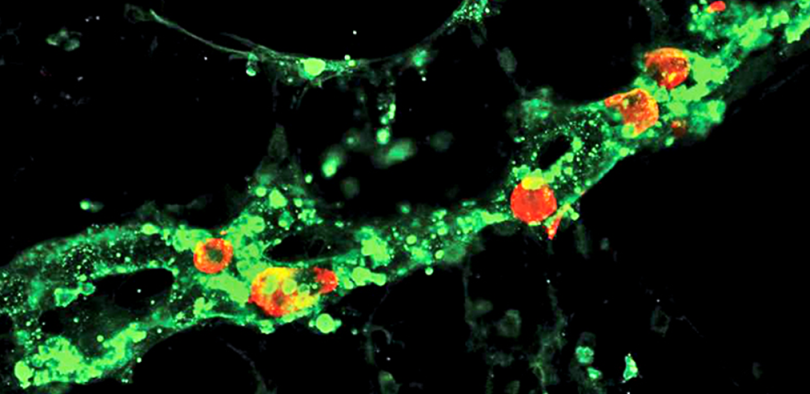
Иммунофлюоресцентная визуализация метастатически пораженного лимфатического узла с окраской на Цитокератин (красный) – маркер характерный для опухолевых клеток эпителиального происхождения. Масштабная линейка: 50 мкм
(Science Advances/Michael Detmar Group ©)
Прогноз
Метастазы в лимфатические узлы шеи могут возникать при онкологических заболеваниях различных локализаций, поэтому давать прогностические оценки для этой группы пациентов следует только после выявления первичной опухоли.
Факторы, влияющие на прогноз:
- стадия заболевания,
- локализация первичной опухоли,
- гистологический подтип и степень дифференцировки,
- количество и размер пораженных лимфатических узлов,
- характеристика края резекции опухоли.
Наблюдение после лечения
Пациенты должны регулярно посещать своего специалиста по опухолям головы и шеи для оценки состояния на предмет любых признаков рецидива заболевания.
Стандартный график наблюдения
В первые 1–2 года осмотр и сбор жалоб рекомендуется проводить каждые 3–6 месяца, на сроке 3–5 лет – один раз в 6–12 месяцев. После 5 лет с момента операции посещать врача необходимо один раз в год или при появлении жалоб. У пациентов с высоким риском рецидива перерыв между обследованиями может быть сокращен.
Список литературы:
- RUSSCO Практические рекомендации по лечению злокачественных опухолей головы и шеи. 2020г
- NCCN Clinical Practice Guidelines in Oncology Head and Neck Cancers Version 1.2021 — November 9, 2020
- DeVita, Hellman, and Rosenberg’s Cancer: Principles & Practice of Oncology (Cancer Principles and Practice of Oncology) 11th Edition 2019
- AJCC (American Joint Committee on Cancer). Cancer Staging Manual – 8th Edition. New York, NY: Springer; 2018
- Pisani, Paolo et al. “Metastatic disease in head & neck oncology.” Acta otorhinolaryngologica Italica 2020
- Van den Brekel MW. Lymph node metastases: CT and MRI. Eur J Radiol. 2000
- Chen ZW, Zhu LJ, Hou QY, Wang QP, Jiang S, Feng H. Clinical application of positron-emission tomography for the identification of cervical nodal metastases of head and neck cancer compared with CT or MRI and clinical palpation. Chinese journal of stomatology. 2008
- Qiaoli Ma et al. Unexpected contribution of lymphatic vessels to promotion of distant metastatic tumor spread. Science Advances 08 Aug 2018
- Sun, J et al. Computed tomography versus magnetic resonance imaging for diagnosing cervical lymph node metastasis of head and neck cancer: a systematic review and meta-analysis. OncoTargets and therapy. 2015
- Robbins KT, Shaha AR, Medina JE, et al. Consensus statement on the classification and terminology of neck dissection. Arch Otolaryngol Head Neck Surg. 2008
- López, Fernando et al. Cervical lymph node metastases from remote primary tumor sites. Head & neck 2016
Источник