Увеличение лимфоузлов после лучевой

Осложнения лучевой терапии головы, шеи и ее побочные эффектыВсе побочные эффекты лучевой терапии можно подразделить на острые и хронические. Их возникновение зависит от общей дозы облучения, однократной дозы облучения, предыдущего или сопутствующего лечения (хирургического вмешательства и/или химиотерапии), объема опухоли. Одним из главных факторов, ограничивающих дозу лучевой терапии, является мукозит. Выраженный лучевой мукозит может стать причиной перерывов в лечении с последующим рецидивом опухолевого роста. Если иммунная система больного подорвана химиотерапией, слизистые оболочки могут инфицироваться. Наиболее распространенным хроническим побочным эффектом является ксеростомия. С целью повышения вероятности успеха лучевой терапии пациент должен отказаться от курения (курение повышает сопротивляемость опухолевых клеток облучению), тщательно следовать схеме лечения, избегая перерывов более чем на пять дней, активно искать поддерживающей терапии. Перед началом лечения пациента должен обследовать фониатр/специалист по глотанию, диетолог, специалист по контролю боли и психолог. Все они могут помочь пациенту справиться с острыми и хроническими побочными эффектами лучевой терапии. Также перед началом лучевой терапии пациента должен осмотреть стоматолог, необходимо выполнить ортопантомограмму, при необходимости удалить больные зубы, приобрести фторированные каппы для зубов, которые могут быть полезны у больных с пломбами (наличие пломб ведет к более выраженному мукозиту, т. к. ионизирующее облучение рассеивается при встрече с пломбировочным материалом).
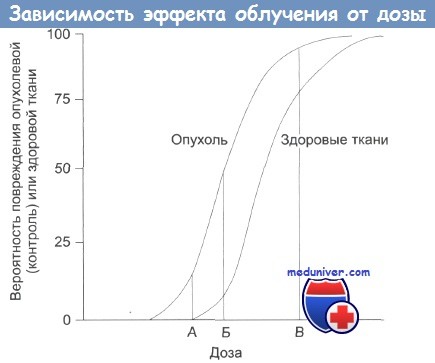
а) Острые побочные эффекты лучевой терапии головы и шеи. Побочные эффекты обычно появляются на третьей неделе лечения. Развивается дерматит, снижается секреция слизи, появляются охриплость, боли в горле, дисфагия, утомляемость, нарушения вкуса, ксеростомия. В редких случаях на первой неделе может развиваться паротит (вследствие закупорки выводных протоков железы густой слизью). Ближе ко второй половине курса, когда симптомы усиливаются, у пациентов появляется необходимость в использовании кремов и масел для кожи, муколитиков, наркотических анальгетиков, противорвотных препаратов, изменений в диете (переход на жидкую пищу и жидкие питательные смеси). Пациентам, которые не способны перенести весь курс лечения (особенно в сочетании с химиотерапией), может быть наложена гастростома. Пациенты могут сильно терять в весе, у них нарушается заживление ран. Все это ведет к сложностям с завершением курса лечения. Важно минимизировать любые перерывы в лечении, поскольку подавление роста опухоли нарушается при прерывании лечения на пять дней и более. б) Хронические побочные эффекты лучевой терапии головы и шеи. Полное восстановление после курса лучевой терапии занимает несколько недель или месяцев. Отказаться от приема дополнительных препаратов пациенты обычно могут спустя 4-6 недель после окончания лечения. Наиболее тяжелыми хроническими побочными эффектами являются фиброз мягких тканей шеи и жевательной мускулатуры, выпадение волос, хондронекроз, дисфагия, гипотиреоз, ксеростомия. Избежать образования стриктур верхнего сфинктера пищевода и фиброза мышц, участвующих в глотании, можно при раннем начале специальных глотательных упражнений. Невозможность нормального глотания может вести к хронической аспирации и необходимости постоянного использования назогастрального зонда. Для предотвращения распада зубов и остеорадионекроза пациенты должны тщательно соблюдать гигиену полости рта, избегать удаления или имплантации зубов. в) Направление будущих исследований. В рандомизированном исследовании RTOG-H5022 будет оценена эффективность добавления С225 к курсу химиолучевой терапии (ускоренный курс облучения с двумя курсами цисплатина). С учетом того, что у пациентов с раком ротоглотки, ассоциированным с ВПЧ, удается достичь превосходных результатов при использовании традиционных методов лечения, многие лечебные учреждения и исследовательские группы занимаются поиском наименее агрессивного варианта. Аналогичных результатов можно достичь использованием меньших доз облучения и меньшим количеством курсов химиотерапии, снизив при этом общую токсичность. У пациентов с крайне агрессивными опухолями, которым требуется более радикальное лечение, возможно применение нескольких подходов: использование индукционной химиотерапии, эскалация дозы облучения, подключение брахитерапии или биологической терапии. С другой стороны, ведется поиск радиопротективных препаратов, которые помогут предотвратить развитие мукозита и других побочных эффектов и одновременно с этим увеличить вероятность сохранения функции пораженного органа, поскольку целью лечения является не только подавление опухолевого роста, но и поддержание общего качества жизни на достойном уровне. Например, исследуется возможность использования лучевой терапии с модулированной интенсивностью (ЛТМИ) для снижения риска развития дисфагии и снижения дозы химиолучевой терапии. Это позволит сохранить пациентам глотание и устранит необходимость в использовании назогастрального зонда. С целью дальнейшей персонализации лечения разрабатываются новые методы лучевой диагностики и молекулярной диагностики, с помощью которых, как мы надеемся, удастся найти сбалансированный способ излечения с использованием минимально допустимых доз и косметическими и функциональными результатами лечения.
г) Ключевые моменты лучевой терапии: – Также рекомендуем “Особенности анатомии полости рта” Оглавление темы “Болезни полости рта и глотки”:
|
Источник
Новости онкологии
25.08.2015
Тюляндин Сергей Алексеевич
Председатель Российского общества клинической онкологии,
заведующий отделением клинической фармакологии и химиотерапии,
заместитель директора по научной работе
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
доктор медицинских наук, профессор,
Москва
За последние годы отмечается неуклонное снижение частоты локальных рецидивов в оперированной молочной железе, на грудной стенке и региональных лимфоузлах у больных операбельным раком молочной железы. Этому способствуют возрастающие диагностические способности по ранней постановке диагноза, выработанные стандарты выполнения операций и послеоперационной лучевой терапии, способность современных морфологических исследований определить стадию, биологические свойства и прогноз заболевания. Однако важнейшим считается назначение практически всем больным системной адъювантной терапии (химио- и/или гормонотерапии), которая достоверно снижает риск развития отдаленных и локальных рецидивов. Возросшие возможности системной терапии трансформировали хирургические подходы к выполнению операции: возрастает частота выполнения резекций вместо мастэктомии и отказ от выполнения подмышечных лимфодиссекций у больных с отсутствием клинически определяемых подмышечных лимфоузлов.
Остается неясным вопрос, какой объем лучевой терапии необходим больным с операбельным раком молочной железы, которые получают адъювантную системную терапию? Два исследования, посвященные этому вопросу, были опубликованы в июльском номере The New England Journal of Medicine.
Первое исследование – долгожданное исследование EORTC, посвященное роли лучевой терапии на парастернальные лимфоузлы у больных раком молочной железы центральной и медиальной локализации [2]. В исследование включались больные I-III стадий после выполнения хирургического лечения (мастэктомии или резекции с подмышечной лимфаденоэктомией) центральной и медиальной локализации независимо от наличия метастазов в подмышечных лимфоузлах и латеральной локализации только при обнаружении метастазов в подмышечные лимфоузлы. Все больные получали лучевую терапию на оставшуюся молочную железу в случае ее резекции или послеоперационный рубец в случае мастэктомии. Больные, которые были рандомизированы в экспериментальную группу, дополнительно получали лучевую терапию на регионарные лимфоузлы (надключичные, медиастинальные) в разовой дозе 2 Гр и суммарной 50 Гр. Больные в зависимости от стадии заболевания могли получать системную адъювантную терапию. Основным критерием эффективности была общая выживаемость. Вторичными критериями были безрецидивная выживаемость, выживаемость без отдаленных метастазов и число умерших от рака молочной железы.
За период 1996-2004 гг. в исследование были включены 4004 больных, из которых у 24% была выполнена мастэктомия и у 76% резекция молочной железы, у 60% опухоль была pT1, метастазы в подмышечных лимфоузлах отсутствовали у 44% и еще у 43% были рN1, адъювантная химиотерапия не проводилась у 15%. Облучение подмышечных лимфоузлов проведено у 7,4% в контрольной группе и у 8,3% в группе с дополнительным облучением региональных лимфоузлов.
При медиане наблюдения 11 лет 10-летняя общая выживаемость составила 82,3% в контроле и 80,7% в группе дополнительного облучения региональных лимфоузлов (HR=0,87, p=0,06). За 10 лет от рака молочной железы умерли 12,5% больных в группе контроля и 14,4% в группе дополнительного облучения (HR=0,82, р=0,02). Число больных, которые должны получить дополнительную лучевую терапию, с тем чтобы сохранить одну жизнь, составило 39 человек.
Частота и локализация прогрессирования заболевания представлена в таблице 1. Показатель 10-летней безрецидивной выживаемости составил 69,1% в контрольной группе и 72,1% в группе дополнительной лучевой терапии на регионарные лимфоузлы (HR=0,89, р=0,04). Безрецидивная выживаемость без отдаленных метастазов составила 75% и 78% соответственно (р=0,02). Из таблицы очевидно, что частота метастазирования в парастернальные лимфоузлы и надключичные лимфоузлы в группе контроля низкая и составляет 0,8% и 2% соответственно. Облучение этих зон уменьшает риск развития метастазов, однако это не сказывается на отдаленных результатах. Наибольшая разница в результатах лечения между контрольной группой и группой дополнительного облучения региональных лимфоузлов отмечена не в частоте развития региональных рецидивов (как ожидалось при планировании исследования), а в частоте развития отдаленных метастазов (4%), что непонятно. Подгрупповой анализ не выявил субпопуляцию больных, у которых проведение дополнительного облучения региональных лимфоузлов достоверно улучшало общую выживаемость.
Таблица 1. Частота и локализация прогрессирования рака молочной железы и отдаленная токсичность [2].
| Локализация | Контроль | Облучение региональных л/у | Всего |
| Число больных | 2002 | 2002 | 4004 |
| Рецидив: | |||
| Локальный | 107 (5,3%) | 112 (5,6%) | 219 (5,5%) |
| Региональный: | 85 (4,2%) | 54 (2,7%) | 139 (3,5%) |
| – подмышечные л/у | 39 (1,9%) | 27 (1,3%) | 65 (1,6%) |
| – надключичные л/у | 41 (2,0%) | 30 (1,5%) | 71 (1,8%) |
| – парастернальные л/у | 16 (0,8%) | 4 (0,2%) | 20 (0,5%) |
| Отдаленные метастазы | 392 (19,6%) | 319 (15,9%) | 711 (17,8%) |
| Второй рак: | |||
| Любой | 222 (11,1%) | 191 (9,5%) | 413 (10,3%) |
| Рак молочной железы | 105 (5,2%) | 97 (4,8%) | 202 (5,0%) |
| Отдаленная токсичность: | |||
| Фиброз легких | 1,7% | 4,4% | 3,0% |
| Кардиосклероз | 0,6% | 1,2% | 1,0% |
В группе дополнительного облучения региональных лимфоузлов достоверно чаще наблюдали развитие фиброза легких и признаков кардисклероза. Не отмечено разницы в частоте развития вторых раков, включая ипсилатеральный и контралатеральный рак молочной железы.
На основании полученных результатов авторы делают вывод, что у больных с центральной и медиальной локализацией рака молочной железы облучение парастернальных и надключичных лимфоузлов со стороны поражения снижает частоту развития региональных рецидивов и улучшает показатели 10-летней безрецидивной выживаемости, уменьшает число больных, умерших от рака молочной железы, но не приводит к достоверному улучшению отдаленных результатов.
В исследовании MA20 больные раком молочной железы после выполнения радикальной резекции с подмышечной лимфаденэктомией или биопсией сентинальных лимфоузлов после проведения адъювантной химиотерапии были рандомизированы в группу лучевой терапии оставшейся части молочной железы только (контрольная группа) или в группу облучения молочной железы и региональных лимфоузлов (подмышечные, надключичные и парастернальные) [2]. Основным критерием эффективности была общая выживаемость. Вторичными критериями были безрецидивная выживаемость, выживаемость без локорегионального прогрессирования и выживаемость без отдаленных метастазов.
В исследование были включены 1832 пациентки, у большинства из которых имелась первичная опухоль Т1-2 (99%), метастазы в подмышечных лимфоузлах числом от 1 до 3 (85%), наличие рецепторов эстрогенов (75%). Большинство больных получили антрациклин- и таксансодержащую адъювантную химиотерапию (91%) совместно с адъювантной гормонотерапией (80%).
Как и в предыдущем исследовании, не отмечено достоверной разницы в показателях 10-летней выживаемости, которые составили 81,8% в контроле и 82,8% в группе облучения региональных лимфоузлов. При подгрупповом анализе обнаружена тенденция лучшей выживаемости в группе облучения региональных лимфоузлов у больных с отрицательными рецепторами эстрогенов: 81,3% и 73,9% (HR=0,69, р=0,05). Показатель 10-летней безрецидивной выживаемости был достоверно лучше в группе дополнительного облучения и составил 95,2% в сравнении с 92,2% в контроле (HR=0,59, р=0,01). Большинство региональных рецидивов заболевания отмечено в подмышечной (63%) и надключичной (27%) областях. Безрецидивная выживаемость без отдаленных метастазов составила 82,4% в контроле и 86,3% в группе дополнительного облучения (HR=0,76, р=0,03). У больных с дополнительным облучением региональных лимфоузлов чаще наблюдали развитие постлучевых пневмонитов и лимфостаза.
Авторы сделали вывод, что у больных раком молочной железы с метастазами в подмышечные лимфоузлы добавление к облучению оставшейся части молочной железы лучевой терапии на региональные лимфоузлы не улучшает общую выживаемость, но снижает частоту прогрессирования (локорегионального и отдаленного).
Таким образом, оба исследования не смогли улучшить общую выживаемость больных за счет облучения региональных лимфоузлов, но достоверно уменьшили частоту местного и отдаленного метастазирования. Возможной причиной этого является высокая эффективность современной системной адъювантной терапии по предотвращению развития прогрессирования заболевания. Все большая частота выявления ранних форм рака молочной железы уменьшает число больных, которым можно было рекомендовать облучения региональных лимфоузлов. Частота локорегионального прогрессирования без лучевой терапии в настоящее время не превышает 5%.
Какие выводы были сделаны из результатов этих исследований экспертами в области лечения операбельного рака молочной железы? Для этого следует обратиться к рекомендациям Санкт-Галленовского консенсуса, который опубликован в августовском номере Annals of Oncology [3]. Согласно консенсусу у больных после органосохранной операции следует ограничиться облучением только оставшейся части молочной железы при отсутствии метастазов в подмышечных лимфоузлах. При обнаружении метастазов в подмышечных лимфоузлах эксперты рекомендуют облучение подмышечной и надключичной областей, но лишь единицы считают необходимым включение в зону облучения парастернальной области независимо от локализации первичной опухоли. После мастэктомии адъювантная лучевая терапия показана при Т3 и наличии метастазов в подмышечных лимфоузлах числом более 3. При числе метастазов от 1 до 3 лучевая терапия показана в случае наличия дополнительных неблагополучных прогностических факторов, к числу которых относится наличие в опухоли лимфоваскулярной инвазии, высокой степени злокачественности, прорастания опухолью капсулы лимфоузла с распространением на клетчатку. Лучевая терапия после мастэктомии проводится с включением грудной клетки и региональных лимфоузлов. При этом вновь большинство экспертов не рекомендует включать в зону облучения парастернальные лимфоузлы.
Ключевые слова: рак молочной железы, адъювантная терапия, лучевая терапия.
Литература:
- Portmans P.M., Colette S., Kirkove C. et al. Internal mammary and medial supraclavicular irradiation in breast cancer. N. Engl. J. Med. 2015, 373:317-27.
- Whelan T.J., Olivotto I.A., Parulekar W.R. et al. Regional nodal irradiation in early-stage breast cancer. N. Engl. J. Med. 2015, 373:307-16.
- Coates A.S., Winer E.P., Goldhirsch A. et al. Tailoring therapies – improving the management of early breast cancer: St. Gallen international expert consensus on the primary therapy of early breast cancer 2015. Ann. Oncol. 2015, 26:1533-1546.
Copyright © Российское общество клинической онкологии (RUSSCO)
Полное или частичное использование материалов возможно только с разрешения администрации портала.
Источник