Удаление матки шейки и лимфоузел
Пути метастазирования опухоли при раке шейки матки и тела матки. Лимфатическая система яичников.
Клинические наблюдения показывают, что чаше всего метастазы при раке шейки матки обнаруживаются в следующих шести группах лимфатических узлов, являющихся для шейки матки регионарными: околошеечных (парацервикальных), околоматочных (параметральных), запирательпых, внутренних подвздошных, наружных подвздошных и общих подвздошных. Значительно реже наблюдается метастазирова-ние рака шейки матки в околоаортальные и паховые лимфатические узлы. Перечисленные группы узлов, в свою очередь, могут быть подразделены на три подгруппы: первичная (околошеечные и околоматочные), промежуточная (наружные и внутренние подвздошные, запирательные) и вторичная подгруппа (общие подвздошные, околоаортальные и паховые лимфатические узлы).
Существует два основных пути лимфогенного метастазирования при раке шейки матки. Первый путь: от околошеечных и околоматочных узлов к наружным подвздошным и запирательным, а затем к околоаортальным и значительно реже — паховым лимфатическим узлам. Второй основной путь: от околошеечных и околоматочных узлов к внутренним подвздошным, а затем к общим подвздошным и околоаортальным лимфатическим узлам. Распространение раковых клеток может происходить как по одному из этих путей, так и по обоим, а также только с одной стороны или с обеих сторон одновременно (Papadia, 1958).
Общность лимфатической и венозной системы шейки матки и влагалища, а также тесный контакт между этими органами является анатомическим обоснованием нередкого распространения карциномы шейки матки на стенки влагалища.
Согласно клиническим данным, при раке шейки матки сначала поражаются внутренние подвздошные и подвздошные (общие и наружные), а затем околоаортальные лимфатические узлы; при раке тела матки в первую очередь поражаются околоаортальные и паховые лимфатические узлы; метастазирование при раке шейки матки происходит быстрее, чем при раке тела матки.

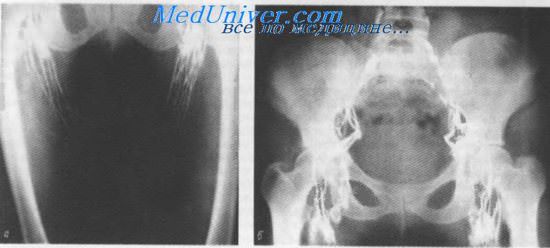
Лимфограмма. Глубокие лимфатические сосуды и узлы нижней конечности (а) и таза (б)
Лимфатическая система яичников
Лимфатические сосуды яичника на поверхности органа представлены в виде грубой сети. В воротах и в брыжейке яичника отводящие лимфатические сосуды образуют богатое подъяичниковое сплетение (plexus subovaricus); по выходящим из него 2—3 лимфатическим стволам лимфа оттекает в общие для яичника, тела матки и маточной трубы лимфатические узлы, расположенные по ходу яичниковых сосудов (nodi lymphatici ovarici) и далее — в регионарные лимфатические узлы; последние расположены преимущественно: слева— по левой полуокружности брюшной аорты, справа — по передней поверхности нижней полой вены.
Взаимоотношения лимфатических сосудов дна матки, яичников и маточной трубы также самые тесные. Отводящие лимфатические сосуды всех трех органов сливаются в упоминавшееся выше общее для них подъничниковое сплетение. Отток лимфы из матки, яичника и маточной трубы происходит в околоаортальные лимфатические узлы, в которые впадают также лимфатические сосуды и от органов брюшной полоста (Д. А. Жданов, 1952). Существует тесная связь путей оттока лимфы матки, мочевого пузыря и прямой кишки.
Хирургическая анатомия лимфатической системы матки имеет практическое значение и в связи с использованием в клинике метода предоперационного (прижизненного) окрашивания лимфатических узлов, например при операции Вертгейма (Е. В. Антипова, 1963; М. Марков, 1960).
Обнаружение метастазов в лимфатических узлах таза затруднено из-за огромного числа вариантов нормы; тем не менее, применение метода лимфографии перед операцией и во время последней имеет много преимуществ в связи с реальной возможностью более полного осуществления лимфаденэктомии. Методом лимфографии, выполнявшейся, в частности, после операции Вертгейма, было установлено, что в зоне иссечения лимфатических узлов последние контрастируются в тех случаях, когда удаление узлов было неполным, так как возможна частичная их регенерация. При тщательном же удалении лимфатических сосудов и узлов на большом протяжении последние не восстанавливаются и на лимфотраммах не обнаруживаются.
Восстановленные лимфатические узлы не достигают исходного состояния: они уменьшены в размерах, полигональны по форме и менее контрастны.
Лимфатические сосуды после операции Вертгейма теряют прямолинейность хода, образуют между собой многочисленные связи, не имеют четкообразных утолщений, становятся более извилистыми и чрезвычайно узкими. Ниже места резецированных лимфатических узлов и сосудов (паховая область, бедро) примерно в половине случаев образуется широкая сеть коллатералей, направляющихся к лимфатическим сосудам противоположной стороны. Основные лимфатические коллекторы бедра подвергаются редукции и деформации.
– Также рекомендуем “Расширенная абдоминальная экстирпация матки.”
Оглавление темы “Операции в гинекологии.”:
1. Хирургическое лечение трубного бесплодия
2. Сальпинго-сальпингоанастомоз. Техника сальпинго-сальпингоанастомоза.
3. Операция пересадки яичника в полость матки. Лимфатическая система матки.
4. Пути метастазирования опухоли при раке шейки матки и тела матки. Лимфатическая система яичников.
5. Расширенная абдоминальная экстирпация матки.
6. Основные этапы расширенной абдоминальной экстирпация матки.
7. Мочеточник. Хирургическая анатомия женского мочеточника.
8. Мочевой пузырь. Хирургическая анатомия женского мочевого пузыря.
9. Мочеиспускательный канал. Хирургическая анатомия женского мочеиспускательного канала.
10. Операции при недержании мочи. Операция прямой мышечной пластики сфинктера мочевого пузыря.
Источник
Удаление регионарных лимфатических узлов после лучевого лечения
Сочетавшая лучевая терапия является основным методом лечения больных РШМ II и III стадий. Усовершенствование ее внутриполостного и дистанционного компонентов привело к улучшению отдаленных результатов, но частота возникновения рецидивов и метастазов остается высокой.
Особенно отягощен прогноз у больных, у которых первичная опухоль классифицируется символами Т2 и ТЗ и имеются регионарные метастазы в лимфатических узлах таза (при Т2 – в 30%; ТЗ – до 50% наблюдений). Многие клиницисты отмечали, что основной причиной неэффективности лучевого лечения являются не местные рецидивы, а регионарные метастазы, локализованные в области боковых отделов малого таза. В связи с этим сложилось представление о том, что лимфогенные метастазы значительно более резистентны к лучевой терапии, чем первичная опухоль.
Большинство клиницистов не поддерживают идею удаления регионарных лимфатических узлов после лучевого лечения РШМ, так как примерно 60—70%) больных (без метастазов) подвергаются не показанному им оперативному вмешательству. Между тем этот аргумент не безупречен, так как в настоящее время с помощью лимфографии можно выявить больных с лимфогенными метастазами и индивидуализировать показаний к лимфаденэктомии после лучевого лечения.
Как видно, вопросы планирования оптимальной терапии больных РШМ (Т2 и ТЗ) с метастазами в регионарных лимфатических узлах таза не решены. Остаются спорными следующие аспекты этой проблемы: возможно ли излечение лимфогенных метастазов лучевыми методами, и улучшаются ли отдаленные результаты лечения этой крайне отягощенной в прогностическом отношении группы больных, если после полного курса сочетанной лучевой терапии производится удаление регионарных лимфатических узлов?
В специальном исследовании, приведенном нами совместно с В. В. Кузнецовым, показано, что при негативных данных лимфографии 5-летняя и выживаемость после сочетанного лучевого лечения составляет 80,1% при T2N0M0 и 40,3% – при T3N0M0. При позитивных данных лимфографии указанные показатели резко снижаются (при T2N1М 0 — 38.6 %; при T3N1M0 — всего 18,2%). Предпринятое у ряда этих больных удаление подвздошных лимфатических узлов (в связи с клиническими проявлениями в виде отека нижней конечности и компрессионного неврита) не улучшило прогноз.
Далее мы перешли к следующему этапу исследования, по протоколу которого у больных РШМ (T2N1M0) через 2 нед после завершения сочетанной гамма-терапии выполнялась экстраперитонеальная лимфаденэктомия, не дожидаясь клинических проявлений почти пекурабельного регионарного рецидива. 5-летняя выживаемость составила 52,9%. Обнаружение у 23 больных (40%) лимфогенных метастазов без признаков лучевого повреждения свидетельствует об относительной резистентности лимфогенных метастазов по сравнению с первичной опухолью.
Экстраперитонеальная подвздошная лимфаденэктомия производится из косого разреза по Пирогову длиной 10—12 см параллельно паховой связке.

Этапы экстраперитонеальной подвздошной лимфаденэктомии
После пересечения апоневроза и косой мышцы живота хирург отодвигает париетальную брюшину в медиальном направлении. После этого хорошо контурируются просвечивающие через тонкую фасцию магистральные сосуды таза. Удаляются единым блоком общие, наружные, внутренние подвздошные и запирательные лимфатические узлы; после операции проводится вакуум-дренирование.
Усовершенствование центрации полей облучения, применение мегавольтного тормозного пучка ДУЭ-25 и выполнение экстраперитонеальной лимфаденэктомии позволили довести уровень 5-летней выживаемости в группе T2N1M0 до 62,1%, а частоту резистентных к облучению регионарных метастазов снизить до 12%.
На первый взгляд, учитывая значительные успехи лучевой терапии РШМ, достигнутое улучшение отдаленных результатов может показаться скромным. Нe следует, однако, упускать из виду, что в этом разделе анализируются результаты лечения выделенных из общего массива больных с сочетанием прогностически неблагоприятных факторов: значительного местного (Т2b) и ТЗ) и регионарного распространения опухоли.
Поэтому улучшение прогноза у этих наиболее трудных больных клинически значимо. Усовершенствование лучевых воздействий на регионарные метастазы, их удаление после облучения существенно повышают шансы на стойкое излечение.
Я.В. Бохман
Опубликовал Константин Моканов
Источник
Какие виды операций выполняют при раке матки и её придатков? Можно ли их выполнить лапароскопически? Каким будет объем операции? От чего это зависит? Обязательно ли удалять маточные трубы и яичники? В чем преимущества лапароскопической операции перед открытой?
Хирургия — основной метод лечения рака матки. Чаще всего начинают именно с операции, дополняя её курсом лучевой терапии и химиотерапии. Выбирая тип хирургического вмешательства, врач учитывает стадию опухоли, возраст и состояние здоровья женщины.

Все операции при раке матки и её придатков можно разделить на четыре группы:
- Радикальные. Цель такой операции — удалить всю опухоль целиком. Впоследствии проводится курс адъювантной химиотерапии, чтобы уничтожить оставшиеся в организме раковые клетки.
- Циторедуктивные. Проводятся в случае, когда опухоль невозможно удалить целиком, из-за больших размеров или сильного прорастания в соседние органы. Хирург старается иссечь как можно больший объем опухолевой ткани. На оставшуюся воздействуют при помощи химиотерапии или лучевой терапии. Как правило, к циторедуктивным операциям прибегают, когда рак матки распространился на всю тазовую полость и на брюшную полость.
- Диагностические. Такие хирургические вмешательства проводят для того, чтобы уточнить стадию рака, оценить, насколько сильно опухоль проросла в соседние органы, взять образцы тканей для биопсии.
- Паллиативные. Проводятся при некурабельных опухолях на поздних стадиях. Цель такой операции — уменьшить симптомы, облегчить состояние пациента, устранить сдавление опухолью внутренних органов.
В Европейской онкологической клинике функционирует операционная, оснащенная современным оборудованием. Наши хирурги проводят операции любой сложности при раке матки на любых стадиях.
Преимущества лапароскопических операций при раке матки
Первая лапароскопическая операция на матке была выполнена еще в 1989 году. С тех пор метод совершенствовался, показания к таким операциям расширялись. Врачи накопили большой опыт в проведении лапароскопических вмешательств. По сравнению с открытыми операциями лапароскопия имеет некоторые преимущества:
- меньше травматизация тканей;
- меньше кровопотеря;
- ниже риск некоторых осложнений;
- более короткий реабилитационный период, возможность быстрее восстановиться и вернуться к привычной жизни.
Диагностическая лапароскопия
Во время диагностической лапароскопии хирург осматривает брюшину, покрывающую тазовые органы и стенки брюшной полости, удаляет подозрительные ткани и лимфатические узлы, чтобы затем отправить их на биопсию. Также врач может промыть физиологическим раствором тазовую и брюшную полость и отправить на цитологическое исследование — на предмет наличия раковых клеток.
В Европейской онкологической клинике есть возможность провести лапароскопическое ультразвуковое исследование с доплеровским картированием. Специальный ультразвуковой датчик вводят прямо в брюшную полость. Он напрямую контактирует с исследуемым органом, благодаря чему УЗ-сигнал не искажается, врач получает максимально четкое и информативное изображение, может оценить кровоток в опухолевой ткани.
Удаление опухоли
В зависимости от стадии опухоли, степени прорастания в соседние ткани и распространения в близлежащие лимфатические узлы, объем операции будет различаться. По возможности врачи Европейской онкологической клиники стараются отдавать предпочтение лапароскопическим операциям. Но в ряде случаев приходится прибегать к открытым вмешательствам.
Гистерэктомия (экстирпация матки)
Гистерэктомия представляет собой хирургическое вмешательство, во время которого удаляют пораженную опухолью матку.
Зачастую приходится прибегать к расширенной гистерэктомии, во время которой удаляют матку вместе с шейкой и верхней частью влагалища, окружающую тазовую клетчатку и лимфатические узлы. Если в дальнейшем планируется курс лучевой терапии в области таза, выполняют транспозицию яичников: их перемещают вверх, для того чтобы они не попали в поле облучения.
Еще более серьезной операцией является эвисцерация таза, во время которой удаляют матку вместе с её придатками, шейку матки, влагалище, мочевой пузырь, прямую кишку, окружающие ткани и лимфатические узлы. К таким вмешательствам прибегают при рецидивах рака.
Удаление придатков матки
При инвазивном раке матки приходится удалять её придатки: маточные (фаллопиевы) трубы вместе с яичниками. Такая операция имеет серьезные последствия для женского организма, так как после неё наступает искусственная менопауза.
Если женщина еще не перенесла климакс, и рак матки был диагностирован на ранних стадиях, хирурги стараются сохранить яичники. В случаях, когда это возможно, врачи Европейской онкологической клиники стараются придерживаться органосохраняющей тактики.
Удаление лимфатических узлов
Во время операции по поводу рака матки могут быть удалены следующие группы лимфатических узлов:
- Тазовые. В данном случае они являются регионарными, так как непосредственно собирают лимфу от матки и других тазовых органов. Именно сюда в первую очередь попадают раковые клетки, распространяющиеся лимфогенным путем.
- Парааортальные. Находятся вокруг нижней части аорты. Сюда попадают раковые клетки, распространившиеся за пределы таза.
Операция по удалению лимфатических узлов называется лимфодиссекцией, или лимфаденоэктомией.
Лапароскопическая хирургия играет важную роль в лечении рака матки и других женских половых органов. При правильном подходе лапароскопическая операция по радикальности не уступает «большой», открытой. В Европейской онкологической клинике проводится как радикальное, так и паллиативное лечение онкологических заболеваний на любых стадиях. Мы знаем, как помочь.
Источник
Рекомендации по удалению матки (гистерэктомии) при раке эндометрия
Гистерэктомия должна быть экстрафасциальной; удаление верхней части влагалища, по-видимому, не снижает частоту рецидивирования в области его культи. Мазки с поверхности органов брюшной полости и брюшины, а также смывы для цитологического исследования должны быть взяты немедленно после лапаротомии.
При наличии асцитической жидкости ее обязательно направляют на цитологическое исследование. В случае выполнения лимфаденэктомии ретроперитонеальные пространства вскрывают обычным доступом. Выделяют сосуды и удаляют ткань, содержащую лимфоузлы вдоль наружных подвздошных сосудов от бифуркации аорты до паховой связки.
Переднюю запирательную ямку и обтураторный нерв отделяют от лимфоидной ткани. Также удаляют лимфоузлы, расположенные по ходу общих подвздошных сосудов. Не предпринимают попыток отделить лимфатические сосуды позади или между крупными сосудами. Основная цель заключается в удалении тазовых лимфоузлов.
Доступ к парааортальным лимфоузлам осуществляется путем ретракции петель тонкого кишечника в верхний отдел живота, рассечения брюшины над верхней частью общей подвздошной артерии и нижней частью аорты. Выделяют крупные сосуды, латерально отводят мочеточник. Единым блоком удаляют ткань, покрывающую полую вену и аорту, начиная от бифуркации аорты и двигаясь в каудальном направлении.
Верхней границей диссекции (если выше ее не контурируются увеличенные лимфоузлы) обычно служит граница между второй и третьей частями двенадцатиперстной кишки в месте, где она ретроперитонеально пересекает крупные сосуды. Гемостаз, как правило, достигается с помощью наложения клипс. Хирург должен получить для гистологического исследования 20—30 тазовых и парааортальных лимфоузлов.
Вероятность метастазирования в лимфоузлы выше у больных раком эндометрия (РЭ) II стадии ввиду распространения процесса на шейку матки. Поэтому зоны лечебных воздействий должны включать участки возможного метастазирования; этого можно достичь несколькими способами. В прошлом стандартом хирургического лечения была признана радикальная гистерэктомия с тазовой лимфаденэктомией.
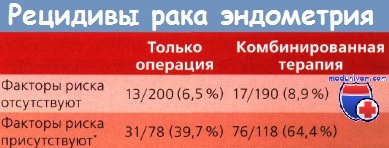
Однако в большинстве случаев, когда шейка матки ограниченно вовлечена в онкологический процесс, оптимальным хирургическим пособием можно признать простую гистерэктомию с двусторонней аднексэктомией, с тазовой и парааортальной лимфаденэктомией. В зависимости от данных, полученных во время операции, и результатов морфологического исследования может быть запланирована послеоперационная ЛТ. Если опухоль ограничена маткой, показаний к послеоперационной ЛТ может и не быть.
Хирургическое лечение при II стадии рака эндометрия (РЭ) такое же, как при умеренно (G2) и низкодифференцированных (G3) аденокарциномах I стадии. Хорошо известно, что при эндоцервикальных поражениях риск распространения процесса за пределы матки более высокий, чем при опухолях, ограниченных дном матки. Вовлечение эндоцервикса у некоторых больных может оказаться единственным неблагоприятным прогностическим фактором.
Данные исследований, посвященных хирургическому стадированию, указывают, что при поражении эндоцервикса достаточно эффективно только оперативное вмешательство. Однако бывают случаи, когда после операции показана ЛТ. Доказано, что эффективность такой последовательности не уступает предоперационному облучению с последующей операцией.
Проведение хирургического вмешательства на первом этапе имеет преимущество, которое позволяет абсолютно точно выявить наличие поражения эндоцервикса. Нередка ситуация, когда после раздельного выскабливания матки полагают, что у больной РЭ II стадии, а затем при гистологическом исследовании диагноз не подтверждается, т. к. клетки опухоли представлены в виде «флотирующих элементов». Этой проблемой занимались Onsrud и соавт. из Norwegian Radium Hospital, которые на основании ретроспективного анализа обнаружили, что из 174 случаев первично диагностированного РЭ II стадии она была подтверждена только в 96 (56%).
Выживаемость больных, в отношении которых была гипердиагностика, не отличалась от таковой у пациенток с I стадией заболевания. Интересно, что в данном проспективном клиническом исследовании у женщин с истинной II стадией РЭ, подтвержденной морфологическим исследованием удаленной матки, ДЛТ не приводила к улучшению выживаемости по сравнению с теми, у кого лечение ограничилось только операцией.
Тщательный анализ 140 пациенток с клинической II стадией рака эндометрия (РЭ) показал, что только 35 (24%) из них действительно имели эту стадию заболевания. Определение истинной распространенности заболевания имеет большое значение не только для выбора последующей адъювантной терапии, но и для прогноза выживаемости.
Имеющиеся данные свидетельствуют о том, что увеличение уровня СА-125 перед операцией — прогностический фактор распространения заболевания за пределы матки. Надежной верхней границей нормы при раке эндометрия (РЭ) может считаться содержание СА-125 >20 ед./мл.
В некоторых центрах изучали возможность применения влагалищной гистерэктомии при высокодифференцировапной аденокарциноме эндометрия. Massi и соавт. прооперировали 180 таких пациенток с показателем 5-летней выживаемости 90 %. Они рекомендовали применять эту операцию для больных с избыточной массой тела и сопутствующими заболеваниями, определяющими высокий операционный риск.

– Также рекомендуем “Рекомендации по химиотерапии рака эндометрия”
Оглавление темы “Рак эндометрия”:
- Рекомендации по хирургическому стадированию рака эндометрия
- Рекомендации по лучевой терапии рака эндометрия
- Рекомендации по удалению матки (гистерэктомии) при раке эндометрия
- Рекомендации по химиотерапии рака эндометрия
- Рекомендации по лимфаденэктомии при раке эндометрия
- Прогестины в лечении рецидива рака эндометрия и их эффективность
- Тамоксифен в лечении рецидива рака эндометрия и его эффективность
- Гонадотропин-рилизинг гормон (ГнРГ) в лечении рецидива рака эндометрия и его эффективность
- Химиотерапия рецидива рака эндометрия и ее эффективность
- Лечение рака эндометрия при первично-множественных опухолях
Источник