Th1 и th2 лимфоциты

Люди, которые страдают от аутоиммунных заболеваний, обычно испытывают симптомы, которые обусловлены дисбалансом функционирования их иммунной системы. Есть много факторов, которые могут влиять на этот баланс – стресс, питание, недостаток витаминов и минералов, кишечная флора и аллергии, среди прочих. Кроме того, практически все аутоиммунные заболевания – состояния, когда иммунная система начинает атаковать собственные ткани – имеют либо Th1, либо Th2 доминирование. Поэтому сегодня немного технической информации(, но я надеюсь дать вам общее представление простыми словами того, как Т-хелперы работают в иммунной системе, и их роль в аутоиммунных заболеваниях. Это необходимо знать, даже потому что, ища ответы на свои вопросы и читая информацию на “медицинском жаргоне”, простому человеку очень сложно что-то понять вообще.
T-хелперы (сокращенно Th) являются важной частью иммунной системы. Это лимфоциты (типа белых клеток крови), которые распознают чужеродные патогены. Они производят цитокины, которые являются гормональными сигналами (криком о помощи), которые призывают Т и В клетки.
Иммунная система имеет две основные иммунные реакции:
Т-хелперов-1 (Th1), которая активирует Т клетки
Т-хелперов-2 (Th2), которая активирует В клетки
Что такое Th1 и Th2 или, по-другому, Т-хелперы 1 или 2-го типа?
Существуют два основных подмножества Т-лимфоцитов, известных как CD4 и CD8. Т-лимфоциты CD4, также известны как Т-хелперы, и они рассматриваются как наиболее плодовитые производители цитокинов. Это подмножество может быть далее подразделено на Th1 и Th2, и цитокины, которые они производят, известные как цитокины Th1-типа и цитокины Th2-типа.
Th1: Th1-клетки участвуют в так называемом “клеточно-опосредованном” иммунитете, которые, как правило, занимаются инфекцией, вирусами и некоторыми бактериями. Это первая линия защиты организма от патогенных микроорганизмов, которые попадают в наши клетки. Они, характеризуются производством провоспалительных цитокинов, таких как IFN-γ, IL-2, и TNF-β и участвуют в развитии органоспецифических аутоиммунных заболеваний.
Th2: Th2 клетки участвуют в так называемом “гуморально-опосредованном” иммунитете, который имеет дело с бактериями, токсинами, и аллергенами. Они несут ответственность за стимулирование производства антител в ответ на внеклеточные патогены (те, которые в крови или других жидкостях тела). Они, характеризуются производством IL-4, IL-5, IL-9, IL-10, и IL-13 и участвуют в системных аутоиммунных заболеваниях и других хронических заболеваниях.
Понимаю, что сложно, поэтому по-другому. В простейшем виде, иммунная система может быть разделена на две части. Провоспалительная сторона иммунной системы (“Th1”) сразу реагирует на захватчик в организме, например, окружив занозу гноем.
Противовоспалительная сторона иммунной системы (“Th2”) имеет задержку ответа и производит антитела к захватчику. Эти антитела помечают захватчика, так что если он появляется снова, иммунная система может более оперативно отреагировать.
Обе иммунные реакции важны для защиты организма от внешних микробов и захватчиков. В хорошо функционирующей иммунной системе, обе группы этих Т-хелперов работают вместе, сохраняя систему сбалансированной. Одна сторона может стать временно более активной, чтобы ликвидировать угрозу, затем все возвращается к сбалансированному состоянию.
Как это влияет на аутоиммунное заболевание?
При аутоиммунных заболеваниях существует сдвиг полюсов или преобладание либо системы Th1 или Th2 и одна сторона системы становится сверхактивной или доминирующей (более чувствительной), хотя есть и исключения. Сдвиг в Th1 или Th2 систему остается постоянным и не изменяется в течение аутоиммунной реакции.
Многие аутоиммунные заболевания классифицируются в учебниках иммунологии по их Т-хелпер доминированию:
TH1 доминирование:
- тиреоидит Хашимото?
- диабет I типа
- рассеянный склероз
- болезнь Крона
- псориаз
- целиакия
- красный плоский лишай
- ревматоидный артрит
- хронические вирусные инфекции
TH2 доминирование:
- болезнь Грейвса?
- волчанка
- аллергический дерматит
- склеродермия
- гайморит
- воспалительные заболевания кишечника
- астма
- аллергия
- рак
- язвенный колит
- множественная химическая чувствительность
Обновление (2019 год): ( или, никому нельзя верить)
Гипертиреоз Грейвса долгое время считался аутоиммунным заболеванием Th2-типа.
Но, несколько недавних исследований оспорили эту концепцию!
Итак, на сегодняшний день! информация такая:
Гипертиреоз Грейвса обусловлен антителами, но является преимущественно заболеванием Th1-типа (источник).
При болезни Грейвса, как и при тиреоидите Хашимото, аутоиммунный ответ включает элементы как Th1, так и Th2. Вывод: неправильно классифицировать болезнь Грейвса и тиреоидит Хашимото как четко выраженное Th1 или Th2 доминирование.
И еще, дополнительная полезная информация:
Ранняя стадия офтальмопатии Грейвса характеризуется Th1-доминирующей воспалительной средой, которая приводит к массивному воспалению орбитальной ткани и отеку. Со временем эта среда Th1 отклоняется в сторону Th2 – доминирования,- уменьшается воспаление, но ремоделирование фиброзной ткани продолжается. (источник)
Когда Th1 клетки иммунной системы являются гиперактивными, они могут подавить активность Th2, и наоборот. Это может быть проблематичным, потому что эти два компонента иммунной системы функционируют в тонко сбалансированных отношениях. В случае аутоиммунных заболеваний, дисбаланс может способствовать атаке на здоровые ткани, повреждая их и тем самым ухудшая симптомы.
Хотя исследования объединяют определенные заболевания под Th1 / Th2 категории, в действительности каждый случай представляет собой не только чрезвычайно сложное, но и весьма индивидуальное аутоиммунное заболевание. Например, хотя большинство пациентов Хашимото имеют доминирование Th1, некоторые могут иметь доминирование Th2. Несколько исследований показали, что ненормальный Th2- гуморально опосредованный иммунитет тесно связан с наступлением болезни Грейвса, хотя, какой тип клеток преобладает при болезни Грейвса остается спорным. Кроме того, обе системы Th1 и Th2 могут быть гиперактивными или неактивными. И каждый из этих случаев требует разного подхода.
Беременность может изменить иммунную систему временно на Th2, а после родов иммунная система делает отскок обратно к Th1 доминированию. Этот отскок может быть настолько велик, что срабатывает аутоиммунный сбой щитовидной железы, поэтому многие женщины узнают, что они имеют Хашимото.
Как я могу узнать, у меня доминирование Th1 или Th2?
Существует анализ Th1:Th2 цитокинов, который делают в специализированных лабораториях.
Идентификация сдвига будет полезной в модуляции иммунного ответа.
И еще, пару слов о так называемых регуляторных Т-клетках.
Th 3 клетки, или регуляторные Т-клетки, являются подтипом Т-клеток, которые сдерживают иммунную систему, поддерживают толерантность к собственным антигенам и минимизируют аутоиммунное заболевание. Это важный механизм “самопроверки” присущ иммунной системе, чтобы предотвратить чрезмерную реакцию. Эти клетки участвуют в закрытии иммунных реакций после успешного устранения вторгшихся организмов, а также в предотвращении аутоиммунных полярных сдвигов Th1 и Th2.
В следующей статье я расскажу о питательных веществах для поддержки регуляторных Т-клеток и баланса Th1 и Th2.
Источник
Т-клетки это фактически приобретенный иммунитет, способный защитить от цитотоксического повреждающего воздействия на организм. Чужеродные клетки-агрессоры, попадая в организм вносят “хаос”, который внешне проявляется в симптомах заболеваний.
Клетки-агрессоры повреждают по ходу своей деятельности в организме все, что могут, действуя в своих интересах. А задача иммунной системы найти и уничтожить все чуждые элементы.
Специфическая защита организма от биологической агрессии (чужеродных молекул, клеток, токсинов, бактерий, вирусов, грибов и т.д.) осуществляется при помощи двух механизмов:
- продуцирования специфических антител в ответ на чужеродные антигены (потенциально опасных для организма веществ);
- выработки клеточных факторов приобретённого иммунитета (Т-клетки).
Как осуществляются иммунные реакции
При попадании в организм человека «клетки-агрессора», иммунная система распознаёт чужеродные и собственные измененные макромолекулы (антигены) и удаляет их из организма. Также при первичном контакте с новыми антигенами происходит их запоминание, что способствует их более быстрому удалению, в случае вторичного попадания в организм.
Процесс запоминания (презентация) происходит благодаря антиген-распознающим рецепторам клеток и работе антиген представляющих молекул (МНС молекул- комплексов гистосовместимости).
Что такое Т-клетки иммунной системы, и какие функции они выполняют
Функционирование иммунной системы обуславливается работой лимфоцитов. Это клетки иммунной системы, являющиеся
разновидностью лейкоцитов и способствующие формированию приобретённого иммунитета. Среди них выделяют:
- В-клетки (распознающие «агрессора» и вырабатывающие к нему антитела);
- Т-клетки (выполняющие функцию регулятора клеточного иммунитета);
- NК- клетки (разрушающие отмеченные антителами чужеродные структуры).
Однако, помимо регуляции иммунного ответа, Т-лимфоциты способны выполнять эффекторную функцию, разрушая опухолевые, мутировавшие и чужеродные клетки, участвовать в формировании иммунологической памяти, распознавать антигены и индуцировать иммунные реакции.
Справочно. Важной особенностью T-клеток является их способность реагировать только на презентированные антигены. На одном T-лимфоците находится только один рецептор к одному конкретному антигену. Это обеспечивает отсутствие реакции T-клеток на собственные аутоантигены организма.
Разнообразие функций Т-лимфоцитов обусловлено наличием в них субпопуляций, представленных Т-хелперами, Т-киллерами и Т-супрессорами.
Субпопуляция клеток, их стадия дифференцирования (развития), степень зрелости и т.д. определяется при помощи специальных кластеров дифференцировки, обозначаемых как СD. Наиболее значимыми являются СD3, СD4 и СD8:
- СD3 находится на всех зрелых T-лимфоцитах, он способствует передаче сигнала от рецептора к цитоплазме. Это важный маркер функционирования лимфоцитов.
- СD8 – это маркер цитотоксических T-клеток.
- СD4 является маркером T-хелперов и рецептором к ВИЧ (вирус иммунодефицита человека)
Т-хелперы
Около половины Т-лимфоцитов имеют антиген CD4, то есть являются Т-хелперами. Это помощники, стимулирующие процесс секреции антител В-лимфоцитами, стимулируют работу моноцитов, тучных клеток и предшественников Т-киллеров к «включению» в иммунную реакцию.
Справочно. Функция хелперов осуществляется за счёт синтеза цитокинов (информационных молекул, регулирующих взаимодействие между клетками).
В зависимости от продуцируемого цитокина, их разделяют на:
- T-хелперные клетки 1-го класса (продуцируют интерлейкин-2 и гамма-интерферон, обеспечивая гуморальный иммунный ответ на вирусы, бактерии, опухоли и трансплантанты).
- T-хелперные клетки 2-го класса (секретируют интерлейкины-4,-5,-10,-13 и отвечают за образование IgЕ, а также иммунного ответа, направленного на внеклеточные бактерии).
Т-хелперы 1-го и 2-го типа всегда взаимодействуют антагонистически, то есть повышенная активность первого типа угнетает функцию второго типа и наоборот.
Работа хелперов обеспечивает взаимодействие между всеми клетками иммунитета, определяя какой тип иммунного ответа будет преобладать (клеточный либо гуморальный).
Важно. Нарушение работы клеток-помощников, а именно недостаточность их функции, наблюдается у больных с приобретённым иммунодефицитом. Т-хелперы являются основной мишенью ВИЧ. В результате их гибели нарушается иммунная реакция организма на стимуляцию антигенов, что приводит к развитию тяжёлых инфекций, росту онкологических новообразований и летальному исходу.
Т-киллеры
Это так называемые T-эффекторы (цитотоксические клетки) или клетки убийцы. Такое название обусловлено их способностью уничтожать клетки-мишени. Осуществляя лизирование (ли́зис (от греч. λύσις — разделение) — растворение клеток и их систем) мишеней, переносящих чужеродный антиген или мутировавший аутоантиген (трансплантанты, опухолевые клетки), они обеспечивают реакции противоопухолевой защиты, трансплантационного и противовирусного иммунитета, а также аутоиммунные реакции.
Т-киллеры при помощи собственных МНС-молекул распознают чужеродный антиген. Связываясь с ним на поверхности клетки, они продуцируют перфорин (цитотоксический белок).
После лизирования клетки «агрессора» Т-киллеры остаются жизнеспособными и продолжают циркулировать в крови, разрушая чужеродные антигены.
Т-киллеры составляют до 25-ти процентов от всех Т-лимфоциотов.
Справочно. Помимо обеспечения реакций нормального иммунного ответа, Т-эффекторы могут участвовать в реакциях антителозависимой клеточной цитотоксичности, способствуя развитию гиперчувствительности второго типа (цитотоксической).
Это может проявляться лекарственными аллергиями и различными аутоиммунными заболеваниями (системные заболевания соединительной ткани, гемолитическая анемия аутоиммунного характера, злокачественная миастения, аутоиммунные тиреоидиты, и т.д.).
Подобным механизмом действия обладают некоторые лекарственные средства, способные запускать процессы некроза опухолевых клеток.
Важно. Препараты с цитотоксическим действием используют в химиотерапии онкологических заболеваний.
Например, к таким медикаментам относится Хлорбутин. Это средство применяют для лечения хронического лимфолейкоза, лимфогранулематоза и рака яичников.
Т-супрессоры и клетки памяти
Супрессоры подавляют функцию хелперов и В-лимфоцитарного звена. Однако современная классификация не выносит супрессоры в отдельную субпопуляцию. Поскольку доказано, что решающую роль в угнетении иммунной реакции играют апоптоз и специфические цитокины.
Помимо основных T-лимфоцитов, в организме человека существуют потомки клеток, контактировавших с антигеном и имеющих к нему рецепторы. Это клетки обеспечивающие иммунологическую память. Они способны в течение от десяти до 15 лет сохранять память об антигене, передавая её другим клеткам.
Справочно. Благодаря клеткам памяти обеспечивается быстрый иммунный ответ при повторном попадании «агрессора» в организм.
Нулевые лимфоциты
К ним относят лимфоциты, не имеющие T и B маркеров. Они составляют до 10% от всей популяции лимфоцитов. К ним относят NК-клетки (естественные киллеры) и K-клетки (киллерные).
Справочно. Основным отличием NK-клеток от T-киллеров является способность уничтожать не сенсибиллизированные клетки-мишени.
K-клетки отвечают за антителозависимую клеточную цитотоксичность. Они отражают взаимодействия гуморального и клеточного звеньев иммунитета, а также выступают в качестве «наводчиков» эффекторных (выполняющих функцию – в данном случае уничтожение) клеток на мишень.
NК- клетки обеспечивают контроль за качеством клеток и участвуют в формировании противовирусного иммунитета, обеспечиваютзащиту от роста опухолей и размножения мутировавших (дефектных) клеток.
Диагностика клеточного иммунитета
Диагностика T- и B-лимфоцитарного звена позволяет оценить состояние клеточного иммунитета. Базовое исследование с определением процентного содержания Т-, В- и нулевых клеток проводится с целью выявления первичных или вторичных иммунодефицитов, а также при контроле иммуностимулирующего лечения.
Исследование основных популяций при помощи маркеров CD3, 8, 19, 16+5б, а также соотношение между хелперами и киллерами, позволяет комплексно оценить иммунный статус. Для исследования используют венозную кровь.
Диагностика проводится при выявлении и контроле течения:
- аутоиммунных заболеваний (увеличено содержание CD3, CD4 хелперов);
- лимфолейкозов (повышено количество Т-лимфоцитов CD3);
- злокачественных новообразований (увеличено количество NK);
- ВИЧ (CD3, CD8);
- хронических инфекций, аллергических реакций, бронхиальной астмы и т.д.
Справочно. В зависимости от результатов анализа пациенту может быть рекомендована консультация иммунолога, гематолога, аллерголога, онколога или инфекциониста. С дальнейшим лечением у профильного специалиста по основному заболеванию.
Источник
Иммунология — одна из самых «прикладных» и «практичных» биологических дисциплин, и эпидемия COVID-19 позволила лишний раз в этом убедиться. Одновременно это, пожалуй, один из самых сложных разделов науки о живом. В реализации иммунного ответа задействованы десятки разных типов клеток; сотни белков-лигандов: цитокинов, хемокинов; тысячи генов. Приложение методов системной биологии к решению иммунологических задач породило самостоятельную дисциплину — системную иммунологию. В третьей статье цикла «Пятерка по системной биологии» мы увидим, как методы системной биологии помогают разобраться в фундаментальных и прикладных аспектах Т-клеточного ответа.
Т-клеточный рецептор (TCR) — ключевая молекула адаптивного иммунного ответа
Иммунная система нашего организма состоит из двух «подсистем»: врожденного и приобретенного (адаптивного) иммунитетов. В основе этого деления лежит фундаментальное различие в молекулярных механизмах распознавания чужеродных молекул — антигенов — в этих двух подсистемах. Значимость изучения иммунной системы сложно переоценить: в 2011 году за это присудили Нобелевскую премию [1–3].
Клетки врожденного иммунитета (наиболее изученные из них — макрофаги) синтезируют множество различных рецепторов, распознающих «типичные» сигналы опасности — например, молекулу липополисахарида (LPS): важный компонент клеточной стенки бактерий. Счет таких рецепторов идет на десятки. Самая известная и хорошо изученная группа — это Toll-подобные рецепторы, но есть и другие. Число антигенов, которые могут распознать рецепторы врожденного иммунитета, может показаться небольшим, но все они проверены миллионами лет естественного отбора, так что в конечном счете врожденный иммунитет, несмотря на свою кажущуюся простоту, — весьма надежная защита. Во всяком случае, беспозвоночные животные, среди которых встречаются и крупные, и достаточно долгоживущие организмы, им обходятся.
Приобретенный (адаптивный) иммунитет устроен совсем иначе. Т-лимфоциты синтезируют лишь один тип рецепторов — Т-клеточные рецепторы (TCR). Однако если взять тысячу макрофагов, синтезирующих рецептор TLR4, то все эти рецепторы будут распознавать одну и ту же молекулу LPS. А если случайным образом выделить из пробы крови тысячу Т-клеток, то они будут распознавать тысячу разных антигенов. Подобное разнообразие достигается благодаря уникальным молекулярным механизмам, задействованным в созревании лимфоцитов: Т- и В-клеток. Подробнее обо всех этих хитросплетениях можно прочесть в статье «Иммунитет: борьба с чужими и… своими» [4].
Ген Т-клеточного рецептора на ранних стадиях созревания Т-лимфоцитов подвергается множеству перестроек и многократно мутирует в той области, которая кодирует часть рецептора, отвечающую за распознавание антигена. В разных клетках-предшественниках этот процесс идет независимо. Так что в результате зрелые Т-лимфоциты несут миллионы вариантов TCR. При этом каждая клетка синтезирует только один определенный вариант рецептора. Миллионы TCR способны распознавать миллионы антигенов — эта способность делает адаптивный иммунный ответ столь точным или, как предпочитают говорить ученые, «специфичным». Разнообразие Т-клеточных рецепторов в организме или в определенной популяции Т-лимфоцитов называется репертуаром TCR («Биомолекула» уже писала об этом [5]).
Чем богаче этот репертуар, тем больше чужеродных молекул способна распознать и обезвредить иммунная система данного человека. Изучение разнообразия Т-клеток и их рецепторов — одно из важнейших направлений современной иммунологии и интереснейшая задача с точки зрения системно-биологических подходов. Вот поэтому стипендия, которую аффилированные лица компании «Филип Моррис Интернэшнл» (ФМИ) в России вручают на базе Сколковского института науки и технологий, поддержала уже три проекта в этой области. Ну а нам особенно приятно отметить, что оба стипендиата, о которых будет рассказано далее, — не только замечательные молодые ученые, но и давние авторы и друзья «Биомолекулы».
Если у вас возник вопрос, что же такое «системная биология» и «системная иммунология», то почитайте нашу предыдущую статью из этого спецпроекта [6].
«Довольно сложно, на мой взгляд, выделить системную иммунологию во что-то отдельное от “просто иммунологии”, — говорит Иван Звягин, с.н.с. отдела геномики адаптивного иммунитета ИБХ РАН. — Методы in silico в настоящее время используются при решении практически любой задачи в иммунологии, да и в других биологических науках. Но для их разработки и совершенствования требуются “мокрые” эксперименты, в результате которых, собственно, и появляются те данные, которые системные биологи позже используют для проверки качества предсказаний. Сложно выделить “вычислительные” методы в самостоятельную науку, на мой взгляд».
Однако термин «системная иммунология» прижился, и ученые, которые заняты преимущественно теоретическими и вычислительными изысканиями в этой области, предпочитают использовать его, чтобы отличать себя от иммунологов-врачей и иммунологов-экспериментаторов.
«Близнецовый метод» в системной иммунологии
В формировании иммунитета, как и в любом сложном биологическом процессе, участвуют по меньшей меры две силы: наследственность человека, запечатленная в его генах, и факторы внешней среды, определяющие особенности индивидуального развития. Чтобы сравнить их относительный вклад, в биологии издавна используется близнецовый метод.
Однако репертуар Т-клеточных рецепторов на первый взгляд не кажется особенно подходящим объектом для изучения таким способом. Перестройка гена ТCR [11] происходит случайно не только в каждом организме, но в каждой отдельной клетке-предшественнице (рис. 1), так что, казалось бы, у близнецов не больше шансов иметь клетки с одинаковыми Т-клеточными рецепторами, чем у любых случайно взятых людей. Однако Михаил Погорелый, стипендиат 2016 года, решил проверить, а так ли это на самом деле?
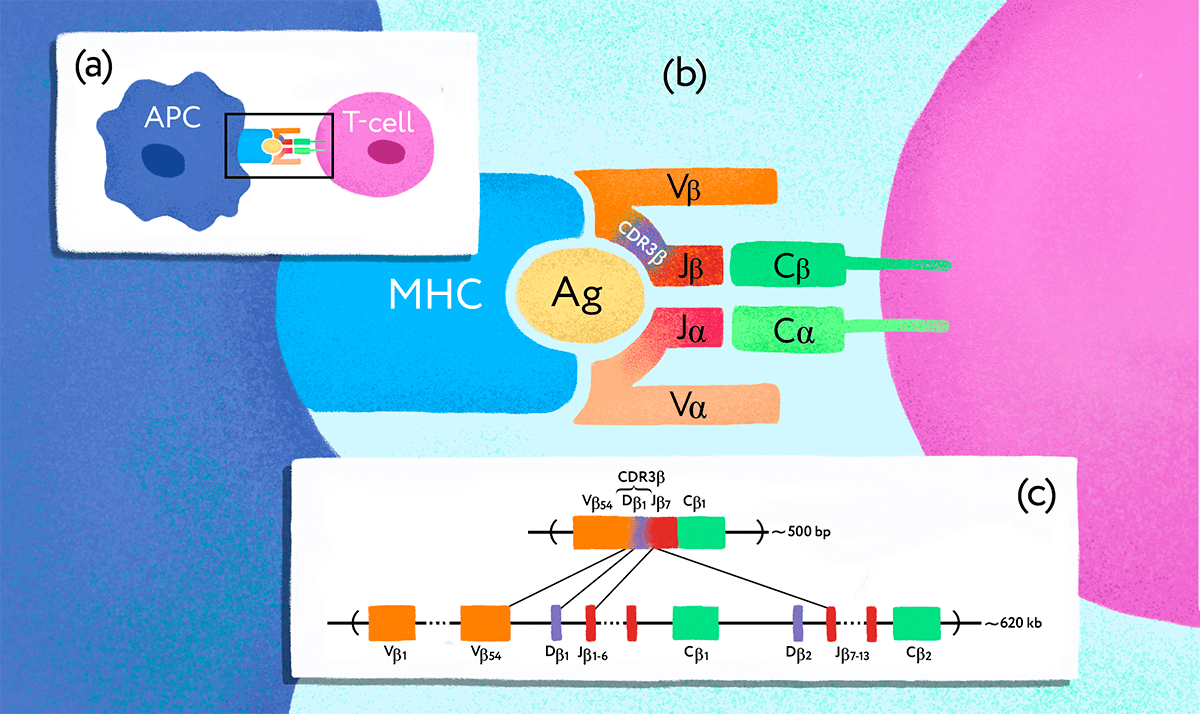
Рисунок 1. Ген Т-клеточного рецептора подвергается перестройке в клетках-предшественниках Т-лимфоцитов. (a) — Взаимодействие антигенпрезентирующей клетки (APC) и Т-лимфоцита (T-cell). (b) — TCR, состоящий из субъединиц ɑ и β, распознает чужеродный антиген (Ag), связанный с MHC. Разнообразие Т-клеточных рецепторов обеспечивается специальными молекулярными механизмами. (c) — В результате процесса, получившего название «VDJ-рекомбинация», в каждой Т-клетке оказывается свой уникальный вариант рабочего гена — так на генетическом уровне формируется репертуар разнообразных TCR.
Первая неожиданность: оказалось, что у близнецов больше клонов Т-лимфоцитов с одинаковым Т-клеточным рецептором! Как такое возможно в свете всего выше изложенного? Дело в том, что иммунная система начинает формироваться еще до рождения человека, хотя полностью «созревает» лишь через несколько лет после рождения. Однояйцевые близнецы делят одну плаценту на двоих, и похоже, что через нее они могут обмениваться иммунными клетками [12].
Дальше исследователи решили проверить, как организмы уже взрослых близнецов реагируют на введение чужеродного антигена.
«Мы использовали вакцину от желтой лихорадки как модель острой вирусной инфекции, — рассказывает Михаил Погорелый “Биомолекуле”. — Отсеквенировали репертуар TCR близнецов в нескольких временных точках, чтобы найти клоны Т-лимфоцитов, которые значимо возросли после вакцинации. Это сработало: нашли, что в каждом человеке около 1000 последовательностей β-цепи TCR проходят клональную экспансию, поскольку специфичны к эпитопам вируса желтой лихорадки».
Михаил продолжает: «Дальше посмотрели на сами эти последовательности. Выяснилось, что:
- совпадений аминокислотной последовательностей между людьми не очень много (из тысячи последовательностей, специфичных к желтой лихорадке, около 20 совпадает с близнецом и всего 1–3 с неродственным донором), то есть набор отвечающих клонов в каждом человеке почти уникальный. Но даже эти несколько совпадений — гораздо больше, чем можно ожидать, если бы клоны выбирались из каждого репертуара случайно. Это значит, что в разных людях для ответа на вакцину отбираются одинаковые последовательности TCR (и еще чаще в близнецах — скорее всего из-за того, что у них совпадают аллели MHC — их антигенпрезентирующие клетки показывают одни и те же антигены);
- внутри набора отвечающих TCR каждого донора много TCR-β-цепей со схожими последовательностями (1–2 а.к. замены). Это объясняется тем, что на один эпитоп одновременно отвечают сразу несколько TCR со схожими последовательностями [13]».
Из результатов этой работы родилась следующая идея. Поскольку в активном иммунном ответе принимает участие много схожих TCR одновременно, то можно создать алгоритм, который будет по единственному образцу репертуара находить TCR, вовлеченные в текущий иммунный ответ (они часто собраны в кластеры схожих последовательностей). Такой алгоритм был разработан и протестирован в лаборатории. И действительно, оказалось, что он позволяет выявлять клоны, отвечающие на вакцинацию, по единственному анализу репертуара (скажем, через три недели после вакцинации). Это, разумеется, куда дешевле и проще, чем делать множество измерений в разных временных точках с той же целью [14].
Проект Михаила — наглядный пример того, как в рамках одного исследования «классическая иммунология», то есть секвенирование рецепторов близнецов, эволюционирует в «системную иммунологию» — разработку алгоритма для поиска кластеров Т-клеток, вовлеченных в текущий иммунный ответ. Именно такой логике следует общее развитие системной иммунологии в наши дни.
Эти многоликие Т-лимфоциты
Человеку, знакомому с разнообразием клеток врожденного иммунитета (макрофаги, дендритные клетки, нейтрофилы, эозинофилы и так далее), система приобретенного иммунитета может показаться даже примитивной, ведь в ней, казалось бы, всего два типа клеток: Т-лимфоциты и В-лимфоциты. Однако это впечатление ошибочно. Во-первых, Т-клетки делятся на две большие группы: «киллеры» (CD8+) и «хелперы» (CD4+). А во-вторых, даже внутри этих групп, особенно среди Т-хелперов, также наблюдается большое разнообразие. Разные группы Т-хелперов — Th1, Th2, Treg, Th9, Th22 — синтезируют различные типы цитокинов и тем самым обеспечивают разнообразие и гибкость иммунного ответа. Все эти Т-лимфоциты экспрессируют на своей поверхности TCR. Естественным образом возникает вопрос: а насколько одинаковы или, напротив, различны репертуары Т-клеточных рецепторов в разных Т-клеточных популяциях? Поискам ответа на него посвящен проект Софьи Касацкой, стипендиата 2019 года.
При этом нужно учесть, что различные типы Т-хелперов при определенных условиях способны превращаться («перепрограммироваться») друг в друга (рис. 3). Механизмы и пути таких перевоплощений изучены пока недостаточно. Но анализ репертуаров ТСR может пролить свет на запутанные отношения между различными популяциями Т-лимфоцитов. Совпадение репертуаров рецепторов в двух разных популяциях клеток-хелперов дает основания полагать, что эти группы клеток имеют общее происхождение и, вероятно, способны превращаться друг в друга. И, напротив, различия в репертуарах ТСR будет знаком того, что данные популяции лимфоцитов формируются независимо.
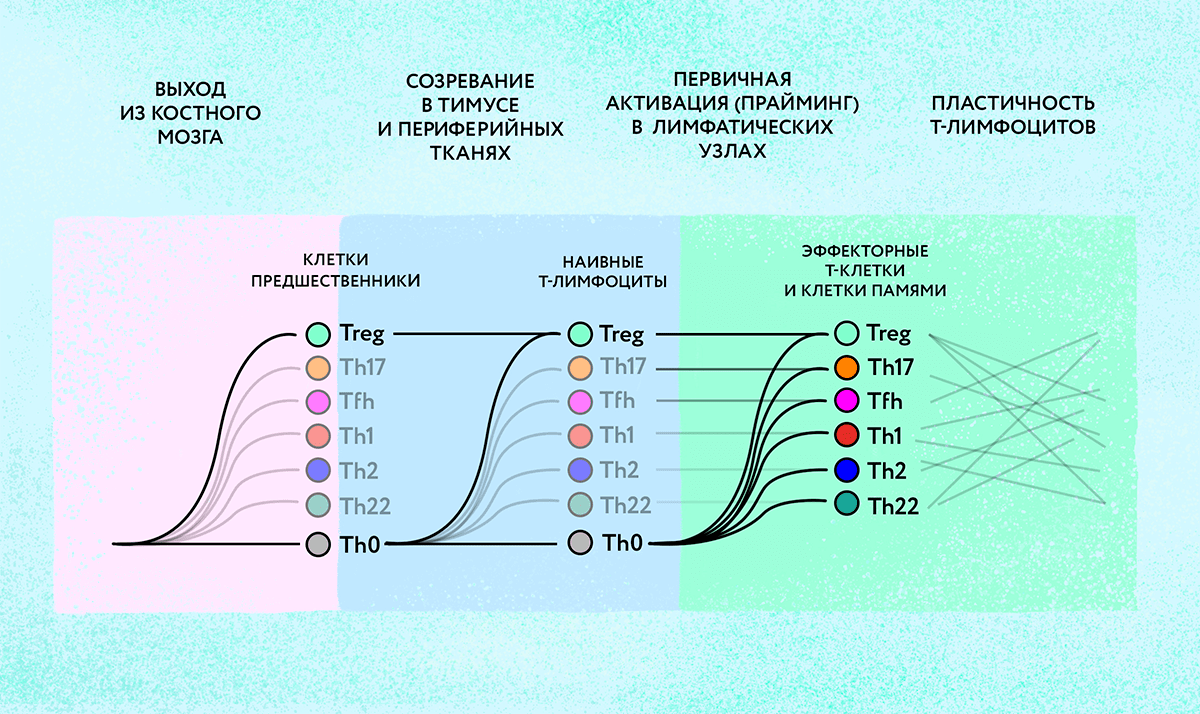
Рисунок 3. Дифференциация Т-лимфоцитов в различные субпопуляции — длительный и сложный процесс, молекулярные механизмы которого изучают иммунологи. Потенциальная способность зрелых Т-лимфоцитов менять свою специализацию (пластичность) является перспективной целью для иммунотерапии различных заболеваний.
Софье удалось показать, что репертуары TCR в популяциях Th17- и Th22-лимфоцитов, играющих важную роль в регуляции аутоиммунных реакций, частично совпадают с репертуаром Th2-клеток, что указывает на тесную связь между этими тремя популяциями. При этом клетки типа Th1-17, обладающие, как это следует из названия, свойствами как Th1, так и Th17-лимфоцитов, имеют общие TCR только с Th1-клетками, но не с Th17. Это позволяет с уверенностью говорить об их происхождении от Th1-лимфоцитов [17]. Так, изучение разнообразия Т-клеточных рецепторов позволяет пролить свет на механизмы пластичности Т-лимфоцитов, понимание которых очень важно, например, при разработке новых видов иммунотерапии.
Особое внимание в проекте уделяется регуляторным Т-клеткам (Treg). Эта популяция Т-лимфоцитов имеет особый путь развития. Их задача в организме — удерживать иммунный ответ в безопасных для организма рамках. Нарушение в активности этих клеток может привести к развитию аутоиммунных заболеваний. Чтобы изучить процесс формирования этой стороны иммунитета, исследователи планируют сравнить TCR-репертуар регуляторных клеток у новорожденных с незрелой иммунной системой, контактировавшей лишь с небольшим числом чужеродных агентов, и у взрослых людей.
Первая статья с результатами по этому проекту уже отправлена в журнал, так что пожелаем Софье скорой и успешной публикации.
Широкие горизонты системной иммунологии
Так получилось, что оба упомянутых в статье стипендиата работают над задачами, связанными с репертуаром Т-клеточных рецепторов. Но это далеко не единственная область иммунологии, где применяются методы системной биологии. Одни ученые собирают и упорядочивают информацию о сигнальных путях иммунных клеток — чтобы использовать ее при анализе разнообразных омиксных данных. Другие строят математические модели, описывающие поведение лимфоцитов. Третьи используют технологии «распознавания образов» (image recognition) для того, чтобы углубить наше знание о взаимодействии иммунных клеток. И это далеко не полный перечень тем и подходов, которые используют иммунологи сегодня. Своими соображениями о будущем системной иммунологии и самых интересных задачах, стоящих перед этой наукой, с нами поделился старший научный сотрудник ИБХ РАН Иван Звягин (рис. 4):

Рисунок 4. Иван Звягин, с.н.с. отдела геномики адаптивного иммунитета ИБХ РАН и зав. лабораторией механизмов иммунотолерантности НИИ трансляционной медицины РНИМУ им. Н.И. Пирогова
«В современной иммунологии есть интереснейшие направления, где алгоритмы анализа больших “иммунологических” и вообще “биологических” данных играют главенствующую роль, так как на их основе можно создавать инструменты, предсказывающие те или иные иммунологические явления и позволяющие манипулировать иммунным ответом в нужном направлении.
В частности, на данный момент мы плохо понимаем, каким образом в каждом конкретном случае происходит связывание Т-клеточного рецептора с комплексом пептид—МНС (pMHC, peptide-loaded major histocompatibility complex), которое приводит к активации Т-лимфоцитов.
Если мы научимся предсказывать силу связывания TCR с тем или иным pMHC на основе их аминокислотных последовательностей, это позволит понять, чем определяется иммуногенность того или иного антигена. В сочетании со знаниями о закономерностях формирования репертуара распознающих рецепторов, это даст возможность разработать алгоритмы для предсказания оптимальных эпитопов для выработки нужного иммунного ответа против новых инфекций или терапии опухолей, оценки риска распознавания “своего” и рационального дизайна узнающей части рецепторов при совершенствовании способов клеточной терапии (например CAR-T-терапия [19]).
С другой стороны, те же алгоритмы будут задействованы и в направлении создания неиммуногенных вариантов белковых последовательностей, когда это важно — например при генотерапии.
Ответы на все эти вопросы — дело ближайшего будущего. Полученные данные и созданные алгоритмы в дальнейшем позволят разрабатывать способы рационального дизайна иммунной системы, исходя из особенностей конкретного человека, с целью снижения риска развития заболеваний и увеличения продолжительности активной жизни».
Заключение
Иммунные клетки, как было рассказано выше, проходят сложные пути дифференциации и развития, которые мы пока понимаем лишь отчасти. Чтобы разобраться в фундаментальных механизмах, определяющих разнообразие клеточных популяций в человеческом теле (около 200 типов!), мы должны опуститься еще глубже — с клеточного на молекулярный уровень — и попытаться понять, каким образом организация хроматина в ядрах клеток определяет их способность участвовать в тех или иных сигнальных путях. Этой интереснейшей теме будет посвящена следующая статья нашего цикла.
- Толл-подобные рецепторы: от революционной идеи Чарльза Джейнуэя до Нобелевской премии 2011 года;
- Иммунологическая Нобелевская премия (2011);
- Интервью с профессором Йельского университета Русланом Меджитовым;
- Иммунитет: борьба с чужими и… своими;
- Анализ индивидуальных репертуаров Т-клеточных рецепторов;
- Клеточная, молекулярная и системная биология: как биологи и биоинформатики вместе рисуют общую картину жизни;
- Feifei Qiu, Chun-Ling Liang, Huazhen Liu, Yu-Qun Zeng, Shaozhen Hou, et. al.. (2017). Impacts of cigarette smoking on immune responsiveness: Up and down or upside down?. Oncotarget. 8, 268-284;
- Won-Kyung Cho, Chun Geun Lee, Lark Kyun Kim. (2019). COPD as a Disease of Immunosenescence. Yonsei Med J. 60, 407;
- Gaetano Caramori, Paolo Casolari, Adam Barczyk, Andrew L. Durham, Antonino Di Stefano, Ian Adcock. (2016). COPD immunopathology. Semin Immunopathol. 38, 497-515;
- Мир до и после изобретения вакцин;
- Daniel J Woodsworth, Mauro Castellarin, Robert A Holt. (2013). Sequence analysis of T-cell repertoires in health and disease. Genome Medicine. 5, 98;
- Mikhail V. Pogorelyy, Yuval Elhanati, Quentin Marcou, Anastasiia L. Sycheva, Ekaterina A. Komech, et. al.. (2017). Persisting fetal clonotypes influence the structure and overlap of adult human T cell receptor repertoires. PLoS Comput Biol. 13, e1005572;
- Mikhail V. Pogorelyy, Anastasia A. Minervina, Maximilian Puelma Touzel, Anastasiia L. Sycheva, Ekaterina A. Komech, et. al.. (2018). Precise tracking of vaccine-responding T cell clones reveals convergent and personalized response in identical twins. Proc Natl Acad Sci USA. 115, 12704-12709;
- Mikhail V. Pogorelyy, Anastasia A. Minervina, Mikhail Shugay, Dmitriy M. Chudakov, Yuri B. Lebedev, et. al.. (2019). Detecting T cell receptors involved in immune responses from single repertoire snapshots. PLoS Biol. 17, e3000314;
- Minervina A.A., Komech E.A., Titov A., Koraichi M.B., Rosati E.