Т лимфоциты ревматоидный артрит
Воспалительные (аутоиммунные) ревматические заболевания относятся к числу распространенных и тяжелых форм патологии человека [1]. Они могут быстро приводить к инвалидности, а нередко и к уменьшению продолжительности жизни пациентов. Неблагоприятный жизненный прогноз определяется прогрессирующим поражением внутренних органов, связанным как с тяжестью самого патологического заболевания, которое плохо контролируется противовоспалительными препаратами, так и токсическим воздействием этих препаратов.
Причины большинства воспалительных ревматических болезней пока остаются не установленными, но основные механизмы патогенеза многих из них изучены достаточно подробно. Это послужило основанием для разработки концепции «патогенетической терапии». К «патогенетическим» относят большое число разнообразных по химической структуре и фармакологическим свойствам лекарственных средств (глюкокортикоиды, цитотоксические препараты и др.), которые объединяет способность подавлять воспаление и/или патологическую активацию системы иммунитета [2]. Однако у многих больных эти препараты недостаточно эффективны.
Ревматоидный артрит (РА) – распространенное (около 1% населения планеты) аутоиммунное ревматическое заболевание, характеризующееся симметричным эрозивным артритом (синовитом) и широким спектром внесуставных (системных) проявлений [3]. Характерными проявлениями РА являются боли, нарушение функции суставов и неуклонно прогрессирующая деформация суставов, необратимое поражение внутренних органов, приводящие к ранней потере трудоспособности (около трети пациентов становятся инвалидами в течение 20 лет от начала болезни) и сокращению продолжительности жизни пациентов (в среднем на 5–15 лет). Преждевременная летальность во многом связана с высокой частотой сопутствующих заболеваний (инфекции, атеросклеротическое поражение сосудов, артериальная гипертензия, остеопоротические переломы костей скелета и др.) [4].
Современная концепция фармакотерапии РА основана на следующих основных принципах [1,5–12]:
• Целью лечения является достижение полной (или хотя бы частичной) ремиссии.
• Для достижения этой цели лечение базисными противовоспалительными препаратами (БПВП), в первую очередь метотрексатом (МТ), должно начинаться как можно раньше, желательно в течение первых 3–х месяцев от начала болезни.
• Лечение должно быть максимально активным, с быстрой эскалацией дозы МТ до 20–25 мг/нед. и последующим изменением (при необходимости) схемы лечения в течение 2–4 мес. для достижения максимально возможного терапевтического эффекта.
• В случае недостаточной эффективности терапии БПВП – назначение генно–инженерных биологических препаратов (ГИБП).
Напомним, что к ГИБП относится широкий спектр препаратов, полученных с помощью методов генной инженерии: моноклональные антитела против определенных детерминант иммунокомпетентных клеток или «провоспалительных» цитокинов, «анти–воспалительные» цитокины и ингибиторы цитокинов (растворимые рецепторы, антагонисты) [13,14]. Все они обладают высокой специфичностью, обеспечивающей селективное воздействие на определенные звенья иммунопатогенеза, в минимальной степени затрагивая нормальные механизмы функционирования иммунной системы. Это позволяет существенно снизить риск «генерализованной» иммуносупрессии, которая характерна для других лекарственных препаратов (в первую очередь глюкокортикоидов и цитотоксиков). Более того, изучение клинических и иммунологических эффектов этих препаратов позволяет получить новые данные о механизмах патогенеза заболеваний человека. Наиболее изученной и широко применяемой при РА группой ГИБП являются ингибиторы ФНО–a (инфликсимаб, адалимумаб и этанерцепт), однако примерно у 40% пациентов с тяжелым активным РА они недостаточно эффективны или вызывают побочные эффекты, являющиеся основанием для прекращения лечения [15–17]. Это диктует необходимость совершенствования подходов к фармакотерапии РА.
Поскольку по современным представлениям Т–клетки имеют фундаментальное значение в развитии РА [18], одним из важных направлений в лечении этого заболевания является подавление патологической активации Т–лимфоцитов [19]. Установлено, что для оптимальной активации Т–лимфоцитов требуется, как минимум, 2 сигнала (рис. 1). Один из них реализуется в процессе взаимодействия Т–клеточных рецепторов (ТКР) с молекулами главного комплекса гистосовместимости (ГКГ), экспрессирующимся на мембране антиген–презентирующих клеток (АПК), другой – за счет взаимодействия так называемых «ко–стимулирующих» рецепторов на Т–клетках и соответствующих лигандов на АПК [20,21]. Ключевой «ко–стимуляторный» сигнал обеспечивается за счет взаимодействия CD28 на Т–лимфоцитах и СD80/СD86 на АПК. CD28 постоянно экспрессируется на наивных CD4+ и CD8+ Т клетках, а CD80 и CD86 – только после стимуляции АПК. При наличии обоих сигналов Т–лимфоциты подвергаются пролиферации и синтезируют цитокины, которые, в свою очередь, активируют другие клетки иммунной системы, и прежде всего макрофаги. В отсутствие «ко–стимуляторного» сигнала Т–лимфоциты теряют способность эффективно «отвечать» на антигенные стимулы и подвергаются апоптозу. Наиболее мощным физиологическим ингибитором взаимодействия CD28–CD80/CD86 является CTLA4 (cytotoxic T–lymphocyte–associated antigen 4) – рецептор для CD80/CD86, который экспрессируется после активации АПК и взаимодействует с этими лигандами с более высокой авидностью (примерно в 500–2500 раз выше), чем CD28. Эта молекула рассматривается, как негативный регуляторный рецептор, который ограничивает неконтролируемую активацию Т–клеток в процессе иммунного ответа.
Это послужило основанием для разработки препарата абатацепт (Abatacept, Orencia, Bristol Myers Squibb), который представляет собой растворимую гибридную белковую молекулу, состоящую из двух компонентов – внеклеточного домена CTLA4 человека и модифицированного Fc (CH2 и CH3 области) фрагмента IgG1 (рис. 2). Модификация Fc фрагмента обеспечивает низкую способность абатацепта индуцировать комплемент–зависимые и антитело–зависимые клеточные цитотоксические реакции. Как и нативный CTLA4, этот белок связывается с более высокой авидностью с CD80/86, чем с CD28, и блокирует активацию Т–клеток (рис. 3).
По данным экспериментальных исследований, абатацепт подавляет развитие коллагенового артрита (классическая лабораторная модель РА у человека) при введении препарата во время иммунизации лабораторных животных коллагеном и замедляет прогрессирование артрита при введении на фоне его развития [22].
Абатацепт разрешен к применению для лечения РА в США (декабрь 2005), Канаде (июнь 2006) и Европе (май 2007) и проходит клиническую апробацию для лечения рассеянного склероза, псориаза и системной красной волчанки.
Лечение абатацептом проводится путем внутривенной инфузии препарата в дозе 10 мг/кг (500 мг при весе пациента менее 60 кг; 750 мг при весе 60–100 кг и 1000 мг при весе более 100 кг), затем через 2 и 4 нед., ежемесячно.
Эффективность
Клинические испытания, в которых была продемонстрирована высокая эффективность и безопасность абатацепта при РА, начались еще в конце прошлого века [23–25]. В дальнейшем была проведена серия рандомизированных плацебо–контролируемых исследований (РКПИ) в рамках фазы III клинических испытаний, которые соответствовали современным стандартам исследования современных БПВП [26–36].
Целью исследования AIM (Abatacept in Inadequate responders to Methotrexate) [26] являлось изучение клинической эффективности и влияния на прогрессирование деструкции суставов комбинированной терапии абатацептом и МТ по сравнению с монотерапией МТ у пациентов с активным РА с неадекватным ответом на МТ. В этом исследовании установлена более высокая эффективность комбинированной терапии абатацептом и МТ по сравнению с монотерапией МТ (рис. 4). Результаты 2–летнего наблюдения за пациентами продемонстрировали длительное сохранение эффекта комбинированной терапии: ACR20/50/70 наблюдался соответственно у 80,3, 55,6 и 34,3% пациентов, низкая активность по DAS28 – у 56,1%, а ремиссия – у 30,9% (рис. 5). Установлено: в целом комбинированная терапия оказывает более выраженное влияние, чем монотерапия на прогрессирование деструкции суставов (1,07 ед. по сравнению с 2,4 ед.), в первую очередь за счет влияния насчет эрозий, но не на сужение суставной щели. Эффект в отношении замедления деструкции суставов сохранялся в течение двух лет терапии [31]. У тех пациентов, которые в течение второго года терапии вместо плацебо получали лечение абатацептом, наблюдалось замедление прогрессирования деструкции суставов (2,4 ед. через год лечения плацебо и 3,1 через год лечения абатацептом). В группе больных, получавших абатацепт в течение 2 лет, этот показатель составил 1,07 ед. в конце первого года и только 1,5 ед. в течение второго года. Эти данные указывают на нарастание эффективности абатацепта в отношении замедления деструктивного процесса в суставах в процессе длительного лечения препаратом.
В открытой фазе исследования [25], в котором была установлена более высокая эффективность комбинированной терапии абатацептом и МТ по сравнению с монотерапией МТ, было показано, что лечение абатацептом и МТ эффективно в течение 5 лет терапии (рис. 6) и не сопровождается нарастанием частоты побочных эффектов [36].
ATTEST (Abatacept or infliximab versus placebo, A Trial for Tolerability, Efficacy and Safety in Treating RA) – первое и пока единственное исследование, в котором сравнивалась эффективность и безопасность двух ГИБП – абатацепта и ингибитора ФНО–a инфликсимаба [29] (рис. 7). Через 6 мес. пациенты, получавшие плацебо, переключались на лечение абатацептом. Через 6 мес. все анализируемые параметры эффективности (критерии ACR и EULAR) в группе пациентов, получавших абатацепт и инфликсимаб, были достоверно лучше, чем у пациентов, получавших плацебо (рис. 8 и 9). Отмечена определенная тенденция к более высокой эффективности и длительности сохранения эффекта у абатацепта по сравнению с инфликсимабом (рис. 8). Однако следует подчеркнуть: в группе пациентов, получавших инфликсимаб, не допускалась эскалация дозы препарата (более 3 мг/кг). Это не позволяет сделать заключение о более высокой эффективности абатацепта по сравнению с инфликсимабом.
Исследование ATTAIN (Abatacept Trial in Treatment of Anti–TNF Inadequate Responders) было посвящено оценке эффективности абатацепта у пациентов с неэффективностью ингибиторов ФНО–a [27]. Через 6 мес. эффективность абатацепта (ACR20) была существенно выше (50,4%), чем в группе плацебо (19,5%). Сходные данные получены при анализе числа пациентов с низкой активностью и достигших ремиссии по критерию EULAR (p<0,001) (рис. 10). Данные 18–месячной открытой фазы этого исследования свидетельствуют о длительном сохранении эффекта (ACR20 – 56,2%).
Важные результаты получены в открытом исследовании ARRIVE (Abatacept Researched in RA patients with an Inadequete anti–TNF response to Validate Effectiveness), в которое вошло 1046 больных с активным РА, несмотря на лечение ингибиторами ФНО–a [28]. Основной целью исследования было получение данных об эффективности и безопасности абатацепта у пациентов с РА в условиях, максимально приближенных к реальной клинической практике. В исследование были включены пациенты с побочными эффектами (или плохой переносимостью) ингибиторов ФНО–a и пациенты, которым проводилось профилактическое лечение по поводу латентного туберкулеза (положительная туберкулиновая проба, но отсутствие изменений при рентгенологическом исследовании легких). Кроме того, допускались прием любых БПВП и монотерапия абатацептом и возможность прямого перехода на лечение абатацептом без периода предварительной «отмывки» после завершения лечения ингибиторами ФНО–a. Было выделено 2 группы пациентов. В первую вошли 449 пациентов, которым проводилась «отмывка» перед назначением абатацепта, и 597 пациентов, которым лечение назначалось сразу после прекращения лечения ингибиторами ФНО–a. Установлено, что схема перехода на лечение абатацептом не влияет на эффективность (рис. 11) и, что самое важное – на безопасность терапии, по крайней мере, в течение первых 6 мес. наблюдения за пациентами. Так, частота ПЭ составила в сравниваемых группах 78% vs. 79,2%, тяжелых ПЭ – 11,1 и 9,9%, а частота прерывания лечения из–за побочных эффектов 3,8% vs. 4/0%.
Как уже отмечалось, современные принципы фармакотерапии РА основаны на ранней агрессивной терапии в дебюте болезни. Особый интерес представляют данные недавно завершенного исследования [34], целью которого было изучение эффективности комбинированной терапии абатацептом и МТ по сравнению с монотерапией МТ у пациентов с ранним РА, впервые начавших получать МТ. При этом пациенты с РА страдали прогностически неблагоприятной формой заболевания, характеризующейся высокими титрами ревматоидного фактора (РФ) и антител к циклическому цитруллинированному пептиду (аЦЦП), которые рассматриваются, как маркер агрессивного течения РА [37]. Установлено, что комбинированная терапия абатацептом и МТ существенно превосходит по эффективности монотерапию МТ, в том числе по частоте развития ремиссии (рис. 12). Интересно, что сходные данные получены в процессе исследования COMET, в котором сравнивалась эффективность комбинированной терапии ингибитором ФНО–a – этанерцептом по сравнению с монотерапией МТ у пациентов с ранним РА [38]. Эти данные свидетельствуют о потенциальной возможности применения не только ингибиторов ФНО–a, но и абатацепта при раннем РА.
В недавних исследованиях было показано, что назначение МТ у пациентов с недифференцированным артритом (НДА) позволяет замедлить (и в некоторых случаях предотвратить) трансформацию НДА в достоверный РА [39], причем эффективность МТ ассоциировалась с обнаружением аЦЦП в сыворотках крови пациентов. Возникает вопрос: может ли агрессивная терапия ГИБД на стадии НДА приостановить развитие РА на самой ранней стадии болезни? Это послужило основанием для проведения специального РКПИ (фаза II) [35], в которое вошли 55 аЦЦП–позитивных пациентов с НДА (
Источник
При подозрении на ревматоидный артрит (РА) проводится тщательное обследование пациента. Трудности при диагностировании патологии возникают из-за пока еще не установленных причин развития воспалительной реакции. Поэтому пациентам показан ряд лабораторных и инструментальных исследований, необходимых для выявления самого заболевания, стадии его течения, степени поражения суставных структур.
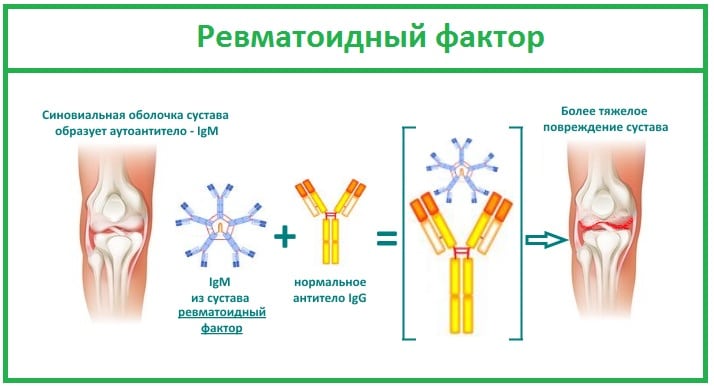
Ведущим диагностическим признаком РА считается ревматоидный фактор — специфические иммуноглобулины, вырабатываемые в процессе иммунного ответа. Но у более 20% больных серонегативной формой РА этого маркера суставной патологии в крови не обнаружено. При комплексном обследовании пациентов заболевание подтверждается анализами на антинуклеарный фактор, АЦЦП, С-реактивный белок. Биохимический анализ крови при ревматоидном артрите позволяет с максимальной точностью выявить аутоиммунную патологию.
Диагностические критерии
Важно знать! Врачи в шоке: “Эффективное и доступное средство от боли в суставах существует…” Читать далее…
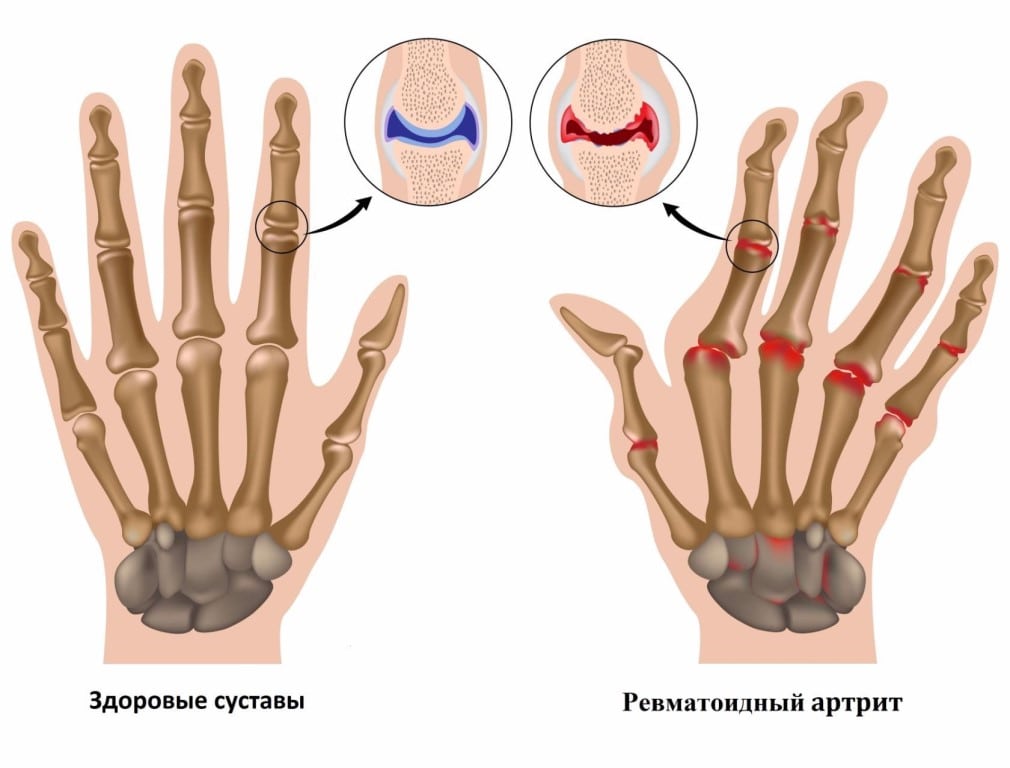
Для ревматоидного артрита характерны эрозивно-деструктивные поражения преимущественно мелких периферических суставов. Заболевание опасно постепенным разрушением сочленений, расстройствами работы внутренних органов. Снижение их функциональной активности можно отследить по изменению состава биологических жидкостей — крови, мочи, синовия. Часто биохимические исследования помогают окончательно выставить диагноз «ревматоидный артрит», подтвердив результаты рентгенографии, МРТ, КТ, артроскопии. При подозрении на развитие патологии необходимо проведение следующих анализов:
- общего анализа мочи;
- общего анализа крови, включая подсчет СОЭ (скорость оседания эритроцитов);
- биохимический анализ крови для установления уровней печеночных ферментов, креатинина, С-реактивного белка;
- обнаружение ревматоидного фактора, антицитруллиновых и антинуклеарных антител;
- выявления маркеров развития гепатитов в качестве дифференциальной диагностики реактивных артритов.
Это самые распространенные методы клинического выявления заболевания суставов. Диагностика ревматоидного артрита по лабораторным анализам одновременно позволяет оценить общее состояние здоровья.
Клинические анализы крови, мочи, кала
Общий анализ крови при артрите позволяет установить ее качественный и количественный состав, физико-химические свойства. Обнаружение некоторых биохимических субстратов помогает определить протекающий в организме воспалительный процесс, в том числе спровоцированный патогенными микроорганизмами.
| Исследования крови, назначаемые при подозрении на развитие ревматоидного артрита | Характерные особенности диагностических мероприятий |
| Определение уровня лейкоцитов | Состояние, при котором в крови повышается количество лейкоцитов. Такое изменение состава крови выявляется при тяжелом течении ревматоидного артрита с присутствием внесуставной симптоматики. Обычно лейкоцитоз выявляется одновременно с повышенным уровнем ревматоидного фактора и служит показанием для назначения пациенту глюкокортикостероидов. Большое количество лейкоцитов в системном кровотоке может быть признаком инфицирования вирусами, бактериями, грибками, что требует дифференциальной диагностики |
| Установление содержания гемоглобина | С помощью этого критерия можно оценить активность РА. Выявляется анемия только у 50% больных. Причина резкого снижения гемоглобина — воспалительный процесс, негативно сказывающийся на состоянии иммунитета. Железодефицитная анемия выявляется несколько реже, требует дифференциальной диагностики для исключения внутренних кровотечений |
| Выявление концентрации лимфоцитов | Повышенный уровень лимфоцитов при одновременном снижении количества лейкоцитов — типичный маркер вирусной инфекции. Подтверждения — увеличение лимфатических узлов, клинические проявления общей интоксикации организма. Такое изменение состава крови характерно для реактивного артрита, спровоцированного проникновением в суставные полости возбудителей гепатита |
Самый информативный анализ для диагностики артрита — скорость оседания эритроцитов. Это неспецифический лабораторный показатель, отражающий соотношение фракций белков плазмы. Кроме клеточных элементов, в крови содержатся белки, вода, различные биохимические субстраты. Эритроциты (красные кровяные тельца) не могут долго оставаться во взвешенном состоянии в пробирке с кровью, поэтому начинают опускаться на дно. Скорость их оседания зависит от присутствия в крови других компонентов. Если в ней много белков (диагностических маркеров воспаления), то эритроциты формируют агрегаты и быстро опускаются на дно пробирки. Выявления высоких значений СОЭ свидетельствует о протекании острого воспаления, которое может быть признаком аутоиммунной реакции. Такие параметры указывают и на развитие тяжелой формы РА, поражение внутренних органов.
Если при исследовании образцов мочи обнаружен повышенный уровень белка и лейкоцитов, необходимо устанавливать локализацию воспаления в организме. Это только косвенный признак ревматоидного артрита, требующий дальнейшей диагностики. Обязательно выявляется содержание в моче:
- глюкозы;
- кетоновых тел;
- билирубина;
- эритроцитов;
- эпителиальных клеток.
Повышенный уровень солей может указывать на нарушение обмена веществ, осложняющего течение РА.
Анализ кала при диагностировании ревматоидного артрита проводится для исключения реактивной патологии. Ее развитие провоцирует неадекватный ответ иммунной системы на проникновение в организм хламидий, сальмонелл, шигелл. Микроорганизмы легко выявляются при бактериологическом исследовании кала.
Биохимический анализ крови
Обнаружение в крови определенных биохимических компонентов помогает установить воспалительный процесс в суставах, его интенсивность и стадию течения. Например, при рецидивах РА повышается уровень белка гаптоглобина, что служит признаком разрушения большого количества красных кровяных телец.
При проведении биохимического анализа крови на ревматоидный артрит обязательно определяется уровень фибриногена — специфического белка, находящегося в сыворотке в растворенном виде. Он служит субстратом для образования тромбов при сворачивании крови. У больных РА уровень фибриногена существенно превышает значения нормы (2-4 г/л).
Неспецифическим диагностическим маркером РА является уровень сиаловых кислот — актированных производных нейраминовой кислоты, которые входят в состав гликопротеинов. В плазме здорового человека их концентрация колеблется в пределах 2-2,33 ммоль/л. На развитие РА указывает превышение этого показателя, свидетельствующее о воспалении в суставных соединительнотканных структурах.
“Врачи скрывают правду!”
Даже “запущенные” проблемы с суставами можно вылечить дома! Просто не забывайте раз в день мазать этим…
>
При проведении биохимического анализа крови при ревматоидном артрите выявляется содержание серомукоидов (сывороточных протеинов), иммуноглобулинов, пептидов. Если их концентрация превышает значения нормы, то врачи подозревают острое, прогрессирующее течение РА.
C-реактивный белок

Так называется белок плазмы крови, относящийся к группе протеинов острой фазы, концентрация которых повышается при воспалительном процессе. С-реактивный белок вырабатывается в большом количестве во время иммунного ответа на проникновение в организм инфекционных или аллергических агентов. Обнаружение уровня этого диагностического маркера помогает дифференцировать РА от артритов невоспалительного характера. Количественное содержание С-реактивного белка необходимо для оценки активности воспаления. Этот критерий в дальнейшем позволяет отследить:
- результативность терапии;
- вероятность прогрессирования дегенеративно-дистрофических изменений в хрящевых, костных, соединительнотканных структурах.
Биохимический маркер не специфичен, так как не позволяет точно выяснить, что спровоцировало воспаление и ее локализацию. Уровень С-реактивного белка всегда увеличивается при аутоиммунных, бактериальных, вирусных патологиях. Но обнаружение этого изменения состава крови с высокой вероятностью указывает на развитие системной патологии, поражающей не только суставы, но и внутренние органы.
Ревматоидный фактор
Важный диагностический маркер РА, обнаруживаемый в крови более чем у 80% пациентов. Ревматоидный артрит развивается при атаке иммунной системы на собственные клетки организма, принимаемые ею за чужеродные белки. Для их уничтожения она продуцирует огромное количество антител — ревматоидного фактора. Эти иммуноглобулины разрушают сначала синовиальную оболочку, а при отсутствии врачебного вмешательства вскоре поражают соединительные ткани внутренних органов.

Ревматоидный фактор — один из важных диагностических критериев РА. Но является высокоспецифичным, но требует подтверждения данными, полученными при проведении инструментальных исследований. Дело в том, что высокий уровень ревматоидного фактора в крови характерен и для других заболеваний:
- системной красной волчанки;
- дерматомиозитов;
- васкулитов;
- склеродермии;
- бактериальных, вирусных, грибковых, паразитарных патологий.
Высокий уровень ревматоидного фактора на начальном этапе РА, когда суставы повреждены незначительно, является характерным признаком быстрого прогрессирования и тяжелого течения патологии. Этот критерий часто выявляется во время терапии для оценки ее эффективности.
Антицитруллиновые и антинуклеарные антитела
В процессе аутоиммунной реакции продуцируются антинуклеарные антитела, предназначенные для атаки белковых ядер собственных клеток организма. Показанием для определения количественного содержания обычно становится высокий уровень СОЭ, указывающий на развитие воспалительного процесса. Маркер неспецифичен, так как выявляется и при других патологиях:
- коллагенозе, системной красной волчанке, поражающих соединительные ткани;
- склеродермии;
- гепатите;
- реактивном артрите.
С помощью уровня антинуклеарных антител удается косвенно подтвердить развитие РА. Это особенно ценно при его серонегативной форме с отсутствием ревматоидного фактора в крови.
Самый специфичный маркер, выявляющий при проведении биохимических анализов при артрите, — наличие в крови антицитруллиновых антител, вырабатываемых иммунной системой к циклическому цитруллиновому пептиду. Химическая структура цитруллина схожа со строением аминокислоты, входящей в состав белковой молекулы. Эти белки — строительные элементы суставной капсулы, которая атакуется иммуноглобулинами при РА.
Если в крови пациента обнаруживается повышенный уровень АЦЦП, то с более чем 90% вероятностью можно предположить развитие ревматоидного артрита. Выявление антицитруллиновых антител позволяет обнаружить суставную патологию на начальной стадии и сразу приступить к лечению. Ранняя диагностика РА помогает избежать тяжелейших осложнений, в том числе необратимого поражения внутренних органов. Но, несмотря на высокую специфичность маркера, в некоторых случаях повышенный уровень АЦЦП указывает на развитие других заболеваний, не связанных с опорно-двигательным аппаратом.
Проведения этих лабораторных анализов на ревматоидный артрит бывает достаточно для подтверждения диагноза. Но в ревматологии существует 7 критериев, позволяющих с высокой точностью установить аутоиммунную патологию. Это количество вовлеченных в воспалительный процесс суставов, симметричность их поражения, выраженность симптоматики, длительность течения заболевания. При обнаружении у больного 4 из 7 критериев пациенту выставляется окончательный диагноз.
Похожие статьи
Как забыть о болях в суставах?
- Боли в суставах ограничивают Ваши движения и полноценную жизнь…
- Вас беспокоит дискомфорт, хруст и систематические боли…
- Возможно, Вы перепробовали кучу лекарств, кремов и мазей…
- Но судя по тому, что Вы читаете эти строки – не сильно они Вам помогли…
Но ортопед Валентин Дикуль утверждает, что действительно эффективное средство от боли в суставах существует! Читать далее >>>
загрузка…
Источник