Т лимфоциты продуцируют интерлейкин 2

Интерлейкин-2 (ИЛ-2) — первый молекулярно-клонированный цитокин, представлялся как важнейший фактор роста Т-клеток, необходимый для их пролиферации и дифференцировки. Последующие исследования показали, что ИЛ-2 способствует генерации, выживаемости и функциональной активности регуляторных Т-клеток Foxp3+ (Treg или Т-супрессоры; Foxp3 — транскрипционный фактор, регулирующий транскрипцию генов, ответственных за дифференцировку Т-клеток и экспрессию цитокинов), и в его отсутствие наблюдается глубокий дефицит Т-супрессоров, приводящий к развитию аутоиммунных заболеваний. Таким образом, ИЛ-2 имеет двойные и противоположные функции: поддержание регуляторных Т-клеток и индукция эффекторных клеток, одновременный контроль и стимуляция иммунных реакций.
Самым ранним терапевтическим применением ИЛ-2 была стимуляция иммунного ответа у онкобольных. Не так давно появились терапевтические стратегии использования ИЛ-2, моноклональных антител к нему, или применения химических модификаций ИЛ-2 для увеличения числа и функции клеток Treg с целью лечения аутоиммунных заболеваний. Однако остается актуальной проблема одновременной генерации эффекторных клеток и клеток памяти, естественных киллеров и других лимфоидных популяций при использовании в лечении ИЛ-2.
История
Интерлейкин-2 (ИЛ-2) был выявлен как аутокринный фактор роста для культивируемых Т-клеток и был первым цитокином, клонированным в 1983 году. Вскоре была установлена его роль в стимуляции пролиферации Т-клеток и дифференцировке эффекторных и клеток памяти. Это подтолкнуло к клиническим испытаниям для оценки способности высоких доз ИЛ-2 стимулировать противоопухолевый иммунный ответ у пациентов с меланомой, раком почек и другими опухолями. Фактически, ИЛ-2 был первым биологическим продуктом, полученным с использованием технологии рекомбинантной ДНК, который был введен онкобольным и ВИЧ-инфицированным пациентам для стимуляции Т-клеток и, таким образом, заложил основу одной из великих революций биотехнологии и клинической медицины. Успех ИЛ-2 в качестве иммунотерапии опухолей был ограничен токсичностью, вызванной необходимостью введения высоких доз, проявляющейся как “цитокиновая буря” и синдром капиллярной утечки. Еще одним доказательством роли ИЛ-2 как важного фактора роста Т-клеток in vivo является использование моноклональных антител для подавления отторжения трансплантатов (таких как базиликсимаб, действующее вещество которого блокирует α-субъединицу ИЛ-2 рецепторного комплекса (IL-2Rα, который также известен как CD25 антиген) на поверхности Т-лимфоцитов).
В 1980-х и 1990-х годах в ходе некоторых наблюдений догма об основной роли ИЛ-2 лишь в качестве индуктора активации эффекторных клеток начала подвергаться сомнению. В ходе исследований было установлено быстрое возникновение аутоиммунных реакций на фоне блокирования ИЛ-2 или его рецептора CD25. Эти данные свидетельствовали о том, что значимая функция ИЛ-2 заключается в контроле иммунных реакций и поддержании иммунологической толерантности, а его отсутствие приводит к дефектному контролю эффекторных клеток, что приводит к аутоиммунной агрессии.
Функции и механизмы регуляции интерлейкина-2
ИЛ-2 необходим для выживания и реализации супрессивных функций регуляторных Т-клеток (которые определяются как CD4+, Foxp3+, CD25+, CD127), а отсутствие ИЛ-2 или нарушение его связи с рецептором проявляется численным и/или функциональным дефицитом регуляторных Т-клеток, что является причиной аутоиммунных реакций. Многие экспериментальные подходы показали, что этот цитокин имеет решающее значение для поддержания функционирования клеток Treg: в отсутствие ИЛ-2 T-супрессоры исчезают из периферических лимфоидных органов, по-видимому, потому, что дефицит этого фактора роста приводит к апоптотической гибели клеток.
Так же важна, как роль ИЛ-2 в выживании регуляторных Т-клеток, его необходимость для реализации функциональной мощности клеток Treg. Он необходим для экспрессии Foxp3 и других медиаторов Treg, подавляющих клеточную активность. Стабильная экспрессия Foxp3 реализуется за счет связи с его промотором ИЛ-2-индуцированного транскрипционного фактора Stat5. Ограниченная доступность ИЛ-2 в тканях, подвергшихся локальному воспалению, может привести к нестабильности клеток Treg, потере экспрессии Foxp3 и последующему производству патогенных цитокинов эффекторными клетками, которые могут усугубить аутоиммунизацию.
Поскольку зрелые клетки Treg не производят ИЛ-2, а он, предположительно, функционирует аутокринно, неизвестен был источник цитокина, который поддерживает на периферии регуляторные Т-клетки. Предполагалось, что стандартные (Foxp3-) Т-клетки продуцируют ИЛ-2, который затем действует на Т-супрессоры. Эта теория была подтверждена исследованиями, проведенными в условиях внутривидовой визуализации и показавшими, что регуляторные и стандартные Т-клетки локализуются вместе с антигенпредставляющими дендритными клетками, и в этих трехклеточных кластерах стандартные клетки реагируют на антиген путем секреции ИЛ-2, тогда как клетки Treg этот цитокин принимают.
Таким образом было установлено, что ИЛ-2 служит, по-видимому, обеим задачам: как стимуляции иммунного ответа, так и его контролю и сдерживанию (рис.1). Интересен вопрос о том, при каких обстоятельствах какая функция доминирует. Одно из предположений заключается в том, что доминирующая функция определяется количеством и кинетикой продукции ИЛ-2: индукция эффекторных клеток в ответ на кратковременное воздействие высоких доз цитокина и регуляторных клеток в ответ на стойкое содержание низкого уровня цитокинов. На активацию различных популяций Т-клеток также влияет кинетика экспрессии интерлейкиновых рецепторов. Рецептор поглощается клеткой после связывания с цитокином, а небольшой пул внутриклеточного IL-2Rβ стандартных CD4+ Т-клеток не позволяет им поддерживать их длительную экспрессию. Регуляторные Т-клетки, напротив, имеют крупные внутриклеточные пулы рецепторных цепей, благодаря чему способны осуществлять их экспрессию и в течение длительного времени могут представлять более устойчивое выделение ИЛ-2, чем другие популяции Т-клеток.
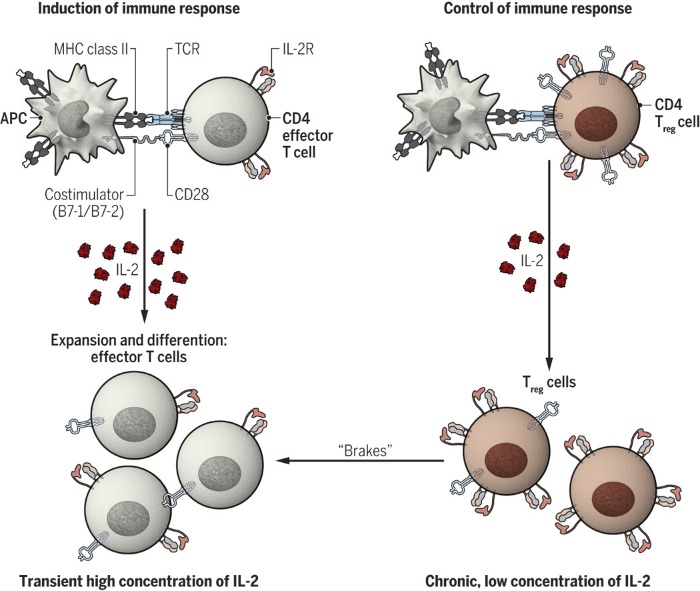
Рис. 1. Двойная роль ИЛ-2 в активации Т-клеток.
ИЛ-2 участвует в индукции иммунных реакций путем стимуляции пролиферации и дифференцировки «обычных» Т-клеток и контроля иммунных реакций за счет поддержания функции регуляторных Т-клеток. Эта двойственная активность, вероятно, различается по кинетике и количеству произведенного ИЛ-2.
MHC — основной комплекс гистосовместимости; TCR — рецептор Т-клеток; APC —антигенпредставляющая клетка.
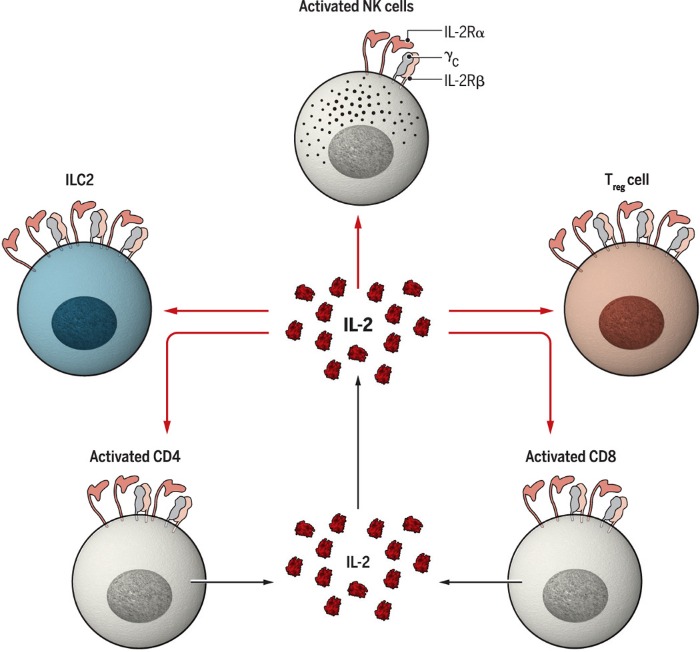
Наконец, следует упомянуть, что ИЛ-2 осуществляет важные функции по отношению к другим клеткам лимфоидного ряда, включая NK-клетки и лимфоидные клетки врожденного иммунного ответа (рис.2). В одних случаях ИЛ-2 может увеличивать подмножество CD56+ NK-клеток, которые считаются популяцией подавляющей микроокружение опухолей, в других — способствует пролиферации лимфоидных клеток врожденного иммунного ответа (ILC2), способствующим продукции ИЛ-5, что, в свою очередь, приводит к эозинофилии и альтернативной активации макрофов. Кроме того, ИЛ-2 контролирует и другие содержащие CD25+ клетки, необходимые для поддержания тканевого гомеостаза.
Рис. 2. Мишени действия ИЛ-2.
Помимо эффекторных и регуляторных Т-клеток, ИЛ-2 действует на NK-клетки и ILC. ILC2 — лимфоидные клетки врожденного иммунного ответа.
Генетические исследования ИЛ-2
Исследования в области генетики указывают на решающую роль нарушений регуляции ИЛ-2 как фактора риска аутоиммунных заболеваний. Редкие мутации, нарушающие аутокринный механизм регуляции ИЛ-2, могут вызывать тяжелые формы иммунной дисрегуляции. Дефицит IL2RA приводит к хроническому иммунодефициту и развитию IPEX-синдрома (иммуннодисрегуляция, полиэндокринопатия, энтеропатия и X-связанный синдром) — вариабельным аутоиммунным реакциям, развивающимся в первый год жизни и обусловленными мутацией транскрипционного активатора FOXP3. Мутации в транскрипционных факторах STAT5B, опосредующих сигналы ИЛ-2, также связаны с первичным иммунодефицитом и переменной аутоиммунизацией, что часто приводит к рецидивирующим инфекциям, экземе, хронической диарее и лимфоидной интерстициальной пневмонии. Варианты мутаций, также связанных с различными аутоиммунными заболеваниями, были обнаружены в генетических локусах, кодирующих ИЛ-2, его рецепторы, и связанные сигнальные факторы (включая STAT5A/STAT5B и PTPN2).
В локусе гена IL2RA однонуклеотидные полиморфизмы (ОНП, SNP) влияют на уровни транскрипта IL2RA, растворимость рецептора IL-2RA, его экспрессию на специфические для него типы иммунных клеток и распространенность экспрессирующих IL-2RA Т-клеток в крови.
Недавно разработанное изящное картирование генов (fine mapping) указывает на потенциальные ОНП с улучшенным разрешением. В качестве значимого примера, в локусе IL-2RA был отображен один некодирующий вариант ОНП в первом интроне, ассоциированный с риском болезни Крона. Парадоксально, но тот же ОНП каким-то образом связан с защитой от сахарного диабета 1 типа, что согласуется с ситуационно ограниченными эффектами ИЛ-2, оказывающих диссонансное воздействие на два разных заболевания.
Регулярно сгруппированные короткие палиндромные повторы (CRISPR) продемонстрировали, что изящно картированный IL-2RA вариант с риском аутоиммунизации снижает время индукции IL-2RA в нативных Т-клетках при стимуляции. В будущем такие работы будут иметь потенциал в качестве открытия изменения в ответ на стимуляцию в индукции IL-2RA может изменять риск развития таких заболеваний, как болезнь Крона и сахарный диабет 1 типа. Селективная генная инженерия может быть использована для определения этих связанных с заболеванием вариантов, для оценки механистического воздействия на регуляцию IL-2RA и создания лекарственного средства будущего, работающего непосредственно в отношении затронутых клеточных реакций. Кроме того, CRISPR дает возможность «корректировать» серьезные мутации, которые нарушают сигнализацию IL-2 или переписывать последовательности кодирующих генов, контролирующих специфическую регуляцию сигнальных компонентов ИЛ-2 для генной инженерии в терапии будущего.
Структура ИЛ-2 и его рецептора
ИЛ-2 представляет собой типичный четырех-α-спиральный цитокин, который жестко регулируется на уровне мРНК с помощью сигналов от T-клеточного рецептора и CD28. ИЛ-2 связывается с клеткой через рецепторный комплекс, состоящий из трех субъединиц: IL-2Rα (CD25), IL-2Rβ (CD122) и общей γ-цепи (CD132). Высокое сродство тримерного комплекса IL-2/IL-2Rα/β указывает на его большую стабильность, чем ИЛ-2, связанный либо только с одной цепью α или β. Во время взаимодействия IL-2R тример IL-2/α/β принимает γ-цепь в четвертичный комплекс, что приводит к внутриклеточной передаче сигнала. Поскольку только часть остатка ИЛ-2 взаимодействуют как с цепями β, так и с γc, связывание ИЛ-2 может индуцировать конформационные изменения в β-цепи, что будет способствовать дальнейшему привлечению цепи γc. Для сигнализации необходимы цепочки β и γc, так как α-цепь не участвует в передаче сигналов. В отсутствие экспрессии IL-2Rα, IL-2Rβ и γc могут образовывать промежуточный аффинный рецептор, который полностью компетентен для сигнала. Структура ИЛ-2 и его рецептора является гибкой и может естественным образом существовать в разных конформациях, которые образуют либо высокоаффинный тримерный IL-2R, либо промежуточный аффинный димерный IL-2R, что приводит к активации иммунных клеток.
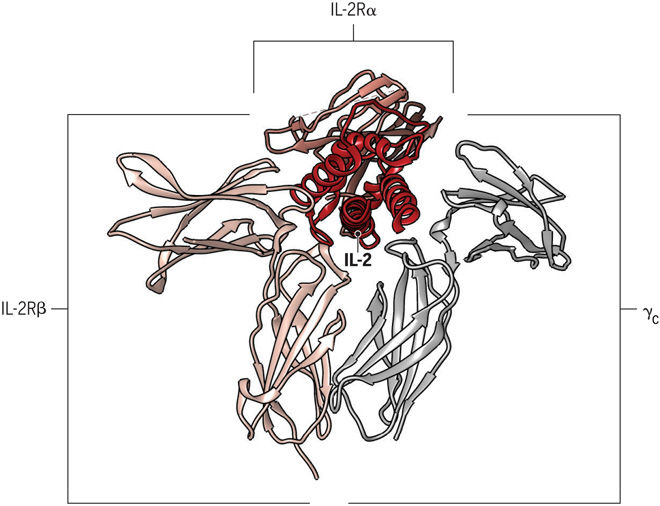
Рис. 3. Структура комплекса IL-2/IL-2R.
На диаграмме изображено, как цитокин взаимодействует с каждой из трех цепей рецептора.
Терапевтические возможности ИЛ-2
Выяснение роли ИЛ-2 для регуляторных Т-клеток предполагало возможность использования цитокина для борьбы с нежелательным иммунным ответом, а также в лечении аутоиммунных и воспалительных заболеваний. Задача использования ИЛ-2 для подавления патологических иммунных реакций заключается в том, что цитокин может активировать эффекторную ветвь клеток лимфоидного ряда, тем самым снижая риск обострения болезни. Разрабатывается несколько подходов для таргетирования ИЛ-2 на регуляторные клетки.
Низкодозированный ИЛ-2
Тримерный IL-2Rαβγc обычно экспрессируется в больших количествах клетками Treg, тогда как димерный IL-2Rβγc представляется в основном на активированных CD8+ Т-клетках и NK-клетках. В настоящее время установлено, что терапия низкими дозами ИЛ-2 предпочтительно активирует клетки Treg из-за свойственной им высокой экспрессии IL-2Rα. Первые клинические испытания показали, что низкодозированный ИЛ-2 эффективен при лечении васкулита, ассоциированного с вирусными гепатитами, и хронической реакции трансплантат против хозяина (GVHD). В дальнейшем испытания были проведены в терапии системной красной волчанки и сахарного диабета 1 типа. Результаты до сих пор являются многообещающими, а биологический агент уже одобрен для клинического применения. Однако терапевтическое окно для доз ИЛ-2 слишком мало, что накладывает сложности на применение такого лечения.
Конъюгаты антитело-цитокин
Другим подходом с изменением структуры ИЛ-2 является создание антител к нему, которые при образовании комплексов с цитокином могут стимулировать экспрессию регуляторных или эффекторных Т-клеток. Этот подход был предложен после обнаружения способности цитокина связываться с различными ИЛ-2-антителами, блокирующими на цитокине сайты для связи с β-цепью рецептора и индуцирующими аллостерический эффект, изменяющий связывание цепи IL-2Rα. Экспериментально разработаны ИЛ-2-антитела JES6-1, стерически блокирующие взаимодействие IL-2/IL-2Rβ и IL-2/IL-2Rγ, индуцируя предпочтительную активацию клеток IL-2Rα. Другие антитела к ИЛ-2, S4B6, напротив, изменяют его конформацию приводя к блокировке взаимодействия ИЛ-2/IL-2Rα и стабилизации взаимодействия IL-2/IL-2Rβ, приводящей к избирательному таргетированию эффекторных Т-клеток.
Эти результаты были воспроизведены путем разработки моноклональных антител к ИЛ-2, которые, связываясь цитокином, приводят к его конформационным изменениям, требующим как большей экспрессии CD25, так и меньшего порога для ускорения пролиферации, что реализует усиление активации и увеличение пула клеток Treg. Было показано, что эти антитела/комплексы ИЛ-2 эффективны в моделях таких аутоиммунных заболеваний, как сахарный диабет 1 типа и экспериментальный аутоиммунный энцефаломиелит, а также в модели РТПХ (реакция «трансплантат против хозяина»). Разработка таких препаратов для клинического применения может быть улучшена путем непосредственного связывания антитела с ИЛ-2, в результате чего образуется единый агент, который может увеличивать период полувыведения ИЛ-2 и в то же время ограничивать его нецелевую токсичность.
Химические модификации ИЛ-2
Некоторые усилия были приложены для модификации самого ИЛ-2 с целью улучшения его терапевтического потенциала. Shanafelt и др. генерировали мутеин ИЛ-2 с ~3000-кратной селективностью для Т-клеток, чем для NK-клеток in vitro в сравнении с натуральным цитокином и продемонстрировал его активность in vivo на животных моделях. В 2012 году лаборатория Garcia выпустила CD25-независимую версию ИЛ-2 с повышенной аффинностью связывания с IL-2Rβ, которая показала превосходное сродство с цитотоксическими клетками, что привело к улучшению противоопухолевого ответа. Несколько компаний, в том числе Celgene, Roche, Amgen и другие, разрабатывают новые ИЛ-2 мутеин, которые преимущественно вызывают прирост эффекторных или регуляторных Т-клеток. Эти аналоги ИЛ-2 действуют как частичные агонисты и по-разному влияют на те или иные популяции лимфоцитов.
Другие подходы к повышению эффективности ИЛ-2 состоят в соединении цитокина с крупными молекулами-переносчиками, такими как альбумин или полиэтиленгликоль (ПЭГ), или с генетическим слиянием ИЛ-2 с Fc (кристаллизующийся фрагмент) иммуноглобулина. В настоящее время ведется разработка ПЭГилированного ИЛ-2 от Nektar Therapeutics с пониженной аффинностью к тримерному IL-2R регуляторных Т-клеток, который в большей степени поддерживает цитотоксические CD8+ клетки, обеспечивая выраженную противоопухолевую активность.
Клеточная терапия ИЛ-2
Потенциал влияния ИЛ-2 на отдельные подтипы T-клеток или NK-клеток может быть использован для создания цитокиновой системы, в которой пара рецептор-лиганд ограничена исключительно совместным взаимодействием. Генно-инженерные Т-клетки могут экспрессировать мутантную версию IL-2Rβ, на которую будет избирательно влиять специфический мутантный ИЛ-2. Это повышает вероятность выборочного влияния на отдельные популяции Т-клеток и, следовательно, в перспективе может использоваться для лечения как аутоиммунных, так и онкозаболеваний.
Выводы
История ИЛ-2 дает замечательные уроки о том, как концепции полностью меняются в ходе тщательных научных изысканий. Долгие годы ИЛ-2 считался основным фактором роста Т-клеток и был вовлечен в инициирование иммунных реакций. Более свежие результаты от разнообразных экспериментальных подходов предполагают, что основная функция ИЛ-2 заключается в поддержании стабильной работы регуляторных T-клеток в лимфоидных органах и тканях. Эти новые разработки и пересмотр взгляда на биологию ИЛ-2 стали основой новых терапевтических стратегий, использующих этот цитокин для подавления, а не для стимуляции иммунных реакций. Конечно, многое еще предстоит изучить, чтобы реализовать весь его потенциал: следует учитывать способность ИЛ-2 воздействовать на различные популяции клеток, многие из которых могут способствовать воспалительным реакциям и, таким образом, служить риском развития аутоиммунных заболеваний. Достижение оптимального баланса между активацией эффекторных и регуляторных Т-клеток также остается постоянной проблемой в терапевтическом применении этого цитокина. Однако многие текущие клинические разработки должны решить эти проблемы в ближайшем будущем.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
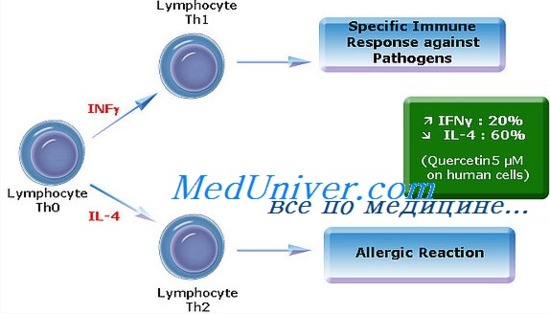
Аллергены. Т-хелперы типа 2 (Th2) при аллергических реакцияхЗа последние 30 лет значительно увеличилась частота таких аллергических заболеваний, как бронхиальная астма, пищевая аллергия, диффузный нейродермит и аллергический ринит. Термин «аллергия» впервые был предложен фон Пирке в 1906 г. для обозначения «нарушенной реактивности на обычные антигены окружающей среды». С конца 1960-х годов, когда выяснилось, что большинство страдающих аллергией лиц реагируют на антигены продукцией антител класса IgE, термин «аллергия» используется как синоним заболеваний, опосредованных IgE. Это, безусловно, слишком упрощенное понимание механизма развития аллергических заболеваний, так как у определенного числа больных бронхиальной астмой, диффузным нейродермитом и аллергическим ринитом болезнь не связана с IgE, хотя и сопровождается эозинофилией и активацией тучных клеток. Кроме того, в патогенезе которых аллергических заболеваний (например, контактного дерматита) основную роль играют Т-лимфоциты, а реакция IgE вообще отсутствует. К заболеваниям, опосредованным IgE, часто применяют термин атопия (от греч. atopos — без места). У таких больных имеется наследственная предрасположенность к аллергическим заболеваниям, проявляющаяся повышенной реактивностью ряда органов и тканей (например, легких, кожи, слизистой оболочки полости носа). Важно подчеркнуть, что в механизме этой повышенной реактивности участвуют как связанные с IgE, так и независимые от него компоненты воспаления, которые снижают порог ответа органов-мишеней на воздействие аллергена. Аллергенами называют антигены, вызывающие продукцию IgE-антител у генетически предрасположенных лиц. Большинство аллергенов представляет собой белки с молекулярной массой 10-70 кДа. Белки с меньшей молекулярной массой не связываются с молекулами IgE на поверхности тучных клеток или базофилов, а белки с большей молекулярной массой, как правило, не проникают через слизистые оболочки, не поглощаются АПК и поэтому не стимулируют иммунную систему. Аллергены нередко обладают активностью протеолитических ферментов и, возможно, увеличивая проницаемость слизистых оболочек, приводят к сенсибилизации организма. Многие аллергены, в том числе Der p 1 и Der p 2 из клещей домашней пыли (Dermatophagoides pteronyssinus), Fel d 1 из шерсти кошек, а также аллергены пыльцы деревьев, трав и водорослей (включая Bet v 1 березы, Phl p 1 и РЫ р 5 тимофеевки и Amb a 1, 2, 3 и 5 гигантской амброзии), выделены, их гены клонированы.
Т-хелперы типа 2 (Th2) при аллергических реакцияхДействию потенциальных аллергенов подвергаются все люди. У лиц, не имеющих наследственной предрасположенности к аллергическим заболеваниям, в ответ на воздействие аллергенов происходит пролиферация Т-хелперов типа 1 (Тh1), секретирующих цитокины (включая ИФН-у), которые стимулируют продукцию специфических для каждого аллергена IgG-антител. ТЫ, как правило, участвуют в уничтожении внутриклеточных микроорганизмов, таких как микобактерии, поскольку выделяемые этими клетками цитокины активируют фагоциты и способствуют образованию опсонизирующих и комплементфиксирующих антител. Генетически предрасположенные лица реагируют на аллергены быстрой пролиферацией Th2, которые секретируют цитокины, ускоряющие синтез IgE-антител и участвуют в защите организма от внеклеточных возбудителей, например паразитов. При атопических реакциях образуются аллергенспецифические IgE-антитела. Их присутствие выявляют путем анализа сыворотки или по возникновению аллергической реакции немедленного типа на внутрикожное введение экстракта аллергена. Ключевую роль в переключении синтеза классов иммуноглобулинов на синтез IgE играют продуцируемые Тh2-клетками цитокины — ИЛ-4 и ИЛ-13. ИЛ-5 и ИЛ-9 еще больше усиливают синтез IgE и стимулируют дифференцировку и пролиферацию эозинофилов. ИЛ-3, ИЛ-4 и ИЛ-9 совместно активируют образование тучных клеток. Таким образом, цитокинам Тh2-клетками принадлежит важнейшая роль в патогенезе бронхиальной астмы и других аллергических заболеваний. Действительно, ткани, остро реагирующие на аллергены, оказываются инфильтрированными Тh2-клетками. Интересно, что при хронических аллергических реакциях обычно находят инфильтрацию тканей и Тh1-, и Тh2-клетками. Это важно отметить, поскольку цитокины Тh1-клеток (такие, как ИФН-у) усиливают функцию эффекторных клеток аллергического воспаления (эозинофилов) и тем самым в какой-то мере определяют тяжесть заболевания. Т-лимфоциты плода принадлежат в основном к Тh2-типу, и это снижает реактивность материнской иммунной системы по отношению к аллоантигенам плода. В норме у ребенка после рождения преобладают Тh1-клетки, которые и опосредуют реакции на аллергены окружающей среды. У детей же с наследственной предрасположенностью к атоническим реакциям продолжает нарастать количество Тh2-клеток, которые во время беременности могли встречаться с материнскими аллергенами вследствие их прохождения через плаценту. Основным стимулом для реакций, опосредуемых Тh1-клетками, являются микробы. Макрофаги или дендритные клетки (ДК) под влиянием микробных продуктов, таких как эндотоксин, секретируют ИЛ-12 — важнейший активатор Thl-клеток. Поскольку Thl-клетки тормозят развитие Тh2-клеток, факторы, стимулирующие дифференцировку Th1-клеток, ослабляют аллергические реакции. К таким факторам относятся высокоаффинные взаимодействия Т-лимфоцитов с АПК, большие количества антигена, цитокины Thl-клеток (ИЛ-12 и ИЛ-18) и микробная ДНК, содержащая цитидинфосфат-гуанозиновые повторы. Напротив, цитокины Тh2-клеток (ИЛ-4), простагландин Е2, оксид азота, низкоаффинные взаимодействия Т-лимфоцитов с АПК и небольшие количества антигена способствуют формированию Тh2-фенотипа. – Также рекомендуем “Антигенпредставляющие (дендритные) клетки при аллергических реакциях” Оглавление темы “Последствия трансплантации стволовых клеток крови”:
|
Источник