Т лимфоциты лечение рака
 Смелый эксперимент с живыми Т-лимфоцитами, в основе которого лежит иммунотерапия, подает большие надежды на возможность излечения последней стадии онкологических заболеваний. Результаты процедуры по-настоящему впечатляют даже самых отъявленных скептиков: у 27 из 29 пациентов с раком крови в последней стадии, прошедших экспериментальный курс «живительной» иммунотерапии, врачи наблюдают устойчивую ремиссию.
Смелый эксперимент с живыми Т-лимфоцитами, в основе которого лежит иммунотерапия, подает большие надежды на возможность излечения последней стадии онкологических заболеваний. Результаты процедуры по-настоящему впечатляют даже самых отъявленных скептиков: у 27 из 29 пациентов с раком крови в последней стадии, прошедших экспериментальный курс «живительной» иммунотерапии, врачи наблюдают устойчивую ремиссию.
Суть инновационной процедуры заключается в том, что собственные Т-лимфоциты пациента «перепрограммируются» таким образом, чтобы уничтожать раковые клетки по всему организму вне зависимости от того, какой орган они поразили. Частично это стало возможным благодаря последним достижениям генной инженерии: с помощью генных модификаций Т-лимфоциты становятся синтетическими молекулами под названием химерические антигенные рецепторы, способные уничтожать опухолевые клетки, разрушающие организм пациента. В число участников эксперимента входят пациенты, страдающие острым лимфобластным лейкозом, неходжкиновской лимфомой и хронической лимфоцитарной лейкемией.
Ввиду того, что Т-лимфоциты имеют способность продолжать размножаться после введения в организм пациента, терапия может проводиться лишь единожды и не нуждаться в цикличных повторениях. Это выгодно отличает эксперимент от широко применяемой сегодня химиотерапии, которые нужно регулярно повторять из-за того, что человеческий организм выводит из себя все инородные клетки. И появление химерических антигенных рецепторов, фактически являющихся одной из подгрупп Т-лимфоцитов, позволило Фреду Хатчу,— главному идейному вдохновителю эксперимента, достичь более продолжительных и устойчивых результатов, дающих иммунитету возможность куда лучше справляться с опухолевыми клетками.
По сути, исследователи просто забирают белые кровяные тельца из организма пациента, модифицируют их в лабораторных условиях и затем помещают обратно в иммунную систему.
Однако в этой бочке меда есть и своя ложка дегтя: некоторые источники сообщают, что двое пациентов умерли после терапии из-за неадекватной иммунной реакции организма. Сами исследователи ни подтвердили, ни опровергли эту информацию.
Эксперты назвали эксперимент «занимательным, но далеким от своей конечной цели». Вся эта информация просочилась в открытый доступ после ежегодной конференции Американской ассоциации содействия развитию науки (ААРН), прошедшей в Вашингтоне.
Ведущий исследователь профессор Стенли Риддел из расположенного в Сиэтле Центра исследований раковых заболеваний имени Фреда Хатчинсона немного рассказал о самих пациентах. Каждый из них на момент проведения процедуры уже перенес на себе все возможные методы лечения, и каждому из них оставалось жить от 2 до 5 месяцев. Профессор Риддел сказал:«Корень процесса заключается в том, что мы генетически перепрограммируем Т-лимфоциты исключительно на распознавание и уничтожение опухолевых клеток пациента. Каждый из них [пациентов] буквально стоял на пороге смерти несмотря на все перенесенные способы лечения, и всего одной дозы нашей терапии оказалось достаточно, чтобы довести более 90% пациентов до состояния полной ремиссии. Ни в ком из них мы более не наблюдаем каких-либо признаков развития лейкемии».
Однако один из экспертов высказал предположение о том, что истинную ценность проведенного исследования все еще трудно оценить по причине того, что большая часть связанных с ним данных до сих пор недоступна.
Кроме того, у семи пациентов после терапии с невиданной силой начал развиваться синдром высвобождения цитокинов, и их пришлось поместить под более пристальное наблюдение. А для двух из них он и вовсе закончился летальным исходом.
Разумеется, для пациентов, находящихся на терминальной стадии рака, в этом нет ничего удивительного. Однако сейчас все говорит о том, что этот подход уже зарекомендовал себя как гораздо более действенная мера лечения по сравнению с широко распространенными сегодня химиотерапией и радиотерапией, с помощью которых пытаются лечить пациентов по всему миру.
Источник
Статья на конкурс «био/мол/текст»: Ученые объединили методы иммунотерапии, цитотерапии и генотерапии для перепрограммирования Т-лимфоцитов в потенциальных «убийц» раковых клеток. Но и этого оказалось недостаточно — следующим шагом стало создание молекулярного «выключателя», с помощью которого можно регулировать время и силу действия активированных Т-клеток. Инновационный метод закладывает основу для резкого сокращения серьезных (а иногда и смертельных) побочных эффектов, вызванных терапией с использованием модифицированных Т-клеток.
Медицина перешла на новый уровень: клетки стали живым лекарством
В последнее время в терапии опухолевых заболеваний особое внимание уделяется адоптивной иммуноцитотерапии (от англ. adoptive — приемный). При этом часть клеток иммунной системы пациента искусственно «натравливают» на опухолевые клетки. Суть метода состоит в том, чтобы отобрать у пациента необходимые иммунные клетки, обработать их — например, иммунными цитокинами (небольшими белками, выполняющими функции регуляторов деления и дифференцировки специфических иммунных клеток), — а затем вернуть в организм уже активированные клетки, которые и будут помогать бороться с опухолями* (рис. 1).
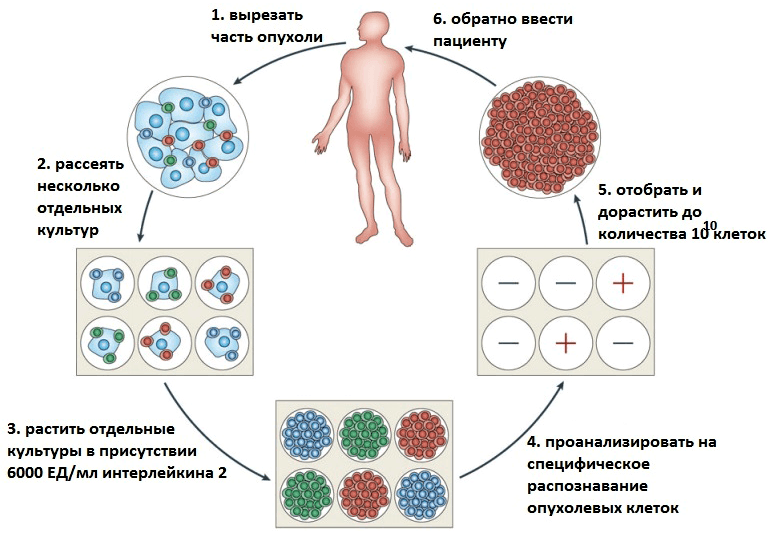
Рисунок 1. Схема получения антиопухолевых Т-клеток для адоптивной иммуноцитотерапии. Рисунок из [3].
Впервые метод адоптивной иммуноцитотерапии был описан еще в 1988 году — у пациентов с метастатической меланомой (то есть раком кожи на четвертой стадии) наблюдалась регрессия заболевания при терапии с помощью их TIL-клеток (лимфоцитов, инфильтрующих опухоль) [2]. В настоящее время терапия метастатической меланомы на основе TIL-клеток является наиболее эффективным способом лечения данного заболевания, поскольку регрессия опухоли наблюдается у половины пациентов [3].
Существует несколько вариантов клеток, которые используются в адоптивной иммунотерапии; из них три используются при терапии опухолевых заболеваний: уже знакомые нам TIL-клетки (лимфоциты, инфильтрующие опухоль), LAC-клетки (лимфокин-активированные киллеры) и CIK-клетки (цитокин-индуцированные киллеры). На самом деле собственные Т-клетки организма тоже стараются бороться с опухолевыми клетками, только зачастую опухолевые клетки им «не по зубам». Не то, чтобы совсем — ведь существует иммунный надзор, осуществляемый Т-клетками и естественными киллерами (NK-клетками), с помощью которых иммунная система старается защититься от опухолей, — однако это вовсе не стопроцентная защита. Однако случается, что иммунный надзор не всегда достаточно силен, чтоб предотвратить развитие опухолей: так, при длительном применении иммунодепрессантов после трансплантаций органов повышается частота развития многих опухолей [4].
Необходима система наведения
Несмотря на сложность получения модифицированных клеток, а также сопутствующий риск возникновения серьезных побочных эффектов, все же главной проблемой метода иммуноцитотерапии является отсутствие способов прицельной доставки вводимых модифицированных иммунных клеток в опухоль. Раковые клетки часто делаются практически «невидимыми» для иммунной системы, и они образуют микросреду, которая подавляет активность и миграцию Т-клеток [5]. Для того, чтобы сбросить мантию-невидимку с опухолевых клеток, Т-лимфоциты надо не только активировать, но и придать им способность прицельно узнавать опухолевые клетки. Т-клетки могут быть перепрограммированы методами генной инженерии путем введения генов, кодирующих рецепторы к опухолевым антигенам (TAA, tumour-associated аntigens) — оснащения собственной «системой наведения». Также можно заодно ввести гены для придания Т-клеткам устойчивости к иммуносупрессии для увеличения выживаемости или облегчения проникновения сконструированных Т-клеток в опухоль. В итоге, могут быть получены высокоактивные «наемные убийцы» раковых клеток [5].
Для получения эффективных «убийц» Т-лимфоциты модифицируют путем оснащения их искусственными химерными антигенными рецепторами (CAR, chimeric antigen receptors). Рецепторы химерные, поскольку одна часть (распознающая) была «позаимствована» у моноклональных антител, а часть, передающая сигнал, — у Т-клеточного рецептора (ТCR). В качестве внеклеточной «распознающей» части обычно служат вариабельные домены тяжелой и легкой цепи иммуноглобулинов необходимой специфичности (scFv), которые образуют специфичный к опухолевым клеткам антиген-связывающий участок [5] (рис. 2).
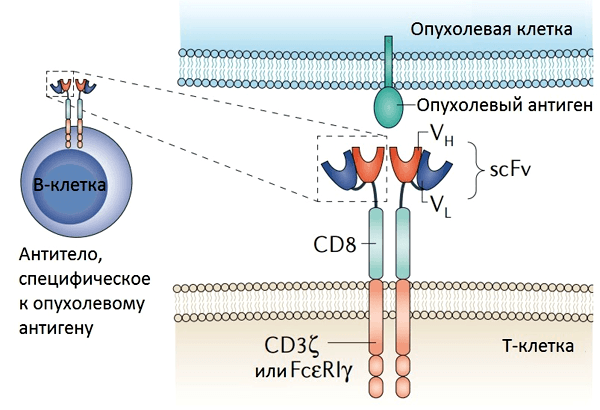
Рисунок 2. Структура химерного антигенного рецептора (CAR). CAR состоит из внеклеточного домена (одноцепочечного вариабельного фрагмента антитела (scFv)), соединенного с помощью цепей и трансмембранных доменов с цитоплазматической сигнальной областью. Гены, кодирующие scFv, получены из В-клеток, продуцирующих антитела, специфичные к опухолевому антигену. CAR существует в виде димера, и распознавание опухоли происходит напрямую (без участия MHC). Рисунок из [5].
Все новое — это хорошо забытое старое. Первые Т-клетки с химерным антигенным рецептором были получены командой ученых под руководством профессора Эсхара (Zelig Eshhar); результаты работы были опубликованы еще в 1989 году [6]. Эсхар понял, что, обладая данной техникой, Т-клетки можно запрограммировать на нацеленную атаку.
Однако с момента обнаружения химерных антигенных рецепторов до внедрения технологии в практику прошло больше 20 лет. За это время были улучшены химерные антигенные рецепторы — были созданы CAR 2-го поколения, в которые был внесен дополнительный сигнальный домен костимулирующей молекулы, который позволил улучшить активацию Т-клеток и их распространение. В CAR 3-го поколения был добавлен еще один сигнальный домен, что в конечном итоге повысило уровни выживания и размножения модифицированных Т-клеток [7] (рис. 3). В конечном итоге были улучшены способность к «выслеживанию» опухолевых клеток, а также уменьшены побочные эффекты.

Рисунок 4. Бутылка с питательной средой для Т-клеток, которые после введения в них нового рецептора выращивают около 10 дней до достижения ими количества в несколько миллиардов. Тогда они могут быть введены в вены пациента. Рисунок из [9].
Первые клинические испытания генетически модифицированных Т-лимфоцитов, несущих химерные антигенные рецепторы, прошли в 2012 году. Они выпали на долю девочки по имени Эмили, больной острой лимфобластной лейкемией. После того, как генетически модифицированные Т-клетки были обратно введены девочке, ее состояние резко ухудшилось, и она провела несколько недель в отделении интенсивной терапии на искусственной вентиляции легких. В какой-то момент жизнь Эмили висела на волоске, но в итоге девочка поправилась, и уже три года в ее организме врачи не находят даже единичных раковых клеток [8].
Побочные эффекты новой терапии
Несмотря на то, что иммуноцитотерапия Т-клетками с CAR является прорывом в области лечения опухолевых заболеваний, есть еще ряд опасностей, которые могут поджидать за углом. Доктор Карл Джун (Carl June) из университета Пенсильвании был одним из первых, кто опубликовал успешные результаты лечения модифицированными Т-клетками, сравнил то, что происходит внутри тела пациента с «серийным убийством» и «массовым убийством». Когда миллиарды Т-клеток, которые были введены в организм, поделятся, то они смогут обнаружить и убить несколько фунтов опухоли. Но в этом тоже немало риска — многие пациенты страдают от синдрома высвобождения цитокинов (цитокинового шторма) — при борьбе Т-клетки с опухолевой клеткой высвобождается большое количество молекул цитокинов, что представляет угрозу для самого организма. Так, семь пациентов умерло вследствие этого синдрома [9].
Побочные эффекты связаны с мощной иммунной активностью модифицированных Т-клеток. Одним из камней преткновения является риск высокой токсичности, не позволяющий ввести подобное лечение на регулярной основе. «Т-клетки — действительно мощные создания», — говорит профессор Венделл Лим (Wendell Lim), заведующий отделом Департамента клеточной и молекулярной фармакологии Калифорнийского университета. — «Будучи активированными, они могут вызвать смерть. Нам необходима система удаленного контроля, которая сохранит силу этих модифицированных Т-клеток, и позволит специфично „общаться“ с ними и управлять Т-клетками, находящимися в организме» [10].
Т-клетки взяли под контроль
Ученые из Калифорнийского университета в Сан-Франциско создали молекулярный «включатель», с помощью которого можно управлять действиями генноинженерных Т-лимфоцитов. Как и обыкновенные Т-клетки, несущие CAR, новые Т-клетки с «включателем» будут взаимодействовать с опухолевыми клетками, но не будут переходить «в атаку», пока не будет введен специальный препарат. Данный препарат является своеобразным «химическим мостиком» внутри Т-клеток: он запускает иммунные реакции, «включает» их, переводя в активное состояние. Когда препарат перестает циркулировать в крови, Т-клетки снова переходят в «выключенное» состояние (рис. 5).
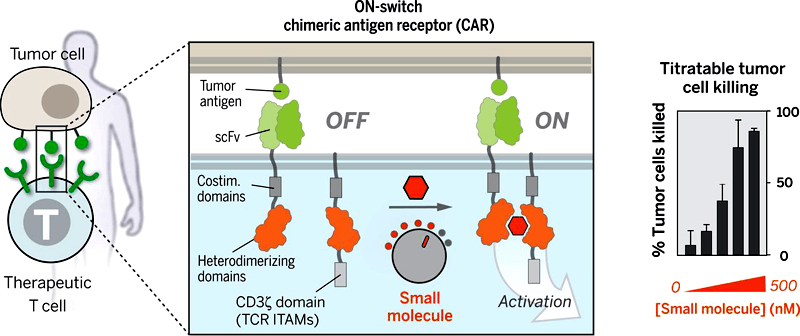
Рисунок 5. Титруемый контроль генноинженерных Т-клеток с помощью включаемого химерного антигенного рецептора. С обычным CAR Т-клетки активируются при соединении с клеткой-мишенью, при этом из-за очень сильного иммунного ответа есть риск высокой токсичности. «Включаемый» CAR требует небольшую стимулирующую молекулу для запуска терапевтической функции. Величину ответа (например, «убийства» клеток-мишеней) можно титровать, тем самым уменьшая токсичность при уменьшении количества небольшой стимулирующей молекулы. Рисунок из [11].
Внедрение «пульта управления» в Т-клетку с химерным антигенным рецептором — это пример простой и эффективной стратегии совмещения собственных и автономных решений клетки (например, обнаружение сигналов болезни) с контролируемыми пользователем из вне. Перегруппировка и расщепление основных частей CAR обеспечивает возможность «включения» и «выключения» химерных антигенных рецепторов. Данная работа также подчеркивает важность разработки оптимизированных биоинертных «пультов управления», таких как небольшие молекулы и свет, вместе с их клеточными компонентами реагирования, в целях повышения точности контролируемой терапии [11].
Таким образом, правильно дозируя препарат, можно управлять уровнем иммунной активности модифицированных Т-клеток. В частности, благодаря данной технологии можно снизить отрицательные последствия синдрома высвобождения цитокинов. Также иногда нормальные клетки экспрессируют небольшие количества белков, которые являются мишенью для Т-клеток с CAR. Поскольку модифицированные Т-клетки вводят в кровяное русло и они проходят через сердце и легкие, ткани этих органов могут быть повреждены прежде, чем Т-клетки достигнут своих намеченных целей в других частях тела. А с новой технологией Т-клетки будут в «выключенном» состоянии, пока не достигнут цели [10].
Иммунотерапия с помощью Т-клеток с CAR успешна против рака крови, но, когда дело доходит до твердых опухолей, которые образуются в толстой кишке, молочных железах, мозге и других тканях, модифицированные Т-клетки до сих пор не показывают высокой эффективности. Возможно, метод дистанционного управления Т-клетками позволит разработать более мощные версии химерных антигенных рецепторов, которые позволят Т-клеткам поражать твердые опухоли, при этом не обладая серьезными побочными эффектами.
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Rosenberg S.A., Packard B.S., Aebersold P.M., Solomon D., Topalian S.L., Toy S.T. et al. (1988). Use of tumor-infiltrating lymphocytes and interleukin-2 in the immunotherapy of patients with metastatic melanoma. A preliminary report. N. Engl. J. Med. 319, 1676–1680;
- Rosenberg S.A., Restifo N.P., Yang J.C., Morgan R.A., Dudley M.E. (2008). Adoptive cell transfer: a clinical path to effective cancer immunotherapy. Nat. Rev. Cancer. 8, 299–308;
- Ярилин А.А. Иммунология. М.: ГЭОТАР-Медиа, 2010. — 752 с.;
- Kershaw M.H., Westwood J.A., Darcy P.K. (2013). Gene-engineered T cells for cancer therapy. Nat. Rev. Cancer. 13, 525–541;
- Gross G., Waks T., Eshhar Z. (1989). Expression of immunoglobulin-T-cell receptor chimeric molecules as functional receptors with antibody-type specificity. Proc. Natl. Acad. Sci. USA. 86, 10024–10028;
- Urba W.J. and Longo D.L. (2011). Redirecting T cells. N. Engl. J. Med. 365, 754–757;
- Emily Whitehead Foundation;
- Regalado A. (2015). Biotech’s coming cancer cure. MIT Technology Review;
- Farley P. (2015). ‘Remote control’ of immune cells opens door to safer, more precise cancer therapies. University of California San Francisco;
- Wu C., Roybal K.T., Puchner E.M., Onuffer J., Lim W.A. (2015). Remote control of therapeutic T cells through a small molecule-gated chimeric receptor. Science. 350, aab4077..
Источник
Когда иммуноонкология может стать альтернативой операции, химиотерапии или облучению
Когда речь заходит о лечении рака, чаще всего приходят на ум либо хирургическая операция, либо химиотерапия, либо облучение. Однако в последнее десятилетие активно развивается инновационный метод лечения онкозаболевания – иммунотерапия. В чём суть этого метода и в каких случаях он может быть эффективен, мы поговорили с воронежскими врачами-онкологами и со специалистами Воронежского областного клинического центра общественного здоровья и медицинской профилактики.
Почему онкоклетки есть у каждого, но не все болеют раком?

Раковые клетки образуются в организме человека ежедневно. Причём не одна-две, а миллионы! Однако при нормальной работе иммунитета наш организм сам справляется с атипичными клетками, вовремя распознавая и уничтожая их.
Опухолевые клетки отличаются от здоровых наличием аномального белка – ракового антигена. Нормальный иммунитет быстро распознаёт этот антиген как чужеродный и уничтожает с помощью Т-лимфоцитов и других компонентов.
Однако в какой-то момент в организме может произойти сбой. И наш иммунитет перестаёт видеть раковые клетки. Они начинают быстро и неконтролируемо делиться. В результате чего формируется злокачественная опухоль.
Чем иммуноонкология отличается от других методов лечения рака?

Классические методы лечения рака направлены на саму опухоль. Это либо её иссечение хирургическим способом, либо воздействие на неё при помощи химиотерапии и лучевой терапии. Но при хирургическом вмешательстве всегда есть риск, что какие-то раковые клетки всё равно остались в организме и продолжат делиться. А при химиотерапии и облучении помимо этого зачастую погибают не только раковые, но и нормальные клетки. Из-за чего у пациента возникает куча побочных эффектов и осложнений (интоксикация организма, выпадение волос и т. д.).
Инновационный метод иммунотерапии отличается тем, что он направлен не на саму опухоль, а на нашу иммунную систему. При помощи определённых препаратов этот метод позволяет нашему иммунитету перестраиваться, снова распознавать раковые клетки и давать им необходимый отпор.
Иммунотерапия может быть активной, пассивной и гибридной (смешанной). Активная иммунотерапия предполагает использование собственных иммунных клеток организма для борьбы с раковыми клетками. Например, один из вариантов такой терапии заключается в том, что иммунные клетки выделяют из крови пациента или непосредственно из опухоли. Затем специфичные в отношении данной опухоли клетки культивируют и вводят обратно в организм пациента, после чего они атакуют раковые клетки.
Пассивная иммунотерапия заключается во введении в организм антител, лимфоцитов и цитокинов, которые выступают в роли «киллеров» по отношению к раковым клеткам.
Преимуществом иммуноонкологии является возможность таргетной терапии (от англ. англ. target — «цель, мишень»), когда происходит адресное воздействие именно на опухолевые клетки при максимальном сохранении здоровых тканей.
Какие виды рака можно лечить при помощи иммунотерапии?

Иммуноонкология считается эффективной при 3 – 4-й стадиях рака, когда в организме уже началось активное метастазирование, а удалить злокачественное новообразование с помощью операции невозможно. Что касается видов опухолей, то в первую очередь это меланома, рак лёгкого, мочеполовой системы у мужчин и женщин, молочной железы, различные виды лимфом, опухоли головы и шеи.
Иммуноонкология успешно применяется и когда противопоказана химиотерапия. Например, при лечении рака мочевого пузыря. При этом виде рака не всегда можно назначить химиотерапию, поскольку препараты на основе платины могут быть противопоказаны ряду пациентов из-за почечной дисфункции.
В ряде случаев даже при запущенных формах рака иммунотерапия позволяет остановить рост опухолей или даже уменьшить их в размерах и существенно продлить жизнь пациента.
Почему иммунотерапия не всегда эффективна?

Увы, иммунотерапия не является универсальным лекарством от рака. Она помогает не всем. Для одних пациентов и при одних формах онкологии она может быть достаточно эффективной, в других случаях – нет. От чего это зависит – ещё предстоит разобраться учёным. Человеческий иммунитет – ещё не до конца изученный механизм, а рак – очень сложное и коварное заболевание.
И всё же врачи всего мира признают, что именно за иммуноонкологией будущее в лечении рака. Нередко иммунотерапию используют в комплексе с другими способами лечения: с химиотерапией, с таргетными и даже другими иммунными препаратами. Причём комбинация двух или нескольких средств, как правило, имеет синергетический эффект, то есть они многократно усиливают действие друг друга.
Самое простое, что может сделать человек для профилактики и предупреждения онкозаболеваний, как мы уже не раз писали, — это заботиться о своём здоровье и укреплять свой иммунитет. Для этого достаточно отказаться от вредных привычек, заниматься физкультурой, правильно питаться, выработать у себя нормальный режим сна и бодрствования, вовремя лечить болезни и регулярно проходить диспансеризацию.
Чего категорически нельзя делать – так это покупать иммунопрепараты в аптеках без назначения врача и применять их самостоятельно! При неграмотном и бесконтрольном приёме иммунологические препараты способны вызвать тяжелейшие побочные явления. Такие препараты должны применяться строго под контролем врача.
Источник