Суставы и лимфоциты в крови

Т-клетки это фактически приобретенный иммунитет, способный защитить от цитотоксического повреждающего воздействия на организм. Чужеродные клетки-агрессоры, попадая в организм вносят “хаос”, который внешне проявляется в симптомах заболеваний.
Клетки-агрессоры повреждают по ходу своей деятельности в организме все, что могут, действуя в своих интересах. А задача иммунной системы найти и уничтожить все чуждые элементы.
Специфическая защита организма от биологической агрессии (чужеродных молекул, клеток, токсинов, бактерий, вирусов, грибов и т.д.) осуществляется при помощи двух механизмов:
- продуцирования специфических антител в ответ на чужеродные антигены (потенциально опасных для организма веществ);
- выработки клеточных факторов приобретённого иммунитета (Т-клетки).
Как осуществляются иммунные реакции
При попадании в организм человека «клетки-агрессора», иммунная система распознаёт чужеродные и собственные измененные макромолекулы (антигены) и удаляет их из организма. Также при первичном контакте с новыми антигенами происходит их запоминание, что способствует их более быстрому удалению, в случае вторичного попадания в организм.
Процесс запоминания (презентация) происходит благодаря антиген-распознающим рецепторам клеток и работе антиген представляющих молекул (МНС молекул- комплексов гистосовместимости).
Что такое Т-клетки иммунной системы, и какие функции они выполняют
Функционирование иммунной системы обуславливается работой лимфоцитов. Это клетки иммунной системы, являющиеся
разновидностью лейкоцитов и способствующие формированию приобретённого иммунитета. Среди них выделяют:
- В-клетки (распознающие «агрессора» и вырабатывающие к нему антитела);
- Т-клетки (выполняющие функцию регулятора клеточного иммунитета);
- NК- клетки (разрушающие отмеченные антителами чужеродные структуры).
Однако, помимо регуляции иммунного ответа, Т-лимфоциты способны выполнять эффекторную функцию, разрушая опухолевые, мутировавшие и чужеродные клетки, участвовать в формировании иммунологической памяти, распознавать антигены и индуцировать иммунные реакции.
Справочно. Важной особенностью T-клеток является их способность реагировать только на презентированные антигены. На одном T-лимфоците находится только один рецептор к одному конкретному антигену. Это обеспечивает отсутствие реакции T-клеток на собственные аутоантигены организма.
Разнообразие функций Т-лимфоцитов обусловлено наличием в них субпопуляций, представленных Т-хелперами, Т-киллерами и Т-супрессорами.
Субпопуляция клеток, их стадия дифференцирования (развития), степень зрелости и т.д. определяется при помощи специальных кластеров дифференцировки, обозначаемых как СD. Наиболее значимыми являются СD3, СD4 и СD8:
- СD3 находится на всех зрелых T-лимфоцитах, он способствует передаче сигнала от рецептора к цитоплазме. Это важный маркер функционирования лимфоцитов.
- СD8 – это маркер цитотоксических T-клеток.
- СD4 является маркером T-хелперов и рецептором к ВИЧ (вирус иммунодефицита человека)
Т-хелперы
Около половины Т-лимфоцитов имеют антиген CD4, то есть являются Т-хелперами. Это помощники, стимулирующие процесс секреции антител В-лимфоцитами, стимулируют работу моноцитов, тучных клеток и предшественников Т-киллеров к «включению» в иммунную реакцию.
Справочно. Функция хелперов осуществляется за счёт синтеза цитокинов (информационных молекул, регулирующих взаимодействие между клетками).
В зависимости от продуцируемого цитокина, их разделяют на:
- T-хелперные клетки 1-го класса (продуцируют интерлейкин-2 и гамма-интерферон, обеспечивая гуморальный иммунный ответ на вирусы, бактерии, опухоли и трансплантанты).
- T-хелперные клетки 2-го класса (секретируют интерлейкины-4,-5,-10,-13 и отвечают за образование IgЕ, а также иммунного ответа, направленного на внеклеточные бактерии).
Т-хелперы 1-го и 2-го типа всегда взаимодействуют антагонистически, то есть повышенная активность первого типа угнетает функцию второго типа и наоборот.
Работа хелперов обеспечивает взаимодействие между всеми клетками иммунитета, определяя какой тип иммунного ответа будет преобладать (клеточный либо гуморальный).
Важно. Нарушение работы клеток-помощников, а именно недостаточность их функции, наблюдается у больных с приобретённым иммунодефицитом. Т-хелперы являются основной мишенью ВИЧ. В результате их гибели нарушается иммунная реакция организма на стимуляцию антигенов, что приводит к развитию тяжёлых инфекций, росту онкологических новообразований и летальному исходу.
Т-киллеры
Это так называемые T-эффекторы (цитотоксические клетки) или клетки убийцы. Такое название обусловлено их способностью уничтожать клетки-мишени. Осуществляя лизирование (ли́зис (от греч. λύσις — разделение) — растворение клеток и их систем) мишеней, переносящих чужеродный антиген или мутировавший аутоантиген (трансплантанты, опухолевые клетки), они обеспечивают реакции противоопухолевой защиты, трансплантационного и противовирусного иммунитета, а также аутоиммунные реакции.
Т-киллеры при помощи собственных МНС-молекул распознают чужеродный антиген. Связываясь с ним на поверхности клетки, они продуцируют перфорин (цитотоксический белок).
После лизирования клетки «агрессора» Т-киллеры остаются жизнеспособными и продолжают циркулировать в крови, разрушая чужеродные антигены.
Т-киллеры составляют до 25-ти процентов от всех Т-лимфоциотов.
Справочно. Помимо обеспечения реакций нормального иммунного ответа, Т-эффекторы могут участвовать в реакциях антителозависимой клеточной цитотоксичности, способствуя развитию гиперчувствительности второго типа (цитотоксической).
Это может проявляться лекарственными аллергиями и различными аутоиммунными заболеваниями (системные заболевания соединительной ткани, гемолитическая анемия аутоиммунного характера, злокачественная миастения, аутоиммунные тиреоидиты, и т.д.).
Подобным механизмом действия обладают некоторые лекарственные средства, способные запускать процессы некроза опухолевых клеток.
Важно. Препараты с цитотоксическим действием используют в химиотерапии онкологических заболеваний.
Например, к таким медикаментам относится Хлорбутин. Это средство применяют для лечения хронического лимфолейкоза, лимфогранулематоза и рака яичников.
Т-супрессоры и клетки памяти
Супрессоры подавляют функцию хелперов и В-лимфоцитарного звена. Однако современная классификация не выносит супрессоры в отдельную субпопуляцию. Поскольку доказано, что решающую роль в угнетении иммунной реакции играют апоптоз и специфические цитокины.
Помимо основных T-лимфоцитов, в организме человека существуют потомки клеток, контактировавших с антигеном и имеющих к нему рецепторы. Это клетки обеспечивающие иммунологическую память. Они способны в течение от десяти до 15 лет сохранять память об антигене, передавая её другим клеткам.
Справочно. Благодаря клеткам памяти обеспечивается быстрый иммунный ответ при повторном попадании «агрессора» в организм.
Нулевые лимфоциты
К ним относят лимфоциты, не имеющие T и B маркеров. Они составляют до 10% от всей популяции лимфоцитов. К ним относят NК-клетки (естественные киллеры) и K-клетки (киллерные).
Справочно. Основным отличием NK-клеток от T-киллеров является способность уничтожать не сенсибиллизированные клетки-мишени.
K-клетки отвечают за антителозависимую клеточную цитотоксичность. Они отражают взаимодействия гуморального и клеточного звеньев иммунитета, а также выступают в качестве «наводчиков» эффекторных (выполняющих функцию – в данном случае уничтожение) клеток на мишень.
NК- клетки обеспечивают контроль за качеством клеток и участвуют в формировании противовирусного иммунитета, обеспечиваютзащиту от роста опухолей и размножения мутировавших (дефектных) клеток.
Диагностика клеточного иммунитета
Диагностика T- и B-лимфоцитарного звена позволяет оценить состояние клеточного иммунитета. Базовое исследование с определением процентного содержания Т-, В- и нулевых клеток проводится с целью выявления первичных или вторичных иммунодефицитов, а также при контроле иммуностимулирующего лечения.
Исследование основных популяций при помощи маркеров CD3, 8, 19, 16+5б, а также соотношение между хелперами и киллерами, позволяет комплексно оценить иммунный статус. Для исследования используют венозную кровь.
Диагностика проводится при выявлении и контроле течения:
- аутоиммунных заболеваний (увеличено содержание CD3, CD4 хелперов);
- лимфолейкозов (повышено количество Т-лимфоцитов CD3);
- злокачественных новообразований (увеличено количество NK);
- ВИЧ (CD3, CD8);
- хронических инфекций, аллергических реакций, бронхиальной астмы и т.д.
Справочно. В зависимости от результатов анализа пациенту может быть рекомендована консультация иммунолога, гематолога, аллерголога, онколога или инфекциониста. С дальнейшим лечением у профильного специалиста по основному заболеванию.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Пандемия COVID-19 продолжается и усиливается. Все больше людей в мире встречается с данным вирусом. Уже давно стало понятно, что SARS-CoV-2 не исчезнет из человеческой популяции. Вероятность встречи с ним возрастает для каждого.
Тем не менее, многие люди, неоднократно и длительно контактировавшие с заболевшими COVID-19 – сами не заболевают, никаких клинических симптомов не появляется. Почему так происходит – один из самых насущных вопросов на всех уровнях попыток понимания текущей пандемии, от бытового до научно-медицинского.
Наиболее вероятный ответ на него – особенности иммунного ответа части населения. В предыдущих публикациях описывались варианты протекания инфекционного процесса при COVID-19, механизмы и сроки антителообразования В-лимфоцитами, с учетом того, что известно про эту инфекцию на данном этапе ее изучения. Однако, «не антителами едиными жив наш иммунитет…». В механизмах специфического иммунного ответа на патогены выделяют гуморальный иммунный ответ (опосредуемый присутствующими в плазме крови антителами) и клеточный иммунный ответ (опосредуемый клетками иммунной системы без участия антител). Клеточное звено иммунной системы (прежде всего, Т-клеточное звено) также играет немаловажную роль в появлении резистентности макроорганизма к той или иной инфекции. Как «вырисовывается» понимание – к COVID-19 тоже.
Т-клеточное звено состоит из различных пулов Т-лимфоцитов (обозначаемых общепринятой в иммунологии для указания их характерных маркеров аббревиатурой CD и цифрой/числом – CD-3, CD-4, CD-8, CD-16 и другие). Если ОЧЕНЬ упрощенно, то основные задачи Т-клеточного звена:
Опознать и изучить антиген – передать информацию о нем другим звеньям иммунной системы – уничтожить антиген – запомнить его.
У части людей, в силу особенностей иммунитета (а также, видимо, при инфицировании низкой дозой возбудителя), Т-клеточное звено элиминирует вирус из организма без значимой активации В-клеточного звена, то есть – с низким уровнем антителообразования, нередко не детектируемым (не определяемым) рутинными лабораторными методами. При этом, клинических симптомов часто не развивается. Иными словами, человек может перенести инфекционный процесс без развития болезни, уровень антител у него не определяется, но организм приобретает защиту от повторного заражения. Насколько стойкую и долгую – вопрос остается открытым.
Однако, недавние, достаточно объемные исследования группы ученых из нескольких стран выявили:
- Образование устойчивого Т-клеточного ответа на SARS-CoV-2 у большинства пациентов, встречавшихся с данным вирусом
- При этом у части пациентов, никогда не встречавшихся с SARS-CoV-2 – уже имеются Т-лимфоциты, реагирующие на данный вирус и элиминирующие его из организма.
До конца данный феномен пока не изучен, но наиболее вероятной является теория о том, что Т-лимфоциты у данных пациентов перекрестно активированы предыдущим воздействием широко циркулирующих в популяции «простудных» коронавирусов.
Подробнее –
здесь.
То есть: у части людей есть приобретенная невосприимчивость к SARS-CoV-2, обусловленная, вероятнее всего Т-клетками, которые ранее «активировались» другими коронавирусами и сохранили иммунологическую память.
Данное утверждение сложно проверить массовым лабораторным скринингом. Изучение Т-клеточного ответа к инфекциям – достаточно трудоемкий процесс и чаще удел специализированных научно-исследовательских лабораторий. Однако, уже опубликованные результаты и продолжающиеся работы по изучению Т-клеточного иммунитета при COVID-19 – дают определенную почву для осторожного оптимизма.
А.С. Поздняков, к.м.н.,
инфекционист, главный врач ООО «Инвитро-Сибирь»
Статистика INVITRO по пациентам с выявленными антителами к коронавирусу
Анализы для выявления антител в организме
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Информация проверена экспертом
Лишова Екатерина Александровна
Высшее медицинское образование, опыт работы – 19 лет
Источник
При подозрении на ревматоидный артрит (РА) проводится тщательное обследование пациента. Трудности при диагностировании патологии возникают из-за пока еще не установленных причин развития воспалительной реакции. Поэтому пациентам показан ряд лабораторных и инструментальных исследований, необходимых для выявления самого заболевания, стадии его течения, степени поражения суставных структур.
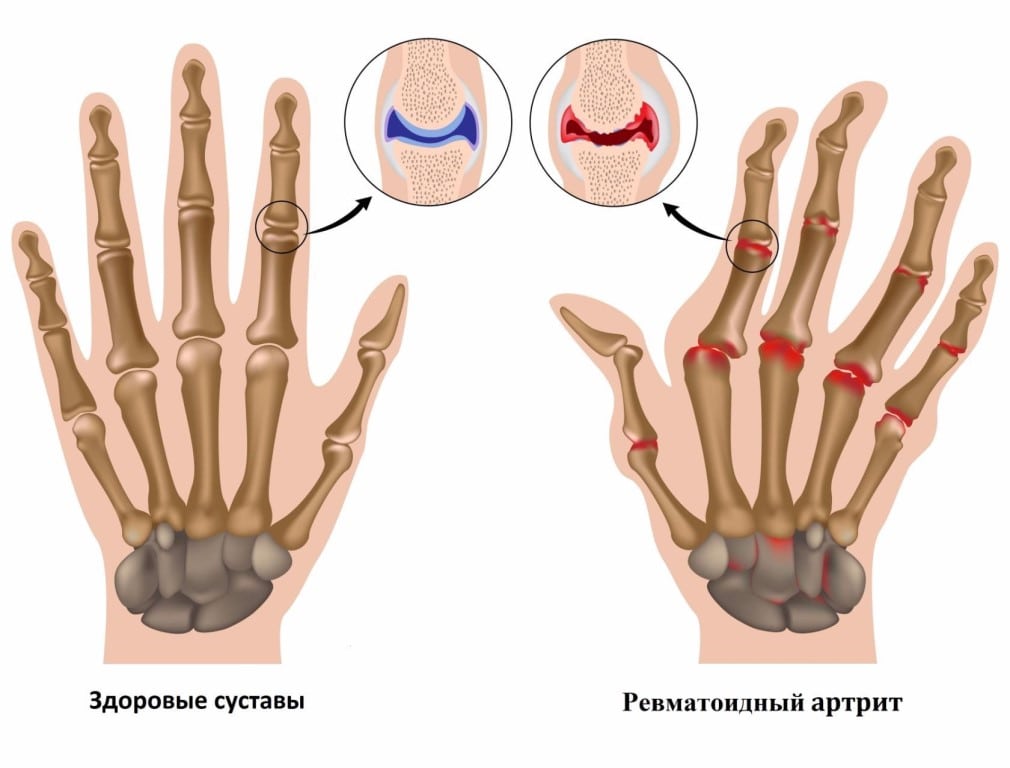
Ведущим диагностическим признаком РА считается ревматоидный фактор — специфические иммуноглобулины, вырабатываемые в процессе иммунного ответа. Но у более 20% больных серонегативной формой РА этого маркера суставной патологии в крови не обнаружено. При комплексном обследовании пациентов заболевание подтверждается анализами на антинуклеарный фактор, АЦЦП, С-реактивный белок. Биохимический анализ крови при ревматоидном артрите позволяет с максимальной точностью выявить аутоиммунную патологию.
Диагностические критерии
Важно знать! Врачи в шоке: “Эффективное и доступное средство от боли в суставах существует…” Читать далее…
Для ревматоидного артрита характерны эрозивно-деструктивные поражения преимущественно мелких периферических суставов. Заболевание опасно постепенным разрушением сочленений, расстройствами работы внутренних органов. Снижение их функциональной активности можно отследить по изменению состава биологических жидкостей — крови, мочи, синовия. Часто биохимические исследования помогают окончательно выставить диагноз «ревматоидный артрит», подтвердив результаты рентгенографии, МРТ, КТ, артроскопии. При подозрении на развитие патологии необходимо проведение следующих анализов:
- общего анализа мочи;
- общего анализа крови, включая подсчет СОЭ (скорость оседания эритроцитов);
- биохимический анализ крови для установления уровней печеночных ферментов, креатинина, С-реактивного белка;
- обнаружение ревматоидного фактора, антицитруллиновых и антинуклеарных антител;
- выявления маркеров развития гепатитов в качестве дифференциальной диагностики реактивных артритов.
Это самые распространенные методы клинического выявления заболевания суставов. Диагностика ревматоидного артрита по лабораторным анализам одновременно позволяет оценить общее состояние здоровья.
Клинические анализы крови, мочи, кала
Общий анализ крови при артрите позволяет установить ее качественный и количественный состав, физико-химические свойства. Обнаружение некоторых биохимических субстратов помогает определить протекающий в организме воспалительный процесс, в том числе спровоцированный патогенными микроорганизмами.
| Исследования крови, назначаемые при подозрении на развитие ревматоидного артрита | Характерные особенности диагностических мероприятий |
| Определение уровня лейкоцитов | Состояние, при котором в крови повышается количество лейкоцитов. Такое изменение состава крови выявляется при тяжелом течении ревматоидного артрита с присутствием внесуставной симптоматики. Обычно лейкоцитоз выявляется одновременно с повышенным уровнем ревматоидного фактора и служит показанием для назначения пациенту глюкокортикостероидов. Большое количество лейкоцитов в системном кровотоке может быть признаком инфицирования вирусами, бактериями, грибками, что требует дифференциальной диагностики |
| Установление содержания гемоглобина | С помощью этого критерия можно оценить активность РА. Выявляется анемия только у 50% больных. Причина резкого снижения гемоглобина — воспалительный процесс, негативно сказывающийся на состоянии иммунитета. Железодефицитная анемия выявляется несколько реже, требует дифференциальной диагностики для исключения внутренних кровотечений |
| Выявление концентрации лимфоцитов | Повышенный уровень лимфоцитов при одновременном снижении количества лейкоцитов — типичный маркер вирусной инфекции. Подтверждения — увеличение лимфатических узлов, клинические проявления общей интоксикации организма. Такое изменение состава крови характерно для реактивного артрита, спровоцированного проникновением в суставные полости возбудителей гепатита |
Самый информативный анализ для диагностики артрита — скорость оседания эритроцитов. Это неспецифический лабораторный показатель, отражающий соотношение фракций белков плазмы. Кроме клеточных элементов, в крови содержатся белки, вода, различные биохимические субстраты. Эритроциты (красные кровяные тельца) не могут долго оставаться во взвешенном состоянии в пробирке с кровью, поэтому начинают опускаться на дно. Скорость их оседания зависит от присутствия в крови других компонентов. Если в ней много белков (диагностических маркеров воспаления), то эритроциты формируют агрегаты и быстро опускаются на дно пробирки. Выявления высоких значений СОЭ свидетельствует о протекании острого воспаления, которое может быть признаком аутоиммунной реакции. Такие параметры указывают и на развитие тяжелой формы РА, поражение внутренних органов.
Если при исследовании образцов мочи обнаружен повышенный уровень белка и лейкоцитов, необходимо устанавливать локализацию воспаления в организме. Это только косвенный признак ревматоидного артрита, требующий дальнейшей диагностики. Обязательно выявляется содержание в моче:
- глюкозы;
- кетоновых тел;
- билирубина;
- эритроцитов;
- эпителиальных клеток.
Повышенный уровень солей может указывать на нарушение обмена веществ, осложняющего течение РА.
Анализ кала при диагностировании ревматоидного артрита проводится для исключения реактивной патологии. Ее развитие провоцирует неадекватный ответ иммунной системы на проникновение в организм хламидий, сальмонелл, шигелл. Микроорганизмы легко выявляются при бактериологическом исследовании кала.
Биохимический анализ крови
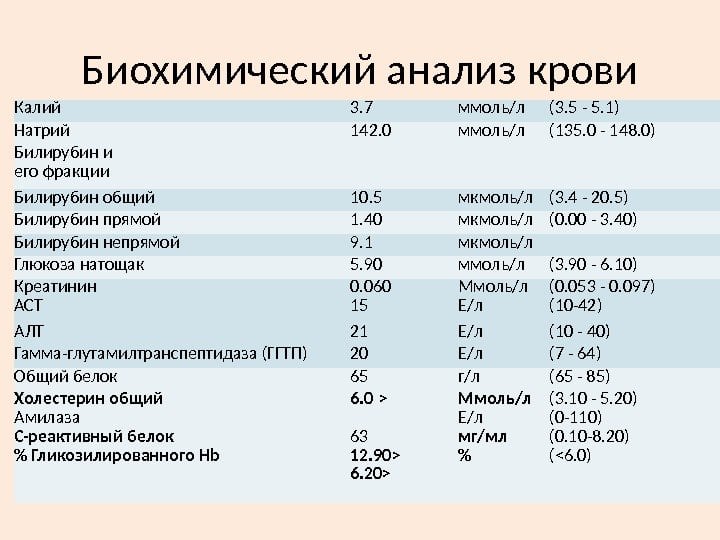
Обнаружение в крови определенных биохимических компонентов помогает установить воспалительный процесс в суставах, его интенсивность и стадию течения. Например, при рецидивах РА повышается уровень белка гаптоглобина, что служит признаком разрушения большого количества красных кровяных телец.
При проведении биохимического анализа крови на ревматоидный артрит обязательно определяется уровень фибриногена — специфического белка, находящегося в сыворотке в растворенном виде. Он служит субстратом для образования тромбов при сворачивании крови. У больных РА уровень фибриногена существенно превышает значения нормы (2-4 г/л).
Неспецифическим диагностическим маркером РА является уровень сиаловых кислот — актированных производных нейраминовой кислоты, которые входят в состав гликопротеинов. В плазме здорового человека их концентрация колеблется в пределах 2-2,33 ммоль/л. На развитие РА указывает превышение этого показателя, свидетельствующее о воспалении в суставных соединительнотканных структурах.
“Врачи скрывают правду!”
Даже “запущенные” проблемы с суставами можно вылечить дома! Просто не забывайте раз в день мазать этим…
>
При проведении биохимического анализа крови при ревматоидном артрите выявляется содержание серомукоидов (сывороточных протеинов), иммуноглобулинов, пептидов. Если их концентрация превышает значения нормы, то врачи подозревают острое, прогрессирующее течение РА.
C-реактивный белок

Так называется белок плазмы крови, относящийся к группе протеинов острой фазы, концентрация которых повышается при воспалительном процессе. С-реактивный белок вырабатывается в большом количестве во время иммунного ответа на проникновение в организм инфекционных или аллергических агентов. Обнаружение уровня этого диагностического маркера помогает дифференцировать РА от артритов невоспалительного характера. Количественное содержание С-реактивного белка необходимо для оценки активности воспаления. Этот критерий в дальнейшем позволяет отследить:
- результативность терапии;
- вероятность прогрессирования дегенеративно-дистрофических изменений в хрящевых, костных, соединительнотканных структурах.
Биохимический маркер не специфичен, так как не позволяет точно выяснить, что спровоцировало воспаление и ее локализацию. Уровень С-реактивного белка всегда увеличивается при аутоиммунных, бактериальных, вирусных патологиях. Но обнаружение этого изменения состава крови с высокой вероятностью указывает на развитие системной патологии, поражающей не только суставы, но и внутренние органы.
Ревматоидный фактор
Важный диагностический маркер РА, обнаруживаемый в крови более чем у 80% пациентов. Ревматоидный артрит развивается при атаке иммунной системы на собственные клетки организма, принимаемые ею за чужеродные белки. Для их уничтожения она продуцирует огромное количество антител — ревматоидного фактора. Эти иммуноглобулины разрушают сначала синовиальную оболочку, а при отсутствии врачебного вмешательства вскоре поражают соединительные ткани внутренних органов.
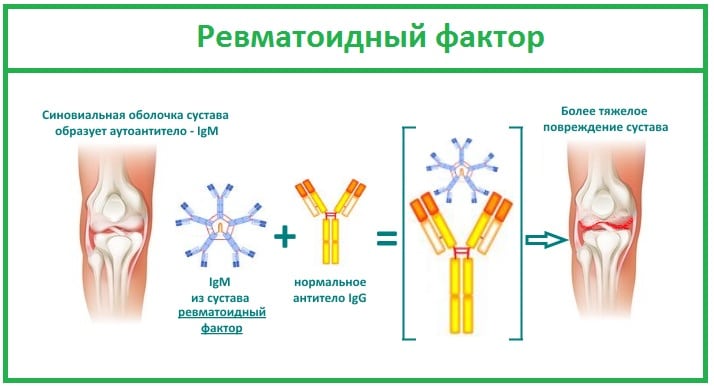
Ревматоидный фактор — один из важных диагностических критериев РА. Но является высокоспецифичным, но требует подтверждения данными, полученными при проведении инструментальных исследований. Дело в том, что высокий уровень ревматоидного фактора в крови характерен и для других заболеваний:
- системной красной волчанки;
- дерматомиозитов;
- васкулитов;
- склеродермии;
- бактериальных, вирусных, грибковых, паразитарных патологий.
Высокий уровень ревматоидного фактора на начальном этапе РА, когда суставы повреждены незначительно, является характерным признаком быстрого прогрессирования и тяжелого течения патологии. Этот критерий часто выявляется во время терапии для оценки ее эффективности.
Антицитруллиновые и антинуклеарные антитела
В процессе аутоиммунной реакции продуцируются антинуклеарные антитела, предназначенные для атаки белковых ядер собственных клеток организма. Показанием для определения количественного содержания обычно становится высокий уровень СОЭ, указывающий на развитие воспалительного процесса. Маркер неспецифичен, так как выявляется и при других патологиях:
- коллагенозе, системной красной волчанке, поражающих соединительные ткани;
- склеродермии;
- гепатите;
- реактивном артрите.
С помощью уровня антинуклеарных антител удается косвенно подтвердить развитие РА. Это особенно ценно при его серонегативной форме с отсутствием ревматоидного фактора в крови.
Самый специфичный маркер, выявляющий при проведении биохимических анализов при артрите, — наличие в крови антицитруллиновых антител, вырабатываемых иммунной системой к циклическому цитруллиновому пептиду. Химическая структура цитруллина схожа со строением аминокислоты, входящей в состав белковой молекулы. Эти белки — строительные элементы суставной капсулы, которая атакуется иммуноглобулинами при РА.
Если в крови пациента обнаруживается повышенный уровень АЦЦП, то с более чем 90% вероятностью можно предположить развитие ревматоидного артрита. Выявление антицитруллиновых антител позволяет обнаружить суставную патологию на начальной стадии и сразу приступить к лечению. Ранняя диагностика РА помогает избежать тяжелейших осложнений, в том числе необратимого поражения внутренних органов. Но, несмотря на высокую специфичность маркера, в некоторых случаях повышенный уровень АЦЦП указывает на развитие других заболеваний, не связанных с опорно-двигательным аппаратом.
Проведения этих лабораторных анализов на ревматоидный артрит бывает достаточно для подтверждения диагноза. Но в ревматологии существует 7 критериев, позволяющих с высокой точностью установить аутоиммунную патологию. Это количество вовлеченных в воспалительный процесс суставов, симметричность их поражения, выраженность симптоматики, длительность течения заболевания. При обнаружении у больного 4 из 7 критериев пациенту выставляется окончательный диагноз.
Похожие статьи
Как забыть о болях в суставах?
- Боли в суставах ограничивают Ваши движения и полноценную жизнь…
- Вас беспокоит дискомфорт, хруст и систематические боли…
- Возможно, Вы перепробовали кучу лекарств, кремов и мазей…
- Но судя по тому, что Вы читаете эти строки – не сильно они Вам помогли…
Но ортопед Валентин Дикуль утверждает, что действительно эффективное средство от боли в суставах существует! Читать далее >>>
загрузка…
Источник