Среда для выделения лимфоцитов
Глава 29. Иммунологические методы
ВЫДЕЛЕНИЕ ПОПУЛЯЦИЙ ЛИМФОЦИТОВ
Для проведения многих иммунологических исследований in vivo и in vitro требуются те или иные популяции лимфоцитов. Их получают от экспериментальных животных, в основном из тимуса, селезенки и периферических лимфоузлов. Некоторые специальные исследования требуют выделения клеток из других участков организма, например и з пейеровых бляшек. Рециркулирующие клетки можно получить путем канюлирования грудного лимфатического протока и сбора клеток в течение нескольких часов. У человека наиболее легко выделить лимфоциты периферической крови, а хирургическим путем можно получить также клетки селезенки, ми н дат и н и лимфоузлов. Однако хирургически отобранный материал часто содержит инфекционные агенты или опухолевые клетки, в зависимости от заболевания, которое вызвало необходимость хирургического вмешательства. Следует иметь в виду, что клеточные популяции, содержащиеся в перечисленных тканях, совершенно различны как но степени зрелости лимфоцитов, так и по численному соотношению в них клеток разных типов.
Тимус является источником довольно чистой Т-клеточной популяции, однако составляющие ее лимфоциты различаются по степени зрелости. При работе с лимфоцитами из других органов и тканей часто возникает необходимость в выделении отдельных субпопуляций для анализа их особых функций. Применение с этом целью описанного выше проточного флуоресцентного клеточного сортера, позволяющего разделять лимфоциты но их поверхностным маркерам, позволяет получать лишь ограниченное число клеток, поскольку скорость цитометрии с сортировкой весьма низка. Существует, однако, и ряд методов, позволяющих выделять лимфоциты и их отдельные субпопуляции сразу из всего объема исследуемого образца, – центрифугирование в градиенте плотности, розеткообразование, пэннинг и магнитное разделение.
Выделение в градиенте плотности основано на том, что лимфоциты имеют меньшую плотность, чем эритроциты и гранулоциты (рис. 29.19). Этот способ позволяет выделять большую часть лимфоцитов крови. Розеткообразование и пэннинг («просеивание» через подложку) используют для выделения субпопуляций (рис. 29.20 и 29.21). Пэннинг представляет собой разновидность аффинной хроматографии применительно к лимфоцитам. На сходном принципе основан и способ разделения с помощью магнитных гранул, покрытых специфическими антителами (например, анти-СD4). При смешивании с клетками гранулы связывают тс из них, которые распознаются фиксированными антителами. Эти клетки можно затем смыть с гранул или выделить путем наложения магнитного поля.

Рис. 29.19. Лимфоциты можно выделить из цельной крови в градиенте плотности фиколла. Для этого кровь дефибринируют путем встряхивания со стеклянными бусами и образовавшийся сгусток удаляют. Затем кровь разводят культуральной средой и наслаивают на раствор фиколла, заполняющий пробирку до половины. Плотность фиколла выше, чем плотность лимфоцитов, но ниже, чем плотность эритроцитов и гранулоцитов (например, нейтрофилов). После центрифугирования эритроциты и полиморфноядерные нейтрофилы (ПЯН), прошедшие через фиколл, образуют на дне пробирки осадок в виде пуговки, тогда как лимфоциты остаются на границе между средой, в которой они взвешены, и фиколлом. Препарат лимфоцитов освобождают затем от макрофагов и оставшихся ПЯН, добавляя в него железные опилки, они фагоцитируются, и поглотившие их фагоциты можно удалить при помощи сильного магнита. Макрофаги могут быть удалены и другим способом: клеточную суспензию помещают в пластиковую чашку; макрофаги прилипают к поверхности пластика и в суспензии остаются только лимфоциты.

Рис. 29.20. Метод розеткообразования основан на том, что лимфоциты некоторых субпопуляций несут рецепторы, связывающиеся с эритроцитами. Т-клетки человека имеют рецепторы для эритроцитов барана (Э) – молекулы CD2 (1). На Т-клетках мыши число таких рецепторов невелико, поэтому Т-лимфоциты мыши изолировать подобным способом невозможно. При смешивании Т-клетки вместе с эритроцитами образуют «розетки», которые могут быть отделены от неспособных к розеткообразованию В-клеток в градиенте плотности фиколла. Существует также модификация этого метода, позволяющая выделять клетки с другими рецепторами (2). Например. Тγ-лимфоциты (Т-клетки, несущие рецептор для Fc-фрагмента IgG, Fcγ) можно идентифицировать и выделить методом розеткообразования с эритроцитами быка, сенсибилизированными субагглютинирующим количеством антител к этим эритроцитам. На микрофотографии (3) виден лимфоцит, образовавший розетку с эритроцитами. (Фото любезно предоставлено д-ром Р. М. Lydyard).

Рис. 29.21. Клеточные популяции можно разделять на подложках, сенсибилизированных антителами. Нанесенные на подложку антитела нековалентно связываются с поверхностью пластика (как при иммуносорбентном анализе), после чего на нее наносят суспензию клеток. Антиген-положительные клетки (Аг+) связываются с антителами, тогда как антиген-отрицательные (Аг+) можно удалить осторожным смыванием. Связанные клетки иногда удается отделить от подложки, изменив условия культивирования или обработав клетки ферментами. Часто связывание клеток с иммобилизованным антигеном вызывает в них те или иные изменения; например, при связывании антигена с пластиком могут возникать перекрестные связи между его молекулами, в результате чего он активирует клетки. Данный метод наиболее подходит для удаления субпопуляций, а не для их выделения из общей популяции лимфоцитов. В качестве примеров применения данного метода можно назвать разделение популяций Тх- и Тц-клеток при помощи антител анти-СD4 или анти-CD8 и отделение Т-клеток от В-лимфоцитов с использованием антител анти-lg (которые связываются с поверхностными антителами В-клеток). При обратной постановке (сенсибилизация подложки антигеном) связывающие антиген клетки можно отделять от несвязывающих.
Другой способ — он применяется для удаления ненужной клеточной популяции, — основан на использовании антител и комплемента. Если к смеси клеток добавить специфические антитела (например, анти-CDS), а затем комплемент, клетки соответствующей субпопуляции будут лизированы. Конечно, для этого метода пригодны лишь такие антитела, которые связывают комплемент; кроме того, клетки-мишени должны нести на поверхности достаточное количество молекул антигена, чтобы фиксировать литическую дозу комплемента.
Источником определенных популяций лимфоцитов могут служить антигенспецифичные Т-клеточные линии, культивируемые в течение длительного периода (рис. 29.22). Получение таких линий позволяет обойтись без частого выделения первичных культур из органов и тканей животных.

Рис. 29.22. Одна из возможных процедур получения Т-клеточных линий. Мышей примируют антигеном, вводя его обычно под кожу на подошвенной стороне задней лапки. Через неделю у животных удаляют дренирующие эту область лимфоузлы (в данном случае подколенные и паховые), и полученные из них клетки культивируют в присутствии антигена на питающем подслое из сингенных (т. е. от мышей той же инбредной линии) клеток, например нормальных лимфоцитов или спленоцитов. Через 4 сут из культуры выделяют лимфобласты и индуцируют их пролиферацию с помощью ИЛ-2. Когда число клеток достаточно возрастет, проверяют их МНС- и антигенспецифичность в реакции трансформации лимфоцитов, Полученную линию культивируют попеременно на питающем подслое из клеток, стимулированных антигеном, и в ИЛ-2-содержащей среде.
Источник
Вакуумные пробирки для выделения моноцитов и лимфоцитов – это специальные пробирки, которые позволяют отделить мононуклеарные клетки периферической крови в один прием, за 20 минут центрифугирования, при этом цельная кровь набирается, центрифугируется и обрабатывается в одной первичной пробирке. Внутренние стенки пробирок покрыты силиконом для минимизации неспецифической активации клеток.
Вакуумные пробирки для выделения моноцитов и лимфоцитов содержат:
- антикоагулянт (натрия цитрат или натрия гепарин);
- разделительный гель;
- специальную жидкость фиколл, создающую градиент плотности, для разделения мононуклеаров.
Вакуумные пробирки для выделения моноцитов и лимфоцитов выпускаются двух видов с сине-черной пестрой пробкой (пробирки с натрия цитратом) и с красно-зеленой пестрой пробкой (пробирки натрия гепарином).
В практике КДЛ вакуумные пробирки для выделения моноцитов и лимфоцитов применяют в целях исследования:
- количественных и функциональных характеристик мононуклеарных клеток;
- пролиферативной активности мононуклеарных клеток;
- РНК/ДНК клеток и вирусов;
- обнаружения злокачественных новообразований;
- HLA-типирования;
- генетических маркеров;
- провирусной ДНК ВИЧ, РНК ВИЧ и др. вирусов.
Преимущества использования вакуумных пробирок для выделения моноцитов и лимфоцитов:
- значительно облегчается процесс отделения мононуклеарных клеток, экономится время лаборанта и повышается эффективность работы лаборатории;
- гарантируется стандартизация процесса отделения мононуклеарных клеток, повышается точность исследований при использовании образцов, доставленных из различных ЛПУ;
- снижается вероятность ошибок, которые происходят при отделении мононуклеарных клеток вручную.
Взятие образца и пробоподготовка
- Кровь в вакуумные пробирки для выделения моноцитов и лимфоцитов берется из вены с помощью вакуумной системы.
- Так как в пробирке содержится химический наполнитель, то нужно обращать особое внимание на предотвращение обратного тока крови: во время взятия крови рука пациента должна находиться в опущенном состоянии, пробирку необходимо поддерживать в вертикальном положении и контролировать, чтобы содержимое пробирки не касалось крышки и мембраны иглы.
- Сразу же после заполнения пробирки и извлечения ее из держателя кровь необходимо тщательно перемешать с антикоагулянтом, для этого пробирку следует аккуратно перевернуть 810 раз. Нельзя встряхивать пробирку, так как это может вызвать пенообразование и гемолиз.
- Пробу крови до центрифугирования следует хранить при комнатной температуре не более 2-х часов, вдали от солнечного света и отопительных приборов.
- Центрифугировать пробу крови нужно в строго течение 20 минут в горизонтальной центрифуге при относительной центробежной силе 1500-1800 g. Меньшее время и/или относительная центробежная сила отрицательно сказывается на эффективности действия пробирки. Большее время и/или относительная центробежная сила может привести к уменьшению выхода моноядерных клеток. Во время центрифугирования формируется устойчивый гелевый барьер между слоем беловатого цвета, содержащим мононуклеарные клетки, распределенные в градиенте плотности над гелем, и слоем эритроцитов и гранулоцитов под гелем.
После центрифугирования моноядерные клетки можно транспортировать и хранить непосредственно в первичной пробирке, в этом случае плазма служит для клеток питательной средой. В таком виде мононуклеарные клетки могут храниться до 48 часов при комнатной температуре. Нужно учитывать, что точное время хранения определяется типом проводимого исследования. Для максимального выхода мононуклеарных клеток закрытую пробирку нужно сразу же после центрифугирования аккуратно перевернуть 5-10 раз, чтобы равномерно распределить клетки в плазме. Гелевый барьер при этом не нарушается. Затем суспензию плазмы и клеток над гелевым барьером следует осторожно перелить или перенести пипеткой во вторичную пробирку для промывания клеток и добавить в нее буферный раствор, доведя общий объем до 15 мл. Нельзя использовать буферы, содержащие кальций и/или магний. При промывании клеток следует придерживаться стандартного протокола, принятого в лаборатории. Если помимо анализа моноядерных клеток необходимо провести дополнительное исследование плазмы, ее нужно осторожно отобрать пипеткой над поверхностью клеточного слоя, а затем добавить в вакуумную пробирку 3-5 мл буферного раствора для промывания клеток.
Источник
 | Метод культивирования клеток и тканей находит применение в биотехнологии, молекулярной и клеточной биологии, фармацевтике |
Основные компоненты культуральной среды.
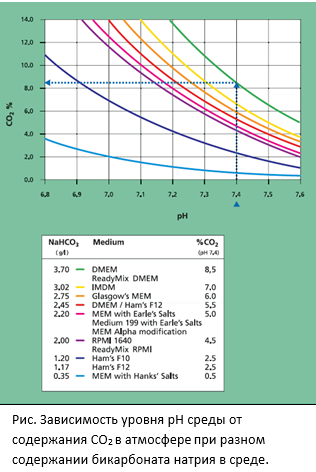 |
Культивируемые клетки сильно реагируют на изменение рН среды. Оптимальное значение рН для большинства клеток лежит в пределах 7,2-7,4. |
- Соли
Неорганические соли поддерживают осмотическое давление в среде и помогают в регуляции мембранного потенциала, обеспечивая среду ионами натрия, калия и кальция. Осмоляльность среды
так же важна, как уровень рН при культивировании клеток. Оптимальное значение осмоляльности лежит в пределах 260-340 мосмоль/кг в зависимости от типа культивируемых клеток.
- Аминокислоты
Аминокислоты являются строительным материалом для белков; незаменимые аминокислоты всегда входят в состав культуральной среды. Особенно важен L-глутамин; обеспечивает азотом НАД,
НАДФН и нуклеотиды, являясь вторичным источником энергии для метаболизма клетки. Заменимые аминокислоты также иногда добавляются в культуральную среду.
- Углеводороды
Большинство сред включают в себя глюкозу и галактозу как источник энергии для клеток.
Наиболее часто используемыми белками и пептидами является альбумин, трансферрин и фибронектин; они особенно важны при бессывороточном культивировании. Альбумин связывает
Особенно важны при бессывороточном культивировании, так как сыворотка обычно содержит их. |  |
 |
Многие витамины необходимы для клеточного роста и пролиферации. В культуральную среду обычно добавляют рибофлавин, тиамин и биотин.
Наиболее важным компонентом культуральной среды является сыворотка; она добавляется перед применением, примерно 5-10 %. Сыворотка представляет собой смесь |
Выбор культуральной среды.
| Среда MEM (Minimum Essential Medium), или среда Игла была разработана Гари Иглом и является наиболее распространенной средой для культивирования клеток |  |
Среда DMEM/F-12 в соотношении 1:1 применяется для выращивания широкого спектра клеточных культур. Изначально среда F12 была разработана для бессывороточного культивирования
СНО клеток, клеток легких и мышиных L-клеток. В связи с богатым содержанием питательных веществ в среду DMEM/F12 можно добавлять относительно небольшое количество эмбриональной
бычьей сыворотки (FBS–fetal bovine serum), либо использовать без сыворотки, но тогда необходимо добавлять такие факторы, как инсулин, трансферин, эпидермиальный фактор роста и др..
Среда RPMI-1640 была разработана в Roswell Park Memorial Institute (откуда и берет свое название) в 1966 Муром и его коллегами для культивирования лейкоцитов. В настоящее время используется для
широкого спектра клеточных культур.
Среда IMDM (Iscove’s Modified Dulbecco’s Medium) – это модификация среды DMEM, содержащая селенит натрия, добавочные аминокислоты и витамины, пируват натрия, ХЕПЕС и нитрат калия вместо
нитрата железа. Среда IMDM используется для поддержания культуры клеток В лимфоцитов, В клеток, стимулированных полисахаридами, Т лимфоцитов и гибридом.
Среда 199 первоначально была разработана для поддержания культуры первичных эксплантов. В настоящее время среда 199 применяется для продукции вакцин, культивирования первичных эксплантов и
тканей хрусталика. Изначально среда 199 готовилась с солями Эрла, но есть модификация среды 199 с солями Хэнкса.
Среды F-12 и F-10 изначально были разработаны Хэмом (Ham′s nutrient mixture) для культивирования СНО клеток, HeLa и мышиных L-клеток. Обе среды были разработаны для бессывороточного культивирования.
Среда F-12 применяется для культивирования широкого спектра клеток млекопитающих и гибридом.
Среда Грейса (Grace’s Insect Media) применяется для поддержания клеточных линий, полученных от бабочек и некоторых двукрылых.
Среда Шнейдера (Schneider’s Insect Media) изначально разрабатывалась для дрозофилы, но может применяться и для поддержания клеточной культуры других двукрылых.
Соли Хэнкса (Hanks’ Balanced Salt) изначально были разработаны для поддержания культуры клеток в атмосфере без СО2. Для диссоциации клеток применяются соли Хэнкса без ионов кальция и магния.
Соли Эрла (Earle’s Balanced Salts) применяются для суспензионных культур, а также при проблеме слипания клеток.
Буфер фосфатный Дульбекко применяется для промывки клеток. Кальций и магний способствуют слипанию клеток; фосфатный буфер без кальция и магния используют для суспензионных культур.
Источник