Сравнение т и в лимфоцитов
Т-лимфоциты и В-лимфоциты иммунитета. Предварительная обработка Т- и В-лимфоцитовХотя при исследовании под микроскопом большинство лимфоцитов в нормальной лимфоидной ткани выглядят одинаковыми, эти клетки подразделяют на две основные популяции. Одна популяция — Т-лимфоциты — ответственна за формирование активированных лимфоцитов, обеспечивающих клеточно-опосредованный иммунитет. Другая популяция — В-лимфоциты — ответственна за формирование антител, обеспечивающих гуморальный иммунитет. Оба типа лимфоцитов образуются у эмбриона из полипотентных гемопоэтических стволовых клеток, формирующих лимфоциты как один из наиболее важных результатов их дифференцировки. Почти все сформированные лимфоциты в результате заселяют лимфоидную ткань, однако прежде чем это произойдет, они дополнительно дифференцируются или проходят предварительную обработку. Лимфоциты, которые в итоге станут активированными Т-лимфоцитами, сначала мигрируют к тимусу, где подвергаются предварительной обработке. Эти ответственные за клеточно-опо-средованный иммунитет лимфоциты называют Т-лимфоцитами, что подчеркивает роль тимуса. Другая популяция лимфоцитов, В-лимфоциты, предназначенные для формирования антител, проходят предварительную обработку в печени плода в середине периода внутриутробной жизни, а также в костном мозге в конце внутриутробной жизни плода и после рождения. Эта популяция клеток впервые была открыта у птиц, имеющих специальный орган для их предварительной обработки, который называют бурсой Фабриция (фабрициевой сумкой). Ответственные за гуморальный иммунитет лимфоциты называют В-лимфоцитами, что подчеркивает роль бурсы. На рисунке показаны две лимфоцитарные системы для формирования: (1) активированных Т-лимфоцитов; (2) антител.
Предварительная обработка Т- и В-лимфоцитовВсе лимфоциты организма происходят от коммитированных в лимфоцитарном направлении стволовых клеток эмбриона, но эти клетки не могут непосредственно превратиться в активированные Т-лимфоциты или антитела. Прежде чем это станет возможным, клетки должны подвергнуться дальнейшей дифференцировке в соответствующих областях, где они проходят специфическую обработку. Т-лимфоциты проходят предварительную обработку в тимусе (вилочковой железе). После образования в костном мозге Т-лимфоциты сначала мигрируют к вилочковой железе. Здесь они быстро делятся, одновременно становясь чрезвычайно разнообразными, т.е. предназначенными для реакции против разных специфических антигенов. Это значит, что один лимфоцит, обработанный в тимусе, проявляет специфическую реактивность в отношении одного антигена. Следующий лимфоцит специфически реагирует на другой антиген. Это продолжается до тех пор, пока в тимусе не появятся тысячи разных типов лимфоцитов со специфической реактивностью в отношении тысяч разных антигенов. Эти разные типы предварительно обработанных Т-лимфоцитов оставляют тимус и распространяются кровью по всему телу, временно оседая в лимфоидной ткани. Кроме того, благодаря обработке в тимусе любой оставляющий его Т-лимфоцит не реагирует с белками или другими антигенами собственных тканей организма (иначе Т-лимфоциты погубили бы собственное тело человека в течение всего нескольких дней). Тимус выбирает, какие Т-лимфоциты могут его покинуть, сначала смешивая их практически со всеми специфическими аутоантигенами собственных тканей тела. Если Т-лимфоцит реагирует, он разрушается и фагоцитируется, вместо того, чтобы выделяться. Это происходит с основной частью клеток (вплоть до 90%). Таким образом, клетки, выделяющиеся из тимуса, не реагируют против собственных антигенов тела; они реагируют лишь на антигены внешних источников, например бактерий, токсинов или тканей, пересаженных от другого человека. Основная часть предобработки Т-лимфоцитов в тимусе происходит перед рождением ребенка и в течение нескольких месяцев после рождения. Удаление вилочковой железы после этого периода ослабляет (но не исключает) Т-лимфоцитарную иммунную систему. Однако удаление тимуса за несколько месяцев до рождения может нарушить развитие всего клеточно-опосредован-ного иммунитета. Поскольку именно клеточный тип иммунитета в основном отвечает за отторжение трансплантированных органов, например сердца или почек, органы можно пересаживать с меньшей вероятностью отторжения, если у животного в соответствующее время до его рождения удалить тимус. В-лимфоциты проходят предварительную обработку в печени и костном мозге. О деталях предварительной обработки В-лимфоцитов известно гораздо меньше, чем о предобработке Т-лимфоцитов. Известно, что у человека предварительная обработка В-лимфоцитов осуществляется в печени в середине внутриутробного периода развития, а также в костном мозге в конце внутриутробного периода и после рождения. Существуют два важных различия между В- и Т-лимфоцитами. Во-первых, В-лимфоциты активно секретируют реактивные агенты, называемые антителами, в отличие от Т-лимфоцитов, реагирующих с антигеном непосредственно. Антитела — это крупные белковые молекулы, способные соединяться с антигенной субстанцией и разрушать ее. Во-вторых, разнообразие В-лимфоцитов выражено больше, чем у Т-лимфоцитов, т.е. формируются миллионы типов В-лимфоцитарных антител с разными специфическими реактивностями. После предобработки В-лимфоциты, как и Т-лимфоциты, мигрируют к лимфоидной ткани по всему телу, где временно располагаются рядом, но несколько обособленно от областей локализации Т-лимфоцитов. – Также рекомендуем “Роль лимфоцитарных клонов. Происхождение клонов лимфоцитов” Оглавление темы “Клетки иммунитета. Виды иммунитета”: |
Источник
Взаимодействие Т- и В-лимфоцитов. Взаимодействие лимфоцитов и макрофаговНа основании всех изложенных данных были предложены различные гипотезы о трехклеточных системах иммунопоэза. В 1969 г. несколько авторов независимо друг от друга предположили, что процесс антителогенеза инициируется в результате кооперации трех типов клеток: клеток-предшественников (В-лимфоцитов), Т-лимфоцитов и макрофагов. При возникновении антигенного стимула В-лимфоцит-предшественник под влиянием сигналов со стороны Т-клеток-помощников и макрофагов переходит из покоящегося состояния в метаболически активную фазу, обеспечивающую клональную пролиферацию и дифференцировку в плазматическую клетку, активно синтезирующую и секретирующую антитела. Роль макрофагов существенна, по-видимому, на самом первом этапе распознавания антигена и приведения его в иммуногенную форму. Опыты с использованием антимакрофагальных сывороток показали необходимость присутствия макрофагов лишь в первые сутки после введения антигена, т. е. в момент антигенной стимуляции (Галактионов, Анфалова, 1974). Все теории индукции антителогенеза в В-лимфоцитах можно разделить на две группы: теория односигнальной и двухсигнальной активации В-лимфоцнтов. Сторонники односигнальных теорий постулируют необходимость одного сигнала для перехода покоящегося В-лимфоцита в метаболически активную фазу. Одни авторы считают, что этим сигналом является неспецифическое ми-тогенное влияние антигена, а не взаимодействие антигенных детерминантов с рецепторами на поверхности В-клетки. Иммуноглобулиновые рецепторы, по их мнению, обеспечивают лишь концентрирование антигена на определенных В-клетках, что приводит к преимущественной активации клонов, детерминированных к синтезу антител данной специфичности.
Экспериментальное обоснование этой гипотезы опирается на результаты опытов но изучению влияния тимуснезависимых антигенов на В-клетки. Большинство известных тимуснезависимых антигенов обладают свойствами поликлональных активаторов и являются митогенами для В-клеток (Doenhoff е. а., 1976). Имеются данные о том, что некоторые В-клеточные митогены вызывают поликлона льный синтез антител в отсутствие специфического антигена (Andersson е. а., 1972). Отсюда делается вывод, что сигналом, вызывающим индукцию иммунной реактивности в В-клетке, является неспецифическое митогенное воздействие, а не связывание специфических антигенных детерминант иммуноглобулиновыми рецепторами. Однако есть факты, которые не укладываются в представление о ведущей роли поликлонального воздействия в активации В-клетки. Так, существуют Т-независимые антигены, которые не вызывают митогенного эффекта или поликлонального синтеза антител, Кроме того, есть сведения об отсутствии корреляции между степенью митогенности тимуснезависимого носителя н силой иммунного ответа к присоединенному к нему гаптену. Известно, например, что пневмококковый полисахарид является лучшим митогеном, чем леван, однако ответ к динитрофенильной группе, конъюгированной с леваном, был выше, чем при конъюгировании данного гаптена с пневмококковым полисахаридом. Вторая точка зрения о природе стимулирующего сигнала заключается в том, что активация В-клеток происходит в результате взаимодействия антигенных детерминант с иммуноглооулиновыми рецепторами В-лимфоцита (Feldmann e. a., 1975 b; Klaus, Hamphrey, 1975). В случае тимуснезависимых антигенов многоточечное присоединение густо повторяющихся детерминант к поверхности В-клетки обеспечивает высокую энергию связывания антигена с В-лимфоцитом, что приводит к его активации. В случае тимуезависимых антигенов необходимая для активации структура антигенных детерминант создается с помощью Т-лимфоцитов, которые концентрируют антиген и представляют его В-клетке в поливалентной форме. Так, согласно гипотезе Фелдмана и соавторов, Т-клетки полимеризуют антиген на поверхности макрофага. Молекулы антигена связываются носителем с IgT, вырабатываемым активированными Т-лимфоцитами. Комплексы антиген — IgT присоединяются к макрофагу, в результате чего на поверхности макрофага создается обойма из антигенных молекул, ориентированных гаптенными группировками наружу. Такая структура с высокой плотностью идентичных антигенных детерминант и активирует В-клетку. При отсутствии макрофагов, являющихся местом структурной организации антигена, развивается не иммунный ответ, а толерантность. Таким образом, односигнальная модель также предусматривает кооперацию различных типов клеток при создании активирующего стимула. Существование тимуснезависимых антигенов, очевидно, не противоречит положению о необходимости взаимодействия клеток при индукции антителогенеза. – Также рекомендуем “Модель активации В-клетки. Индукция антителообразования” Оглавление темы “Супрессия иммунного ответа. Клетки супрессоры”: |
Источник
Оглавление темы “Иммунная система. Функции клеток иммунной системы. Т-лимфоциты. В-лимфоциты. Структура и функции органов иммунной системы.”: Т-лимфоциты. Характеристика Т-лимфоцитов. Типы молекул на поверхности Т-лимфоцитов.Решающее событие в развитии Т-лимфоцитов — формирование антигенраспознающего Т-клеточного рецептора — происходит только в тимусе. Для обеспечения возможности распознавания любого антигена нужны миллионы различных по специфичности антигенраспознающих рецепторов. Формирование огромного разнообразия антигенраспознающих рецепторов возможно благодаря перестройке генов в процессе пролиферации и дифференцировки клеток-предшественниц. По мере созревания Т-лимфоцитов на их поверхности появляются ан-тигенраспознающие рецепторы и другие молекулы, опосредующие их взаимодействие с антигенпредставляющими клетками. Так, в распознавании собственных молекул главного комплекса гистосовместимости наряду с Т-клеточным рецептором участвуют молекулы CD4 или CD8. Межклеточные контакты обеспечиваются наборами поверхностных адгезионных молекул, каждой из которых соответствует молекула — лиганд на поверхности другой клетки. Как правило, взаимодействие Т-лимфоцита с антигенпредставляющей клеткой не ограничивается распознаванием антигенного комплекса Т-клеточным рецептором, а сопровождается связыванием других попарно комплементарных поверхностных «костимулирующих» молекул. Таблица 8.2. Типы молекул на поверхности Т-лимфоцитов
Сочетание поверхностных молекул лимфоцитов, которые принято обозначать порядковыми номерами «кластеров дифференцировки» (clusters of differentiation — CD), обозначается как «поверхностный фенотип клетки», а отдельные поверхностные молекулы называют «маркерами», так как они служат метками конкретных субпопуляций и стадий дифференцировки Т-лимфоцитов. Так, например, на поздних этапах дифференцировки одни Т-лимфоциты утрачивают молекулу CD8 и сохраняют только CD4, а другие утрачивают CD4, а сохраняют CD8. Поэтому среди зрелых Т-лимфоцитов различают CD4+ (Т-хелперы) и CD8+ (цитотоксические Т-лимфоциты). Среди циркулирующих в крови Т-лимфоцитов клеток с маркером CD4 примерно в два раза больше, чем клеток с маркером CD8. Зрелые Т-лимфоциты несут на поверхности рецепторы для разных цитокинов и рецепторы для иммуноглобулинов (табл. 8.2). При распознавании Т-клеточным рецептором антигена Т-лимфоциты получают сигналы активации, пролиферации и дифференцировки в направлении клеток-эффекторов, т. е. клеток, способных непосредственно участвовать в защитных или повреждающих эффектах. Для этого на их поверхности резко возрастает количество адгезионных и костимулирующих молекул, а также рецепторов для цитокинов. Активированные Т-лимфоциты начинают продуцировать и секретировать цитокины, активирующие макрофаги, другие Т-лимфоциты и В-лимфоциты. После завершения инфекции, сопряженной с усиленной продукцией, дифференцировкой и активацией Т-эффекторов соответствующего клона, в течение нескольких дней 90 % эффекторных клеток погибают, поскольку не получают дополнительных сигналов активации. В организме остаются долгоживущие клетки памяти, несущие соответствующие по специфичности рецепторы и способные ответить пролиферацией и активацией на повторную встречу с тем же антигеном. – Также рекомендуем “Популяции Т-лимфоцитов. Субпопуляции Т-лимфоцитов. СD4 Т-лимфоциты. СD8 Т-лимфоциты..” |
Источник
Т-лимфоциты несут на себе поражающее воображение разнообразие рецепторов, позволяющее распознавать практически любые чужеродные субстанции, с которыми может столкнуться организм. Путь от гемопоэтической стволовой клетки к 107–109 клонов Т-лимфоцитов с уникальными антиген-связывающими последовательностями — удивительное достижение эволюции. Многостадийное развития Т-лимфоцитов может выглядеть пугающим и запутывающим со страниц учебников. Однако, если вы дадите ему второй шанс, вы увидите, что это красивый и слаженный процесс.
Как и остальные клетки крови, Т-лимфоциты берут свое начало в костном мозге от гемопоэтической стволовой клетки. Такие клетки-предшественницы имеют мало общего со зрелыми функциональными Т-лимфоцитами: они не имеют антигенных рецепторов (TCR) и не умеют узнавать чужеродные антигены. Их ждет сложный путь развития, который осилят немногие, однако те, которые выживут, создадут армию, готовую к любой угрозе. Для развития Т-лимфоцитов в нашем теле формируется специальный орган — тимус. Создав достаточный репертуар рецепторов, тимус подвергается инволюции и практически не детектируется после пубертатного периода. Численность Т-лимфоцитов во взрослом организме в основном поддерживается делением зрелых клеток.
Для миграции в тимус клетки, чья судьба — стать Т-лимфоцитом, используют хемокиновый рецептор CCR9, лиганд для которого — CCL25 — секретируют клетки тимуса. Достигнув тимуса, предшественники Т-лимфоцитов становятся тимоцитами. Первым делом они получают сигнал от эпителиальных клеток тимуса через рецептор Notch-1, который окончательно определяет их судьбу в пользу Т-лимфоцита.
Следующая задача тимоцитов — активная пролиферация. Скорость деления тимоцитов крайне высока, поскольку 95 %–98 % этих клеток погибает. Дело в том, что судьба развивающегося Т-лимфоцита по умолчанию — апоптоз, спасти от которого его может только успешное прохождение нескольких раундов отбора. Сигнал для первого раунда деления — интерлейкин 7, который выделяют эпителиальные и другие клетки тимуса. Мутации в гене ИЛ-7 или его рецептора приводят к тяжелым иммунодефицитам. Пролиферация приводит к созданию большого пула клеток, которые называют дважды негативными клетками, поскольку они не несут на себе корецепторы CD4 и CD8. Большинство из них (90 %) дадут начало αβ Т-лимфоцитам, а 10 % — γδ Т-лимфоцитам.
После этого тимоциты приступают к перестройке генов антигенных рецепторов. Это тот самый момент, когда из небольшого количества генов возникает всё разнообразие антигенных рецепторов — миллионы и миллиарды. В ходе этого процесса участки генов антигенных рецепторов перестраиваются случайным образом. Ключевое слово здесь — случайный, поскольку процесс формирования рецепторов, способных эффективно распознавать чужеродные антигены, никак не зависит от этих антигенов и происходит задолго до встречи с ними!
До сих пор тимоциты содержали гены TCR в зародышевой конфигурации, т. е. не подвергшиеся перестройке. Такие гены не могут образовать TCR. Тимоциты начинают с перестройки генов одной из двух цепей TCR — β-цепи. После этого тимоциты проходят через первую контрольную точку. В случае успешной перестройки клетка экспрессирует β-цепь, которая вместе с инвариантной α-цепью формирует на поверхности клетки pre-TCR. Такой рецептор активируется без участия лиганда и передает в клетку сигналы для дальнейшего развития. Остальные клетки не проходят отбор: в случае неудачной перестройки pre-TCR не экпрессируется и клетка подвергается апоптозу в отсутствие сигналов к выживанию.
Активация pre-TCR поставляет в клетку важные сигналы для дальнейшего развития:
- Останавливается перестройка локуса β-цепи во втором аллеле. Это называется аллельное исключение — зрелые Т-лимфоциты экспрессируют β-цепь TCR только с одного аллеля.
- Начинается экспрессия двух ко-рецепторов CD4 и CD8, теперь тимоциты называются дважды позитивными.
- Начинается второй раунд пролиферации. Через pre-TCR клетки получают мощный сигнал к делению, приводящий к еще более интенсивной экспансии, чем в первом раунде.
- После этапа деления запускается перестройка α-цепи рецептора.
В отличие от цепи-партнера, α-цепь может подвергаться многократной перестройке, и большинство тимоцитов успешно с ней справятся. После перестройки α-цепи тимоциты наконец экспрессируют на своей поверхности полный αβ TCR. Однако впереди главная проверка, пройти которую суждено немногим.
Задачи последнего этапа отбора:
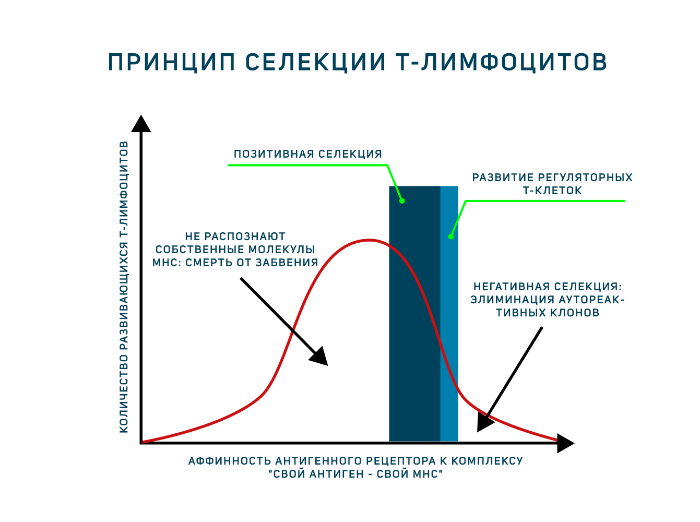
- Отобрать клетки, распознающие молекулы главного комплекса гистосовместимости (MHC) организма. Этот этап присутствует в развитии тимоцитов, поскольку зрелые Т-лимфоциты способны распознавать антигены только в составе МНС. Поэтому они должны знать МНС своего организма в лицо. Это называется позитивная селекция.
- Элиминировать клетки, распознающие собственные антигены. Это называется негативная селекция.
Однако антигенпрезентирующие клетки тимуса (эпителиальные клетки тимуса, дендритные клетки и макрофаги) располагают только комплексами «свой МНС — свой антиген». И позитивная, и негативная селекция осуществляется на основании взаимодействия TCR с такими комплексами! Для объяснения была предложена гипотеза аффинности. Тимоциты, чьи антигенные рецепторы проявят низкую аффинность к таким комплексам, продолжат развитие. Тимоциты, чьи рецепторы свяжутся с представленными антиген-МНС комплексами прочно, подвергнутся апоптозу как аутореактивные клоны (клональная делеция). Клетки, не распознающие МНС вовсе, т. е. не прошедшие позитивную селекцию, умрут особым способом, который называется смерть от забвения (death by neglect). Ещё один вариант развития — среднее связывание рецептора с антигенным комплексом, такие тимоциты могут дать начало регуляторным Т-клеткам. Таким образом, регуляторные Т-клетки — единственные лимфоциты, которые взаимодействуют со своим будущим антигеном в процессе развития! Развитию этого подтипа Т-лимфоцитов сейчас посвящено много исследований.
Особую роль в негативной селекции играет белок AIRE (аутоиммунный регулятор), который заставляет клетки тимуса экспрессировать в небольших количествах антигены, в норме присутствующие только в определенных тканях. Это позволяет сформировать толерантность к тканеспецифичным антигенам, встречающимся только за пределами тимуса. Мутация в белке AIRE приводит к развитию аутоиммунного полиэндокринного синдрома. AIRE содержится в эпителиальных клетках медуллы. При этом известно, что наиболее эффективно негативная селекция осуществляется при презентации антигена дендритными клетками и макрофагами, а не стромой тимуса. В новом исследовании был показан перенос антигенов из эпителиальных клеток тимуса в дендритные клетки, которые их и презентируют!
Одновременно с позитивной и негативной селекцией осуществляется проверка, соответствует ли корецептор распознаваемому классу МНС — т. е. происходит дифференцировка в функциональные подклассы. Выживают только клетки с правильной комбинацией: CD8 + MHC I — цитотоксические Т-лимфоциты и CD4 + MHC II — Т-хелперы.
Последнее, что должен сделать лимфоцит перед тем, как покинуть тимус — это изменить тип сигналинга через антигенный рецептор. Если незрелые Т-лимфоциты с высоким родством к антигену погибают, то зрелые — активируются (молекулярные основы такой принципиальной разницы не ясны). Теперь лимфоциты готовы заселить периферические лимфоидные органы и нести оборону. Зрелые Т-лимфоциты покидают тимус, используя градиент сфингозин-1-фосфата, — липида, присутствующего в высоких концентрациях в крови и лимфе, для хемотаксиса в кровяное русло. Для хоуминга во вторичные лимфоидные ткани они используют CD62L (L-селектин).
γδ Т-лимфоциты несут менее разнообразные антигенные рецепторы, по-видимому, не зависящие от МНС. Они не экспрессируют корецепторы CD4, CD8. γδ Т-лимфоциты выступают в роли первой линии обороны против часто встречающихся бактерий в эпителиальных и слизистых тканях и скорее относятся ко врожденной иммунной системе, чем к адаптивной.
Источники:
- Kenneth Murphy, Casey Weaver. Janeway’s Immunobiology 9th edition. Garland Science, 2017.
- Abul Abbas, Andrew H. Lichtman, Shiv Pillai. Cellular and Molecular Immunology 9th Edition. Elsevier, 2017.
- Perry J. S. et al. CD36 Mediates Cell-Surface Antigens to Promote Thymic Development of the Regulatory T Cell Receptor Repertoire and Allo-tolerance //Immunity. – 2018. – 923-936.
Источник