Сколько живут с метастазами в брюшной полости в лимфоузлах
Метастазы в брюшине могут развиться при всех злокачественных процессах, но при раке яичников и желудка — это типичная и самая частая локализация. В большинстве случаев метастазирование в брюшной полости отсекает возможность радикального хирургического лечения, только больные раком яичников находятся в выигрышном положении — их активно и результативно оперируют.
Механизм формирования метастазов
Механизм образования метастазов — одна из основополагающих характеристик злокачественного процесса. Метастатический узел образуется из одной злокачественной клетки, получившей способность жить без помощи материнской опухоли и выживать на удалении от неё. К путешествию по организму злокачественную клетку понуждают образующиеся в ней и в её окружении специфические белковые комплексы — факторы роста опухоли.
В кровеносном и лимфатическом русле больного раком циркулирует огромное число злокачественных клеток, 99.9% которых погибает. Мизерное число злокачественных клеток находит приют в небольших сосудах разных органов, образуя там фиксированный раковый эмбол. По какому-то сигналу начинается размножение раковых клеток, образующих микроскопическое злокачественное сообщество, разъедающее стенку сосуда своими ферментами. Дальше клеточная группа внедряется в здоровую ткань, чтобы сначала стать микрометастазом, а после и клинически определяемым метастатическим узлом.
Пути распространения метастазов
Серозные листки организма, к которым относятся брюшина, плевра и сердечная сумка — перикард восприимчивы к опухолевым клеткам, которые попадают на них несколькими путями:
- в разветвленную сеть кровеносных сосудов внутренних органов раковые эмболы приносятся с кровотоком — гематогенное метастазирование;
- лимфатическая сеть брюшины вырабатывает влагу для исключения трения внутренних органов при дыхательных движениях, создавая отличные условия для приживления заносимых лимфой злокачественные клеток — лимфогенное метастазирование;
- лимфогематогенный путь предполагает сочетанное действие двух описанных патогенетических механизмов;
- клетки отрываются от ракового конгломерата внутреннего органа и путешествуют вместе с внутрибрюшной жидкостью, контактно внедряясь в подходящий по условиям участок серозной оболочки — это имплантационный вид распространения.
В большинстве случаев действуют все механизмы метастазирования.
Способы диагностики метастазов
Диагностика зависит от анатомической области:
- метастатические образования в коже и мягких тканях определяются на ощупь — при пальпации, их границы хорошо видны при УЗИ;
- в легких метастазы находят при рентгене, КТ и МРТ, также и в костях, но совсем крошечные очаги обнаруживают только при сцинтиграфии;
- в органах брюшной полости метастазы обнаружат УЗИ, КТ и МРТ, в желудочно-кишечном тракте большую пользу приносят эндоскопические методы обследования;
- очаговые метастатические образования в головном мозге выявляет МРТ и КТ;
- в любом месте опухолевый очаг найдет изотопное исследование — ПЭТ.
Какой рак может дать метастазы в брюшину?
Любой рак может осложниться метастазами в брюшину, но самый высокий процент отмечается при карциномах яичников, желудка, толстой кишки и поджелудочной железы.
Уже на 1-2 стадиях карциномы яичников в брюшной полости находят свободно циркулирующие раковые клетки, при 3 стадии на листках брюшины развиваются видимые метастазы разных размеров.
При карциномах всех других органов метастазы переводят процесс в неоперабельный и констатируется 4 стадия, радикальное лечение невозможно, но при случае и с пользой для пациента может выполнятся циторедукция — удаление всех видимых опухолевых образований.
Симптомы возникновения метастаз в брюшине
Клинические проявления внутрибрюшинного метастазирования часто протекают скрытно — где-то кольнуло, что-то потянуло, какая-то непонятная слабость. Симптомы появляются при значительном увеличении живота в размере за счёт образования в полости избыточного количества жидкости — асцита. Опухолевые узлы на листках брюшины находят только при УЗИ, КТ или МРТ.
Нередко прогрессирующее опухолевое поражение брюшины так и остается бессимптомным, на первый план выходят признаки накопления внутрибрюшной жидкости и вызываемые асцитом симптомы сердечно-легочной недостаточности: одышка, отеки нижней половины тела, застой в легких, кашель, нарушение сердечной деятельности, слабость. Болевой синдром, как правило, очень слабый.
Что делать, если пошли метастазы в брюшной полости?
При раке яичников с сохраненной подвижностью опухолевого конгломерата в малом тазу обязательно предложат циторедуктивную операцию, при которой убирается всё опухолевое, что можно удалить, и метастатические узелки буквально срезаются с брюшины. Цель циторедукции — удалить всю злокачественную ткань по максимуму, узелки меньше сантиметра эффективно уничтожаются лекарствами. Далее больной предстоит длительная химиотерапия с производными платины и таксанами.
При других нозологических формах рака метастазирование отрезает путь к радикальной операции, только паллиативные вмешательства по поводу осложнений и создания обходящих опухоль путей для беспрепятственного движения пищевых или каловых масс, больному предстоит системная и локальная — внутрь брюшной полости химиотерапия.
Лечение метастаз в брюшине
Системная химиотерапия помогает при чувствительных к цитостатикам злокачественных процессах: раке молочной железы, лимфомах. Карциномы органов желудочно-кишечного тракта неактивно отзываются на лекарственное лечение, но нельзя не использовать возможность их уменьшения, особенно при агрессивных быстро прогрессирующих процессах.
При раке желудка предлагается 18 недель химиотерапии, при опухоли толстой кишки — не менее 4 месяцев, при панкреатической карциноме — до прогрессирования заболевания. Схема определяется состоянием пациента, тяжелым больным проводится симптоматическое лечение при необходимости с эвакуацией асцита.
Повысить противоопухолевый эффект химиотерапии удается при локальном введении цитостатика — внутрибрюшинно. При необходимости частых введений цитостатика внутрь полости устанавливается порт-система, исключающая тягостные симптомы классического лапароцентеза. Сложности неизбежны, поскольку постоянная выработка асцитической жидкости снижает концентрацию химиопрепарата, а тяжесть состояния ограничивает спектр цитостатиков.
Особенно эффективна технология лечения метастазов HIPEC с локальной доставкой цитостатика непосредственно к опухоли на фоне такого же локального повышения температуры — гипертермии, поэтому второе название методики ХТ «гипертермическая интраперитонеальная». Раковые клетки убивает синергизм повышенной и не снижающейся концентрации химиопрепарата и высокой температуры на фоне совершенно уникального действия HIPEC — доставки противоракового лекарства внутрь метастатических узлов.
Прогноз при метастазах в брюшине
Прогноз определяется чувствительностью злокачественных клеток к лекарствам, но в любом случае метастазирование по брюшине относится к самым неблагоприятным, исключая рак яичников. При карциномах кишки, когда удаётся провести паллиативную операцию и максимально удалить метастатические новообразования, трёхлетняя выживаемость приближается к 20%, 2 года переживает только каждый третий. Проведение химиотерапии улучшает выживаемость, но она хуже, чем при метастазах другой локализации.
В нашей клинике никогда не отступают перед раком, предлагая пациенту оптимальные и все известные онкологии методики противоопухолевого воздействия. Мы не ограничиваемся одним оружием, используя комбинацию лекарств, паллиативных вмешательств и неинвазивных методик. Наша цель — сохранить и улучшить жизнь наших пациентов, и нам это удается.
Список литературы:
- Чиссов В.И., Вашакмадзе Л.А., Бутенко А.В., и др./ Комбинированные вмешательства при колоректальном раке / // Колопроктология, спецвыпуск: вопросы онкопатологии; 2002, № 2.
- Стилиди И.С., Неред С.Н. /Современные представления об основных принципах хирургического лечения местно-распространенного рака желудка// Практич. Онкология; 2009, т. 10, № 1.
- Тюляндин С.А., Коломиец Л.А., Морхов К.Ю., и др./ Практические рекомендации по лекарственному лечению рака яичников, первичного рака брюшины и рака маточных труб// Злокач. опухоли: Практич. рекомендации RUSSCO; 2017 (том 7).
- Fujitani K., Yang H-K., Misuzawa J., et al./ Gastrectomy plus chemotherapy versus chemotherapy alone for advanced gastric cancer with a single-curable factor (REGATTA): a phase 3, randomized controlled trial// Lancet Oncol; 2016, 17.
- Hugen N., Brown G., Glynne-Jones R., et al. /Advances in the care of patients with mucinous colorectal cancer// Nature Reviews Clinical Oncology; 2015, (Sept).
- Pentheroudakis G., Pavlidis N. /Serous papillary peritoneal carcinoma: unknown primary tumour, ovarian cancer counterpart or a distinct entity? A systematic review// Crit Rev Oncol Hematol; 2009, Nov 6.
Источник
Метастазы — это вторичные опухолевые образования, которые возникают в результате рассеивания злокачественных клеток из первичных очагов. Они могут распространяться по всему организму, поражая практически любой орган. Однако в подавляющем большинстве случаев первые метастазы обнаруживаются в лимфоузлах.
Причины метастазирования в лимфоузлы
Механизмы возникновения метастазов до конца не ясны. Известно, что в данном процессе играет роль активация у злокачественных клеток способности к миграции и структурная перестройка кровеносных и лимфатических сосудов, питающих и окружающих опухоль — в них отсутствует базальная мембрана и перициты. Некоторые капилляры даже образованы непосредственно опухолевыми клетками. Таким образом, злокачественные клетки попадают в лимфатические сосуды и по ним достигают ближайших лимфатических узлов.
Способность рака к метастазированию определяется несколькими факторами:
- Степенью злокачественности рака. Чем менее дифференцированы клетки опухоли, тем она агрессивнее и тем раньше начинает метастазировать.
- Гистологическим типом опухоли. Чаще всего лимфогенным путем метастазируют карциномы — злокачественные новообразования, происходящие из эпителиальной ткани.
- Возрастом пациента. У молодых людей метастазы при одних и тех же опухолях в среднем появляются раньше, чем у людей пожилого возраста. Это связывают с особенностями кровообращения и активностью иммунной системы.
Ускорить процесс метастазирования могут тепловые процедуры и физиопроцедуры на область локализации новообразования, а также несоблюдение правил абластики при удалении опухоли. Последний момент очень важен при хирургическом лечении рака, поэтому онкологические операции должны выполняться в специализированных стационарах, в которых есть определенные условия для проведения подобных вмешательств и квалифицированный персонал.
Пути распространения
Сначала поражаются регионарные лимфоузлы, т. е. те, которые расположены ближе всего к первичному опухолевому очагу. На какое-то время они сдерживают дальнейшее распространение, но злокачественные клетки прорываются через этот барьер и распространяются на отдаленные группы лимфоузлов. Там они также на какое-то время блокируются, но затем идут дальше, распространяясь до другим группам лимфатических узлов, внутренним органам и даже костям и костному мозгу.
На какие виды рака указывает наличие метастазов в лимфоузлах
Как мы уже говорили, в лимфоузлы чаще всего метастазируют опухоли эпителиального происхождения, т. е. карцинома. Саркомы (злокачественные опухоли из соединительной ткани) чаще метастазируют гематогенным путем, т. е. с током крови. Однако и лимфогенный путь также имеет место быть.
Также лимфоузлы поражаются при лейкозах (раке крови) и лимфомах (рак лимфатической системы). В последнем случае количество групп пораженных лимфоузлов играет решающее значение для определения стадии заболевания.
Для определения вида опухоли потребуется гистологическое исследование измененных узлов. Только после этого можно говорить об определенном диагнозе. Но бывают случаи, когда имеются метастазы, в том числе и множественные, но первичный очаг выявить не удается даже с использованием самых современных методов исследования. В этом случае диагноз так и звучит — метастатическое поражение из невыясненного первичного источника.
Как проявляются метастазы в лимфоузлах
Главным клиническим симптомом метастатического поражения лимфоузлов является их увеличение. Это неспецифическое проявление, которое может развиваться при воспалительных заболеваниях, некоторых инфекциях, лимфоаденопатиях, аутоиммунных патологиях и др. Если лимфоузлы располагаются поверхностно, их можно пропальпировать. При раке они, как правило, имеют мягкую консистенцию и безболезненны на ощупь.
Если происходит увеличение глубоко расположенных лимфоузлов, они могут сдавливать внутренние органы, нарушать их работу и вызывать боль. Симптоматика в этом случае будет зависеть от локализации пораженных лимфоузлов. Узлы ворот печени могут сдавливать воротную вену, приводя к развитию портальной гипертензии. Поражение лимфоузлов брыжейки может вызвать нарушение работы кишечника, внутригрудных — одышку и нарушение работы сердца.
Диагностика метастатического поражения лимфоузлов
При обнаружении злокачественных опухолей обязательно проводится исследование регионарных и отдаленных лимфатических узлов. С этой целью применяются инструментальные и лабораторные методы:
- Ультразвуковое исследование.
- Компьютерная томография.
- Магнитно-резонансная томография.
- Контрастная лимфоангиография.
- Эндоскопические методы исследования — с помощью специальной оптической техники производится осмотр внутренних полостей и органов.
Одним из самых перспективных методов обнаружения метастазов является ПЭТ-КТ. В основе метода лежит внутривенное введение короткоживущих изотопов, которые сильнее всего накапливаются в зонах активного метаболизма, коими являются злокачественные новообразования. Таким способом можно диагностировать даже микрометастазы размером всего несколько миллиметров, которые невозможно детектировать другими методами исследования.
После обнаружения подозрительных лимфоузлов, их пунктируют или проводят биопсию. Полученный материал отправляют в лабораторию на гистологическое или цитологическое исследование. Только после лабораторного подтверждения можно достоверно говорить о наличии метастазов.
Как лечат метастазы в лимфоузлах
Тактика лечения метастазов выбирается индивидуально, с учетом следующих аспектов:
- Органная принадлежность новообразования и ее гистологический вариант.
- Молекулярно-генетические особенности рака.
- Чувствительность к тому или иному методу лечения.
- Количество метастазов, их локализация и размеры.
- Общее состояние больного.
В качестве лечения могут применяться как стандартные противоопухолевые методы, так и самые современные разработки:
- Химиотерапия.
- Радиотерапия.
- Хирургические лечение.
- Таргетная терапия.
- Иммунотерапия.
- Гормонотерапия.
Хирургическое удаление лимфатических узлов называется лимфаденэктомией. Такие операции могут проводиться превентивно, при первичном удалении опухоли с высоким риском распространения по лимфатической системе, например, при раке яичников. В других случаях лимфоузлы удаляются после подтверждения их метастатического поражения. Например, проводят биопсию сторожевого лимфоузла, и если результат положительный, проводят лимфаденэктомию.
Другим методом борьбы с метастазами является химиотерапия. Она оказывает системное влияние на организм и повсеместно уничтожает раковые клетки, даже в случае микрометастазов, которые невозможно диагностировать имеющимися на сегодняшний день методами исследования. Химиотерапия может быть назначена как самостоятельное лечение, так и в дополнение хирургическим операциям или лучевой терапии.
Следует отметить, что опухоль представляет собой гетерогенную группу клеток с мутациями различного типа. Химиопрепараты уничтожают их основную массу, но какая-то часть из них выживает и приобретает устойчивость к терапии первой линии. Из-за этого развивается рецидив или прогрессирование заболевания. В таком случае переходят к терапии второй и последующих линий, которые помимо цитостатиков могут содержать таргетные препараты (моноклональные антитела) и др. Они более прицельно действуют на молекулярные механизмы онкогенеза и если не приводят к выздоровлению, то на какое-то время сдерживают прогрессирование опухоли.
Некоторые злокачественные новообразования чувствительны к действию гормонов, которые в свою очередь стимулируют их рост и размножение. Если подавить этот механизм, опухоль не сможет активно развиваться, что на некоторое время сдержит ее рост. К таким новообразованиями относятся многие виды рака молочной железы. Проведение антигормональной терапии хоть и не излечивает больных, но продляет им жизнь на годы, а в некоторых случаях даже на десятки лет.
Лучевая терапия назначается для удаления метастазов радиочувствительных опухолей. В некоторых случаях она может заменять хирургические операции без ухудшения качества лечения и соответственно прогноза заболевания.
Профилактика
Для рака с высоким риском лимфогенного метастазирования обязательно проводятся профилактические мероприятия. В одних случаях требуется превентивное удаление лимфоузлов, даже если нет данных за их поражение. В других — проводят их облучение. Также в большом количестве случаев назначается химиотерапия, которая призвана в максимальном объеме уничтожить распространившиеся по организму раковые клетки.
Если говорить о профилактике возникновения метастазов в лимфоузлах, то стоит отметить, что практически любая злокачественная опухоль рано или поздно метастазирует. Обнаружив у себя новообразование, необходимо незамедлительно обратиться за специальной помощью, а не заниматься самолечением, которое может лишь усугубить ситуацию и ухудшить прогноз.
Источник
28 января 2020 г.
Просмотров: 2020
Многие злокачественные опухоли распространяют метастазы на брюшину — тонкую «оболочку», которой покрыты внутренние органы и стенки брюшной полости. Называется это явление (от лат. peritoneum — брюшина) перитонеальный карциноматоз (канцероматоз — не всеми признаваемый, но общепринятый синоним, который мы тоже употребляем). Просовидные (мелкие, как пшено) метастазы рассеяны по всей поверхности брюшины.
Это случается в 50% случаев в абдоминальной онкологии (опухоли ЖКТ или репродуктивных органов). Напомним, колоректальный рак (толстой и прямой кишки) и рак желудка находятся на 2 и 3 месте по количеству смертей среди всех онкозаболеваний.
Средняя продолжительность жизни при карциноматозе брюшины без лечения — от 1,5 до 6 месяцев. Лечить же таких больных еще совсем недавно было нечем. Ни хирургия, ни химиотерапия не справлялись. Пациентов признавали инкурабельными (неизлечимыми). Показатель 5-летней выживаемости в начале 90-х был практически равен 0.
Но последние 20 лет активно развивается методика лечения перитонеального канцероматоза с применением HIPEC (англ. hyperthermic intraperitoneal chemotherapy) — гипертермической интраперитонеальной (внутрибрюшинной) химиотерапии. Методика дает отличные результаты: увеличивает 5-летнюю выживаемость до 40–50%, а иногда дает полное излечение.

Наш эксперт в этой сфере:
Заместитель главного врача по лечебной работе,
врач-онколог, хирург, химиотерапевт, врач высшей категории, к.м.н.
Позвонить врачу
В Россию методика HIPEC пришла с сильным опозданием. Кроме нашей «Медицины 24/7» ее до сих пор применяют в считанном количестве клиник даже в Москве, а в регионах это совсем редкий случай. Лечение, которое успешно используется в мире более 20 лет, пациентам в России почти не доступно. Причина — высокая стоимость расходных материалов.
Самое плохое — даже многие врачи не знают, что при канцероматозе существует способ продлить жизнь. Поэтому сегодня мы расскажем про HIPEC подробно: кому это поможет, какие дает результаты и сколько стоит.
Что такое HIPEC
Суть методики HIPEC — в том, что сразу после циторедуктивной (т. е. направленной на удаление опухолевых клеток) операции на брюшине и органах брюшной полости, пациенту в течение 60–90 минут проводят перфузию — «промывают» брюшную полость концентрированным раствором химиопрепарата, нагретым до 42–43 °C.
Цель — уничтожить максимум опухолевых клеток, которые неизбежно останутся даже после самого тщательного хирургического удаления очагов и спровоцируют рецидив.
Свойства, которые делают HIPEC действительно уникальной методикой, мы разъясним чуть ниже, а сначала определимся, при каких диагнозах она может помочь и почему она иногда оказывается единственным способом продлить жизнь человеку на последних стадиях рака.
При каких опухолях образуется канцероматоз брюшины, и почему он так опасен
В брюшную полость распространяются многие из часто встречающихся видов рака.
- рак яичников — в 60–70% случаев приводит к канцероматозу;
- рак желудка — канцероматоз в 40–50% случаев;
- рак поджелудочной железы — в 30–40% случаев;
- рак толстой и прямой кишки (колоректальный рак) — в 10–15% случаев;
- рак печени;
- рак шейки матки;
- рак червеобразного отростка (аппендикса);
- редкие первичные опухоли брюшины (мезотелиома и псевдомиксома).
Все эти злокачественные новообразования распространяют раковые клетки либо когда первичная опухоль физически прорастает в брюшную полость, либо вместе с током крови и лимфы — иногда это происходит во время хирургических операций по поводу первичных опухолей.
Наши врачи вам помогут
Оставьте свой номер телефона
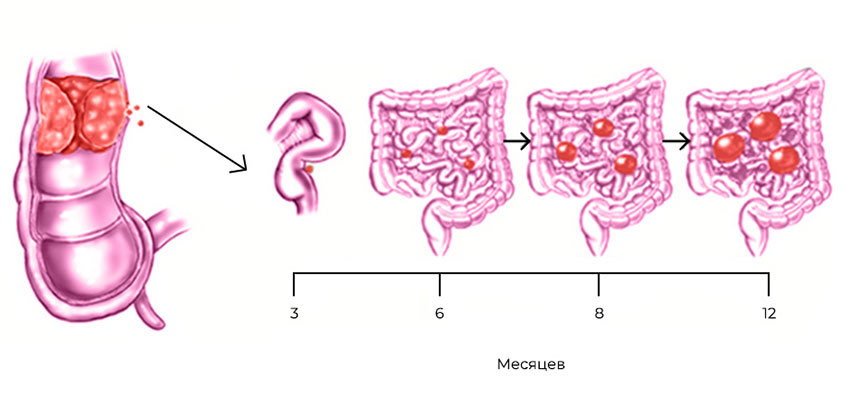 Развитие канцероматоза при колоректальном раке: из прямой кишки в брюшную полость
Развитие канцероматоза при колоректальном раке: из прямой кишки в брюшную полость
Стоит раковым клеткам попасть в полость, ограниченную брюшиной — они, скорее всего, дадут начало вторичным опухолям, метастазам. Перитонеальная ткань — богатый источник факторов роста и комфортная среда для их развития. Микроскопические метастазы распространяются по поверхности брюшины, поражают внутренние органы.
Метастазы нарушают кровоток и лимфоток, лишают внутренние органы питания и пространства, зачастую становятся причиной непроходимостей (например, кишечной, или сдавливают мочеточники). Кроме того, это провоцирует асцит — выпот и скопление жидкости в брюшной полости — наиболее распространенный симптом при канцероматозе.
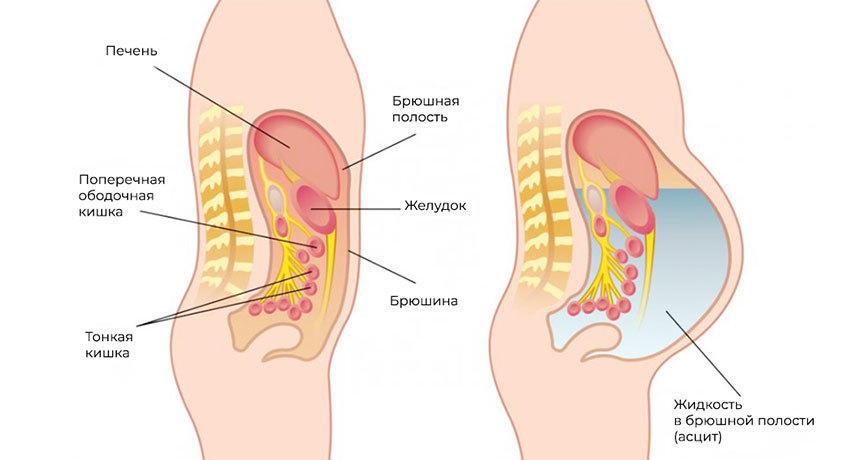
Асцит — скопление жидкости в брюшной полости
Застой крови и лимфы, интоксикация, сдавление внутренних органов метастазами и/или скопившейся жидкостью при асците — это причины, почему пациенты с канцероматозом без лечения не проживают и года.
Другие методы лечения в таких случаях — не работают
На протяжении почти всей истории онкологии считалось, что перитонеальный карциноматоз и опухоли брюшины не поддаются никакому из существующих видов лечения.
Лучевая терапия в лечении канцероматоза не применяется, поскольку высокие дозы облучения такой обширной области живота опасны для пациента еще более серьезными осложнениями.
Хирургическое лечение малоэффективно, т. к. метастазы на поверхности брюшины могут быть микроскопического размера, либо расположены в недоступных местах, и врач не видит их во время операции. А для быстрого рецидива канцероматоза достаточно и единичных раковых клеток, оставшихся в полости брюшины.
Системная химиотерапия почти не дает чувствительного воздействия на опухоли брюшины -опухолевые очаги размером до 3 мм (таких при канцероматозе большинство) практически не развивают систему собственных кровеносных сосудов — и поэтому слабо доступны для системной внутривенной химиотерапии.
Вводить химиотерапию в более высоких дозах, чтобы повысить концентрацию препаратов в перитонеальной области — невозможно, т. к. это может необратимо навредить остальным органам и тканям, до которых доберется перенасыщенный химиопрепаратом кровоток.
Поэтому долгое время считалось, что пациенты с карциноматозом брюшины — неизлечимы. И до сих пор многие врачи — кстати, в разных странах — придерживаются того же мнения. Среди наших пациентов часто бывают те, кого «выписали» из больницы, потому что «канцероматоз нечем лечить». Когда они приходят к нам и узнают про возможность лечения с помощью HIPEC — оказывается, что о такой методике они слышат впервые.
Во второй половине 20 века появились первые работы, рассказывающие о возможностях применения внутрибрюшинной химиотерапии. Последние 20 лет это направление активно развивается, а создал его еще в 80-х годах XX века американский хирург-онколог Пол Шугабейкер — он первым придумал совместить циторедуктивную операцию с горячей химиотерапией, вводимой непосредственно в брюшную полость. И это дало результат
HIPEC — в чем секрет эффективности
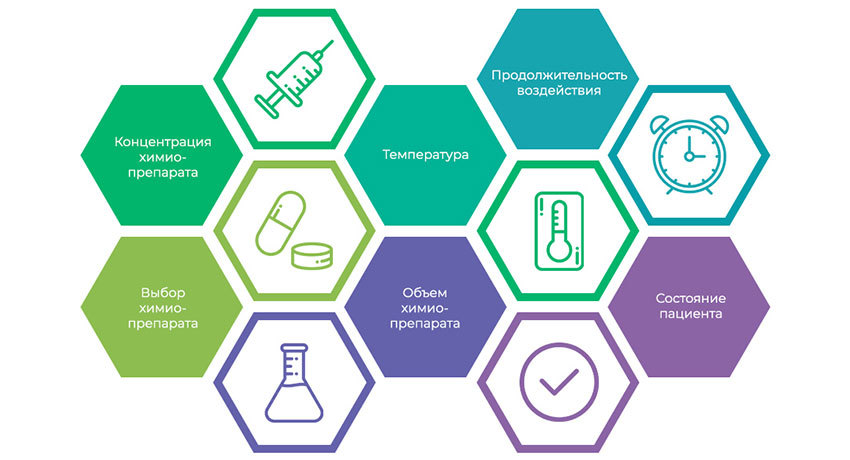
 5 параметров, определяющих результативность HIPEC
5 параметров, определяющих результативность HIPEC
В названии «гипертермическая внутрибрюшинная химиотерапия» важны оба прилагательных.
Гипертермия — это повышение температуры.
Высокая температура сама по себе способна вызывать повреждение и гибель опухолевых клеток. К тому же, делает их более уязвимыми для действия химиопрепаратов: усиливает проницаемость клеточных мембран.
Причем чувствительность увеличивается избирательно — опухолевые клетки начинают гибнуть при температуре 40 °C, а здоровые — сохраняются до 44°C. В условиях гипертермии особенности опухолевых тканей (иное кровоснабжение, степень оксигенации, особенности репарации ДНК) становятся для них не преимуществом, а слабым местом.
Кроме того, повышение температуры обычно вызывает иммунную реакцию: растет количество лимфоцитов — клеток иммунитета, способных уничтожать опухолевые клетки. В плазме крови увеличивается уровень интерлейкинов, интерферонов, факторов некроза опухоли и т. д. Все они имеют собственную противоопухолевую активность и дополнительно способны усиливать эффект некоторых химиопрепаратов.
Еще один важный плюс гипертермии — она способствует более активному проникновению препарата в ткани — на глубину до 3 мм — этого хватит, чтобы охватить большинство микро-метастазов, которые останутся после хирургической операции.
Внутри брюшины — химиотерапия работает лучше. Для HIPEC используются стандартные химиопрепараты, но их локальное применение при перитонеальном карциноматозе — куда эффективнее.
Во-первых, химиотерапия контактирует непосредственно с опухолевыми очагами. Локальное прямое воздействие — сильнее, чем через кровоток при внутривенной химиотерапии.
Во-вторых, через брюшину препараты практически не «просачиваются» в общий кровоток.
Это позволяет использовать при HIPEC концентрации химиопрепаратов в 20, 50, а иногда и в 100 раз больше, чем при системной химиотерапии — раковые клетки внутри брюшной полости получают смертельные дозы, а весь организм практически не страдает от побочных эффектов.
Как все происходит
Процедура HIPEC — это, строго говоря, вторая половина целого комплекса мероприятий. Без циторедуктивной хирургической операции HIPEC может проводиться в считанном количестве случаев по особым показаниям. Обычно, процедура — продолжение хирургической операции, которое дает серьезное улучшение прогноза выживаемости.
Вместе с удалением опухолевых очагов, все вмешательство занимает от 6 до 18 часов. Процесс можно разделить на 4 этапа.
1) Ревизия брюшной полости. Проводится она для того, чтобы понять, показано ли лечение с помощью HIPEC для этого пациента, принесет ли оно увеличение продолжительности жизни и улучшение ее качества. Во время ревизии хирург внимательно осматривает брюшную полость и определяет перитонеальный индекс рака (peritoneal cancer index — PCI).
Чтобы его рассчитать, брюшную полость и тонкую кишку условно делят на 13 областей-квадрантов, в каждом из них оценивают самый крупный опухолевый очаг по шкале от 0 до 3:
- очагов не обнаружено — 0 баллов;
- очаги размером менее 0,5 см — 1 балл;
- очаги размером менее 0,5–5 см — 2 балла;
- очаг более 5 см или несколько узлов меньшего размера- 3 балла.
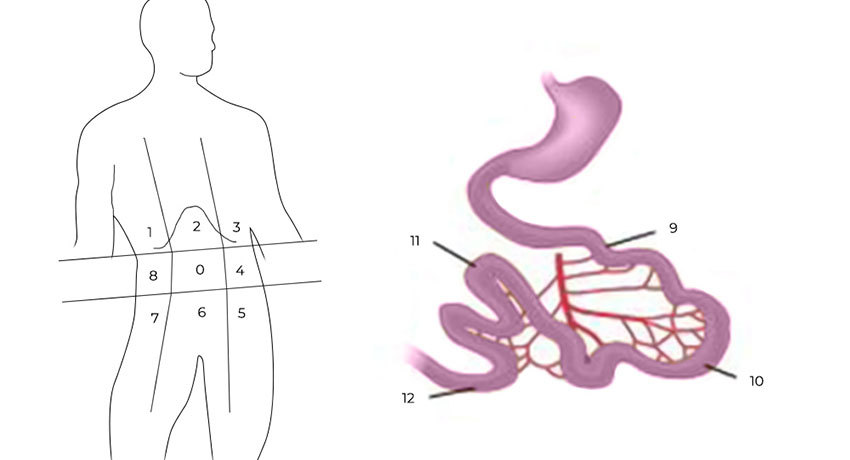 Разделение брюшной полости на участки для определения PCI
Разделение брюшной полости на участки для определения PCI
Баллы суммируются по всем квадрантам — это и есть значение PCI. Чем больше баллов — тем хуже прогноз. Если PCI выше критического (принимая во внимание тип опухоли и состояние пациента) — то и операцию, и процедуру HIPEC могут признать нецелесообразными.
Проводят ревизию интраоперационно, т. е. непосредственно перед проведением основной операции. В некоторых случаях ее можно провести в виде отдельной диагностической лапароскопической операции — малотравматичной, через небольшие проколы в стенке живота.
2) Циторедуктивная операция. Если по результатам ревизии PCI оценен как удовлетворительный, то хирург приступает к удалению всех видимых и пальпируемых (те, что чувствуются наощупь) опухолевых узлов.
Удаляют отдельные участки брюшины, орган, в котором находится первичная опухоль, соседние внутренние органы или их части, если они тоже поражены метастазами. Часто это участки кишечника, селезенка, желчный пузырь.
У нас в «Медицине 24/7» хирурги могут провести у стола на этом этапе и 6, и 9 часов, потому что понимают — от того, как тщательно они выполнят свою работу, зависит то, как эффективно будет и дальнейшая процедура HIPEC. А значит и то, насколько дольше проживет пациент.
3) Гипертермическая интраперитонеальная химиотерапия. Собственно, HIPEC. В брюшную полость вводят катетеры и температурные датчики, соединенные со специальным аппаратом и емкостью с раствором химиопрепарата. Эта перфузионная система (под контролем врачей, конечно) поддерживает заданную температуру и давление циркулирующей жидкости. Раствор химиопрепарата в течение 60–90 минут циркулирует в брюшной полости пациента.
За это время он и чисто механически «вымывает» все сгустки крови и лимфы, на которых опухолевые клетки могли закрепиться. Горячий химиотерапевтический препарат глубоко действует на ткани, где могли остаться невидимые для хирурга микро-метастазы и уничтожает эти зарождающиеся опухоли до того, как они успеют развиться. Кроме того, химиопрепарат активно проникает в лимфоузлы, которых множество в брюшной полости, что препятствует дальнейшему распространению метастазов по организму.
После процедуры препарат удаляют из брюшной полости, промывают ее физраствором, удаляют датчики и катетеры.
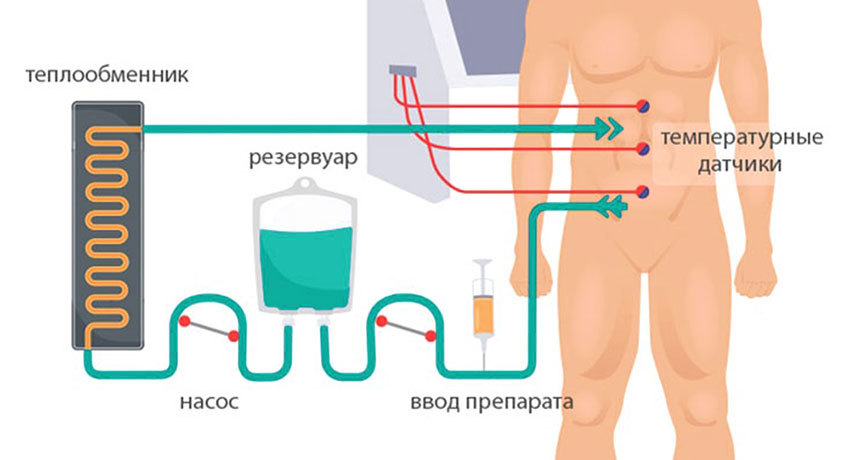 Схема проведения HIPEC
Схема проведения HIPEC
4) Реконструктивная операция. Если удалены части кишечника, хирург восстанавливает непрерывность кишки — формирует анастомоз, выводит верхний конец толстой/тонкой/слепой кишки на поверхность живота для отхождения каловых масс.
В среднем, в клинике пациент проводит 2–4 недели. Через 2–3 недели после операции проводится контрольное обследование. Его необходимо повторять через 3 месяца, и постепенно частоту проверок снижают до 1 раза в год.
В этом видео наши коллеги проводят процедуру HIPEC пациентке с раком яичников.
Узнайте больше о процедуре HIPEC
Оставьте свой номер телефона
Как любое лечение, HIPEC имеет риски и противопоказания
Послеоперационный период стоит отдельным этапом, но он не менее важен. Мы всегда понимаем, насколько сложным для наших пациентов (а многие попадают к нам в крайне тяжелом состоянии) может быть период восстановления после такого длительного и достаточно агрессивного вмешательства, как циторедуктивная операция + HIPEC. Поэтому сразу после операции мы переводим пациента в отделение интенсивной терапии, под круглосуточное наблюдение.
Осложнения могут быть те же, что и после любого хирургического вмешательства на брюшной полости, поэтому за пациентом внимательно следят на случай появления признаков кровотечения или воспаления послеоперационной раны — и готовы в любую минуту оказать помощь.
Побочные действия от химиотерапевтического препарата при внутрибрюшной гипертермической химиотерапии даже менее выражены, чем при внутривенном введении — при том, что дозировки, а значит, и противоопухолевое действие, при HIPEC в десятки раз выше.
К сожалению, при всем нашем желании и мастерстве наших хирургов, есть пациенты, для которых полезный эффект вмешательства не оправдает сложностей послеоперационного восстановления.
Чтобы циторедуктивная операция с последующей процедурой HIPEC была эффективной, нужно соблюдение нескольких условий:
- Пациент должен быть в состоянии перенести и хирургическую операцию, и химиотерапию одновременно. Возраст или показатели здоровья не должны этому препятствовать — например, не должно быть почечной или печеночной недостаточности. Перед процедурой мы обязательно всесторонне обследуем пациента.
- Процесс распространения метастазов должен быть ограничен только брюшной полостью. Если есть метастазы в других органах, которые нельзя удалить — они будут распространяться дальше, и сведут эффект HIPEC на нет.
- Метастазы размером более 2,5 мм не должны покрывать всю поверхность брюшины — удалить их все будет невозможно.
Однако, плюсов у HIPEC все же значительно больше, чем ограничений
Большому числу людей нам удается помочь. Одна из таких пациенток попала к нам после лечения в нескольких клиниках — в том числе в Израиле и Сингапуре. Причем, долгое время врачи не находили первичной опухоли, причины прогрессирующего канцероматоза. Оказалось, что еще в 2012 г. ее оперировали по поводу «аппендицита», и не сообщили ей, что в аппендиксе была редкая опухоль — псевдомиксома, За последние 5 лет пациентке сделали 13 операций — их проводили по 2–4 раза в год! Но ни в одном из лечебных учреждений ей не предложили проведение HIPEC, хотя в ее случае это было идеальным решением. Об этой методике пациентка даже не слышала после стольких лет лечения.
Мы провели ей циторедуктивную операцию и процедуру HIPEC, и после этого она уже 10 месяцев живет без прогрессирования заболевания.
В некоторых случаях HIPEC приводит к устойчивому излечению. Например, коллеги из США сообщали о женщине с мезотелиомой брюшины. С помощью HIPEC она преодолела болезнь, уже 3 года живет без признаков рака и смогла родить ?