Сигнальный лимфоузел при раке молочной железы
Больным раком молочной железы cT1-4N0M0 необходимо выполнение биопсии сигнального лимфатического узла. Биопсия сигнального лимфатического узла с использованием флуоресцентной лимфографии является современной технологией, имеющей очень высокую частоту нахождения сигнального лимфатического узла. Однако, частота ложноотрицательных ответов при использовании этой технологии адекватно не оценена, что и явилось целью нашего исследования. Было оперировано 99 больных со 100 случаями рака молочной железы cT1-4N0M0. Подмышечный этап операции состоял из биопсии сигнального лимфатического узла с использованием флуоресцентной лимфографии и лимфаденэктомии I–II или I—II—III уровней. Сигнальный лимфатический узел был найден в 98 случаях (98%). В 28 случаях из 98 (28,6%) были обнаружены метастазы в лимфатических узлах. У больных с N+ метастатическое поражение других лимфатических узлов кроме сигнальных присутствовало только в 35,7%. Ложноотрицательный результат наблюдался в 1 случае из 28 (3,6%). Применение флуоресцентной лимфографии с индоцианином зелёным позволяет производить биопсию сигнального лимфатического узла с высокой частотой обнаружения лимфатического узла и низкой частотой ложноотрицательных результатов.
Введение
Биопсия сигнального лимфатического узла (СЛУ) при раке молочной железы (РМЖ) с cN0 является стандартной операцией в странах с развитой медициной и интенсивно осваиваемой онкологами Российской Федерации. Безопасность биопсии СЛУ была доказана в рандомизированных исследованиях, ставших фундаментальными для этого раздела онкомаммологии [7, 20, 21, 25, 15], а также в метаанализе рандомизированных исследований [18]. Ограничение объёма вмешательства на подмышечных лимфатических узлах биопсией СЛУ узла привело к резкому снижению частоты осложнений, связанных с подмышечной лимфаденэктомией и, прежде всего, частоты лимфостаза верхней конечности [22].
К новым технологиям поиска СЛУ относится технология флуоресцентной лимфографии с использованием зелёного индоцианина. Зелёный индоцианин обладает способностью к флуоресценции. Пик поглощаемого излучения имеет длину волны около 780 нм, испускаемое излучение (в инфракрасном спектре) имеет длину волны около 830 нм. Флуоресценция проникает через ткани толщиной не более 10 мм. Флуоресцентная лимфография не уступает радионуклидной технологии по частоте нахождения СЛУ (94-100%), однако адекватность первой почти не оценена по показателю частоты ложноотрицательных заключений [5,12,14,23,24].
Целью нашей работы было изучение возможности биопсии СЛУ методом флуоресцентной лимфографии с оценкой основных диагностических характеристик метода: частоты нахождения СЛУ и частоты ложноотрицательных ответов.
Материалы и методы
Было оперировано 99 больных со 100 случаями рака молочной железы cT1-4N0M0 (T1 — 43, T2 — 55, T3 — 1, T4 — 1). Во всех случаях диагноз инфильтративного рака был подтверждён гистологически. 12 больных получали предоперационную химиотерапию, 8 — предоперационную гормонотерапию. Подмышечный этап операции состоял из биопсии СЛУ с использованием флуоресцентной лимфографии и лимфаденэктомии I–II или I—II—III уровней.
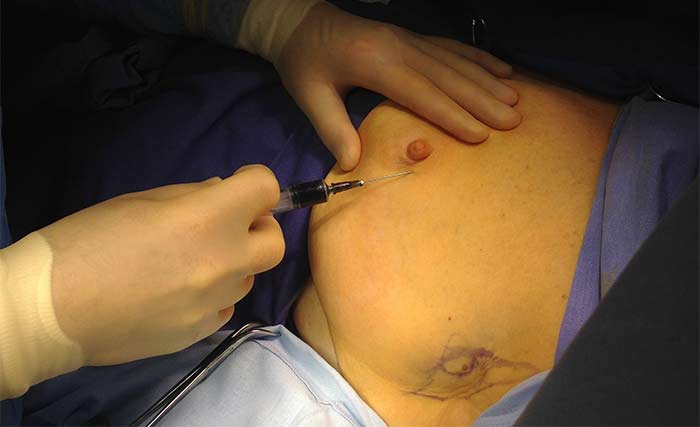
Прибор Photodynamic Eye C9830 (Hamamatsu Photonics K.K) использовался для генерации возбуждающего инфракрасного излучения и регистрации ответной флуоресценции. Флуоресцентное изображение передавалось на экран компьютера. Биопсия СЛУ производилась под наркозом как первый этап операции. Зелёный индоцианин в виде водного раствора (5 мг/мл) в объёме 2 мл вводился внутрикожно и подкожно по наружному краю ареолы молочной железы или над опухолью (рисунок 1).

Рисунок 1. Ведение индоцианина зелёного (0 мин.)
Через 2-5 минут можно было видеть флуоресцентное изображение лимфатического пути, идущего к подмышечной области (рисунок 2). Изображение на экране компьютера было видно в режиме реального времени, что позволяло зарисовывать на коже пациентки изображение лимфатического протока. Изображение лимфатического узла через не рассечённые ткани удавалось увидеть менее, чем в 10%.
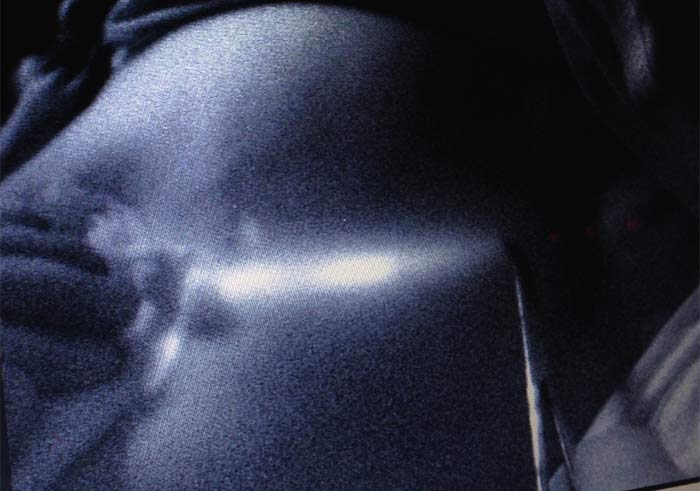
Рисунок 2. Получение изображения доминирующего пути лимфооттока (3 мин.)
Место «обрыва» лимфатического протока, видимого сквозь кожу, являлось ориентиром для поиска сигнального лимфатического узла в глубине тканей подмышечной области. Для этого было необходимо рассечение, как минимум, кожи, подкожной клетчатки и поверхностной фасции (рисунок 3). Технической ошибкой, допущенной дважды, являлась попытка проследить ход флуоресцирующего лимфатического протока в ране. Повреждение протока приводило к излиянию зелёного индоцианина из протока в рану и беспорядочному прокрашиванию тканей. Флуоресцирующий участок тканей в таких случаях был ошибочно принят за СЛУ, и при гистологическом исследовании в этих 2 случаях лимфатический узел не был обнаружен. Для исключения подобной ошибки, нужно было представить локализацию лимфатического узла, в который впадает лимфатический проток, и оперативный доступ к этому СЛУ осуществлять со стороны противоположной впадению лимфатического протока в СЛУ.
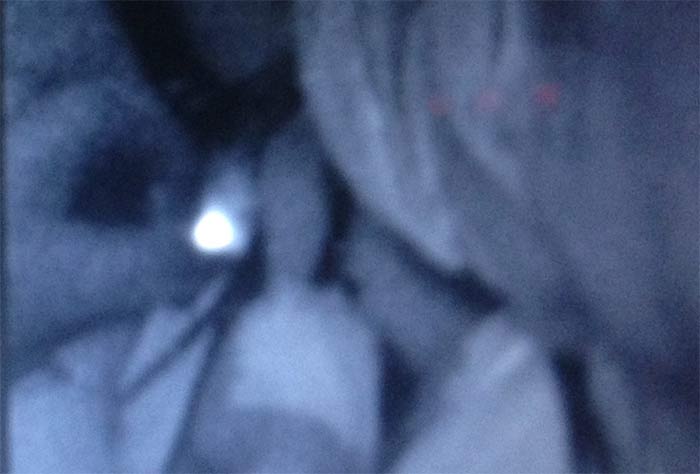
Рисунок 3. Флуоресцирующий узел в ране (6 мин.)
После удаления СЛУ контролировалась его флуоресценция (рисунок 4), в ране контролировалось наличие или отсутствие дополнительных лимфатических узлов как с помощью поиска флуоресценции, так и пальпаторно. И флуоресцирующие и пальпируемые лимфатические узлы расценивались как сигнальные и отправлялись на срочное гистологическое исследование по замороженным срезам с окраской гематоксилином и эозином. На собственно биопсию СЛУ уходило 15-30 минут и ещё такое же время на гистологическое исследование.
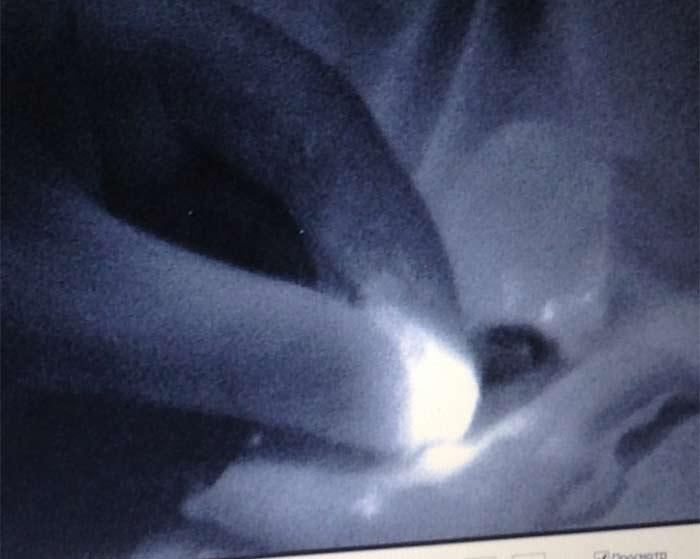
Рисунок 4. Флуоресцирующий узел на препарате (14 мин.)
Результаты
Флуоресцирующий через кожу лимфатический проток был виден во всех 100 случаях, а флуоресцирующий лимфатический узел, — менее, чем в 10%. Обычно последний становился виден в ране после рассечения кожи, подкожной клетчатки, поверхностной и собственной фасций. СЛУ был найден в 98 случаях (98 %). Среднее количество лимфатических узлов, удалённых как сигнальные, = 1,9±0,1 (1-7 узлов). Среднее количество лимфатических узлов, удалённых при лимфаденэктомии, = 10,5±0,5 (5-26 узлов). В 28 случаях из 98 (28,6%) были обнаружены метастазы в лимфатических узлах. У больных с N+ метастатическое поражение других лимфатических узлов кроме сигнальных присутствовало только в 35,7%. По данным интраоперационного гистологического исследования ложноотрицательный результат наблюдался в 3 случаях из 28, по данным планового гистологического исследования — в 1 случае из 28 (3,6%). Чувствительность составила 96,4%, специфичность — 100%, точность — 99,0% (97 правильных заключений из 98). Не наблюдалось аллергических реакций или других побочных эффектов и осложнений при введении индоцианина зелёного.
Обсуждение
Gould E.A. et al. были первыми, кто обосновал и применил на практике хирургическую тактику биопсии СЛУ. У больных раком околоушной слюнной железы лимфатический узел, находящийся в месте слияния передней и задней лицевых вен, по наблюдению авторов являлся сигнальным. Приводятся сведения о 9 больных, оперированных в 1951-1957 гг. СЛУ удалялся и исследовался интраоперационно гистологически. При нахождении в нём метастаза, производилась радикальная шейная диссекция, если СЛУ не был поражён, диссекция не выполнялась. Четверо больных, которым радикальная шейная диссекция не выполнялась, были прослежены от 2 до 8 лет без признаков рецидива [11]. Нахождение и морфологическая оценка состояния СЛУ, — лимфатического узла, первым воспринимающим лимфу от поражённого злокачественной опухолью органа, позволяют оценить вероятность метастатического поражения других лимфатических узлов. В случае отсутствия такого поражения, — с высокой степенью достоверности предвидеть отсутствие метастазов в последующих лимфатических узлах и отказаться от их удаления без ущерба для эффективности противоопухолевого лечения. Такова концепция биопсии СЛУ, изложенная R. Cabanas в 1977 г. Для поиска СЛУ у больных раком полового члена автор применял рентгеновскую лимфографию с использованием контраста, вводимого в лимфатический сосуд полового члена [6].
Применительно к раку молочной железы речь идёт о сохранении подмышечных лимфатических узлов и предотвращении осложнений, связанных с подмышечной лимфаденэктомией: лимфатическим отёком верхней конечности, лимфатическим отёком молочной железы (при органосохраняющих операциях), нарушением кожной чувствительности на плече и в подмышечной области. Первоначально биопсия СЛУ применялась у больных РМЖ сT1-2N0M0, в настоящее время показания к её использованию ставятся значительно шире: она применима в тех случаях, когда по данным клинического обследования (пальпация, УЗИ ± тонкоигольная биопсия) отсутствуют признаки метастатического поражения подмышечных лимфатических узлов исходно, то есть, cN0 (не ограничиваясь T1-2); либо после эффективной предоперационной системной терапии cN1-3→ «N0» [8,9], а также при выполнении мастэктомии по поводу протокового рака in situ [4].
Общепринятая в настоящее время технология поиска СЛУ основана на радионуклидной маркировке лимфатических узлов с использованием радиофармпрепаратов, включающих 99mTc. Средний размер частиц радиофармпрепарата может колебаться от 3 до 400 nm [10], однако использование частиц размером менее 100 нм позволяет более успешно находить СЛУ [2, 3]. Большинство методических вопросов отработано при исследованиях с использованием радионуклидной методики. Показано, что место введения лимфотропного препарата: перитуморальное, подкожное над опухолью, периареолярное, внутрикожное в ареолу, субареолярное не имеют значения, любой из них позволяет осуществить успешный поиск СЛУ. Мультицентричность опухоли, предшествующая эксцизионная биопсия опухоли не мешают выполнению биопсии СЛУ [10]. Адекватность технологии поиска подтверждается высокой частотой обнаружения СЛУ (>90%) и низкой частотой ложноотрицательных заключений (<10%). Частота ложноотрицательных заключений является главной характеристикой метода, она демонстрирует, с какой частотой метастатически поражённые лимфатические узлы остаются не удалёнными у пациентов, которым выполняется только биопсия СЛУ. Первое исследование диагностических возможностей поиска СЛУ в России с использованием радиофармпрепарата и красителя было успешным, частота обнаружения СЛУ составила 91,4%, ложноотрицательные ответы получены в 6,4% [1].
Из новых технологий поиска СЛУ можно отметить появление радиофармпрепарата, содержащего молекулу таргетного действия по отношению к Т-лимфоцитам и дендритным клеткам в лимфатических узлах [99mTc-tilmanocept (Lymphoseek®)]. Такой механизм действия и малый размер частиц (7 нм) позволяет радиофармпрепарату быстро попадать в СЛУ и надолго там задерживаться [19]. Технология с использованием наночастиц супер парамагнитного оксида железа оказалась не хуже по диагностическим возможностям, чем сочетание радиофармпрепарата с красителем [13].
Флуоресцентная лимфография также является относительно новой технологией. Первая публикация по применению индоцианина зелёного для поиска СЛУ без использования эффекта флуоресценции относится к 1999 г. [16]. Успешное обнаружение СЛУ было получено только в 74% из 172 больных РМЖ. Первое использование зелёного индоцианина, основанное на флуоресцентной навигации, также было сделано японскими авторами: Kitai T., Inomoto T., Miwa M., Shikayama T. в 2005 г. СЛУ был обнаружен в 94% [14]. По мнению Ballardini B. et al флуоресцентный метод с индоцианином позволяет находить сигнальный лимфатический узел в 99,6%. Флуоресцентная лимфография с индоцианином зелёным позволяет легко идентифицировать СЛУ с частотой не ниже, чем при использовании радиоактивных препаратов и может использоваться как самостоятельный метод [5]. Флуоресцентная лимфография не уступает радионуклидной технологии по частоте нахождения СЛУ (94-100%) или превосходит её [5,12,14,23,24], однако характеристика флуоресцентной технологии не полна из-за недостатка сведений по показателю частоты ложноотрицательных заключений. Только в одной работе на небольшом количестве больных (серии по 21 и 13 пациенток) показано, что частота ложноотрицательных ответов составила 10% и 8% [17].
Таблица 1: частота ложноотрицательных результатов при биопсии СЛУ
| Источник n | в группах с лимфаден- эктомией | Лимфотропный препарат | Частота нахождения СЛУ в % | Частота ложно- отрицательных результатов в % |
| 1. Canavese G., et al. [7] | 115 | 99mTc + blue dye | 99,1 | 22,9 (8/35) |
| 2. Veronesi U., et al. [20] | 257 | 99mTc | 98,8 | 8,8 (8/91) |
| 3. Zavagno G., et al. [25] | 323 | 99mTc | 94,9 | 16,7 (18/108) |
| 4. Krag D.N., et al. [15] | 2807 | 99mTc + Isosulfan blue | 97,3 | 9,8 (75/766) |
| В объединённой группе 1-4. | 3502 | 99mTc +- | 94,9- 99,1 | 10,9 (109/1000) |
| Наши данные | 100 | Индоцианин зелёный | 98% | 3,6 (1/28) |
В таблице 1 приводятся сведения о частоте ложноотрицательных ответов при биопсии СЛУ в фундаментальных исследованиях по этой проблеме. Усреднённая частота этого показателя составила 10,9%. В нашем исследовании, несмотря на технические неудачи, связанные с освоением метода (2 случая не нахождения СЛУ из 100 были связаны с пересечением лимфатического протока и выходом индоцианина в ткани), частота нахождения СЛУ у больных с cN0 и частота ложноотрицательных ответов оказались на высоком уровне, — 98% и 3,6% соответственно.
Заключение
Флуоресцентный метод поиска СЛУ при РМЖ имеет свои технологические особенности: в большинстве случаев СЛУ не визуализируется через кожу, его нужно искать в ране, ориентируясь на ход лимфатического протока. Выполнение метода поиска от введения препарата до получения СЛУ занимает 15-30 минут. У больных с cN0 метод по своим диагностическим характеристикам идеален, может применяться в самостоятельном варианте. Очевидным преимуществом флуоресцентного метода является отсутствие лучевой нагрузки на пациента и персонал.
Благодарность
Авторы благодарят профессоров G.C. Wishart и J.R. Benson за обучение технологии биопсии СЛУ с использованием флуоресцентной лимфографии.
Cписок авторов
С.М. Портной, А.В. Кузнецов, Н.М. Шакирова, Н.А. Козлов, А.В. Масляев, А.В. Карпов, Е.Б. Кампова-Полевая, М.Г. Мистакопуло, Ю.С. Егоров, О.А. Анурова, Т.А. Шендрикова, А.С.Горностаева, Д.В. Хайленко.
Источники литературы
- Вельшер Л.З., Решетов Д.Н., Габуния З.Р., и др. Сторожевые лимфатические узлы при раке молочной железы. //Маммология. 2007.- № 1, c.23-25.
- Петровский А.В., Афанасьева К.В., Гончаров М.О. и др. Использование различных радиофармпрепаратов при биопсии сторожевых лимфатических узлов у больных раком молочной железы. //Радиационная онкология и ядерная медицина. 2013.- № 1.- c.85-89.
- Криворотько П.В., Канаев С.В., Семиглазов В.Ф. и др. Методологические проблемы биопсии сигнальных лимфатических узлов у больных раком молочной железы. //Вопросы онкологии. 2015.- 61.- 3.- c.418-423.
- Ansari B, Ogston SA, Purdie CA, et al. Meta-analysis of sentinel node biopsy in ductal carcinoma in situ of the breast. //Br. J. Surg. 2008.-95.-547-554.
- Ballardini B, Santoro L, Sangalli C, et al. The indocyanine green method is equivalent to the ⁹⁹mTc-labeled radiotracer method for identifying the sentinel node in breast cancer: a concordance and validation study. //Eur. J. Surg. Oncol. 2013.-39.-1332-1336.
- Cabanas R. An approach for the treatment of penile carcinoma. //Cancer. 1977.-39.-456-466.
- Canavese G, Catturich A, Vecchio C, et al. Sentinel node biopsy compared with complete axillary dissection for staging early breast cancer with clinically negative lymph nodes: results of randomized trial. //Ann. Oncol. 2009.-20.-1001—1007.
- Coates AS, Winer EP, Goldhirsch A, et al. Tailoring therapies—improving the management of early breast cancer: St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2015. //Ann Oncol. 2015.-26.-1533—1546.
- Curigliano G, Burstein HJ, Winer EP, et al. De-escalating and escalating treatments for early-stage breast cancer: the St. Gallen International Expert Consensus Conference on the Primary Therapy of Early Breast Cancer 2017. // Ann Oncol. 2017.-28.-1700—1712.
- Giammarile F, Alazraki N, Aarsvold JN, et al. The EANM and SNMMI practice guideline for lymphoscintigraphy and sentinel node localization in breast cancer. // Eur J Nucl Med Mol Imaging. 2013.-40.-1932—1947.
- Gould EA, Winship T, Philbin PH, Kerr HH. Observations on a «sentinel node» in cancer of the parotid. Cancer. 1960.-13.-77-78.
- Hojo T, Nagao T, Kikuyama M, et al., Evaluation of sentinel node biopsy by combined fluorescent and dye method and lymph flow for breast cancer. // Breast. 2010.-19.-210-213.
- Karakatsanis A, Christiansen PM, Fischer L, et al. The Nordic SentiMag trial: a comparison of super paramagnetic iron oxi de (SPIO) nanoparticles versus Tc(99) and patent blue in the detection of sentinel node (SN) in patients with breast cancer and a meta-analysis of earlier studies. //Breast Cancer Res Treat. 2016.-157.-:281-294.
- Kitai T, Inomoto T, Miwa M, Shikayama T. Fluorescence navigation with indocyanine green for detecting sentinel lymph nodes in breast cancer. //Breast Cancer. 2005.-12.-211—215.
- Krag DN, Anderson SJ, Julian TB, et al. Sentinel-lymph-node resection compared with conventional axillary-lymph-node dissection in clinically node-negative patients with breast cancer: overall survival findings from the NSABP B-32 randomised phase 3 trial. //Lancet Oncol. 2010.-11.-927—933.
- Motomura K, Inaji H, Komoike Y, et al. Sentinel node biopsy guided by indocyanine green dye in breast cancer patients. // Jpn J Clin Oncol. 1999.-29.-604—607.
- Murawa D, Hirche C, Dresel S, Hünerbein M. Sentinel lymph node biopsy in breast cancer guided by indocyanine green fluorescence. //Br J Surg. 2009.-96.-1289-1294.
- Petrelli F, Lonati V, Barni S. Axillary dissection compared to sentinel node biopsy for the treatment of pathologically node-negative breast cancer: a meta-analysis of four randomized trials with long-term follow up. //Oncol Rev. 2012.-6.-e20.
- Vera DR, Wallace AM, Hoh CK. A synthetic macromolecule for sentinel node detection: (99m)Tc-DTPA-mannosyl-dextran. //J Nucl Med. 2001.-42.-951—959.
- Veronesi U, Paganelli G, Viale G, et al. A Randomized Comparison of Sentinel-Node Biopsy with Routine Axillary Dissection in Breast Cancer. //N Engl J Med. 2003.-349.-546-553.
- Veronesi U, Viale G, Paganelli G, et al. Sentinel lymph node biopsy in breast cancer: ten year results of a randomized controlled study. //Ann Surg. 2010.-251.-595—600.
- Wang Z, Wu LC, Chen JQ. Sentinel lymph node biopsy compared with axillary lymph node dissection in early breast cancer: a meta-analysis. //Breast Cancer Res Treat. 2011.-129.-675—689.
- Wishart GC, Loh SW, Jones L, Benson JR. A feasibility study (ICG-10) of indocyanine green (ICG) fluorescence mapping for sentinel lymph node detection in early breast cancer. //Eur J Surg Oncol. 2012.-38.-651-656.
- Xiong L, Gazyakan E, Yang W, et al. Indocyanine green fluorescence-guided sentinel node biopsy: a meta-analysis on detection rate and diagnostic performance. // Eur J Surg Oncol. 2014.-40:843-849.
- Zavagno G, De Salvo GL, Scalco G, et al. A randomized clinical trial on sentinel lymph node biopsy versus axillary lymph node dissection in breast cancer: results of the Sentinella/GIVOM trial. //Ann Surg. 2008.-247.-207-213.
Источник

Лимфоузлы при раке молочной железы — сторожевые иммунной системы и зона развития первых метастазов, поскольку получают из ткани и кожи молочной железы лимфу с циркулирующими клетками рака. Опухолевое поражение лимфатического коллектора сигнализирует о распространенности рака в организме. Степень вовлеченности лимфатической системы молочной железы определяет выбор лечебной тактики и в конечном счёте — прогноз на излечение.
Роль лимфоузлов при раке молочной железы
Лимфатический узел (ЛУ) — своеобразный фильтр с большим числом разнообразных лимфоцитов и других иммунных клеток, в который лимфатическая жидкость из органов приносит всё лишнее и вредное. ЛУ образуют группы от нескольких узелков до многих десятков, к каждой группе притекает лимфатическая жидкость от определенной анатомической области.
От молочной железы к лимфатическим узлам подмышечной области и далее к подключичным и надключичным ведет несколько лимфососудистых путей:
- Первый и самый объемный, вбирающий почти 95% всей отработанной лимфы от молочной железы — подмышечный путь, сюда также притекает жидкость от руки, половины грудной стенки и верней части живота. При блокаде клетками рака подмышечных ЛУ жидкость устремляется к лимфоколлекторам брюшной полости, которые связаны сетью капилляров с лимфоидными образованиями в средостении и связке печени, занося в них метастатические эмболы.
- От верхних и задних квадрантов молочной железы лимфа сразу или окольным путем через мелкие узелочки между грудными мышцами попадает в подключичный коллектор, а оттуда утекает в надключичные лимфоузлы, чтобы в дальнейшем влиться в грудной проток.
- Парастернальный путь собирает жидкость от внутренних отделов молочной железы и несет её к узелкам в межреберных промежутках и дальше в подключичные и надключичные зоны. Путь анастомозирует с межреберными лимфососудами, которые связаны с лимфатической сетью грудных позвонков, что и объясняет развитие метастазов в позвоночнике.
- В лимфатическую систему средостения уносится лимфа от центра и срединных долек молочной железы, обуславливая образование метастазов в легких.
- В коже молочной железы образованы две взаимосвязанные лимфатические сетки, направляющие жидкость в сосуды грудной клетки и противоположной молочной железы, помогая распространению метастазов в коже грудной стенки.
Как узнать, что подмышечные лимфоузлы подверглись поражению?
Размеры нормального и здорового лимфатического узелка — от нескольких миллиметров до двух сантиметров, он мягкий и безболезненный, при прощупывании легко смещается в сторону. Увеличение ЛУ — симптом неадекватности защитных возможностей лимфоидного органа оздоровительным потребностям организма, когда иммунный фильтр не справляется с возложенной на него функцией и внутри образуются зоны скопления раковых комплексов, впоследствии остающихся на ПМЖ.
Массивное поражение метастазами легко определяется на ощупь — ЛУ большие и плотные, но безболезненные пока не вросли в сосудисто-нервный пучок. При маммографии и УЗИ молочной железы определяется опухолевый лимфатический узел, правда без взятия клеточного материала для микроскопии это только «подозрение на рак», которое необходимо доказать или отвергнуть.
Во время операции на молочной железе или перед началом предоперационной химиотерапии обязательно выполняется биопсия главного или сторожевого узла, куда направляется основная масса лимфатической жидкости. При наличии в сторожевом ЛУ клеток рака одним блоком удаляется вся подмышечная жировая клетчатка со всем находящимися в ней.
Как поражаются лимфоузлы при распространении в них опухолевого процесса?
Все удаленные лимфоузлы, сколько бы их не было в клетчатке, обязательно исследуются под микроскопом, при наличии клеток рака в них выполняются дополнительные исследования, в том числе ИГХ.
Распространение рака протекает, как предполагают, поэтапно: от нескольких клеток до массивных поражений, от подмышечных лимфоузлов в подключичные и далее в надключичные. Степени поражения также идут от минимальной до максимально 3-й:
- При морфологическом исследовании обнаруживают всё патологическое, даже клеточные скопления в долю миллиметра — микроинвазию. В гистологическом заключении будет указано рN1miс, то есть клеточный комплекс имеет размер от 0,2 мм до 2 миллиметров, а литера «р» — сокращение от патоморфология;
- Когда в лимфоузле нет опухоли — патоморфолог обозначит состояние как «рN0», если рядом стоит (I-), то значит выполнялась гистология и ИГХ, без иммуногистохимии — рN0 (I+);
- Следующий уровень распространения рака по лимфосистеме — градация рN1, свидетельствующая о метастатическом поражении размером больше 2 миллиметров, причём должно быть не более трёх ЛУ в подмышке;
- Вариант поражения рN2 обозначает группу от 4 до 9 метастатических ЛУ в подмышечной зоне или опухоль во внутригрудном лимфоузле;
- Завершающая градация рN3 предполагает вариации от десятка метастатических подмышечных, или поражение раком подключичных, или вовлечение надключичных ЛУ.
Лимфоузлы при онкоопухоли молочной железы согласно классификации TNM
В системе ТNМ литерой «Т» обозначается первичная раковая опухоль, регионарные лимфатические узлы — «N», соответственно метастазы — «М».
Образовавшиеся в регионарных ЛУ метастазы всегда только N, тогда как рак в подмышечной области противоположной железы — уже М, также как лимфоколлекторы шеи или в паху.
Клиническая классификация по степени поражения следующая:
- N0 — лимфоузлы здоровы;
- N1 — уже есть метастазы под мышкой, но без фиксации к окружающим тканям и с сохранением своей подвижности;
- N2 — констатирует врастание или плотные конгломераты в подмышечной зоне;
- N3 — опухоль вовлекла подключичные или надключичные, или внутригрудные.
Какие лимфоузлы при раке груди являются регионарными?
Собирающие непосредственно от молочной железы лимфатическую жидкость лимфоузлы считаются регионарными.
Первый лимфатический коллектор — подмышечная впадина, где на пяти уровнях от ближайшего к железе до самого высокого в верхушке располагается до 75 ЛУ, в среднем — около трёх десятков. Самый первый и крупный — узел Зоргиуса или сигнальный.
Подключичные ЛУ принимают лимфу от подмышечных.
Около грудины между ребрами находится цепочка парастернальных лимфатических узлов или внутригрудных.
Надключичные ЛУ не регионарные, не так давно метастазы в них обозначали, как отдаленные, и процесс считался неоперабельным. Сегодня предоперационная химиотерапия позволяет изменить ситуацию и выполнить радикальную операцию даже в такой ситуации.
Прекрасное оборудование нашей клиники и специально подобранный по квалификационным и личностным характеристикам медицинский персонал выявит даже крошечный злокачественный очаг и поможет справиться с массивным.
Список литературы:
- WHO classification of tumours of the breast/ Lakhani, Sunil R; International Agency for Research on Cancer; World Health Organization// Lyon: Intern Agency for Research on Cancer; 2012.
- Glechner A., Wöckel A., Gartlehner G., et al. /Sentinel lymph node dissection only versus complete axillary lymph node dissection in early invasive breast cancer: a systematic review and meta-analysis//Eur. J Cancer; 2013 Mar; 49.
- Litière S., Werutsky G., Fentiman I.S., et al./ Breast conserving therapy versus mastectomy for stage I-II breast cancer: 20 year follow-up of the EORTC 10801 phase 3 randomised trial// Lancet Oncol; 2012 Apr; 13(4).
- Fisher B., Anderson S., Bryant J./ Twenty-year follow-up of randomized trial comparing total mastectomy, lumpectomy and lumpectomy plus irradiaton for the treatment of invasive breast cancer// N. Engl. j Med; 2002; 347.
Источник