Регионарные лимфоузлы толстого кишечника
Лимфатическая система толстой кишки представлена внутриорганными лимфатическими сетями, состоящими из капилляров и лимфатических сосудов, располагающихся в подслизистом, мышечном и брюшинном слоях кишки. Эти сети непрерывно переходят одна в другую как по толщине стенки кишки, так и по ее длиннику. В стенке кишки, особенно в червеобразном отростке, располагается скопление лимфатических фолликулов.
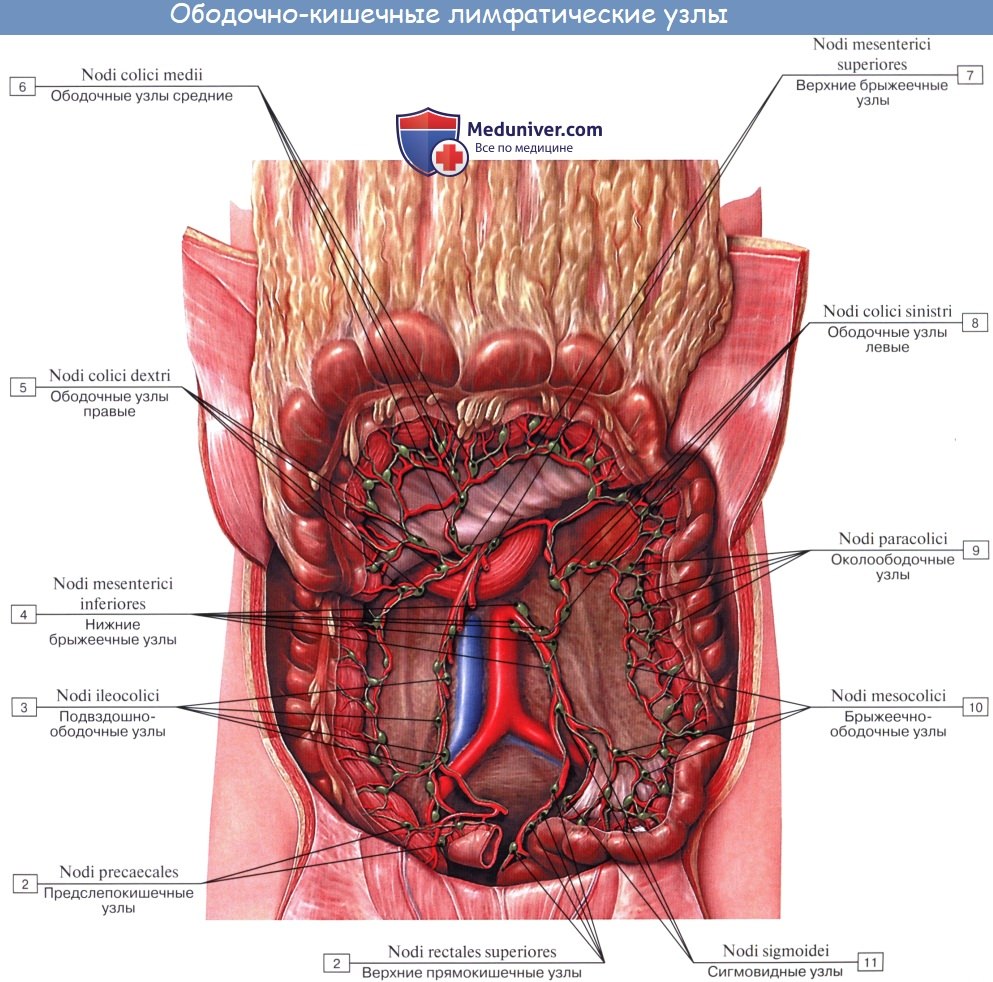
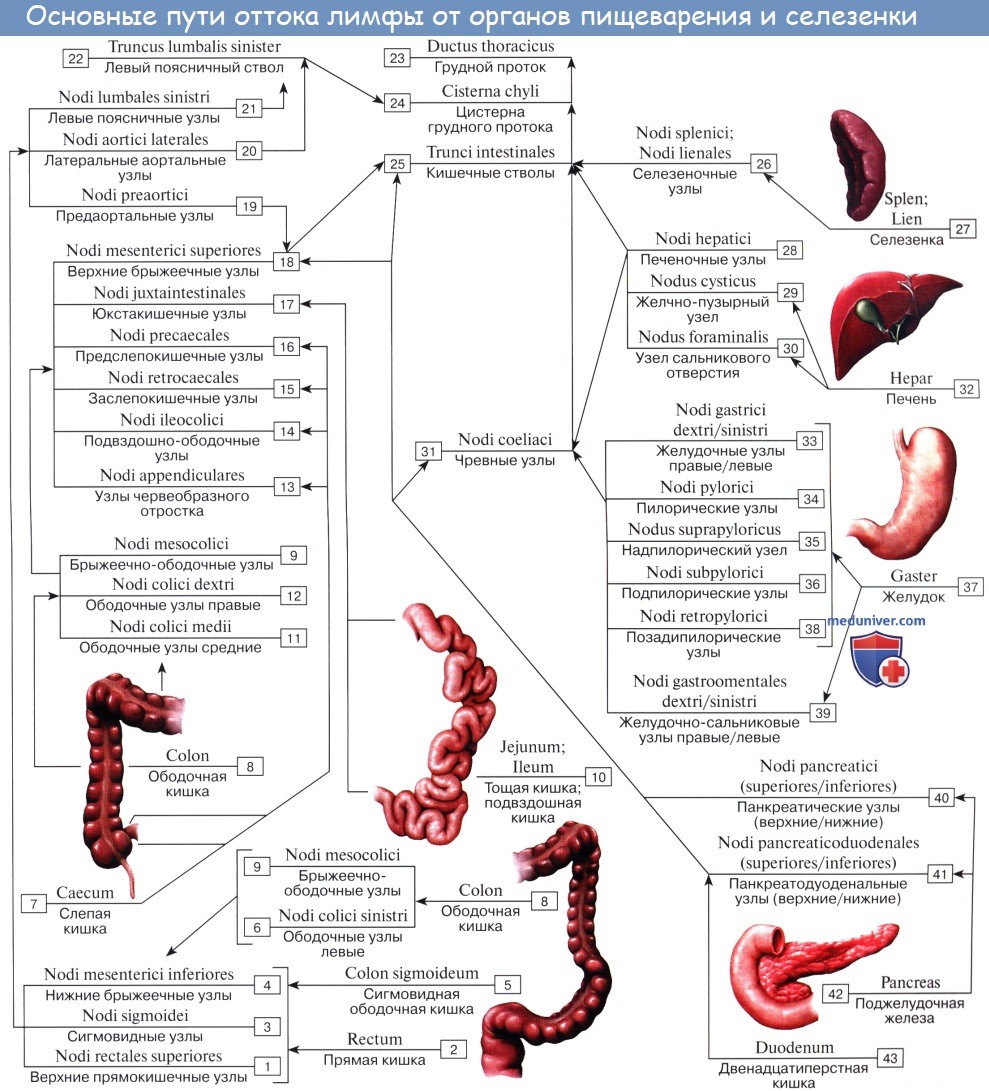
Предслепокишечные лимфатические узлы(n.l. prececales) располагаются забрюшинно по ходу слепокишечной артерии. Принимают лимфу от червеобразного отростка и слепой кишки. Выносящие сосуды впадают в подвздошно-ободочные лимфатические узлы.
Заслепокишечные лимфатические узлы(n.l. retrocecales) располагаются забрюшинно, позади слепой кишки по ходу задней слепокишечной артерии. В них поступает лимфа из червеобразного отростка и слепой кишки. От этой группы узлов лимфа идет в подвздошно-ободочные лимфатические узлы.
Правые ободочные лимфатические узлы(n.l. colici dextri) располагаются в брыжейке ободочной кишки, сопровождая правую ободочную артерию. К ним оттекает лимфа от восходящей ободочной кишки. Выносящие лимфатические сосуды впадают в верхние брыжеечные узлы.
Средние ободочные лимфатические узлы(n.l. colici medii) располагаются в брыжейке поперечной ободочной кишки, сопровождая ветви средней ободочной артерии. В них направляется лимфа от поперечной ободочной кишки и большого сальника. Отводящие сосуды впадают в верхние брыжеечные и поясничные лимфатические узлы.
Левые ободочные лимфатические узлы(n.l. colici sinistri) сопровождают левую ободочную артерию в брыжейке левой ободочной кишки. Получают лимфу от левой половины толстой кишки. Отток лимфы от них осуществляется в нижние брыжеечные и поясничные лимфоузлы.
Сигмовидные лимфатические узлы(n.l. sigmoidei) залегают под брюшиной по ходу сигмовидной артерии и ее ветвей. В них впадает лимфа от сигмовидной кишки. От данных узлов выносящие сосуды впадают в нижние брыжеечные лимфатические узлы.
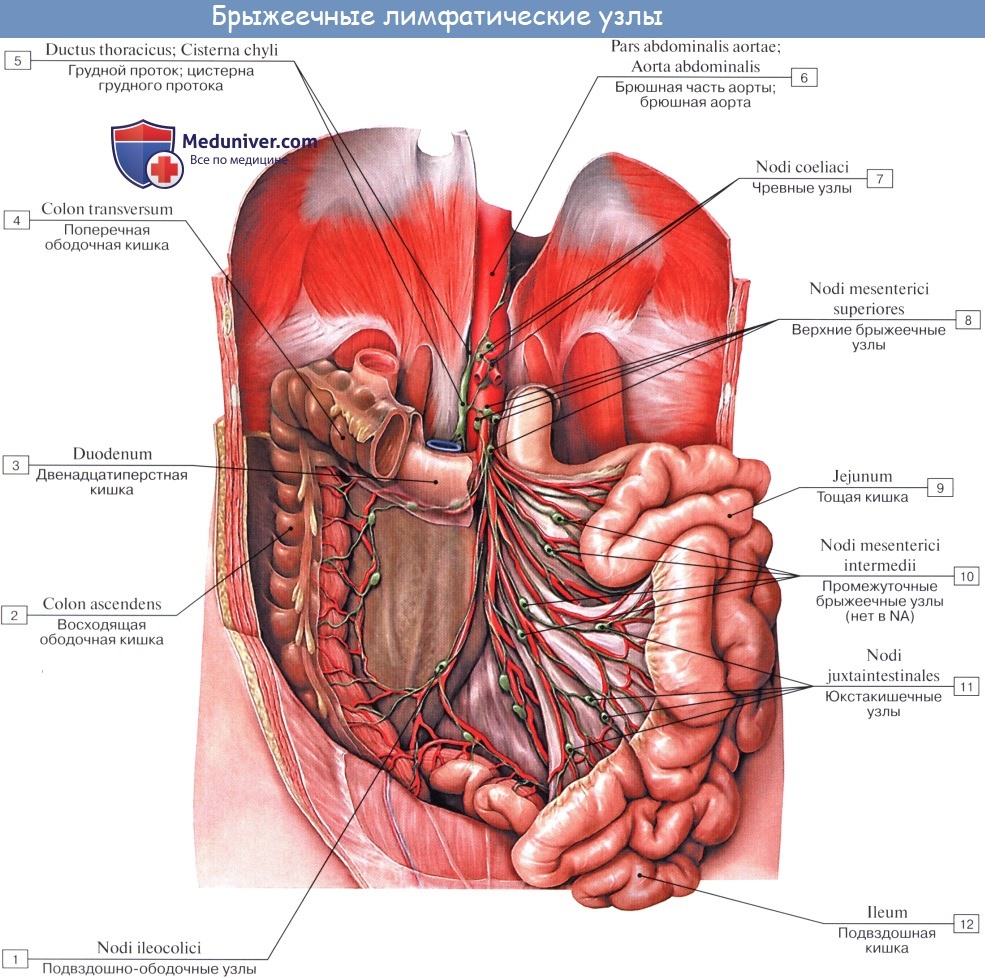
От слепой кишки и червеобразного отростка отводящие сосуды впадают в группу подвздошно-ободочных лимфатических узлов (n.l. ileoco- lici), расположенных по ходу одноименных кровеносных сосудов. Часть сосудов, идущих от червеобразного отростка, впадает непосредственно в центральные верхнебрыжеечные лимфатические узлы (n.1. mesenterici superiores), обусловливая перенос инфекции из отростка в забрюшинное пространство.
Червеобразный отросток связан с лимфатической системой желудка, слепой кишки, почки, яичников и маточных труб в основном в районе верхнебрыжеечных и почечных узлов. Подобные лимфатические связи необходимо учитывать при метастазировании.
Отводящие лимфатические сосуды ободочной кишки прерываются в основном в брыжеечно-ободочных (n.l. mesocolici) и околоободочных (n.l. paracolici) лимфатических узлах лежащих соответственно на стенке кишки или между стенкой кишки и периферическими артериальными дугами.
От левой половины поперечной ободочной кишки и левого ободочного изгиба лимфатические сосуды идут к околоободочным лимфатическим узлам, лежащим около сосудистой дуги Риолана, затем к узлам, расположенным около восходящей ветви левой ободочной артерии и далее к узлам, находящимся у места отхождения нижней брыжеечной артерии (n.l. mesenterici inferiores).
От нисходящей ободочной и сигмовидной кишки лимфа оттекает по сосудам, прерывающимся в лимфатических узлах, располагающихся между стенкой и артериальными дугами (n.l. colici sinistri et sigmoidei). Выносящие лимфатические сосуды этих узлов направляются к регионарным лимфатическим узлам, лежащим у корня нижней брыжеечной артерии (n.l. mesenterica inferiores). Эти узлы являются общими регионарными узлами для сигмовидной и прямой кишки.
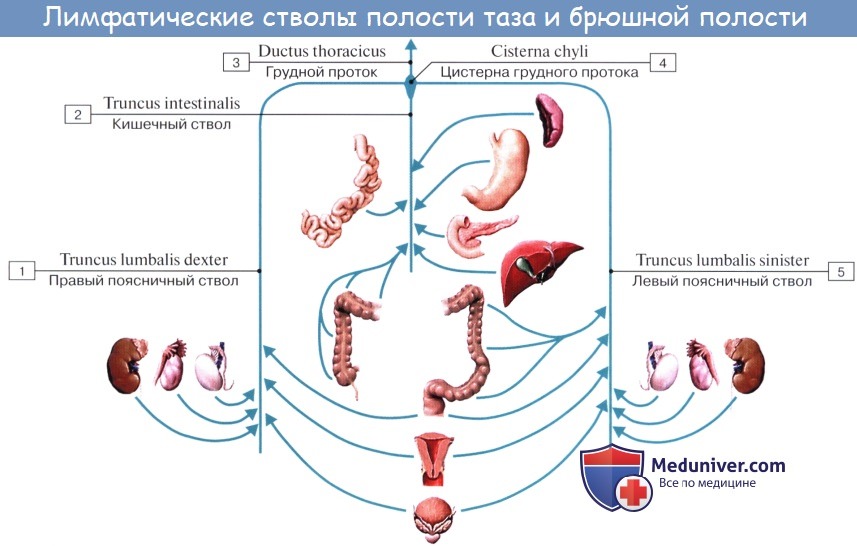
Часть лимфы может поступать непосредственно в кишечный ствол (truncus intestinales) или в млечную цистерну (cysterna chylli).
III. Этиология.
РТК относящийся к категории наследственных и включает – семейный неполипозный РТК (синдром Линча), рак, возникший из наследственных аденоматозных и гамартомных полипов.
Больные с наследственными болезнями составляют среди всех заболевающих РТК 6%.
Неполипозный семейный РТК имеет 2 разновидности:
1. тип “а” – рак возникает только в толстой кишке
2. тип “в” – одновременно могут возникнуть опухоли в эндометрии или желудке, или в мозге, или в молочной железе или мочеполовой системе.
В 66% случаев семейный рак возникает по типу “а”. Возраст заболевших на 20-30 лет меньше, чем у больных спорадическим РТК.
В 56% наследственные раковые опухоли обнаруживаются в проксимальной части толстого кишечника, при спорадическом раке – в 39%. Пятилетняя выживаемость у больных с типом “а” – 58%, с типом “в” –21%. Обычно больные этой формой рака имеют родственников с подобной патологией не менее чем в двух генерациях. У 70% больных выявляются мутации MMR генов -hMSH2 и hMLHI. В норме эти гены кодируют репарацию непарных оснований ДНК (mismatch repair).
Семейный аденоматозный полипоз характеризуется появлением сотен и тысяч полипов (каждый менее 1 см с ножкой или без нее) по всей толстой кишке. Полипы появляются в возрасте 25 лет, диагностируются у тридцатилетних, рак выявляют у 36-летних, к 42 годам обнаруживаются другие наследственные изменения – остеомы нижней челюсти, гиперпигментация сетчатки, полипы желудка.
Синдромы Туркота и Гарднера не имеют различий по клинике изменений в толстой кишке с вышеописанной картиной семейного «аденоматозного полипоза». Различия лишь в том, что при синдроме Туркота могут быть еще опухоли мозга, а при синдроме Гарднера большее разнообразие других новообразований помимо изменений в кишечнике (десмоиды, опухоли щитовидной железы, надпочечников, печени, желчных протоков). Риск РТК у таких больных- 100%.
К наследственным гамартомным полипозам относят также синдром Пейтца-Джегерса, ювенильный полипоз, множественный синдром гамартом, нейрофиброматоз.
К самым большим достижениям фундаментальной науки в рассматриваемой области следует отнести идентификацию генетических изменений при спорадическом (не наследственном) раке толстой кишки, которая дала возможность приступить к разработке генной терапии этого заболевания во многих онкологических центрах и научно-исследовательских лабораториях крупнейших фармацевтических компаний.
Впервые модель колоректального канцерогенеза была представлена в литературе Vogelstein et.al. (1988). В последующем эта модель подверглась уточнениям и сейчас признается, что она правильно аккумулирует генетические изменения и спорно описывает последовательность этих изменений.
Модель колоректального канцерогенеза и мишени генной терапии представлены ниже.
Ген АРС (аденоматозного полипоза толстой кишки) расположен в длинном плече 5 хромосомы. Он ответственен за развитие тысяч аденом у больных семейным полипозом. Мутация этого гена у будущих больных спорадическим ненаследственным РТК ведет к гиперпролиферации нормального эпителия. Цитогенетическим выражением мутации этого гена является потеря аллели в 5-ой хромосоме. При упомянутом, наследственном РТК потеря аллели в 5-ой хромосоме не наблюдается никогда, при спорадическом ненаследственном РТК она отмечается у 30-50% больных.
Образование ранних аденом (второй этап в развитии РТК), связывают с мутированным колоректальным раковым геном (МСС) и метилированием ДНК. Ген МСС расположен в 5 хромосоме, он играет важную роль в передаче сигнальной трансдукции (его значение при РТК пока является предположением).
Метилирование ДНК необходимо для регуляции экспрессии генов и важно для метаболизма цитозин нуклеотидов. В ДНК клеток аденом содержится меньше метильных групп, чем в клетках нормальной слизистой. Гипометилирование по современным представлениям дополняет клеточную генетическую нестабильность.
Переход ранних аденом в промежуточные обусловлен генами ras. Трансформирующие гены семейства ras расположены в коротком плече 12 хромосомы (K-ras) и хромосоме l(N-ras). Мутации этих генов обнаруживаются у 45-50% больных РТК. При аденомах размером менее 1 см мутации гена встречаются у 10% больных, при размерах более 1 см – у 50%. Мутации характеризуются подменой аминокислот в 12,13 и 61 позициях структуры гена, что приводит к расстройствам трансдукции. Ras гены связаны с внутренней поверхностью клеточной мембраны и гидролизом нуклеотидов гуанина (превращением трифосфатов в дифосфаты). Потеря аллели в 18 хромосоме отмечается у 70% больных РТК и 50% больных с поздними аденомами. Потерянная аллель обычно содержит ген DCC (D от слова deleted- потерянный, СС – рак ободочной кишки). DCC – это супрессорный ген, белок которого поверхностный гликопротеин, ответственен за процессы клеточной адгезии. Снижение экспрессии гена DCC ведет к рассеиванию опухолевых клеток. DCC определяется при раке без метастазов, и его экспрессии нет при метастатических формах.
Мутациями гена Р-53 объясняются делеции в 17 хромосоме. Аминокислотные подмены в результате мутации наблюдаются в 5-8 позициях структуры гена. Супрессорный ген Р-53 тормозит клеточную прогрессию и трансформацию. Данные о значении гиперэкспрессии Р-53 при РТК противоречивы. Уточняется тип мутации Р-53, который ответственен за снятие сдерживающего контроля пролиферации.
Замещение или подавление трансформированных мутированных генов ras, MCC, Р-53 восстановление гена DCC – таковы вполне достижимые цели будущего лечения РТК. Экспериментальные разработки в этом направлении ведутся весьма энергично.
Выходцы из азиатских, африканских и южноамериканских стран с низкой заболеваемостью РТК при эмиграции в страны Европы или Северной Америки заболевают с частотой, свойственной их новому месту жительства, что свидетельствует об этиологическом значении влияний внешней среды.
Развиваются 3 гипотезы о решающем значении особенностей питания
1. Рафинированные углеводы и РТК
2. Животные жиры и РТК
3. Потребление мяса и РТК.
Burkitt (1971), в начале семидесятых годов сформулировал концепцию, согласно которой диета, богатая волокнами, приводит к быстрому транзиту кала по кишечнику и уменьшает экспозицию потенциальных канцерогенов на слизистую.
В условиях замедленного пассажа по кишечнику создаются лучшие условия для индукции РТК. Рафинирование муки, круп, сахара приводит к уменьшению не всасываемой массы. При этом изменяется флора кишечника, которая продуцирует канцерогенные вещества. В эпидемиологических исследованиях показано, что время транзита кала по кишечнику у англичан в 2 раза больше, чем у африканцев.
Хотя эта концепция представляется логичной и привлекательной, прямых доказательств полезности применения отрубей для профилактики РТК не получено.
Вместе с тем, есть сторонники этого направления профилактики, опирающиеся на данные мета-анализа.
Вторая этиологическая гипотеза – потребление жиров. В США на долю насыщенных животных жиров приходится от 40до44% калорий, в Японии – лишь 12%. Заболеваемость РТК в этих странах разнится в 7-8 раз. Вторая генерация японских мигрантов на Гавайских островах “изменила” традиционным японским привычкам. Животные жиры употребляются ими в таком же количестве, как и американцами. Заболеваемость РТК среди японцев на Гавайях также велика, как среди американцев.
Reddy Winder (1996), изучая состав кала в группах населения с разным потреблением жиров, обратили внимание на три обстоятельства:
а) у вегетарианцев в среднем с калом выделяется 318мг стеролов в день, у американцев, соблюдающих обычную диету, включающую и животные жиры, в кале, в среднем, содержится 817 мг стеролов.
б) основная масса стеролов в группе с высоким потреблением жира приходится на копростанол и копростанон. Соотношение их ко всем выделенным нейтральными стеролам равняется 96% у американцев и 46% у японцев
в) содержание желчных кислот (диоксихолевой и литохолевой) в кале американцев в 2,5-5 раза выше, чем в кале людей, отказывающихся от животных жиров. Эти желчные кислоты служат строительным материалом для синтеза канцерогенных структур, близких к метилхолантрену.
Gregor et.al. (1997), придают решающее значение животным белкам. Основываясь на данных 28 стран, они обнаружили связь между уровнем смертности от РТК и потреблением мяса на душу населения.
В частности, что в странах где потребление мяса значительно выросло, отмечен подъем заболеваемости раком толстой кишки. Продукты распада белков могут быть материалом для внутрикишечного синтеза нитрозаминов, метаболитов триптофана и т.д., обладающих канцерогенной активностью. В частности, установлена выраженная канцерогенность гетероциклического амина – 2 амин-1 метил-6 фенилимидазол пиридин, содержащегося в жареном мясе.
С общих позиций значение повышенного употребления животных жиров и животных белков трудно разграничить. В большинстве статей говорят уже о роли “диеты с высоким содержанием животных жиров и белков”.
Общепризнанно, что микрофлора толстого кишечника повинна в производстве канцерогенов из пищевых продуктов и кишечных секретов.
Hill (1995), особенно глубоко занимавшийся изучением роли бактерий в этиологии РТК, делает акцент на синтезе канцерогенов из желчных кислот, хотя и признает возможное значение канцерогенных метаболитов трифосфана, канцерогенных фенолов, вторичных аминов, нитрозоаминов и диметилгидразинов – продуктов распада жиров.
Важнейшие выводы, установленные Hillом при исследовании кала групп населения с разным риском возникновения РТК в Африке, Европе, США, Азии следующие;
а) Концентрация желчных кислот в кале населения Европы и США выше, чем в других странах.
б) Степень деградации желчных кислот в кале и концентрация стеролов в нем также повышена в Европе и США, флора содержит большое количество анаэробов.
Соотношение анаэробов к аэробам в кале в зонах с высокой частотой РТК колеблется от 2,1 до 2,7, в странах с редкой заболеваемостью от 0,5 до 1,5. Интересно, что у животных, лишенных микроорганизмов, гораздо труднее индуцировать РТК при введении им через рот канцерогенов. Анаэробные бактерии метаболизируют стероиды, соли желчных кислот значительнее интенсивнее аэробных микробов. Особое значение придается анаэробу – clostridium paraputrificum, который разрушает стероидные структуры с образованием химических канцерогенов. Этот микроб превалирует в кишечной флоре групп риска по РТК. Резюмируя информацию о роли питания, в этиологии РТК можно представить себе такую последовательность событии:
Повышенное потребление животных жиров и белков влияет на композицию кишечной флоры,
последняя интенсивно разрушает стероиды, желчные кислоты, образуя при этом канцерогенные или коканцерогенные соединения
рафинированные углеводы создают лучшие условия для контактов канцерогенных агентов со слизистой кишка, замедляя пассаж кала.
Значение повышенного чаепития в увеличении или уменьшении заболеваемости РТК не доказано. Имеются данные об увеличении РТК у лиц, подвергнутых в прошлом холецистэктомии.
Синхронный рак.
Частота встречаемости синхронных раков толстой кишки варьирует от 1,5до8%. Их выявление обозначилось более четко после широкого внедрения колоноскопии. Полипы встречаются у больных РТК в 12-60% случаев, а у больных с синхронным РТК в 57-86%. Чаще синхронный рак возникает в том же сегменте кишки, что и первичная опухоль. Однако, после внедрения колоноскопии синхронные раки стали чаще обнаруживаться и в других частях кишечника (не там где была первичная опухоль).
Источник
Оглавление темы “Лимфатическая система ( systema Lymphaticum ).”: Лимфатические узлы и сосуды брюшной полости (живота). Топография, строение, расположение лимфатических узлов и сосудов брюшной полости (живота)
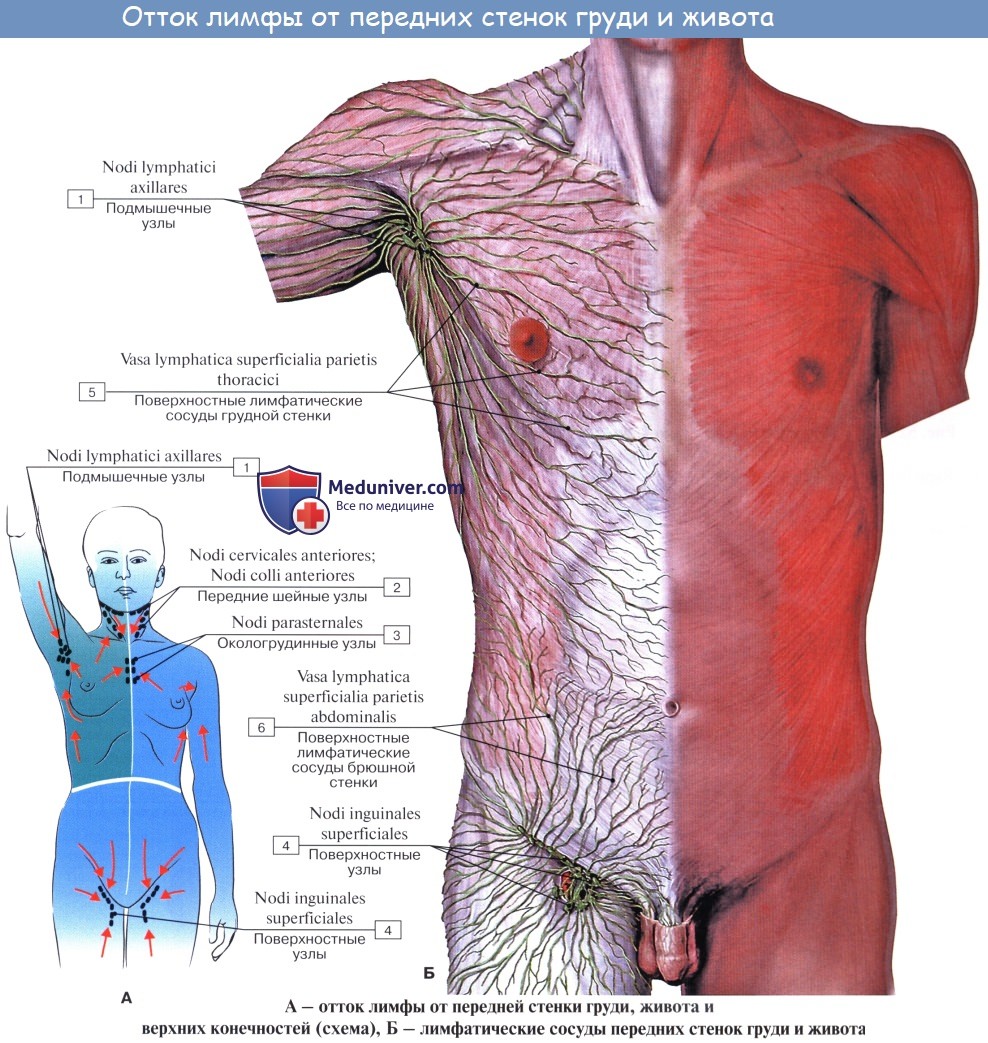
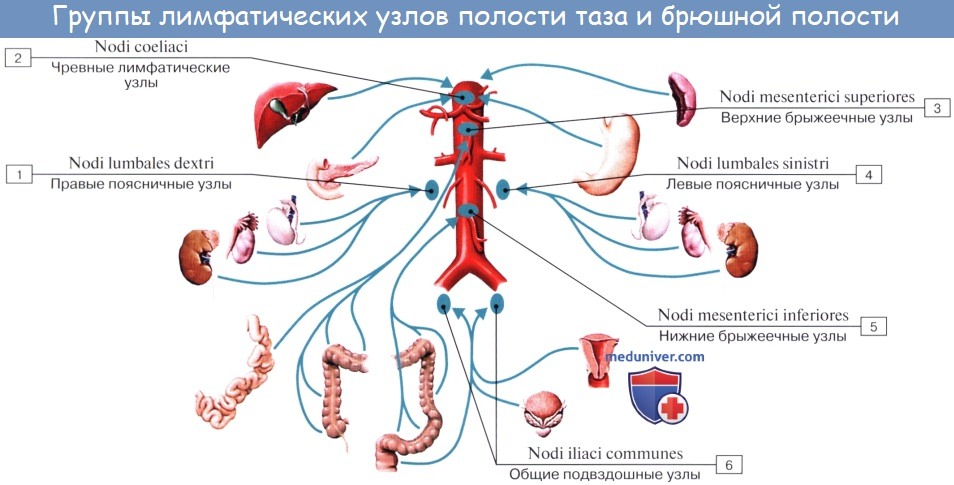
Лимфатические сосуды верхней половины стенки живота направляются вверх и латерально к nodi lymphatici axillares; сосуды нижней половины стенки живота, напротив, спускаются к nodi lymphatici inguinales. В брюшной полости различают: 1) париетальные узлы, залегающие вокруг аорты и нижней полой вены, и 2) висцеральные, которые распределяются вдоль стволов и ветвей чревного ствола, верхней и нижней брыжеечных артерий. Количество париетальных узлов достигает 30 — 50. Общее название этих узлов «поясничные», nodi lymphatici lumbales. Висцеральные узлы брюшной полости распадаются на две большие группы: 1) по ходу ветвей чревного ствола, 2) по ходу ветвей брыжеечных артерий, nodi lymphatici mesenterici superkkes et inferiores. Лимфатические узлы первой группы получают название по отношению к артериям и органам: nodi lymphatici coeliaci, gastrici sinistri et dextri, hepatici, pancreaticoduodenales, pylorici. Вторая группа висцеральных узлов, расположенных вдоль брыжеечных артерий, отличается своей многочисленностью (около 300). Она заложена в толще брыжейки тонкой и толстой кишки и была описана вместе с их лимфатическими сосудами. Впадающие в перечисленные лимфатические узлы лимфатические сосуды органов брюшной полости описаны при изложении анатомии каждого органа (см. «Спланхнология»).
Тонкая кишка имеет особую систему лимфатических сосудов — систему млечных сосудов. Кишка содержит сплетение лимфатических сосудов во всех слоях, составляющих ее стенку: в слизистой, подслизистой, мышечной и серозной. При этом различают две группы лимфатических сосудов: 1. Лимфатические сосуды серозной оболочки. 2. Хилусные, или млечные сосуды (chylus — млечный сок) имеют своими корнями центральные лимфатические сосуды, начинающиеся слепо под эпителием, на вершине ворсинки. Они залегают в слизистой оболочке и подслизистой основе кишки, продолжаясь затем в брыжейку, и транспортируют всасывающийся жир, придающий лимфе вид молочной эмульсии (хилуса), откуда и происходит название этих сосудов (рис. 258). Остальные питательные вещества всасываются венозной системой и уносятся к печени через воротную вену. Отводящие лимфатические сосуды двенадцатиперстной кишки идут к панкреатодуоденальным лимфатическим узлам. Отводящие лимфатические сосуды тощей и подвздошной кишки идут в толще брыжейки к брыжеечным узлам. В брыжейке тонкой кишки следует выделять три группы лимфатических сосудов: 1) левая группа — от начального отрезка тошей кишки (40 — 70 см), 2) средняя группа — от остальной части тощей кишки и 3) правая группа — от подвздошной кишки. Проходя в брыжейке, млечные сосуды прерываются брыжеечными лимфатическими узлами, расположенными в четыре ряда. Узлы первого ряда расположены вдоль брыжеечного края кишки, узлы второго — несколько отступя от края, узлы третьего — около корня брыжейки и узлы четвертого — в корне брыжейки. Из брыжеечных узлов лимфа течет к поясничным узлам, а оттуда в truncus lumbalis sinister и далее в грудной проток. Иногда часть выносящих сосудов брыжеечных и других висцеральных узлов брюшной полости собирается в короткие стволы, называемые trunci intestinales, которые впадают или непосредственно в начало грудного протока, или в левый (редко в правый) поясничный ствол. Из толстой кишки лимфоотток происходит в nodi lymphatici ileocolici, colici dextri, colici medii, mesenterici inferiores, colici sinistri, расположенные по ходу одноименных сосудов.
– Также рекомендуем “Лимфатические узлы и сосуды грудной клетки. Топография, строение, расположение лимфатических узлов и сосудов грудной клетки.” |
Источник