Регионарные лимфатические узлы яичника

Пути метастазирования опухоли при раке шейки матки и тела матки. Лимфатическая система яичников.
Клинические наблюдения показывают, что чаше всего метастазы при раке шейки матки обнаруживаются в следующих шести группах лимфатических узлов, являющихся для шейки матки регионарными: околошеечных (парацервикальных), околоматочных (параметральных), запирательпых, внутренних подвздошных, наружных подвздошных и общих подвздошных. Значительно реже наблюдается метастазирова-ние рака шейки матки в околоаортальные и паховые лимфатические узлы. Перечисленные группы узлов, в свою очередь, могут быть подразделены на три подгруппы: первичная (околошеечные и околоматочные), промежуточная (наружные и внутренние подвздошные, запирательные) и вторичная подгруппа (общие подвздошные, околоаортальные и паховые лимфатические узлы).
Существует два основных пути лимфогенного метастазирования при раке шейки матки. Первый путь: от околошеечных и околоматочных узлов к наружным подвздошным и запирательным, а затем к околоаортальным и значительно реже — паховым лимфатическим узлам. Второй основной путь: от околошеечных и околоматочных узлов к внутренним подвздошным, а затем к общим подвздошным и околоаортальным лимфатическим узлам. Распространение раковых клеток может происходить как по одному из этих путей, так и по обоим, а также только с одной стороны или с обеих сторон одновременно (Papadia, 1958).
Общность лимфатической и венозной системы шейки матки и влагалища, а также тесный контакт между этими органами является анатомическим обоснованием нередкого распространения карциномы шейки матки на стенки влагалища.
Согласно клиническим данным, при раке шейки матки сначала поражаются внутренние подвздошные и подвздошные (общие и наружные), а затем околоаортальные лимфатические узлы; при раке тела матки в первую очередь поражаются околоаортальные и паховые лимфатические узлы; метастазирование при раке шейки матки происходит быстрее, чем при раке тела матки.
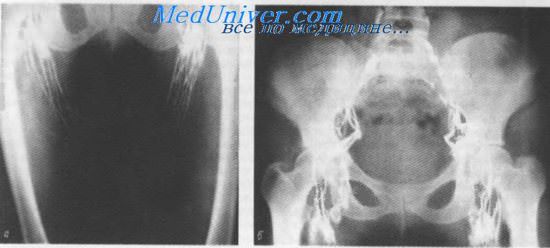
Лимфограмма. Глубокие лимфатические сосуды и узлы нижней конечности (а) и таза (б)
Лимфатическая система яичников
Лимфатические сосуды яичника на поверхности органа представлены в виде грубой сети. В воротах и в брыжейке яичника отводящие лимфатические сосуды образуют богатое подъяичниковое сплетение (plexus subovaricus); по выходящим из него 2—3 лимфатическим стволам лимфа оттекает в общие для яичника, тела матки и маточной трубы лимфатические узлы, расположенные по ходу яичниковых сосудов (nodi lymphatici ovarici) и далее — в регионарные лимфатические узлы; последние расположены преимущественно: слева— по левой полуокружности брюшной аорты, справа — по передней поверхности нижней полой вены.
Взаимоотношения лимфатических сосудов дна матки, яичников и маточной трубы также самые тесные. Отводящие лимфатические сосуды всех трех органов сливаются в упоминавшееся выше общее для них подъничниковое сплетение. Отток лимфы из матки, яичника и маточной трубы происходит в околоаортальные лимфатические узлы, в которые впадают также лимфатические сосуды и от органов брюшной полоста (Д. А. Жданов, 1952). Существует тесная связь путей оттока лимфы матки, мочевого пузыря и прямой кишки.
Хирургическая анатомия лимфатической системы матки имеет практическое значение и в связи с использованием в клинике метода предоперационного (прижизненного) окрашивания лимфатических узлов, например при операции Вертгейма (Е. В. Антипова, 1963; М. Марков, 1960).
Обнаружение метастазов в лимфатических узлах таза затруднено из-за огромного числа вариантов нормы; тем не менее, применение метода лимфографии перед операцией и во время последней имеет много преимуществ в связи с реальной возможностью более полного осуществления лимфаденэктомии. Методом лимфографии, выполнявшейся, в частности, после операции Вертгейма, было установлено, что в зоне иссечения лимфатических узлов последние контрастируются в тех случаях, когда удаление узлов было неполным, так как возможна частичная их регенерация. При тщательном же удалении лимфатических сосудов и узлов на большом протяжении последние не восстанавливаются и на лимфотраммах не обнаруживаются.
Восстановленные лимфатические узлы не достигают исходного состояния: они уменьшены в размерах, полигональны по форме и менее контрастны.
Лимфатические сосуды после операции Вертгейма теряют прямолинейность хода, образуют между собой многочисленные связи, не имеют четкообразных утолщений, становятся более извилистыми и чрезвычайно узкими. Ниже места резецированных лимфатических узлов и сосудов (паховая область, бедро) примерно в половине случаев образуется широкая сеть коллатералей, направляющихся к лимфатическим сосудам противоположной стороны. Основные лимфатические коллекторы бедра подвергаются редукции и деформации.
– Также рекомендуем “Расширенная абдоминальная экстирпация матки.”
Оглавление темы “Операции в гинекологии.”:
1. Хирургическое лечение трубного бесплодия
2. Сальпинго-сальпингоанастомоз. Техника сальпинго-сальпингоанастомоза.
3. Операция пересадки яичника в полость матки. Лимфатическая система матки.
4. Пути метастазирования опухоли при раке шейки матки и тела матки. Лимфатическая система яичников.
5. Расширенная абдоминальная экстирпация матки.
6. Основные этапы расширенной абдоминальной экстирпация матки.
7. Мочеточник. Хирургическая анатомия женского мочеточника.
8. Мочевой пузырь. Хирургическая анатомия женского мочевого пузыря.
9. Мочеиспускательный канал. Хирургическая анатомия женского мочеиспускательного канала.
10. Операции при недержании мочи. Операция прямой мышечной пластики сфинктера мочевого пузыря.
Источник
Стадирование основано на знании этапов метастазирования рака яичников.
Основным путем диссеминации при злокачественных эпителиальных опухолях яичников является имплантация по париетальной и висцеральной брюшине и несколько реже – в забрюшинные лимфоузлы (парааортальные и тазовые).
При хирургическом стадировании необходимо учитывать все возможные места метастазирования.
Достаточно полный обзор брюшной полости может обеспечить только срединная лапаротомия. По вскрытии брюшной полости при наличии асцитической жидкости последняя отправляется для цитологического исследования. При отсутствии свободной жидкости необходимо сделать смывы физиологическим раствором с брюшины дугласова пространства или взять мазки-отпечатки с париетальной брюшины.
Кроме того, производится биопсия брюшины дугласова пространства и латеральных каналов брюшной полости, диафрагмы даже при отсутствии макроскопических признаков канцероматоза брюшины. Отсутствие информации о состоянии париетальной брюшины может привести к неправильному стадированию, а значит и к неадекватному лечению.
Ниже приведена классификация TNM 6-го пересмотра, рекомендованная к использованию в настоящее время. Для удобства приведена классификация по стадиям FIGO.
Правила классификации
Должно быть гистологическое подтверждение диагноза, позволяющее выделить гистологические подвиды опухолей. По согласованию с FIGO, рекомендуется использование гистологической классификации эпителиальных опухолей ВОЗ (1973).
Должна фиксироваться степень дифференцировки опухолевых клеток. Для оценки категорий Т, N и М применяются физикальный осмотр, методы визуализации, лапароскопия и/или хирургические методы.
Регионарные лимфатические узлы
Регионарными лимфатическими узлами являются подчревные (запирательные), общие и наружные подвздошные, боковые крестцовые, парааортальные и паховые (рис.43). В целом, для опухолей яичников регионом считается всё пространство, ограниченное сверху диафрагмой, а снизу паховыми областями.

Рис. 43. Регионарные лимфатические узлы. 1 – внутренние подвздошные (включая запирательные); 2 – общие подвздошные; 3 – внешние подвздошные; 4 – боковые крестцовые; 5 – парааортальные; 6 – паховые лимфоузлы.
Т- первичная опухоль
N – регионарные лимфатические узлы
NX – недостаточно данных для оценки состояния регионарных лимфатических узлов;
N0 – нет признаков поражения метастазами регионарных лимфатических узлов;
N1 – метастазы в регионарных лимфатических узлах.
М – отдаленные метастазы
MX – недостаточно данных для оценки отдалённых метастазов;
M0 – нет признаков отдалённых метастазов;
M1 – имеются отдалённые метастазы.
Гистопатологическая дифференцировка (G)
GX – степень дифференцировки не может быть установлена;
G1 – высокая степень дифференцировки;
G2 – средняя степень дифференцировки;
G3 – низкая степень дифференцировки или недифференцированные опухоли.
Таблица 6. Классификация TNM и классификация Всемирной организации акушеров и гинекологов (FIGO)

Примечание. Метастазы в капсулу печени классифицируются как Т3/стадия III, метастазы в паренхиме печени классифицируются как М1/стадия IV. Позитивные цитологические находки в плевральной жидкости как М1/стадия IV.

Рис. 44. Стадирование злокачественных новообразований яичников по символу Т.
а – опухоль ограничена одним яичником, капсула не поражена, нет опухолевого разрастания на поверхности яичника, нет опухолевых клеток в асците и смыве из брюшной полости (Т1а); б – опухоль ограничена двумя яичниками, капсула не поражена, нет опухолевого разрастания на поверхности яичника, нет опухолевых клеток в асците или смыве из брюшной полости (T1b); в – опухоль ограничена одним или двумя яичниками, сопровождается разрывом капсулы, наличием опухолевого разрастания на поверхности яичника, наличием злокачественных клеток в асцитической жидкости или смыве из брюшной полости (Т1с); г – распространение на ткани таза, нет опухолевых клеток в асците или в смыве из брюшной полости (T2b), распространение в тазу (2а или 2b) с наличием опухолевых клеток в асцитической жидкости или смыве из брюшной полости (T2c).

Рис. 45. Стадирование злокачественных новообразований яичников по символу Т. а – имплантационные метастазы в пределах брюшной полости (Т3); б – имплантационные метастазы (Т3), паренхиматозный метастаз (М1).
Таблица 7. Группировка рака яичников по стадиям развития процесса

При выработке тактики лечения у молодых пациенток, а так же для определения прогноза течения заболевания рекомендуется использовать критерии риска рецидивирования при раке яичников (табл. 8).
Таблица 8. Критерии риска рецидивирования при раке яичников

А.С. Марьенко, A.И. Новиков, В.К. Косенок, В.А. Акулинин
Опубликовал Константин Моканов
Источник
ГЛАВА 36 РАК ЯИЧНИКА
ЭПИДЕМИОЛОГИЯ
Рак
яичника – группа злокачественных эпителиальных опухолей, которые
составляют 90 % злокачественных новообразований яичника. Ежегодно в мире
раком яичника заболевают до 200 тыс. женщин и умирают более 100 тыс. В
России ежегодно регистрируется до 12 тыс. новых случаев рака яичника. В
2007 г. зарегистрировано 12 609 заболевших. В 1997 г. заболеваемость в
РФ составляла 9,89 на 100 тыс. женского населения, а в 2007 г. – 16,5.
Рак яичника является одной из наиболее частых злокачественных опухолей
женских половых органов и занимает 5-е место в структуре онкологической
смертности у женщин. У большинства больных (75 %) заболевание выявляется
на поздних стадиях. Поздняя диагностика связана со «стертой»
клинической картиной заболевания. Средний возраст больных раком яичника –
60 лет. До 5-10 % рака яичника являются семейными или наследственными
формами заболевания и диагностируются у женщин молодого возраста.
ЭТИОЛОГИЯ
Причины
возникновения большинства опухолей яичников остаются неизвестными.
Обзоры эпидемиологических исследований указывают на высокую частоту рака
яичника в индустриальных странах, за исключением Японии. Возможно, это
обусловлено диетическими факторами – а именно высоким потреблением
животных жиров.
Наибольшая роль в развитии рака
яичников отводится гормональным и генетическим факторам. В
многочисленных эпидемиологических исследованиях отмечено, что
беременность снижает риск возникновения рака яичников и во многих
случаях даже оказывает значительное защитное действие. Бесплодие же
повышает риск развития рака яичников, а препараты, стимулирующие
овуляцию в течение более 12 циклов, увеличивают этот риск в 2-3 раза. В
то же
время применение оральных контрацептивных препаратов снижает в 2 раза риск рака яичника.
Наследственность
– один из важных факторов риска в развитии рака яичников. Хотя
большинство карцином яичника (90 %) являются спорадическими по своей
природе, риск их развития в популяции не превышает 1,5 %, т.е.
заболевает 1 из 100 женщин. И несмотря на то, что только 5-10 % случаев
рака яичника могут быть отнесены к наследственным формам, риск
заболевания может возрастать до 50 %, т.е. заболевает каждая 2-я
женщина. В настоящее время описаны 3 синдрома наследственной
предрасположенности к возникновению рака яичника: семейный рак яичника,
семейный рак молочной железы/яичника, синдром Линча II. Наиболее высок
риск развития рака яичника среди женщин, у родственниц которых 1-й
степени родства был рак яичника/молочной железы с мутацией генов BRCA1 или BRCA2.
Морфологическая классификация ВОЗ (1999) злокачественных
эпителиальных опухолей яичника включает серозный, муцинозный,
эндометриоидный, светлоклеточный (мезонефроидный) рак, злокачественную
опухоль Бреннера, смешанный и неклассифицированный рак.
Метастазирование. Метастазирует
рак яичника обычно имплантационно по брюшине малого таза и брюшной
полости с прорастанием в толстую кишку и мочевой пузырь. Вероятность
лимфогенного метастазирования при I стадии достигает 20 %. Регионарными
лимфатическими узлами являются лимфатические узлы таза, парааортальные и
паховые. Блок лимфатического дренирования приводит к развитию асцита,
плеврита.
КЛИНИЧЕСКАЯ КЛАССИФИКАЦИЯ ПО СИСТЕМЕ TNM (2002) И МЕЖДУНАРОДНОЙ ФЕДЕРАЦИИ АКУШЕРОВ И ГИНЕКОЛОГОВ (FIGO, 1988)
При
раке яичников критерии выделения категорий Т, NиМ соответствуют стадиям
FIGO. Ниже для сравнения приведены обе классификации (табл. 36.1).
Классификация
FIGO основана на клинической стадийности заболевания. Стадии ТNМ имеют
как клинический, так и патоморфологический вариант.
Правила классификации
Представленная
ниже классификация применима для злокачественных
эпителиально-стромальных опухолей, включая опухоли пограничной
злокачественности и низкого злокачественного потенциала (определения
взяты из: WHO Classification of Tumours, Pathology and Genetics. Tumours
of the Breast and Female Genital Organs, Tavassoli F., Devilee P.,
eds., 2003), которые соответствуют (в старой терминологии) «общим
эпителиальным опухолям яичников». Представленная ниже схема применима
также для опухолей неэпителиальной природы*. В каждом случае необходимы
гистологическое подтверждение диагноза, определение гистологического
типа опухоли.
Обратите внимание!
* В классификации FIGO подобная возможность опущена.
Регионарные лимфатические узлы
1. Внутренние подвздошные (включая запирательные).
2. Общие подвздошные.
3. Внешние подвздошные.
4. Боковые крестцовые.
5. Парааортальные.
6. Паховые лимфатические узлы.
Клиническая классификация TNM
Т – первичная опухоль
Таблица 36.1. Классификация рака яичников TNM и Международной
федерации акушеров и гинекологов (FIGO)
TNM | FIGO | Описание |
Tх | – | Оценка первичной опухоли невозможна |
Т0 | – | Первичная опухоль не обнаружена |
T1 | I | Опухоль в пределах яичника (одного или обоих) |
IA | Опухоль |
Окончание табл. 36.1
Обратите внимание!
Метастазы
в капсуле печени позволяют отнести опухоль к группе T3 (III стадия), в
паренхиме печени – к группе M1 (IV стадия). Выявление опухолевых клеток в
плевральном выпоте позволяет отнести опухоль к группе M1 (IV стадия).
N – регионарные лимфатические узлы
? – состояние регионарных лимфатических узлов оценить невозможно.
N0 – метастазов в регионарных лимфатических узлах нет. N1 – метастазы в регионарных лимфатических узлах имеются.
М – отдаленные метастазы
Мх – недостаточно данных для определения отдаленных метастазов.
M0 – нет признаков отдаленных метастазов. М1 – имеются отдаленные метастазы.
Патоморфологическая классификация pTNM
Критерии выделения категорий pT, рN и рМ соответствуют таковым для категорий T, N и M.
С
целью патоморфологической оценки показателя N проводят удаление десяти
паховых лимфатических узлов и более. В настоящее время принято, что
отсутствие характерных изменений ткани при патоморфологическом
исследовании биоптатов меньшего количества лимфатических узлов позволяет
подтвердить стадию
G – гистопатологическая дифференцировка
Gх – степень дифференцировки не может быть установлена.
G1 – высокая степень дифференцировки.
G2 – средняя степень дифференцировки.
G3 – низкая степень дифференцировки или недифференцированные опухоли.
ДИАГНОСТИКА
У
большинства больных раком яичника к моменту установления диагноза
имеется распространенный опухолевый процесс. С одной стороны, это
объясняется быстрой имплантацией серозно-папиллярной опухоли по брюшине.
С другой стороны, абдоминальные боли, симптомы со стороны ЖКТ имеют
«стертый» характер, что приводит к поздней диагностике рака яичника.
Жалобы на общую
слабость, потерю аппетита, увеличение
живота за счет асцита, одышку в связи с гидротораксом появляются при
распространенном злокачественном процессе.
В
большинстве случаев опухоль выявляется при клиническом обследовании
(общем и гинекологическом осмотре) с применением трансабдоминального и
трансвагинального УЗИ. При подозрении на злокачественную опухоль яичника
проводится КТ органов брюшной полости и малого таза (рис. 36.1-36.3,
стрелками указана опухоль). По показаниям выполняется эндоскопическое
исследование желудка и кишечника для исключения метастатического
характера опухоли яичника.
Для выявления отдаленных метастазов рака яичника обязательно выполнение рентгенографии легких.
Рис. 36.1. Двустороннее поражение яичников – с обеих сторон кистозные опухоли. Компьютерная томограмма
Рис. 36.2. Опухоль
левого яичника с бугристыми контурами, неоднородной структуры с
участками распада. По париетальной брюшине передней брюшной стенки
массивные метастазы. Компьютерная томограмма
Рис. 36.3. Диссеминация
опухоли яичников по брюшине – и по париетальному, и по висцеральному
листкам на всем протяжении мягкотканной плотности масса с бугристым
контуром. Асцит. Компьютерная томограмма
Показано
определение уровня опухольассоциированного антигена CA-125. Хотя CA-125
не является столь значимым показателем на момент установления диагноза
рака яичника, его динамика в процессе лечения крайне важна.
В
случаях, когда не может быть выполнена операция на 1-м этапе лечения,
необходимо морфологическое подтверждение диагноза (цитологическое
исследование эвакуированной асцитической/плев- ральной жидкости или
гистологическое исследование биоптатов метастатических очагов). Общий и
биохимический анализы крови позволяют оценить состояния кроветворения, а
также функции печени и почек.
Рис. 36.4. Вид пациентки на операционном столе. Диагноз: рак яичников
Рис. 36.5. Рак левого яичника. Макропрепарат
ЛЕЧЕНИЕ
Основополагающим
в лечении рака яичника является применение хирургического и
химиотерапевтического методов. Стандартным объемом операции при раке
яичников I стадии является экстирпация матки с двусторонним удалением
придатков и удалением большого сальника на уровне поперечной ободочной
кишки из срединного лапаротомного доступа (рис. 36.4, 36.5). Тщательная
ревизия органов брюшной полости дополняется цитологическим исследованием
выпота или смывов и гистологическим изучением биоптатов с
подозрительных участков брюшины.
У молодых больных
раком яичника IA стадии только при пограничной опухоли или
высокодифференцированной аденокарциноме (G1) при настойчивом желании
пациентки сохранить
фертильность возможно выполнение
органосохраняющей операции в объеме односторонней аднексэктомии без
экстирпации матки с обязательной биопсией другого яичника.
Считается,
что при пограничных опухолях и высокодифференцированном раке яичников
(G1) IA стадии (поражение одного яичника, без прорастания опухоли
капсулы кисты) адъювантного (дополнительного) лечения после операции не
требуется. Хирургическое лечение, выполненное в соответствии с
современными канонами, позволяет достичь 5-летней выживаемости более чем
у 90 % больных. Тем не менее уже сегодня больные раком яичников ранних
стадий с высоким риском рецидива (светлоклеточный рак, умеренно или
низкодифференцированный рак IA/IB стадий, или стадии IC и IIA) должны
получать адъювантную химиотерапию с включением производных платины.
Число курсов химиотерапии колеблется от 3 до 6.
При
распространенном раке яичника выполняются циторедуктивные операции. Цель
такого вмешательства – максимальное удаление первичной опухоли и
метастазов. Качество выполненной операции во многом определяет
последующий прогноз заболевания. Циторедуктивная операция может
считаться оптимальной в случае удаления всех видимых опухолевых очагов
или когда диаметр остаточной опухоли не превышает 1 см. Первичная
циторедуктивная операция является стандартом при III стадии рака
яичников, а также в некоторых клинических ситуациях может быть выполнена
при IV стадии. У пациенток с распространенным раком яичников при
невыполнимости оптимальной первичной циторедукции альтернативой может
стать отсроченная операция после 2-3 курсов химиотерапии. Повторные
вмешательства после первичных циторедуктивных операций и последующих
курсов химиотерапии при прогрессировании опухолевого процесса
выполняются крайне редко, так как они не улучшают прогноз заболевания.
Показанием к вмешательствам такого рода могут быть солитарный опухолевый
узел, молодой возраст больной, продолжительность безрецидивного периода
после окончания химиотерапии более 12 мес.
Приблизительно у
50-60 % больных распространенным раком яичников можно выполнить
циторедуктивную операцию, однако только хирургическая операция не
повышает выживаемость; циторедукция опухолевых масс уменьшает симптомы
заболевания, улучшает качество жизни больных и создает условия для
успешной химиотерапии.
В настоящее время стандартом
химиотерапии 1-й линии являются 6 курсов однодневной комбинированной
химиотерапии по схеме карбоплатин (AUC-5)/паклитаксел (175 мг/м2)
с интервалами 3 нед. Химиотерапия позволяет рассчитывать на продление
срока до прогрессии в среднем до 18 мес, а средней продолжительности
жизни – до 36 мес.
После окончания первичного лечения
больные раком яичников должны находиться под постоянным наблюдением
онкогинеколога. В процессе наблюдения каждые 3 мес рекомендуется, помимо
клинического и УЗ-обследования, определять в крови концентрацию
опухолевого маркера СА-125. Повышение уровня СА-125 может стать первым
сигналом, свидетельствующим о рецидиве заболевания, что в дальнейшем
подтверждается лучевыми методами диагностики (УЗИ, КТ) и клинически. По
мнению многих клиницистов, повышение уровня СА-125 даже при отсутствии
других доказательств рецидива заболевания служит показанием к
возобновлению химиотерапии. Последняя может быть аналогична
проводившейся первичной химиотерапии, если рецидив развился более чем
через 12 мес после предыдущего лечения. Если прогрессирование опухоли
произошло в более короткий промежуток после окончания химиотерапии 1-й
линии, рекомендуется использовать химиотерапию 2-й линии с включением в
схемы лечения паклитаксела, топотеканов, антрациклиновых антибиотиков,
этопозида и других препаратов.
Лечебная тактика в зависимости от стадии заболевания
Ранние стадии (I и IIA стадии)
Хирургическое
лечение включает экстирпацию матки с придатками и оментэктомией.
Необходимы тщательная ревизия брюшины, диафрагмы, тазовых,
парааортальных лимфатических узлов с биопсией подозрительных очагов,
цитологическое исследование перитонеального выпота или смывов. У молодых
женщин, желающих сохранить детородную функцию, при
высокодифференцированной карциноме !А стадии допустимо выполнение
односторонней аднексэктомии.
Адъювантная химиотерапия
не назначается только при высокодифференцированной карциноме !А стадии.
Во всех остальных случаях показана химиотерапия производными платины
(цисплатином 75мг/м2 или карбоплатином AUC5-6) в монорежиме; 3-6 курсов
каждые 3 нед либо в сочетании с алкилирующими агентами или паклитакселом.
Местно-распространенные стадии (IIB, IIC и III стадии)
Хирургическое
лечение заключается в выполнении максимальной циторедукции так, чтобы
оставшиеся опухолевые массы не превышали в диаметре 1 см (оптимальная
циторедуктивная операция).
Химиотерапия 1-й линии –
комбинированная химиотерапия производными платины с другими
цитостатиками. Оптимальная химиотерапия 1-й линии: карбоплатин или
цисплатин в сочетании с паклитакселом; 6 курсов каждые 3 нед.
После
циторедуктивной операции R1 (оставшаяся опухолевая ткань диаметром
>1см) и трех последующих курсов химиотерапии в случае эффективного
лекарственного лечения возможно выполнение повторной операции с
назначением в дальнейшем еще трех курсов цитостатической терапии.
Распространенная стадия (IV стадия)
Больным
относительно молодого возраста в удовлетворительном состоянии показано
хирургическое лечение с целью максимальной циторедукции.
Если
хирургическое лечение не планируется, то после морфологического
подтверждения диагноза (исследование биоптатов опухоли или выпота из
брюшной и плевральной полостей) назначают химиотерапию в тех же режимах,
что и при III стадии.
Оценка эффективности лечения и наблюдение за больными
В
процессе терапии, помимо общего и гинекологического осмотра, показаны
определение уровня CA-125, выполнение УЗИ брюшной полости и малого таза
перед каждым курсом химиотерапии 1-й линии.
КТ брюшной
полости показана при росте уровня СА-125 в процессе химиотерапии 1-й
линии, а также после субоптимальной циторедуктивной операции и трех
курсов химиотерапии при решении вопроса о возможности выполнения
промежуточной операции. После завершения 6-го курса химиотерапии 1-й
линии, если не достигнут полный регресс остаточных опухолевых масс,
лечение может быть продлено до девяти курсов. После окончания первичного
лечения рекомендуются определение СА-125, УЗИ и по показаниям КТ
брюшной полости и малого таза.
Дальнейшее динамическое
наблюдение (общий и гинекологический осмотр, определение СА-125, УЗИ
брюшной полости и малого таза) осуществляется 1 раз в 3 мес первые 2
года, далее 1 раз в 4 мес в течение 3-го года и 1 раз в 6 мес в
последующие годы. В случае повышения содержания СА-125 при отсутствии
клинических и эхографических признаков рецидива заболевания показана КТ
брюшной полости и малого таза.
Лечение рецидивов
При
платиночувствительных рецидивах (более 6 мес после химиотерапии 1-й
линии) рекомендуется химиотерапия производными платины в комбинации с
таксанами, антрациклинами или гемцитабином. Эффект необходимо оценивать
после двух курсов.
При платинорефрактерных (прогрессия
на фоне химиотерапии 1-й линии) и платинорезистентных (в пределах 6 мес
после химиотерапии 1-й линии) рецидивах назначают цитостатики 2-й линии
в монорежиме (таксаны, топотекан, липосомальный доксорубин, гемцитабин,
этопозид и др.). Оценка эффекта проводится после двух курсов.
Повторная операция возможна после всестороннего обследования больной.
В настоящее время
активно изучается интраперитонеальная химиотерапия 1-й линии после
оптимальных циторедуктивных операций, а также интраперитонеальная
химиотерапия 2-й линии с гипертермией (или без нее) при повторных
операциях. Таргетная терапия (бевацизумаб и др.) находится на этапе
клинического внедрения.
ПРОГНОЗ
Прогноз
заболевания неблагоприятный, 5-летняя выживаемость в среднем составляет
35-40 %, при этом при ранних стадиях (IA и IIB) она может достигать
80-90 %, но при III стадии не превышает 20 %.
Вопросы для самоконтроля
1. Какие существуют факторы риска возникновения рака яичника?
2. Какие гистологические типы опухолей яичника выделяют согласно морфологической классификации ВОЗ?
3. Приведите
клиническую классификацию рака яичника по системе TNM (2002) и
Международную классификацию федерации акушеров и гинекологов (FIGO,
1988).
4. Как происходит метастазирование рака яичников?
5. Какие методы используются в диагностике рака яичника?
6. Какие особенности лечебной тактики существуют в зависимости от стадии рака яичника?
7. Какой объем лечебных мероприятий проводится при ранних стадиях (I и ПА стадии) рака яичника?
8. Как проводится лечение при местно-распространенных стадиях (IIB, IIC и III стадии)?
9. Как осуществляется ведение больных при распространенной стадии (IV стадия)?
10. Как проводятся оценка эффективности терапии и наблюдение за больными?
11. Как осуществляется лечение рецидивов рака яичников?
12. Каков прогноз заболевания?
Источник