Размеры лимфоузлов на сигмовидной кишке
Опухоль сигмовидной кишки – это новообразование злокачественной природы, которое происходит из эпителиальных клеток сигмовидного отдела кишечника. Для начальных этапов развития заболевания характерно бессимптомное течение, впоследствии присоединятся боли соответствующей локализации, дискомфорт в животе.
Опухоль сигмовидного отдела кишечника встречается достаточно часто. Располагается этот отдел несколько выше прямой кишки. Среди всех колоректальных опухолей, доля опухолей сигмовидной кишки составляет 34%. Чаще всего возраст пациентов составляет от 40 до 60 лет. Женщины в отличие от мужчин заболевают в 1,5 раза реже. Опухоль опасна метастазированием в рядом расположенные органы. В первую очередь поражаются легкие, печень и позвоночник.
Содержание:
- Причины опухоли сигмовидной кишки
- Симптомы опухоли сигмовидной кишки
- Классификация опухолей сигмовидной кишки
- Диагностика опухоли сигмовидной кишки
- Лечение опухоли сигмовидной кишки
Причины опухоли сигмовидной кишки

Причины опухоли сигмовидной кишки в первую очередь обусловлены самим строением этого участка кишечника. Он располагается в левой части брюшной полости и образует букву S. Если переваренная пища по каким-то причинам проходит по кишечнику медленно, то именно в сигмовидном участке она задерживается дольше всего. Токсические вещества, содержащиеся в химусе, длительное время контактируют со стенками кишки, вызывая воспалительные процессы, которые являются основой для дальнейшего развития злокачественной опухоли.
Факторами-провокаторами, увеличивающими риск формирования опухоли, выступают:
Отсутствие адекватной физической нагрузки, малоподвижный образ жизни.
Неправильное питание, преобладание в рационе жирной, жареной и острой пищи, жиров животного происхождения и легких углеводов. Чем меньше в рационе растительной клетчатки, тем выше риск развития заболевания. Подобное меню ведет к замедлению перистальтики кишечника и к тому, что в его кишечном содержимом будет увеличено количество канцерогенных веществ.
Хронические запоры – вот еще одна причина формирования опухоли. Они приводят к тому, что вредные вещества долго не выводятся из организма, а сами твердые каловые массы травмируют слизистую оболочку кишечника.
Злоупотребление алкоголем повышает риск развития опухоли.
Опасны любые воспалительные заболевания кишечника, а также предраковые состояния, среди которых: полипы, дивертикулы и пр.
Генетическая предрасположенность к развитию заболевания имеется у людей, чьи близкие родственники перенесли аналогичную патологию.
Симптомы опухоли сигмовидной кишки
Симптомы опухоли сигмовидной кишки на ранних этапах развития заболевания заметить практически невозможно. В этом заключается главная опасность болезни. Бессимптомное прогрессирование часто приводит к тому, что опухоль удается обнаружить на поздних стадиях ее развития.
Признаки, которые могут указывать на опухолевый процесс в сигмовидной кишке, следующие:
Ощущение дискомфорта в кишечнике, вздутие живота, урчание и переливы, симптомы метеоризма. Иногда они малозаметны, а иногда способны серьезно нарушать качество жизни больного.
Если на ранних этапах развития болезни стул чаще всего нестабильный (запоры сменяются поносами), то по мере роста опухоли у людей начинают преобладать именно запоры.
В каловых массах могут быть видны прожилки крови, примеси гноя и слизи.
Схваткообразные боли в левой половине живота могут свидетельствовать о том, что опухоль проросла в кишечную стенку и препятствует нормальному продвижению каловых масс. Иногда болезнь обнаруживают во время лечения пациента по поводу развившейся кишечной непроходимости.
Больные испытывают общую слабость и недомогание. По мере прогрессирования заболевания нарастает утомляемость, пропадает аппетит, уходит вес. Кожа приобретает нездоровый сероватый оттенок, температура тела длительное время сохраняется на субфебрильных отметках.
Опухолевая интоксикация организма медленно, но неуклонно прогрессирует.
Если у человека формируется кишечная непроходимость, то он испытывает сильные боли по типу схваток. Они возникают приступами, которые повторяются в среднем каждые 10 минут. Газы перестают отходить, стул отсутствует, живот увеличивается в размерах. Иногда возникает рвота.
Перитонит – опасное осложнение опухолевого процесса, который развивается на фоне разрушения стенки сигмовидной кишки.
Увеличение печени в размерах, пожелтение кожных покровов, анемия – все эти симптомы развиваются при запущенных стадиях заболевания.
Иные признаки опухолевого процесса будут возникать в зависимости от того, какой орган оказывается поражен метастазами.
Классификация опухолей сигмовидной кишки
В зависимости от того, какое строение имеет опухоль, различают следующие ее типы:
Аденокарцинома, представленная железистыми клетками. Это наиболее распространенный тип опухолей, который выявляется в среднем в 80% случаев. Различают три степени дифференцировки аденоматозных новообразований (высоко-, средне- и низкодифференцированные опухоли), чем она ниже, тем ниже порог выживаемости онокобольных.
Мукозные аденокарциномы, представленные муцинозными клетками, продуцирующими большое количество слизи. Эти новообразования быстро растут и рано дают метастазы.
Перстневидно-клеточная опухоль характеризуется неблагоприятным течением, но выявляется редко, не более чем в 4% случаев.
Диагностика опухоли сигмовидной кишки
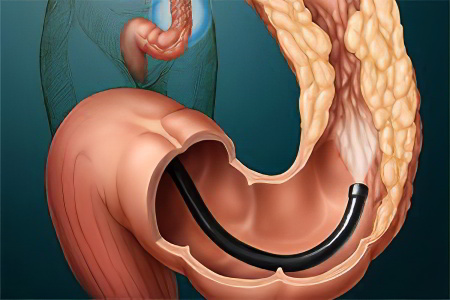
Диагностика опухоли сигмовидной кишки начинается с осмотра больного, сбора анамнеза и жалоб пациента. Максимум информации об опухоли можно получить после проведения колоноскопии и ректороманоскопии. Эти методы позволяют визуализировать опухоль, оценить ее размеры, определить точное место расположения. Во время проведения исследования, врач осуществляет забор ткани опухоли для выполнения последующего гистологического анализа.
В обязательном порядке сдается кал на скрытую кровь, а также проводится ирригоскопия. Тем не менее, выставить окончательный диагноз можно лишь по результатам гистологического исследования опухоли. Метастазы в других органах обнаруживают с помощью УЗИ, рентгенографии, МРТ и КТ.
Лечение опухоли сигмовидной кишки
Лечение опухоли сигмовидной кишки должно быть комплексным. Оно включает в себя хирургическое вмешательство, химиотерапию и лучевую терапию. При этом ведущая роль отводится именно операции, во время которой осуществляется максимально возможное удаление новообразования. Объем вмешательства зависит от того, насколько распространена опухоль. Если новообразование было обнаружено на ранних этапах развития, то возможно проведение эндоскопических манипуляций на кишечнике.
Резекция сигмовидной кишки выполняется при обнаружении опухолей значительных размеров. Параллельно удаляются лимфатические узлы, расположенные регионально, а также участок брыжейки. Кроме пораженных тканей, в обязательном порядке захватывают по 5 см неизмененных тканей (проксимального и дистального отделов). Возможно выполнение двухэтапной и одноэтапной операции. Если вмешательство проводится в один этап, то больному удаляют опухоль, после чего накладывают анастомоз. Эта манипуляция позволяет сохранить целостность кишечника. Когда опухоль имеет широкое распространение, то сигмовидную кишку полностью вырезают и формируют колостому. При этом часть толстой кишки выводится через переднюю брюшную стенку. Вторым этапом операции является формирование межкишечного анастомоза с помощью которого часть толстой кишки соединяется с прямой кишкой. Эту процедуру выполняют через несколько месяцев после первой операции.
Перед хирургическим вмешательством и после него, больным рекомендован курс химиотерапии и лучевой терапии. Если заболевание имеет запущенную стадию, то пациента обеспечивают паллиативным лечением, призванным уменьшить боли и продлить его жизнь. Экстренные операции выполняют при формировании кишечной непроходимости, при перитоните и прочих состояниях, несущих прямую угрозу жизни больного.
Что касается прогноза, то он зависит от степени распространенности опухолевого процесса на момент начала лечения. Средний процент пятилетней выживаемости таких больных составляет 65%, причем если болезнь диагностируется на первой стадии, то эта цифра приравнивается к 93%, а на второй стадии к 82%. Показательно, что при опухоли четвертной стадии процент пятилетней выживаемости составляет всего 8%.

Автор статьи: Быков Евгений Павлович | Онколог, хирург
Образование:
окончил ординатуру в «Российском научном онкологическом центре им. Н. Н. Блохина» и получил диплом по специальности «Онколог»
Наши авторы
Источник
Клетки карциномы начали распространяться. Рак кишечника 3 стадия – это опухоль в толстой кишке любых размеров при обязательном поражении лимфатической системы: чем больше очагов в лимфоузлах, тем хуже прогноз.
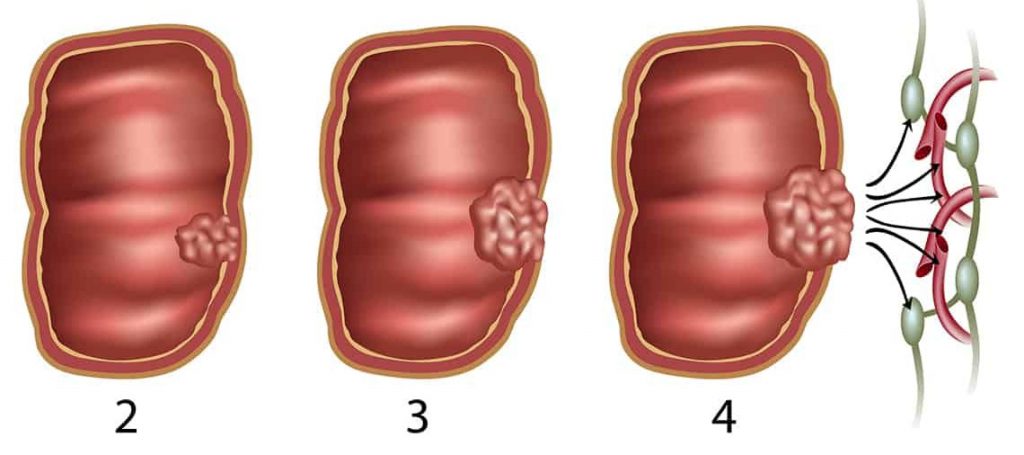 Размер любой + поражение лимфоузлов
Размер любой + поражение лимфоузлов
Рак кишечника 3 стадия
Пусть
и величина небольшая, но карцинома уже отправила по лимфатической системе опухолевые
клетки. Рак кишечника 3 стадия – это начальная форма метастазирования: пока только
в ближайшие лимфоузлы, но, лиха беда начало, с каждым днем риск тотального
распространения злокачественного новообразования возрастает, снижая шансы на
выздоровление. Выделяют 3 варианта:
- IIIA – опухоль еще не
прорастает через все слои или дошла до подсерозной оболочки, но уже обнаружены
от 1 до 6 пораженных метастазами лимфоузлов; - IIIB – карцинома вышла
за пределы кишечной стенки и выявлены 1-6 очагов в лимфатической системе; - IIIC – прорастание в
соседние органы и/или брюшину на фоне метастазирования в 1-7 и более лимфоузлов.
Да, размер важен, но гораздо хуже то,
что карцинома вырвалась на простор и начала захватывать новые территории. Самый
простой и доступный путь распространения – через лимфатическую систему: и
злокачественное новообразование обязательно воспользуется этим шансом, отправив
раковые клетки из первичного очага в толстокишечной стенке.
Объем обследования
Чем
раньше выявим, тем больше вероятность вылечить. Проблема в том, что диагноз рак
кишечника 3 стадия – это наиболее частый вариант обнаружения опухоли в толстой
кишке. По сути, это уже запущенный вид карциномы (оптимально «поймать»
злокачественное новообразование на первых стадиях). Помимо скрининговых
исследований, к стандартным методам
обследования относятся:
- Ультразвуковое
сканирование органов брюшной полости; - Ирригоскопия
(рентгеновское исследование с заполнением кишки контрастным веществом); - Колоноскопия
(осмотреть надо весь толстый кишечник); - Компьютерная
томография (виртуальная колоноскопия); - Биопсия
опухоли (при проведении эндоскопического обследования); - Диагностическая
лапароскопия (визуальный осмотр брюшной полости); - Онкомаркеры
(РЭА, CA 19-9, CA 242).
Главная задача – не только выявить толстокишечную
опухоль, но и найти пораженные лимфатические узлы. По сути, своевременно
поставить точный диагноз и выбрать оптимальную тактику лечения.
Рак кишечника 3 стадия: возможности терапии
Если
есть возможность для хирургического удаления злокачественного новообразования в
толстой кишке, то надо это делать: несмотря на прогресс в медицине, только радикально
выполненная операция дает шанс пациенту
на выздоровление. Во всех случаях врач попытается найти все лимфоузлы с
опухолевыми очагами и удалить их.
Рак
кишечника 3 стадия – это показание для адъювантной химиотерапии: курсы длительностью
до полугода, обязательно комбинация нескольких лекарственных препаратов,
индивидуальный подбор схем терапии и применение симптоматического лечения.
Прогноз хуже, чем при колоректальной опухоли 1 или при карцноме 2 стадии (к 5-летнему рубежу доберутся чуть больше 50% пациентов с 3 стадией кишечной онкологии), но, тем не менее, необходимо использовать все шансы для выживания, имеющиеся у современной медицины.
Запись опубликована в рубрике Онкология с метками болезни, диагностика, карцинома, онкология, опухоль, рак. Добавьте в закладки постоянную ссылку.
Источник
Лимфатическая система толстой кишки представлена внутриорганными лимфатическими сетями, состоящими из капилляров и лимфатических сосудов, располагающихся в подслизистом, мышечном и брюшинном слоях кишки. Эти сети непрерывно переходят одна в другую как по толщине стенки кишки, так и по ее длиннику. В стенке кишки, особенно в червеобразном отростке, располагается скопление лимфатических фолликулов.
Предслепокишечные лимфатические узлы(n.l. prececales) располагаются забрюшинно по ходу слепокишечной артерии. Принимают лимфу от червеобразного отростка и слепой кишки. Выносящие сосуды впадают в подвздошно-ободочные лимфатические узлы.
Заслепокишечные лимфатические узлы(n.l. retrocecales) располагаются забрюшинно, позади слепой кишки по ходу задней слепокишечной артерии. В них поступает лимфа из червеобразного отростка и слепой кишки. От этой группы узлов лимфа идет в подвздошно-ободочные лимфатические узлы.
Правые ободочные лимфатические узлы(n.l. colici dextri) располагаются в брыжейке ободочной кишки, сопровождая правую ободочную артерию. К ним оттекает лимфа от восходящей ободочной кишки. Выносящие лимфатические сосуды впадают в верхние брыжеечные узлы.
Средние ободочные лимфатические узлы(n.l. colici medii) располагаются в брыжейке поперечной ободочной кишки, сопровождая ветви средней ободочной артерии. В них направляется лимфа от поперечной ободочной кишки и большого сальника. Отводящие сосуды впадают в верхние брыжеечные и поясничные лимфатические узлы.
Левые ободочные лимфатические узлы(n.l. colici sinistri) сопровождают левую ободочную артерию в брыжейке левой ободочной кишки. Получают лимфу от левой половины толстой кишки. Отток лимфы от них осуществляется в нижние брыжеечные и поясничные лимфоузлы.
Сигмовидные лимфатические узлы(n.l. sigmoidei) залегают под брюшиной по ходу сигмовидной артерии и ее ветвей. В них впадает лимфа от сигмовидной кишки. От данных узлов выносящие сосуды впадают в нижние брыжеечные лимфатические узлы.
От слепой кишки и червеобразного отростка отводящие сосуды впадают в группу подвздошно-ободочных лимфатических узлов (n.l. ileoco- lici), расположенных по ходу одноименных кровеносных сосудов. Часть сосудов, идущих от червеобразного отростка, впадает непосредственно в центральные верхнебрыжеечные лимфатические узлы (n.1. mesenterici superiores), обусловливая перенос инфекции из отростка в забрюшинное пространство.
Червеобразный отросток связан с лимфатической системой желудка, слепой кишки, почки, яичников и маточных труб в основном в районе верхнебрыжеечных и почечных узлов. Подобные лимфатические связи необходимо учитывать при метастазировании.
Отводящие лимфатические сосуды ободочной кишки прерываются в основном в брыжеечно-ободочных (n.l. mesocolici) и околоободочных (n.l. paracolici) лимфатических узлах лежащих соответственно на стенке кишки или между стенкой кишки и периферическими артериальными дугами.
От левой половины поперечной ободочной кишки и левого ободочного изгиба лимфатические сосуды идут к околоободочным лимфатическим узлам, лежащим около сосудистой дуги Риолана, затем к узлам, расположенным около восходящей ветви левой ободочной артерии и далее к узлам, находящимся у места отхождения нижней брыжеечной артерии (n.l. mesenterici inferiores).
От нисходящей ободочной и сигмовидной кишки лимфа оттекает по сосудам, прерывающимся в лимфатических узлах, располагающихся между стенкой и артериальными дугами (n.l. colici sinistri et sigmoidei). Выносящие лимфатические сосуды этих узлов направляются к регионарным лимфатическим узлам, лежащим у корня нижней брыжеечной артерии (n.l. mesenterica inferiores). Эти узлы являются общими регионарными узлами для сигмовидной и прямой кишки.
Часть лимфы может поступать непосредственно в кишечный ствол (truncus intestinales) или в млечную цистерну (cysterna chylli).
III. Этиология.
РТК относящийся к категории наследственных и включает – семейный неполипозный РТК (синдром Линча), рак, возникший из наследственных аденоматозных и гамартомных полипов.
Больные с наследственными болезнями составляют среди всех заболевающих РТК 6%.
Неполипозный семейный РТК имеет 2 разновидности:
1. тип “а” – рак возникает только в толстой кишке
2. тип “в” – одновременно могут возникнуть опухоли в эндометрии или желудке, или в мозге, или в молочной железе или мочеполовой системе.
В 66% случаев семейный рак возникает по типу “а”. Возраст заболевших на 20-30 лет меньше, чем у больных спорадическим РТК.
В 56% наследственные раковые опухоли обнаруживаются в проксимальной части толстого кишечника, при спорадическом раке – в 39%. Пятилетняя выживаемость у больных с типом “а” – 58%, с типом “в” –21%. Обычно больные этой формой рака имеют родственников с подобной патологией не менее чем в двух генерациях. У 70% больных выявляются мутации MMR генов -hMSH2 и hMLHI. В норме эти гены кодируют репарацию непарных оснований ДНК (mismatch repair).
Семейный аденоматозный полипоз характеризуется появлением сотен и тысяч полипов (каждый менее 1 см с ножкой или без нее) по всей толстой кишке. Полипы появляются в возрасте 25 лет, диагностируются у тридцатилетних, рак выявляют у 36-летних, к 42 годам обнаруживаются другие наследственные изменения – остеомы нижней челюсти, гиперпигментация сетчатки, полипы желудка.
Синдромы Туркота и Гарднера не имеют различий по клинике изменений в толстой кишке с вышеописанной картиной семейного «аденоматозного полипоза». Различия лишь в том, что при синдроме Туркота могут быть еще опухоли мозга, а при синдроме Гарднера большее разнообразие других новообразований помимо изменений в кишечнике (десмоиды, опухоли щитовидной железы, надпочечников, печени, желчных протоков). Риск РТК у таких больных- 100%.
К наследственным гамартомным полипозам относят также синдром Пейтца-Джегерса, ювенильный полипоз, множественный синдром гамартом, нейрофиброматоз.
К самым большим достижениям фундаментальной науки в рассматриваемой области следует отнести идентификацию генетических изменений при спорадическом (не наследственном) раке толстой кишки, которая дала возможность приступить к разработке генной терапии этого заболевания во многих онкологических центрах и научно-исследовательских лабораториях крупнейших фармацевтических компаний.
Впервые модель колоректального канцерогенеза была представлена в литературе Vogelstein et.al. (1988). В последующем эта модель подверглась уточнениям и сейчас признается, что она правильно аккумулирует генетические изменения и спорно описывает последовательность этих изменений.
Модель колоректального канцерогенеза и мишени генной терапии представлены ниже.
Ген АРС (аденоматозного полипоза толстой кишки) расположен в длинном плече 5 хромосомы. Он ответственен за развитие тысяч аденом у больных семейным полипозом. Мутация этого гена у будущих больных спорадическим ненаследственным РТК ведет к гиперпролиферации нормального эпителия. Цитогенетическим выражением мутации этого гена является потеря аллели в 5-ой хромосоме. При упомянутом, наследственном РТК потеря аллели в 5-ой хромосоме не наблюдается никогда, при спорадическом ненаследственном РТК она отмечается у 30-50% больных.
Образование ранних аденом (второй этап в развитии РТК), связывают с мутированным колоректальным раковым геном (МСС) и метилированием ДНК. Ген МСС расположен в 5 хромосоме, он играет важную роль в передаче сигнальной трансдукции (его значение при РТК пока является предположением).
Метилирование ДНК необходимо для регуляции экспрессии генов и важно для метаболизма цитозин нуклеотидов. В ДНК клеток аденом содержится меньше метильных групп, чем в клетках нормальной слизистой. Гипометилирование по современным представлениям дополняет клеточную генетическую нестабильность.
Переход ранних аденом в промежуточные обусловлен генами ras. Трансформирующие гены семейства ras расположены в коротком плече 12 хромосомы (K-ras) и хромосоме l(N-ras). Мутации этих генов обнаруживаются у 45-50% больных РТК. При аденомах размером менее 1 см мутации гена встречаются у 10% больных, при размерах более 1 см – у 50%. Мутации характеризуются подменой аминокислот в 12,13 и 61 позициях структуры гена, что приводит к расстройствам трансдукции. Ras гены связаны с внутренней поверхностью клеточной мембраны и гидролизом нуклеотидов гуанина (превращением трифосфатов в дифосфаты). Потеря аллели в 18 хромосоме отмечается у 70% больных РТК и 50% больных с поздними аденомами. Потерянная аллель обычно содержит ген DCC (D от слова deleted- потерянный, СС – рак ободочной кишки). DCC – это супрессорный ген, белок которого поверхностный гликопротеин, ответственен за процессы клеточной адгезии. Снижение экспрессии гена DCC ведет к рассеиванию опухолевых клеток. DCC определяется при раке без метастазов, и его экспрессии нет при метастатических формах.
Мутациями гена Р-53 объясняются делеции в 17 хромосоме. Аминокислотные подмены в результате мутации наблюдаются в 5-8 позициях структуры гена. Супрессорный ген Р-53 тормозит клеточную прогрессию и трансформацию. Данные о значении гиперэкспрессии Р-53 при РТК противоречивы. Уточняется тип мутации Р-53, который ответственен за снятие сдерживающего контроля пролиферации.
Замещение или подавление трансформированных мутированных генов ras, MCC, Р-53 восстановление гена DCC – таковы вполне достижимые цели будущего лечения РТК. Экспериментальные разработки в этом направлении ведутся весьма энергично.
Выходцы из азиатских, африканских и южноамериканских стран с низкой заболеваемостью РТК при эмиграции в страны Европы или Северной Америки заболевают с частотой, свойственной их новому месту жительства, что свидетельствует об этиологическом значении влияний внешней среды.
Развиваются 3 гипотезы о решающем значении особенностей питания
1. Рафинированные углеводы и РТК
2. Животные жиры и РТК
3. Потребление мяса и РТК.
Burkitt (1971), в начале семидесятых годов сформулировал концепцию, согласно которой диета, богатая волокнами, приводит к быстрому транзиту кала по кишечнику и уменьшает экспозицию потенциальных канцерогенов на слизистую.
В условиях замедленного пассажа по кишечнику создаются лучшие условия для индукции РТК. Рафинирование муки, круп, сахара приводит к уменьшению не всасываемой массы. При этом изменяется флора кишечника, которая продуцирует канцерогенные вещества. В эпидемиологических исследованиях показано, что время транзита кала по кишечнику у англичан в 2 раза больше, чем у африканцев.
Хотя эта концепция представляется логичной и привлекательной, прямых доказательств полезности применения отрубей для профилактики РТК не получено.
Вместе с тем, есть сторонники этого направления профилактики, опирающиеся на данные мета-анализа.
Вторая этиологическая гипотеза – потребление жиров. В США на долю насыщенных животных жиров приходится от 40до44% калорий, в Японии – лишь 12%. Заболеваемость РТК в этих странах разнится в 7-8 раз. Вторая генерация японских мигрантов на Гавайских островах “изменила” традиционным японским привычкам. Животные жиры употребляются ими в таком же количестве, как и американцами. Заболеваемость РТК среди японцев на Гавайях также велика, как среди американцев.
Reddy Winder (1996), изучая состав кала в группах населения с разным потреблением жиров, обратили внимание на три обстоятельства:
а) у вегетарианцев в среднем с калом выделяется 318мг стеролов в день, у американцев, соблюдающих обычную диету, включающую и животные жиры, в кале, в среднем, содержится 817 мг стеролов.
б) основная масса стеролов в группе с высоким потреблением жира приходится на копростанол и копростанон. Соотношение их ко всем выделенным нейтральными стеролам равняется 96% у американцев и 46% у японцев
в) содержание желчных кислот (диоксихолевой и литохолевой) в кале американцев в 2,5-5 раза выше, чем в кале людей, отказывающихся от животных жиров. Эти желчные кислоты служат строительным материалом для синтеза канцерогенных структур, близких к метилхолантрену.
Gregor et.al. (1997), придают решающее значение животным белкам. Основываясь на данных 28 стран, они обнаружили связь между уровнем смертности от РТК и потреблением мяса на душу населения.
В частности, что в странах где потребление мяса значительно выросло, отмечен подъем заболеваемости раком толстой кишки. Продукты распада белков могут быть материалом для внутрикишечного синтеза нитрозаминов, метаболитов триптофана и т.д., обладающих канцерогенной активностью. В частности, установлена выраженная канцерогенность гетероциклического амина – 2 амин-1 метил-6 фенилимидазол пиридин, содержащегося в жареном мясе.
С общих позиций значение повышенного употребления животных жиров и животных белков трудно разграничить. В большинстве статей говорят уже о роли “диеты с высоким содержанием животных жиров и белков”.
Общепризнанно, что микрофлора толстого кишечника повинна в производстве канцерогенов из пищевых продуктов и кишечных секретов.
Hill (1995), особенно глубоко занимавшийся изучением роли бактерий в этиологии РТК, делает акцент на синтезе канцерогенов из желчных кислот, хотя и признает возможное значение канцерогенных метаболитов трифосфана, канцерогенных фенолов, вторичных аминов, нитрозоаминов и диметилгидразинов – продуктов распада жиров.
Важнейшие выводы, установленные Hillом при исследовании кала групп населения с разным риском возникновения РТК в Африке, Европе, США, Азии следующие;
а) Концентрация желчных кислот в кале населения Европы и США выше, чем в других странах.
б) Степень деградации желчных кислот в кале и концентрация стеролов в нем также повышена в Европе и США, флора содержит большое количество анаэробов.
Соотношение анаэробов к аэробам в кале в зонах с высокой частотой РТК колеблется от 2,1 до 2,7, в странах с редкой заболеваемостью от 0,5 до 1,5. Интересно, что у животных, лишенных микроорганизмов, гораздо труднее индуцировать РТК при введении им через рот канцерогенов. Анаэробные бактерии метаболизируют стероиды, соли желчных кислот значительнее интенсивнее аэробных микробов. Особое значение придается анаэробу – clostridium paraputrificum, который разрушает стероидные структуры с образованием химических канцерогенов. Этот микроб превалирует в кишечной флоре групп риска по РТК. Резюмируя информацию о роли питания, в этиологии РТК можно представить себе такую последовательность событии:
Повышенное потребление животных жиров и белков влияет на композицию кишечной флоры,
последняя интенсивно разрушает стероиды, желчные кислоты, образуя при этом канцерогенные или коканцерогенные соединения
рафинированные углеводы создают лучшие условия для контактов канцерогенных агентов со слизистой кишка, замедляя пассаж кала.
Значение повышенного чаепития в увеличении или уменьшении заболеваемости РТК не доказано. Имеются данные об увеличении РТК у лиц, подвергнутых в прошлом холецистэктомии.
Синхронный рак.
Частота встречаемости синхронных раков толстой кишки варьирует от 1,5до8%. Их выявление обозначилось более четко после широкого внедрения колоноскопии. Полипы встречаются у больных РТК в 12-60% случаев, а у больных с синхронным РТК в 57-86%. Чаще синхронный рак возникает в том же сегменте кишки, что и первичная опухоль. Однако, после внедрения колоноскопии синхронные раки стали чаще обнаруживаться и в других частях кишечника (не там где была первичная опухоль).
Источник