Распознавание антигена наивными лимфоцитами

Оглавление темы “Селезенка. Лимфатические узлы. Стадии иммунного ответа. Формы иммунного ответа. Воспаление. Механизмы, контролирующие иммунную систему.”:
1. Селезенка. Функции селезенки. Лимфатические узлы. Функции лимфатических узлов.
2. Мукозно-ассоциированная лимфоидная ткань. Лимфоидная ткань слизистых оболочек.
3. Стадии иммунного ответа. Формы иммунного ответа. Воспаление. Ранний защитный воспалительный ответ.
4. Представление антигена. Распознавание антигена. Взаимодействие Т-хелперов ( Тh1 ) с антигенпредставляющими клетками.
5. Активация Т- и В-лимфоцитов в иммунном ответе. Активация лимфоцитов. Формы специфического иммунного ответа.
6. Клеточный иммунный ответ. Гуморальный иммунный ответ. Защитные функции иммуноглобулинов ( антител ).
7. Иммуноглобулин G ( IgG ). Иммуноглобулин М ( IgM ). Функции иммуноглобулинов G и М.
8. Иммуноглобулин A ( IgA ). иммуноглобулин Е ( IgE ). Функции иммуноглобулинов А и Е.
9. Формы специфического иммунного ответа. Иммунологическая память как вид имунного ответа.
10. Иммунологическая толерантность. Механизмы, контролирующие иммунную систему. Гормональный контроль имумнной системы.
11. Цитокиновый контроль имунной системы. Местное действие цитокинов. Механизм действия цитокинов на иммунитет.
Представление антигена. Распознавание антигена. Взаимодействие Т-хелперов ( Тh1 ) с антигенпредставляющими клетками.
В случае неэффективности раннего защитного ответа и факторов врожденного иммунитета в организме накапливаются микроорганизмы, содержащие чужеродные антигены. Контакт этих антигенов с клетками иммунной системы приводит к развитию специфического иммунного ответа, который начинается с этапа представления и распознавания антигена.
Растворимые антигены в нативной форме связываются антителами и антигенраспознающими иммуноглобулиновыми рецепторами В-клеток.
Т-лимфоциты своими антигенраспознающими Т-клеточными рецепторами связывают короткие пептидные фрагменты белковых антигенов в комплексах с собственными молекулами главного комплекса гистосовместимости I или II классов на мембранах антигенпредставляющих клеток.
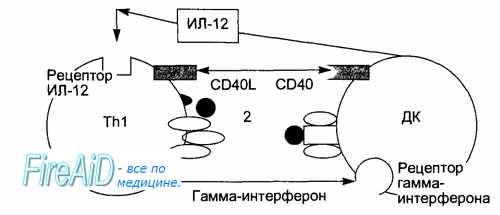
Рис. 8.8. Взаимодействие Т-хелперов (Тh1) с антигенпредставляющими дендритными клетками (ДК) опосредовано цитокинами (ИЛ-12, гамма-интерферон) и кости-мулирующими молекулами (CD40, CD40L).
В центре «иммунологического синапса» находятся: Т-клеточный антиген распознающий рецептор (1) и распознаваемый им комплекс антигенного пептида с молекулой главного комплекса гистосовместимости (2).
Молекулы главного комплекса гистосовместимости на поверхности лейкоцитов человека, получили название «человеческие лейкоцитарные антигены» (Human Leukocyte Antigens — HLA). Молекулы главного комплекса гистосовместимости I класса присутствуют на поверхности всех типов клеток, кроме эритроцитов и клеток трофобласта. Молекулы главного комплекса гистосовместимости II класса находятся на поверхности антигенпредставляющих клеток: дендритных клеток, макрофагов, В-лимфоцитов.
Антигенпредставляющие клетки играют важную роль на начальном (пусковом) этапе специфического иммунного ответа:
1) макрофаги, как правило, представляют антигены бактериального происхождения — продукты захвата и внутриклеточной переработки ими бактерий,
2) В-лимфоциты представляют микробные антигены, антигены токсинов, связанные их поверхностными иммуноглобулиновыми рецепторами,
3) наиболее универсальными антигенпредставляющими клетками являются дендритные клетки, которые необходимы для запуска первичного иммунного ответа, представляют многие, в том числе опухолевые, антигены.
После захвата чужеродного белка — антигена этими клетками и его разложения до коротких пептидов внутри клеток происходит комплексирова-ние отдельных молекул главного комплекса гистосовместимости с конкретными пептидами. Такие комплексы транспортируются на поверхность антигенпредставляющих клеток (рис. 8.8).
При встрече антигенпредставляющей клетки с Т-лимфоцитом, несущим на своей поверхности подходящий по структуре антигенраспознающий рецептор, замыкается лиганд-рецепторная связь, т. е. происходит распознавание антигена.
CD4+ T-лимфоциты способны распознавать антигенные пептиды в комплексах с собственными молекулами главного комплекса гистосовместимости II класса, a CD8+ Т-лимфоциты — в комплексах с собственными молекулами главного комплекса гистосовместимости I класса. Связывание антигена Т-клеточным рецептором служит сигналом усиления пролиферации данного Т-лимфоцита с последующей ускоренной дифференцировкой и активацией его клеток-потомков. В результате формируется клон Т-лим-фоцитов, способных при встрече с тем же антигеном быстро активироваться для участия в удалении патогенного агента.
– Также рекомендуем “Активация Т- и В-лимфоцитов в иммунном ответе. Активация лимфоцитов. Формы специфического иммунного ответа.”
Источник
Для реализации иммунного ответа необходимы три типа клеток – макрофаг (или дендритная клетка), Т-лимфоцит и В-лимфоцит (трехклеточная система кооперации).
Основными стадиями иммунного ответа являются:
1. Поглощение антигена, его переработка и презентация лимфоцитам;
2. Распознавание антигена лимфоцитами;
3. Активация лимфоцитов;
4. Клональная пролиферация лимфоцитов;
5. Дифференцировка лимфоцитов в функционально зрелые клетки;
6. Деструкция антигена.
Стадия поглощения, переработки и презентации антигена. Антигенпрезентирующая клетка (АПК – макрофаг или дендритная клетка) фагоцитирует встреченный антиген и уходит в циркуляцию, направляясь в периферические лимфоидные органы. По пути туда фагоцит разрушает (процессирует) антиген до пептидов с помощью внутриклеточных ферментов. В результате происходит высвобождение антигенной детерминанты. Затем процессированный антиген связывается с молекулами главного комплекса гистосовместимости (с HLA-молекулами) и транспортируется на поверхность АПК для представления его лимфоцитам. Соединение антигена с HLA-молекулами является необходимым условием для распознавания антигена, поскольку лимфоциты узнают антиген на поверхности АПК только на фоне «своего» HLA-антигена (так называемое двойное распознавание). В случае гуморального иммунного ответа антиген соединяется с HLA-молекулами 2-го класса, в случае клеточного ответа – с HLA-молекулами 1-го класса.
В лимфоузле АПК представляет расщепленный антиген лимфоцитам, при этом происходит взаимодействие между мембранными молекулами лимфоцита и АПК. В этом взаимодействии участвуют наивные CD4+-лимфоциты, которые распознают антиген и дифференцируются в Т-хелперы 1-го или 2-го типа и дальше развивается тот или иной вид иммунного ответа – соответственно клеточный или гуморальный.
Гуморальный иммунный ответ
Стадия распознавания. Распознавание антигена, представленного на мембране АПК, может осуществляться В-лимфоцитом 2 способами: с участием Т-хелпера 2-го типа и без него. Первый способ реализуется в отношении Т-зависимых антигенов (например, внеклеточных вирусов), второй – в отношении Т-независимых антигенов (например, бактерий). При этом В-лимфоцит и Т-хелпер распознают разные части антигена: В-лимфоцит – информационную часть, Т-хелпер – несущую. В-лимфоцит распознает антиген с помощью антигенраспознающего В-клеточного рецептора (BCR), который представлен поверхностными IgM и -D, ассоциированными с CD- молекулами (19, 21, 79 и 81). Распознавание антигена Т-хелпером осуществляется с помощью Т-клеточного рецептора (TCR), ассоциированного с корецептором CD4.
Стадия активации. Т-хелпер 2-го типа, получивший антигенную информацию, передает её В-лимфоциту (с помощью антигенного мостика или путем секреции растворимой части антигена в комплексе с HLA-2-молекулой). Вместе с информацией об антигене В-лимфоцит получает неспецифические сигналы активации через цитокины: через ИЛ-1, секретируемый АПК (в частности макрофагом), и через цитокины, секретируемые активированным Т-хелпером 2-го типа. При этом активация Т-хелпера и секреция им цитокинов также обусловливаются макрофагальным ИЛ-1.
Стадия клональной пролиферации. После распознавания антигена и активации В-лимфоциты начинают пролиферировать. Размножение В-клеток осуществляется в лимфатических узлах и регулируется цитокинами, которые выделяет Т-хелпер 2-го типа.
Стадия дифференцировки. За пролиферацией следует созревание В-клеток в плазматические клетки, которые мигрируют в костный мозг и слизистые оболочки, где синтезируют антитела, поступающие в кровь (это IgM и G) или в слизистые секреты (это IgА). Часть активированных В-лимфоцитов не дифференцируется в плазматические клетки, а сохраняется как долгоживущие В-клетки памяти. Они обеспечивают более быстрый и эффективный вторичный иммунный ответ при повторном контакте с антигеном.
Клеточный иммунный ответ реализуется похожим образом.
Цитотоксические Т-лимфоциты или ТГЗТ-лимфоциты (клетки воспаления) распознают антиген на поверхности АПК (макрофага или дендритной клетки) в комплексе с HLA-молекулами 1-го класса. В распознавании участвуют Т-хелперы 1-го типа. Распознавание антигена цитотоксическими либо ТГЗТ-лимфоцитами осуществляется с помощью Т-клеточного рецептора – TCR. На цитотоксических Т-лимфоцитах TCR ассоциирован с корецептором CD8, на ТГЗТ-лимфоцитах – с корецептором СD4. Т-хелперы 1-го типа с помощью выделяемых ими цитокинов стимулируют пролиферацию и созревание цитотоксических или ТГЗТ-лимфоцитов в зрелые эффекторные клетки. Пролиферация и созревание Т-клеток протекают в лимфатических узлах и селезенке. Клоны цитотоксических CD8+-лимфоцитов нарастают быстро, клоны CD4+-ТГЗТ-лимфоцитов – медленно. Часть Т-клеток превращается в Т-клетки памяти с фенотипом CD4+ и CD8+.
Конечной стадией как гуморального, так и клеточного иммунного ответа является деструкция антигена, которая осуществляется с привлечением неспецифических факторов защиты. Известны следующие эффекторные механизмы деструкции антигена:
1. Комплементзависимый лизис антигена, связанного с антителом;
2. Фагоцитоз макрофагами растворимых комплексов антиген+антитело и расщепление их в лизосомах;
3. Цитолиз. Цитотоксические Т-лимфоциты лизируют клетки-мишени с помощью белков – перфоринов, образующих поры в клеточной мембране, либо запускают апоптоз клеток-мишеней.
4. Антителозависимая клеточная цитотоксичность (АЗКЦ). Реализуется путем разрушения клетками-киллерами покрытых антителами клеток-мишеней через присоединение к Fc-фрагменту антитела. Такими АЗКЦ-киллерами могут быть НК-клетки, моноциты/макрофаги, гранулоциты;
5. ТГЗТ-лимфоциты с помощью секретируемых цитокинов вызывают миграцию макрофагов и нейтрофилов в очаг иммунного воспаления и их активацию. Активированные макрофаги и нейтрофилы разрушают клетки-мишени путем фагоцитоза.
Источник
Глава 1. ОСНОВНЫЕ ПОЛОЖЕНИЯ
Иммунитет – особое биологическое свойство многоклеточных организмов, направленное на защиту от генетически чужеродных факторов: микроорганизмов (бактерий, вирусов, простейших, грибов), инородных молекул и др. Иммунитет также обеспечивает невосприимчивость организма к инфекции при повторной встрече с патогеном. В медицинском смысле этот термин употребляли ещё до нашей эры в значениях: неприкосновенный, чистый, не затронутый заболеванием, невредимый, находящийся под хорошей защитой, устойчивый к заразной болезни.
Совокупность органных, тканевых, клеточных и молекулярных компонентов, функцией которых является осуществление иммунной защиты, называется иммунной системой. Иммунология – наука о строении и функциях иммунной системы как в норме, так и при различных патологических состояниях, в том числе и при нарушениях самой иммунной системы – иммунопатологиях.
Иммунную защиту обеспечивают два механизма: врождённый и адаптивный.
Врождённый иммунитет является присущей каждому организму с рождения, генетически закреплённой способностью противостоять инфекции. Это передовая линия обороны организма против патогенов, пытающихся проникнуть или уже проникших в покровные ткани или внутреннюю среду. Врождённый иммунитет срабатывает мгновенно или в течение первых нескольких часов после контакта с патогеном (возбудители, выделяемые ими токсины и другие чужеродные молекулы). Он включает четыре основных уровня защиты: анатомический, физиологический, фагоцитарный и воспалительный – покровные ткани, фагоциты, микробоцидные гуморальные вещества (протеазы, сильные окислители и свободные радикалы, продуцируемые фагоцитами, эндогенные противомикробные пептиды и др.), сосудистые реакции. Первичные рецепторы врождённого иммунитета – это молекулы многоклеточных, позволяющие «считывать» эволюционную память – информацию о том, чем отличаются микроорганизмы от собственных клеток.
Эти рецепторы способны распознавать консервативные молекулярные структуры – РАМР (Pathogen-Associated Molecular Patterns), характерные для групп сходных микроорганизмов. В настоящее время постоянно открывают новые патогенраспознающие рецепторы врождённого иммунитета. К ним относят мембраносвязанные паттернраспознающие рецепторы (Pattern Recognition Receptors, PRR), а также растворимые рецепторы – ряд белков сыворотки крови: C-реактивный белок (СРБ), маннозосвязывающий лектин (MBL – Mannose-Binding Lectin), компоненты комплемента.
Собственные возможности клеток врождённого иммунитета санировать организм от проникшего патогена часто недостаточны. Множество патогенов приспособилось выживать в присутствии факторов врождённой резистентности к инфекциям. Именно поэтому в процессе эволюции, начиная с челюстных рыб, к врождённому иммунитету добавился адаптивный иммунитет – специфический. Материальные носители адаптивного иммунитета – лимфоциты. Уникальное и отличительное свойство лимфоцитов как множества клеток – способность распознавать почти неограниченное (1018) разнообразие молекулярных объектов – антигенов. Лимфоциты характеризуются экспрессией Т-клеточных (TCR) или В-клеточных (BCR) рецепторов, распознающих только одну антигенную детерминанту либо небольшое число структурно очень близких детерминант, и поэтому, в отличие от PRR, обладающих высокой специфичностью (рис. 1-1).
Адаптивный (приобретённый) иммунитет формируется в течение жизни индивидуума. Активно приобретённый иммунитет – состояние невосприимчивости к инфекции после перенесённого инфекционного заболевания или после вакцинации (сам организм вырабатывает соответствующие антитела). Пассивно приобретённый иммунитет – состояние невосприимчивости к инфекции в результате поступления в организм уже готовых антител от матери или в результате инъекции (сам организм эти антитела не вырабатывает).
ИММУННЫЙ ОТВЕТ
Врождённая и адаптивная системы защиты организма включают клеточный и гуморальный компоненты и активно взаимодействуют друг с другом в процессе иммунного ответа. Иммунный ответ – многоэтапный процесс, заключающийся в распознавании и деструкции патогена и повреждённых им тканей. В его основе лежит уникальное свойство иммун-

Рис. 1-1. Сравнение врождённого и адаптивного иммунитета
ной системы отличать «свое» («sef») от «чужого» («nonself») и применять по отношению к «чужому» механизмы нейтрализации и уничтожения, а именно – иммунные реакции. Распознавание множества чужеродных антигенов происходит благодаря наличию в организме огромного разнообразия образующихся в тимусе клонов T-лимфоцитов (отбор клонов) и при помощи комплекса генов главного комплекса гистосовместимости (MHC) классов I и II. Нейтрализацию «чужого» осуществляют цирку-
лирующие в жидкостях организма антитела (гуморальный иммунитет) и цитотоксические лимфоциты (клеточный иммунитет).
Таким образом, основными характеристиками адаптивного иммунного ответа являются умение различать собственные антигены от чужеродных, специфичность и иммунная память.
• Различение «своего» и «чужого» выражается в дифференциации компонентов собственных тканей организма и чужеродных молекул. Специфическую неотвечаемость организма на собственные антигены обозначают как иммунную толерантность. Если же организм воспринимает собственные компоненты как чужеродные, развивается аутоиммунный ответ.
• Специфичность иммунного ответа проявляется в том, что иммунитет, сформировавшийся в результате контакта с определённым антигеном, будет обеспечивать защиту только против этого антигена.
• Иммунная память формируется в результате адаптивного иммунного ответа против конкретного возбудителя и сохраняется, как правило, в течение всей последующей жизни организма, защищая его от повторной инфекции, вызываемой этим же возбудителем. Такой механизм обеспечивается способностью иммунной системы к «запоминанию» антигенных детерминант патогена за счёт образования клеток иммунной памяти. Наличие иммунной памяти обусловливает развитие ускоренного и усиленного ответа (вторичный иммунный ответ) при повторном контакте с антигеном. Формирование иммунной памяти является основной целью вакцинации, т.е. процесса естественного или искусственного формирования иммунной защиты против определённой инфекции.
Схема развития иммунного ответа представлена на рис. 1-2. Содержание отдельных этапов иммунного ответа раскрыто ниже.
• Воспаление: участвуют клетки, поглощающие антигены (фагоциты, антигенпрезентирующие клетки) – в частности, дендритные клетки (ДК), макрофаги, эндотелиальные и другие клетки. Выделяются провоспалительные цитокины и хемокины.
• Переработка антигена (процессинг). После поглощения антигена антигенпрезентирующей клеткой (АПК) происходит его процессинг (расщепление и встраивание в молекулы MHC) и презентация на поверхности клетки. Это необходимо для распознавания антигена Т-лимфоцитами.
• Распознавание антигена происходит в периферических лимфоидных органах. Начало специфического иммунного ответа – про-

Рис. 1-2. Основные этапы иммунного ответа
лиферация и дифференцировка эффекторных и регуляторных лимфоцитов.
• Деструкция антигена и повреждённых патогеном тканей. При этом одни лимфоциты (помощники – хелперы) «нанимают» для выполнения эффекторных функций другие лимфоциты (эффекторные) и/или воспалительные лейкоциты (нейтрофилы, моноциты, базофилы, эозинофилы), тучные клетки, а также гуморальные литические системы типа комплемента.
• Выведение продуктов распада происходит с участием известных систем выделения.
КЛЕТКИ ИММУННОЙ СИСТЕМЫ
Клетки иммунной системы условно подразделяют на клетки врождённого и адаптивного иммунитета (рис. 1-3). Главным их различием является специфичность распознавания: низкая у первых и высокая у вторых. Существует и третья группа клеток – промежуточная, несущая черты обеих групп. Наличие этой группы показывает единство происхождения и способов защиты организма от чужеродных веществ антигенной природы.

Рис. 1-3. Клетки иммунной системы
В выполнении эффекторных иммунных функций очень важную роль играют АПК, T- и B-лимфоциты и NK-клетки (от англ. Natural Killer – естественный киллер, натуральный киллер).
• Антигенпрезентирующие клетки (АПК). К АПК относят макрофаги, дендритные клетки (включая клетки Лангерганса эпидермиса, М-клетки лимфатических фолликулов пищеварительного тракта и других слизистых оболочек, дендритные эпителиальные клетки тимуса), а также B-лимфоциты. АПК захватывают антиген, обрабатывают его (процессируют) и презентируют антигенные фрагменты на своей поверхности T-лимфоцитам (рис. 1-4).
• T-лимфоциты обусловливают клеточный иммунный ответ, а также помогают отвечать на антиген B-лимфоцитам при гуморальном иммунном ответе. Каждый T-лимфоцит несет на своей поверхности рецептор T-лимфоцитов (TCR – T-Cell Receptor) (см. рис. 5-1, в и рис. 6-1) строго одной специфичности, т.е. взаимодействующий с одним антигеном. T-клетки по экспрессии маркёрных антигенов CD (Cluster Differentiation) подразделяют на CD4+ и CD8+.
– CD4+ Т-лимфоциты (хелперы). Среди T-клеток, экспрессирующих мембранные маркёры CD4, выделяют Т-лимфоциты с эффекторными функциями (Th1, Th2, Th17) и Т-регуляторные клетки (естественные – Treg и индуцированные – Th3, или Tr1).

Рис. 1-4. Взаимодействие клеток в ходе гуморального иммунного ответа. Рецептор T-хелпера (TCR) распознаёт антигенную детерминанту (эпитоп), экспрессированную на поверхности антигенпрезентирующей клетки вместе с молекулой главного комплекса гистосовместимости класса II (MHC-II). Во взаимодействии участвует маркёрная молекула T-хелпера – CD4. В результате подобного взаимодействия антигенпрезентирующая клетка секретирует интерлейкин-1 (ИЛ-1), стимулирующий в T-хелпере синтез и секрецию цитокинов, включая ИЛ-2, а также синтез и перенос на плазматическую мембрану T-хелпера рецепторов для ИЛ-2 (ИЛ-2 также стимулирует пролиферацию T-хелперов). Отбор B-лимфоцитов происходит при взаимодействии антигена с вариабельными участками антител (иммуноглобулинов) на поверхности этих клеток (правая часть рисунка). Эпитоп этого антигена в комплексе с молекулой MHC-II распознаёт рецептор T-хелпера, после чего T-лимфоцит секретирует цитокины, стимулирующие пролиферацию B-лимфоцитов и их дифференцировку в плазматические клетки, синтезирующие антитела к данному антигену. Также показаны некоторые мембранные белки (CD40/CD40L и CD28/B7), участвующие в проведении костимуляторных сигналов, необходимых для полноценной активации взаимодействующих клеток (они описаны подробнее в главе 7)
◊ T-хелперы при взаимодействии с АПК специфически распознают антигены и начинают вырабатывать определённый набор цитокинов соответственно типу инфекционного агента: Th2 при взаимодействии с B-клетками индуцируют гуморальный иммунный ответ (см. рис. 1-4), а Th1 – при взаимодействии с макрофагами и цитотоксическими Т-лимфоцитами (ЦТЛ) – клеточный иммунный ответ. Th17 продуцируют ИЛ17 – мощный индуктор тканевого воспаления, привлекающий и активирующий гранулоциты и макрофаги.
◊ Регуляторные T-клетки (Т-регуляторы) контролируют интенсивность иммунного ответа, подавляя активность других субпопуляций Т-лимфоцитов.
– CD8+ Т-лимфоциты. Субпопуляция T-клеток, экспрессирующих мембранные молекулы CD8. Эти клетки выступают в роли ЦТЛ. Они лизируют клетки-мишени, несущие чужеродные или видоизменённые собственные антигены – аутоантигены: например, клетки опухоли, трансплантата, инфицированные вирусом клетки, несущие поверхностные вирусные антигены. Эффекторные функции ЦТЛ реализуются через индукцию образования в клетках-мишенях пор (под действием особых белков – перфоринов) и секрецию в поры специализированных сериновых протеаз – гранзимов. Вызванное этим нарушение осмотического баланса с внеклеточной средой приводит к гибели клетки (рис. 1-5). Под влиянием гранзимов индуцируются процессы запрограммированной гибели клетки – апоптоза.
• Т-клетки памяти – долгоживущие рециркулирующие малые лимфоциты, формируемые при первичном иммунном ответе. Они «запоминают» особенности детерминант антигенов и при повторном распознавании того же антигена развивают быстрый и усиленный ответ. Т-клетки памяти отличаются от наивных и эффекторных Т-лимфоцитов высоким уровнем экспрессии мембранных маркёров активации, меньшей потребностью в провоспалительных медиаторах и корецепторных сигналах для развития вторичного иммунного ответа.
• B-лимфоциты отвечают за гуморальный иммунный ответ. На мембране B-лимфоцитов присутствует рецептор для антигена – мономер IgM. Продолжительность жизни большинства B-лимфоцитов (если они не активируются антигеном!) не превышает 10 сут.

Рис. 1-5. Уничтожение клетки-мишени цитотоксическим T-лимфоцитом (Т-киллером). При сближении цитотоксического T-лимфоцита с клеткоймишенью после специфичного взаимодействия мембранных молекул клетокпартнёров T-лимфоцит убивает клетку-мишень
– Эффекторные B-лимфоциты. Активированные B-лимфоциты размножаются и дифференцируются в плазматические клетки (см. рис. 5-9), вырабатывающие антитела (иммуноглобулины, специфичные к конкретному антигену). При этом плазматические клетки теряют экспрессию специфических рецепторов для антигена.
– B-лимфоциты иммунной памяти – долгоживущие рециркулирующие малые лимфоциты. Они не превращаются в плазматические клетки, но сохраняют иммунную «память» об антигене, с которым когда-то контактировали, за счёт продолжающейся экспрессии рецептора для антигена. Клетки памяти активируются
при повторном распознавании того же антигена. В этом случае B-лимфоциты памяти, при обязательном участии T-хелперов и ряда других факторов, превращаются в плазматические клетки, обеспечивая быстрый синтез большого количества специфичных антител, взаимодействующих с чужеродным антигеном, и развитие эффективного иммунного ответа. • NK-клетки (от англ. Natural Killer – естественный киллер) – лимфоциты, лишённые характерных для T- и B-клеток поверхностных CD-маркёров, а также антигенраспознающих рецепторов – TCR (T Cell Receptor) или BCR (B Cell Receptor). Эти клетки играют важную роль в механизмах врождённого иммунитета (см. главу 3), уничтожают трансформированные, инфицированные вирусами и чужеродные клетки.
Источник