Предшественники т лимфоцитов это
Т-лимфоциты несут на себе поражающее воображение разнообразие рецепторов, позволяющее распознавать практически любые чужеродные субстанции, с которыми может столкнуться организм. Путь от гемопоэтической стволовой клетки к 107–109 клонов Т-лимфоцитов с уникальными антиген-связывающими последовательностями — удивительное достижение эволюции. Многостадийное развития Т-лимфоцитов может выглядеть пугающим и запутывающим со страниц учебников. Однако, если вы дадите ему второй шанс, вы увидите, что это красивый и слаженный процесс.
Как и остальные клетки крови, Т-лимфоциты берут свое начало в костном мозге от гемопоэтической стволовой клетки. Такие клетки-предшественницы имеют мало общего со зрелыми функциональными Т-лимфоцитами: они не имеют антигенных рецепторов (TCR) и не умеют узнавать чужеродные антигены. Их ждет сложный путь развития, который осилят немногие, однако те, которые выживут, создадут армию, готовую к любой угрозе. Для развития Т-лимфоцитов в нашем теле формируется специальный орган — тимус. Создав достаточный репертуар рецепторов, тимус подвергается инволюции и практически не детектируется после пубертатного периода. Численность Т-лимфоцитов во взрослом организме в основном поддерживается делением зрелых клеток.
Для миграции в тимус клетки, чья судьба — стать Т-лимфоцитом, используют хемокиновый рецептор CCR9, лиганд для которого — CCL25 — секретируют клетки тимуса. Достигнув тимуса, предшественники Т-лимфоцитов становятся тимоцитами. Первым делом они получают сигнал от эпителиальных клеток тимуса через рецептор Notch-1, который окончательно определяет их судьбу в пользу Т-лимфоцита.
Следующая задача тимоцитов — активная пролиферация. Скорость деления тимоцитов крайне высока, поскольку 95 %–98 % этих клеток погибает. Дело в том, что судьба развивающегося Т-лимфоцита по умолчанию — апоптоз, спасти от которого его может только успешное прохождение нескольких раундов отбора. Сигнал для первого раунда деления — интерлейкин 7, который выделяют эпителиальные и другие клетки тимуса. Мутации в гене ИЛ-7 или его рецептора приводят к тяжелым иммунодефицитам. Пролиферация приводит к созданию большого пула клеток, которые называют дважды негативными клетками, поскольку они не несут на себе корецепторы CD4 и CD8. Большинство из них (90 %) дадут начало αβ Т-лимфоцитам, а 10 % — γδ Т-лимфоцитам.
После этого тимоциты приступают к перестройке генов антигенных рецепторов. Это тот самый момент, когда из небольшого количества генов возникает всё разнообразие антигенных рецепторов — миллионы и миллиарды. В ходе этого процесса участки генов антигенных рецепторов перестраиваются случайным образом. Ключевое слово здесь — случайный, поскольку процесс формирования рецепторов, способных эффективно распознавать чужеродные антигены, никак не зависит от этих антигенов и происходит задолго до встречи с ними!
До сих пор тимоциты содержали гены TCR в зародышевой конфигурации, т. е. не подвергшиеся перестройке. Такие гены не могут образовать TCR. Тимоциты начинают с перестройки генов одной из двух цепей TCR — β-цепи. После этого тимоциты проходят через первую контрольную точку. В случае успешной перестройки клетка экспрессирует β-цепь, которая вместе с инвариантной α-цепью формирует на поверхности клетки pre-TCR. Такой рецептор активируется без участия лиганда и передает в клетку сигналы для дальнейшего развития. Остальные клетки не проходят отбор: в случае неудачной перестройки pre-TCR не экпрессируется и клетка подвергается апоптозу в отсутствие сигналов к выживанию.
Активация pre-TCR поставляет в клетку важные сигналы для дальнейшего развития:
- Останавливается перестройка локуса β-цепи во втором аллеле. Это называется аллельное исключение — зрелые Т-лимфоциты экспрессируют β-цепь TCR только с одного аллеля.
- Начинается экспрессия двух ко-рецепторов CD4 и CD8, теперь тимоциты называются дважды позитивными.
- Начинается второй раунд пролиферации. Через pre-TCR клетки получают мощный сигнал к делению, приводящий к еще более интенсивной экспансии, чем в первом раунде.
- После этапа деления запускается перестройка α-цепи рецептора.
В отличие от цепи-партнера, α-цепь может подвергаться многократной перестройке, и большинство тимоцитов успешно с ней справятся. После перестройки α-цепи тимоциты наконец экспрессируют на своей поверхности полный αβ TCR. Однако впереди главная проверка, пройти которую суждено немногим.
Задачи последнего этапа отбора:
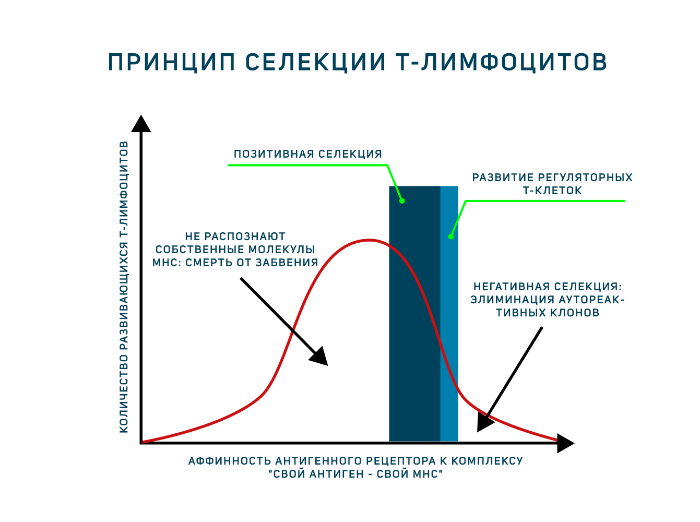
- Отобрать клетки, распознающие молекулы главного комплекса гистосовместимости (MHC) организма. Этот этап присутствует в развитии тимоцитов, поскольку зрелые Т-лимфоциты способны распознавать антигены только в составе МНС. Поэтому они должны знать МНС своего организма в лицо. Это называется позитивная селекция.
- Элиминировать клетки, распознающие собственные антигены. Это называется негативная селекция.
Однако антигенпрезентирующие клетки тимуса (эпителиальные клетки тимуса, дендритные клетки и макрофаги) располагают только комплексами «свой МНС — свой антиген». И позитивная, и негативная селекция осуществляется на основании взаимодействия TCR с такими комплексами! Для объяснения была предложена гипотеза аффинности. Тимоциты, чьи антигенные рецепторы проявят низкую аффинность к таким комплексам, продолжат развитие. Тимоциты, чьи рецепторы свяжутся с представленными антиген-МНС комплексами прочно, подвергнутся апоптозу как аутореактивные клоны (клональная делеция). Клетки, не распознающие МНС вовсе, т. е. не прошедшие позитивную селекцию, умрут особым способом, который называется смерть от забвения (death by neglect). Ещё один вариант развития — среднее связывание рецептора с антигенным комплексом, такие тимоциты могут дать начало регуляторным Т-клеткам. Таким образом, регуляторные Т-клетки — единственные лимфоциты, которые взаимодействуют со своим будущим антигеном в процессе развития! Развитию этого подтипа Т-лимфоцитов сейчас посвящено много исследований.

Особую роль в негативной селекции играет белок AIRE (аутоиммунный регулятор), который заставляет клетки тимуса экспрессировать в небольших количествах антигены, в норме присутствующие только в определенных тканях. Это позволяет сформировать толерантность к тканеспецифичным антигенам, встречающимся только за пределами тимуса. Мутация в белке AIRE приводит к развитию аутоиммунного полиэндокринного синдрома. AIRE содержится в эпителиальных клетках медуллы. При этом известно, что наиболее эффективно негативная селекция осуществляется при презентации антигена дендритными клетками и макрофагами, а не стромой тимуса. В новом исследовании был показан перенос антигенов из эпителиальных клеток тимуса в дендритные клетки, которые их и презентируют!
Одновременно с позитивной и негативной селекцией осуществляется проверка, соответствует ли корецептор распознаваемому классу МНС — т. е. происходит дифференцировка в функциональные подклассы. Выживают только клетки с правильной комбинацией: CD8 + MHC I — цитотоксические Т-лимфоциты и CD4 + MHC II — Т-хелперы.
Последнее, что должен сделать лимфоцит перед тем, как покинуть тимус — это изменить тип сигналинга через антигенный рецептор. Если незрелые Т-лимфоциты с высоким родством к антигену погибают, то зрелые — активируются (молекулярные основы такой принципиальной разницы не ясны). Теперь лимфоциты готовы заселить периферические лимфоидные органы и нести оборону. Зрелые Т-лимфоциты покидают тимус, используя градиент сфингозин-1-фосфата, — липида, присутствующего в высоких концентрациях в крови и лимфе, для хемотаксиса в кровяное русло. Для хоуминга во вторичные лимфоидные ткани они используют CD62L (L-селектин).
γδ Т-лимфоциты несут менее разнообразные антигенные рецепторы, по-видимому, не зависящие от МНС. Они не экспрессируют корецепторы CD4, CD8. γδ Т-лимфоциты выступают в роли первой линии обороны против часто встречающихся бактерий в эпителиальных и слизистых тканях и скорее относятся ко врожденной иммунной системе, чем к адаптивной.
Источники:
- Kenneth Murphy, Casey Weaver. Janeway’s Immunobiology 9th edition. Garland Science, 2017.
- Abul Abbas, Andrew H. Lichtman, Shiv Pillai. Cellular and Molecular Immunology 9th Edition. Elsevier, 2017.
- Perry J. S. et al. CD36 Mediates Cell-Surface Antigens to Promote Thymic Development of the Regulatory T Cell Receptor Repertoire and Allo-tolerance //Immunity. – 2018. – 923-936.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
Т-клетки это фактически приобретенный иммунитет, способный защитить от цитотоксического повреждающего воздействия на организм. Чужеродные клетки-агрессоры, попадая в организм вносят “хаос”, который внешне проявляется в симптомах заболеваний.
Клетки-агрессоры повреждают по ходу своей деятельности в организме все, что могут, действуя в своих интересах. А задача иммунной системы найти и уничтожить все чуждые элементы.
Специфическая защита организма от биологической агрессии (чужеродных молекул, клеток, токсинов, бактерий, вирусов, грибов и т.д.) осуществляется при помощи двух механизмов:
- продуцирования специфических антител в ответ на чужеродные антигены (потенциально опасных для организма веществ);
- выработки клеточных факторов приобретённого иммунитета (Т-клетки).
Как осуществляются иммунные реакции
При попадании в организм человека «клетки-агрессора», иммунная система распознаёт чужеродные и собственные измененные макромолекулы (антигены) и удаляет их из организма. Также при первичном контакте с новыми антигенами происходит их запоминание, что способствует их более быстрому удалению, в случае вторичного попадания в организм.
Процесс запоминания (презентация) происходит благодаря антиген-распознающим рецепторам клеток и работе антиген представляющих молекул (МНС молекул- комплексов гистосовместимости).
Что такое Т-клетки иммунной системы, и какие функции они выполняют
Функционирование иммунной системы обуславливается работой лимфоцитов. Это клетки иммунной системы, являющиеся
разновидностью лейкоцитов и способствующие формированию приобретённого иммунитета. Среди них выделяют:
- В-клетки (распознающие «агрессора» и вырабатывающие к нему антитела);
- Т-клетки (выполняющие функцию регулятора клеточного иммунитета);
- NК- клетки (разрушающие отмеченные антителами чужеродные структуры).
Однако, помимо регуляции иммунного ответа, Т-лимфоциты способны выполнять эффекторную функцию, разрушая опухолевые, мутировавшие и чужеродные клетки, участвовать в формировании иммунологической памяти, распознавать антигены и индуцировать иммунные реакции.
Справочно. Важной особенностью T-клеток является их способность реагировать только на презентированные антигены. На одном T-лимфоците находится только один рецептор к одному конкретному антигену. Это обеспечивает отсутствие реакции T-клеток на собственные аутоантигены организма.
Разнообразие функций Т-лимфоцитов обусловлено наличием в них субпопуляций, представленных Т-хелперами, Т-киллерами и Т-супрессорами.
Субпопуляция клеток, их стадия дифференцирования (развития), степень зрелости и т.д. определяется при помощи специальных кластеров дифференцировки, обозначаемых как СD. Наиболее значимыми являются СD3, СD4 и СD8:
- СD3 находится на всех зрелых T-лимфоцитах, он способствует передаче сигнала от рецептора к цитоплазме. Это важный маркер функционирования лимфоцитов.
- СD8 – это маркер цитотоксических T-клеток.
- СD4 является маркером T-хелперов и рецептором к ВИЧ (вирус иммунодефицита человека)
Т-хелперы
Около половины Т-лимфоцитов имеют антиген CD4, то есть являются Т-хелперами. Это помощники, стимулирующие процесс секреции антител В-лимфоцитами, стимулируют работу моноцитов, тучных клеток и предшественников Т-киллеров к «включению» в иммунную реакцию.
Справочно. Функция хелперов осуществляется за счёт синтеза цитокинов (информационных молекул, регулирующих взаимодействие между клетками).
В зависимости от продуцируемого цитокина, их разделяют на:
- T-хелперные клетки 1-го класса (продуцируют интерлейкин-2 и гамма-интерферон, обеспечивая гуморальный иммунный ответ на вирусы, бактерии, опухоли и трансплантанты).
- T-хелперные клетки 2-го класса (секретируют интерлейкины-4,-5,-10,-13 и отвечают за образование IgЕ, а также иммунного ответа, направленного на внеклеточные бактерии).
Т-хелперы 1-го и 2-го типа всегда взаимодействуют антагонистически, то есть повышенная активность первого типа угнетает функцию второго типа и наоборот.
Работа хелперов обеспечивает взаимодействие между всеми клетками иммунитета, определяя какой тип иммунного ответа будет преобладать (клеточный либо гуморальный).
Важно. Нарушение работы клеток-помощников, а именно недостаточность их функции, наблюдается у больных с приобретённым иммунодефицитом. Т-хелперы являются основной мишенью ВИЧ. В результате их гибели нарушается иммунная реакция организма на стимуляцию антигенов, что приводит к развитию тяжёлых инфекций, росту онкологических новообразований и летальному исходу.
Т-киллеры
Это так называемые T-эффекторы (цитотоксические клетки) или клетки убийцы. Такое название обусловлено их способностью уничтожать клетки-мишени. Осуществляя лизирование (ли́зис (от греч. λύσις — разделение) — растворение клеток и их систем) мишеней, переносящих чужеродный антиген или мутировавший аутоантиген (трансплантанты, опухолевые клетки), они обеспечивают реакции противоопухолевой защиты, трансплантационного и противовирусного иммунитета, а также аутоиммунные реакции.
Т-киллеры при помощи собственных МНС-молекул распознают чужеродный антиген. Связываясь с ним на поверхности клетки, они продуцируют перфорин (цитотоксический белок).
После лизирования клетки «агрессора» Т-киллеры остаются жизнеспособными и продолжают циркулировать в крови, разрушая чужеродные антигены.
Т-киллеры составляют до 25-ти процентов от всех Т-лимфоциотов.
Справочно. Помимо обеспечения реакций нормального иммунного ответа, Т-эффекторы могут участвовать в реакциях антителозависимой клеточной цитотоксичности, способствуя развитию гиперчувствительности второго типа (цитотоксической).
Это может проявляться лекарственными аллергиями и различными аутоиммунными заболеваниями (системные заболевания соединительной ткани, гемолитическая анемия аутоиммунного характера, злокачественная миастения, аутоиммунные тиреоидиты, и т.д.).
Подобным механизмом действия обладают некоторые лекарственные средства, способные запускать процессы некроза опухолевых клеток.
Важно. Препараты с цитотоксическим действием используют в химиотерапии онкологических заболеваний.
Например, к таким медикаментам относится Хлорбутин. Это средство применяют для лечения хронического лимфолейкоза, лимфогранулематоза и рака яичников.
Т-супрессоры и клетки памяти
Супрессоры подавляют функцию хелперов и В-лимфоцитарного звена. Однако современная классификация не выносит супрессоры в отдельную субпопуляцию. Поскольку доказано, что решающую роль в угнетении иммунной реакции играют апоптоз и специфические цитокины.
Помимо основных T-лимфоцитов, в организме человека существуют потомки клеток, контактировавших с антигеном и имеющих к нему рецепторы. Это клетки обеспечивающие иммунологическую память. Они способны в течение от десяти до 15 лет сохранять память об антигене, передавая её другим клеткам.
Справочно. Благодаря клеткам памяти обеспечивается быстрый иммунный ответ при повторном попадании «агрессора» в организм.
Нулевые лимфоциты
К ним относят лимфоциты, не имеющие T и B маркеров. Они составляют до 10% от всей популяции лимфоцитов. К ним относят NК-клетки (естественные киллеры) и K-клетки (киллерные).
Справочно. Основным отличием NK-клеток от T-киллеров является способность уничтожать не сенсибиллизированные клетки-мишени.
K-клетки отвечают за антителозависимую клеточную цитотоксичность. Они отражают взаимодействия гуморального и клеточного звеньев иммунитета, а также выступают в качестве «наводчиков» эффекторных (выполняющих функцию – в данном случае уничтожение) клеток на мишень.
NК- клетки обеспечивают контроль за качеством клеток и участвуют в формировании противовирусного иммунитета, обеспечиваютзащиту от роста опухолей и размножения мутировавших (дефектных) клеток.
Диагностика клеточного иммунитета
Диагностика T- и B-лимфоцитарного звена позволяет оценить состояние клеточного иммунитета. Базовое исследование с определением процентного содержания Т-, В- и нулевых клеток проводится с целью выявления первичных или вторичных иммунодефицитов, а также при контроле иммуностимулирующего лечения.
Исследование основных популяций при помощи маркеров CD3, 8, 19, 16+5б, а также соотношение между хелперами и киллерами, позволяет комплексно оценить иммунный статус. Для исследования используют венозную кровь.
Диагностика проводится при выявлении и контроле течения:
- аутоиммунных заболеваний (увеличено содержание CD3, CD4 хелперов);
- лимфолейкозов (повышено количество Т-лимфоцитов CD3);
- злокачественных новообразований (увеличено количество NK);
- ВИЧ (CD3, CD8);
- хронических инфекций, аллергических реакций, бронхиальной астмы и т.д.
Справочно. В зависимости от результатов анализа пациенту может быть рекомендована консультация иммунолога, гематолога, аллерголога, онколога или инфекциониста. С дальнейшим лечением у профильного специалиста по основному заболеванию.
Источник
Часть лимфоидных стволовых клеток мигрирует в вилочковую
железу (тимус) и созревает там до Т-лимфоцитов; другая их часть остается в
костном мозге и созревает до В-лимфоцитов. На пути созревания (дифференцировки)
в центральных органах иммунитета стволовая клетка проходит несколько этапов.
Эти этапы созревания Т- и В-лимфоцитов происходят без участия антигена и
поэтому получили название антиген независимой дифференцировки.
Первый этап – это появление на стволовой клетке структур, указывающих,
по какому пути дифференцировки (Т- или В-лимфоцитов) пойдет ее развитие; он
происходит еще в костном мозге.
Ранний предшественник В-лимфоцитов имеет на своей мембране так
называемую суррогатную L-цепь молекулы иммуноглобулина, а ранний предшественник
Т-лимфоцитов – гликопротеин с молекулярной массой 3,3*104 D (ГП-33), который
впоследствии ассоциируется с бета-цепью Т-клеточного антигенораспознающего
рецептора.
Указанные структуры, определяющие дальнейшую судьбу
гемопоэтической стволовой клетки, играют важную роль: 1) задают путь
дифференцировки Т- и В-лимфоцитов; 2) передают сигнал ранним предшественникам
Т- и В-лимфоцитов, по которому начинается их пролиферация.
Например, на этапе появления суррогатной L-цепи и ГП-33
таких клеток в костном мозге и тимусе у мышей насчитывается по 3-5*106. Однако
уже через 4 недели их количество увеличивается в 10-100 раз и составляет 5*107
– 108 клеток. Таким образом, наличие суррогатной L-цепи и ГП-33 является тем
инструментом, с помощью которого количество пре-В- и пре-Т-клеток достигает
необходимого уровня.
Второй этап дифференцировки лимфоцитов- это появление
незрелых предшественников В- и Т-лимфоцитов.
Он определяется появлением на мембране В- и Т-лимфоцитов
антигенраспознающих рецепторов, с помощью которых В- и Т-лимфоциты после этого
этапа дифференцировки приобретают способность распознавать антигены.
Для В-лимфоцита антигенраспознающим рецептором (ВАГРР)
является мембранный IgM, а для Т-лимфоцита (ТАГРР) – специальная димерная молекула,
имеющая альфа- и-бетацепи, и относящаяся к супер семейству иммуноглобулинов
(подробно об антигенраспознающих рецеп-торах будет сказано в разделах о Т- и
В-лимфоцитах).
Между I и II этапом есть еще несколько стадий дифференцировки,
о которых здесь не упоминается.Таким образом, появление на поверхности ранних
предшественников лимфоидных клеток определенных структур (рецепторов) служит
тем сигналом, который позволяет клеткам дифференцироваться в специфическую
линию лимфоцитов. Имеющие такие рецепторы клетки-предшественники мигрируют в
определенную область центральных иммунных органов, а затем взаимодействуют со
специфическим микроокружением, необходимым для того, чтобы в этой области
произошла дифференцировка данной клетки. В ответ на контакт с
клеткой-предшественником, в стромальных клетках локального микроокружения в
свою очередь развиваются молекулярные процессы, которые направлены на
“обучение” (коммитирование) клеток-предшественников для дальнейшей их
дифференцировки в отдельно взятую линию.
Показано, что клетки-предшественники в тесном контакте с их
стромальным клеточным ми-кроокружением сохраняют очередную стадию
дифференцировки до тех пор, пока имеется достаточно пространства в соответствующей зоне (компартменте)
центрального органа иммунитета (тимуса или костного мозга), и пока
соответствующий цитокин, ответственный за пролифера-цию и дифференцировку
продуцируется в данной зоне.
Таким образом, отсутствие контакта со стромальными клетками
и потеря сигнала через ци-токиновый рецептор являются теми условиями, при
которых клетка-предшественник переходит к дальнейшей стадии дифференцировки.
Это позволяет ей осуществить новый контакт в следующем, новом месте
микроокружения.
Источник