Популяции в лимфоциты в крови
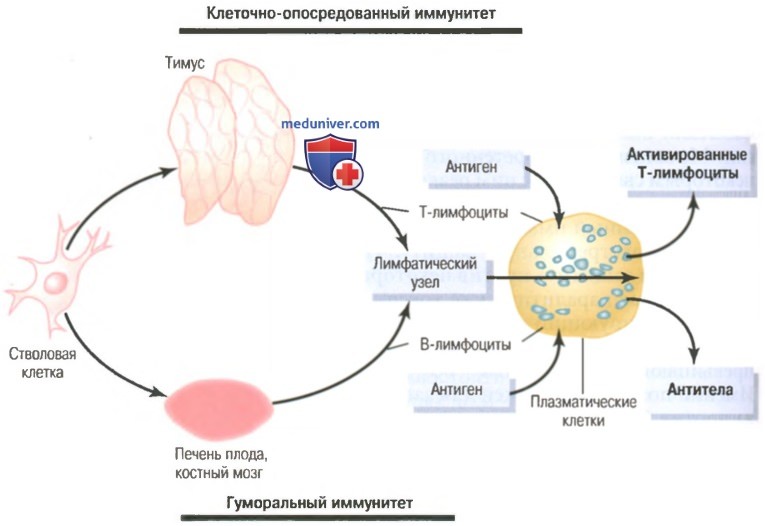
Т-лимфоциты и В-лимфоциты иммунитета. Предварительная обработка Т- и В-лимфоцитова) Клеточно-опосредованный и гуморальный иммунитеты обеспечивают два типа лимфоцитов – Т- и В-лимфоциты. Хотя при исследовании под микроскопом большинство лимфоцитов в нормальной лимфоидной ткани выглядят одинаковыми, эти клетки подразделяют на две основные популяции. Одна популяция — Т-лимфоциты — ответственна за формирование активированных лимфоцитов, обеспечивающих клеточно-опосредованный иммунитет. Другая популяция — В-лимфоциты — ответственна за формирование антител, обеспечивающих гуморальный иммунитет. Оба типа лимфоцитов образуются у эмбриона из полипотентных гемопоэтических стволовых клеток, формирующих лимфоциты как один из наиболее важных результатов их дифференцировки. Почти все сформированные лимфоциты в результате заселяют лимфоидную ткань, однако прежде чем это произойдет, они дополнительно дифференцируются или проходят предварительную обработку. Лимфоциты, которые в итоге станут активированными Т-лимфоцитами, сначала мигрируют к тимусу, где подвергаются предварительной обработке. Эти ответственные за клеточно-опо-средованный иммунитет лимфоциты называют Т-лимфоцитами, что подчеркивает роль тимуса. Другая популяция лимфоцитов, В-лимфоциты, предназначенные для формирования антител, проходят предварительную обработку в печени плода в середине периода внутриутробной жизни, а также в костном мозге в конце внутриутробной жизни плода и после рождения. Эта популяция клеток впервые была открыта у птиц, имеющих специальный орган для их предварительной обработки, который называют бурсой Фабриция (фабрициевой сумкой). Ответственные за гуморальный иммунитет лимфоциты называют В-лимфоцитами, что подчеркивает роль бурсы. На рисунке ниже показаны две лимфоцитарные системы для формирования: (1) активированных Т-лимфоцитов; (2) антител.
Предварительная обработка Т- и В-лимфоцитовВсе лимфоциты организма происходят от коммитированных в лимфоцитарном направлении стволовых клеток эмбриона, но эти клетки не могут непосредственно превратиться в активированные Т-лимфоциты или антитела. Прежде чем это станет возможным, клетки должны подвергнуться дальнейшей дифференцировке в соответствующих областях, где они проходят специфическую обработку. а) Т-лимфоциты проходят предварительную обработку в тимусе (вилочковой железе). После образования в костном мозге Т-лимфоциты сначала мигрируют к вилочковой железе. Здесь они быстро делятся, одновременно становясь чрезвычайно разнообразными, т.е. предназначенными для реакции против разных специфических антигенов. Это значит, что один лимфоцит, обработанный в тимусе, проявляет специфическую реактивность в отношении одного антигена. Следующий лимфоцит специфически реагирует на другой антиген. Это продолжается до тех пор, пока в тимусе не появятся тысячи разных типов лимфоцитов со специфической реактивностью в отношении тысяч разных антигенов. Эти разные типы предварительно обработанных Т-лимфоцитов оставляют тимус и распространяются кровью по всему телу, временно оседая в лимфоидной ткани. Кроме того, благодаря обработке в тимусе любой оставляющий его Т-лимфоцит не реагирует с белками или другими антигенами собственных тканей организма (иначе Т-лимфоциты погубили бы собственное тело человека в течение всего нескольких дней). Тимус выбирает, какие Т-лимфоциты могут его покинуть, сначала смешивая их практически со всеми специфическими аутоантигенами собственных тканей тела. Если Т-лимфоцит реагирует, он разрушается и фагоцитируется, вместо того, чтобы выделяться. Это происходит с основной частью клеток (вплоть до 90%). Таким образом, клетки, выделяющиеся из тимуса, не реагируют против собственных антигенов тела; они реагируют лишь на антигены внешних источников, например бактерий, токсинов или тканей, пересаженных от другого человека. Основная часть предобработки Т-лимфоцитов в тимусе происходит перед рождением ребенка и в течение нескольких месяцев после рождения. Удаление вилочковой железы после этого периода ослабляет (но не исключает) Т-лимфоцитарную иммунную систему. Однако удаление тимуса за несколько месяцев до рождения может нарушить развитие всего клеточно-опосредован-ного иммунитета. Поскольку именно клеточный тип иммунитета в основном отвечает за отторжение трансплантированных органов, например сердца или почек, органы можно пересаживать с меньшей вероятностью отторжения, если у животного в соответствующее время до его рождения удалить тимус. б) В-лимфоциты проходят предварительную обработку в печени и костном мозге. О деталях предварительной обработки В-лимфоцитов известно гораздо меньше, чем о предобработке Т-лимфоцитов. Известно, что у человека предварительная обработка В-лимфоцитов осуществляется в печени в середине внутриутробного периода развития, а также в костном мозге в конце внутриутробного периода и после рождения. Существуют два важных различия между В- и Т-лимфоцитами. Во-первых, В-лимфоциты активно секретируют реактивные агенты, называемые антителами, в отличие от Т-лимфоцитов, реагирующих с антигеном непосредственно. Антитела — это крупные белковые молекулы, способные соединяться с антигенной субстанцией и разрушать ее. Во-вторых, разнообразие В-лимфоцитов выражено больше, чем у Т-лимфоцитов, т.е. формируются миллионы типов В-лимфоцитарных антител с разными специфическими реактивностями. После предобработки В-лимфоциты, как и Т-лимфоциты, мигрируют к лимфоидной ткани по всему телу, где временно располагаются рядом, но несколько обособленно от областей локализации Т-лимфоцитов. Видео физиология защитной функции крови (иммунитета) и группы крови – профессор, д.м.н. П.Е. Умрюхин– Также рекомендуем “Роль лимфоцитарных клонов. Происхождение клонов лимфоцитов” Оглавление темы “Клетки иммунитета. Виды иммунитета”: |
Источник
[20-069]
Иммунологическое обследование при аутоиммунных заболеваниях
11170 руб.
Данный вариант исследования, помимо оценки основных субпопуляций лимфоцитов, уровня циркулирующих иммунных комплексов и основных классов иммуноглобулинов, включает в себя более углубленный анализ малых популяций В-лимфоцитов. Это В-1 клетки (популяция, связанная с продукцией аутоантител), В-клетки памяти, а также Т-регуляторные клетки. Анализ этих клеток в совокупности с основными субпопуляциями лимфоцитов позволяет определить выраженность аутоиммунного компонента в течение заболевания, в динамике оценить эффективность проводимой иммуносупрессивной и противовоспалительной терапии.
* Результаты исследования выдаются с заключением врача – аллерголога-иммунолога, доктора медицинских наук.
Набор тестов:
- Клинический анализ крови: общий анализ, лейкоцитарная формула, СОЭ (с микроскопией мазка крови при выявлении патологических изменений)
- Суммарные иммуноглобулины класса A в сыворотке (IgA)
- Суммарные иммуноглобулины класса G в сыворотке (IgG)
- Суммарные иммуноглобулины класса M в сыворотке (IgM)
- Состояние клеточного звена иммунитета
- Углубленный анализ малых популяций B-клеток
- Циркулирующие иммунные комплексы (ЦИК)
Синонимы русские
Иммунограмма, иммунофенотипирование, клеточный иммунитет, многоцветный клеточный анализ методом проточной цитометрии.
Синонимы английские
Human Immune System, Immunophenotyping, Multicolor Flow Cytometry Cell Analysis, Human Leukocyte Differentiation Antigens.
Метод исследования
Проточная цитометрия, иммунотурбидиметрия, ИФА.
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как подготовиться к исследованию?
- Исключить из рациона алкоголь в течение 24 часов до исследования.
- Не принимать пищу в течение 12 часов до исследования.
- Полностью исключить прием лекарственных препаратов в течение 24 часов перед исследованием (по согласованию с врачом).
- Исключить физическое и эмоциональное перенапряжение в течение 24 часов до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
В современном понимании иммунный статус человека – это совокупность лабораторных показателей, характеризующих количественную и функциональную активность клеток иммунной системы в данный момент времени. Оценка иммунного статуса проводится с помощью иммунологического лабораторного обследования – иммунограммы. Иммунограмма крови не отражает избирательно состояние патологически измененного органа или системы, но позволяет оценить иммунную систему в целом (суммарный эффект изменения активности иммунной системы в ответ на чужеродный антиген).
Определение клеточного состава (иммунофенотипирование) лимфоцитов крови – основной компонент в оценке иммунного статуса – выполняется методом проточной цитофлюориметрии.
Иммунофенотипирование – это характеристика клеток, полученная при помощи моноклональных антител или каких-либо других зондов, позволяющих судить об их типе и функциональном состоянии по наличию того или иного набора клеточных маркеров.
Иммунофенотипирование лейкоцитов заключается в обнаружении на их поверхности маркеров дифференциации, или CD-антигенов. Лейкоциты экспрессируют ряд поверхностных и цитоплазматических антигенов, уникальных для своей субпопуляции и стадии развития.
CD-антигены (англ. cluster of differentiation antigens) – это антигены на поверхности клеток, маркеры, отличающие одни типы клеток от других. Дифференциации этих антигенов изучены и стандартизованы, им присвоены определенные номера. CD могут быть распознаны с помощью соответствующих моноклональных антител. Используя флюоресцентно меченные моноклональные антитела, связывающиеся с определенными CD, можно с помощью метода проточной цитометрии рассчитать содержание лимфоцитов, относящихся к различным по функции или стадии развития субпопуляциям.
В основе проточной цитофлюориметрии лежит фотометрическое и флюоресцентное измерение отдельных клеток, пересекающих одна за другой вместе с потоком жидкости луч монохроматического света, обычно света лазера.
Метод позволяет не только определить количественное соотношение основных популяций лимфоцитов –
- Т-лимфоциты (CD3+CD19-),
- Т-хелперы/индукторы (CD3+CD4+CD45+),
- Т-цитотоксические лимфоциты (Т-ЦТЛ) (CD3+CD8+CD45+),
- истинные натуральные “киллеры” (NK-клетки) (CD3-CD56+CD45+),
- В-лимфоциты (CD19+CD3-), –
но и оценить малые клеточные популяции, а также изучить их функциональную активность:
- Т-лимфоциты, экспрессирующие маркеры NK-клеток (Т-NK-клетки) (CD3+CD56+CD45+),
- NK-клетки, экспрессирующие альфа-цепь антигена CD8 (CD3-СD8+CD45+),
- В-1-клетки (CD19+CD5+CD27-CD45+), связанные с продукцией аутоантител,
- активированные В-лимфоциты (CD3-CD25+CD45+),
- В-2-клетки (CD19+CD5-CD27-CD45+),
- В-клетки памяти (CD19+CD5-CD27+CD45+),
- активированные Т-лимфоциты (CD3+HLA–DR+CD45+) и активированные цитотоксические лимфоциты (CD8+HLA–DR+CD45+),
- В-лимфоциты и активированные NK-клетки (CD3-HLA–DR+CD45+),
- активированные Т-лимфоциты, экспрессирующие альфа-цепь рецептора ИЛ-2 (CD3+CD25+CD45+),
- регуляторные Т-хелперные клетки (CD4+CD25brightCD127negCD45+), выполняющие иммуносупрессорную функцию.
Такое всестороннее изучение клеточного состава лимфоцитов в совокупности с результатами других тестов, входящих в состав исследования, позволяет установить более тонкие механизмы иммунологических нарушений, уточнить степень и глубину поражения иммунной системы и подобрать препарат для последующей адекватной иммунокорректирующей терапии, оценки эффективности проводимого лечения, определения прогноза заболевания.
Когда назначается исследование?
Исследование рекомендовано для комплексного обследования пациентов, входящих в группу риска по аутоиммунным и иммунопатологическим синдромам:
- ревматоидный артрит;
- рассеянный склероз;
- диффузные заболевания соединительной ткани (системная красная волчанка, склеродермия, дерматомиозит);
- аутоиммунный тиреоидит;
- неспецифический язвенный колит и т.д.
Что означают результаты?
Уровень различных клеточных популяций лимфоцитов может повышаться или понижаться при различных патологических процессах в организме, таких как инфекции, аутоиммунные и онкологические заболевания, иммунодефициты, в постоперационном периоде, при трансплантации органов.
Ниже представлена таблица с клиническими ситуациями, которые могут приводить к изменениям в субпопуляционном составе лимфоцитов.
Субпопуляция лимфоцитов | Повышение показателя | Снижение показателя |
T-лимфоциты (CD3+CD19-) | – Острые и хронические инфекции – Гормональный дисбаланс – Длительный прием лекарственных препаратов (особенно монотерапия) – Прием биологически активных добавок – Интенсивные занятия спортом – Беременность – T-клеточные лейкозы | – Некоторые виды инфекций – Иммунодефицит-ные состояния – Алкогольный цир-роз печени – Карцинома печени – Аутоиммунные за-болевания – Прием иммуносу-прессивных препаратов |
T-хелперы (CD3+CD4+CD45+) | – Ряд аутоиммунных заболеваний – Гормональный дисбаланс – Некоторые инфекции – Отдельные T-клеточные инфекции – Отравление солями бериллия | – Иммунодефицитн. состояния (основной лабораторный признак вторичного иммунодефицита) – Алкогольная болезнь печени – Аутоиммунные заболевания – Прием иммуносупрессивных препаратов или прием стероидов |
T-цитотоксические лимфоциты (CD3+CD8+CD45+) | – Некоторые вирусные инфекции – Ряд T-клеточных лимфозов – Наркоз – Острая фаза аллергии – Ряд аутоиммунных патологий | – Некоторые виды аутоиммунных, аллергических заболеваний – Иммуносупрессив-ная терапия |
Активированные T-лимфоциты (CD3+HLA-DR+CD45+) | – Инфекции – Аутоиммунная патология – Аллергия – Онкологические заболевания – Алкогольный цирроз печени – Беременность | Не имеет диагностического значения |
B-лимфоциты (CD19+CD3-) | – Ряд аутоиммунных патологий – Стресс – B-клеточные лимфомы – Длительное воздействие формальдегида | Гипореактивность, перераспределение B-лимфоцитов в очаги воспаления |
Натуральные “киллеры” (CD3-CD56+CD45+), (CD3-CD16+CD45+) | – Фаза восстановления после вирусных инфекций (гепатит B, C) – Ряд аутоиммунных заболеваний – Онкологические заболевания – Беременность – Алкогольный цирроз печени | – Ряд инфекций – Ряд аутоиммунных заболеваний – Курение – Иммуносупрессив-ная терапия и терапия стероидами |
T-натуральные “киллеры”, НК-Т (CD3+CD56+CD45+) | – Длительные хронические воспалительные процессы – Тяжелое течение воспалительных процессов – Длительная персистенция антигена в организме | Не имеет диагностического значения |
B-1-клетки (CD19+CD5+CD27-CD45+) | – Аутоиммунная патология (системная красная волчанка, ревматоидный артрит, аутоиммунный тиреоидит, неспецифический язвенный колит, миастения) – Аутоиммунные поражения при инфекционных заболеваниях (хламидиоз, синдром Рейтера, бруцеллез) – Лимфопро-лиферативные процессы | Не имеет диагностического значения |
T-reg. (регуляторные T-клетки (CD4+CD25brightCD127negCD45+) | – Различные новообразования – Лимфопроли-феративные процессы – Инфекционные заболевания | – Аутоиммунная патология (сахарный диабет 1-го типа, рассеянный склероз, ревматоидный артрит, аутоиммунный тиреоидит, неспецифический язвенный колит, болезнь Крона, миастения) – Аллергические заболевания (бронхиальная астма, атопический дерматит, пищевая аллергия) |
К каждой иммунограмме прилагается письменное заключение врача-иммунолога.
Важные замечания
Для диагностики патологий результаты этого исследования необходимо сопоставлять с клиническими данными и показателями других лабораторных анализов. Также следует отметить, что клиническую значимость исследования существенно повышает оценка иммунологического статуса пациента в динамике.
Литература
- Хаитов, Р. М. Аллергология и иммунология : национальное руководство / под ред. Р. М. Хаитова, Н. И. Ильиной. – М. : ГЭОТАР-Медиа, 2009. – 656 с.
- Хаитов, Р. М. Руководство по клинической иммунологии. Диагностика заболеваний иммунной системы : руководство для врачей / Р. М. Хаитов, Б. В. Пинегин, А. А. Ярилин. – М. : ГЭОТАР-Медиа, 2009. – 352 с.
- Зуева Е. Е. Иммунная система, иммунограмма : рекомендации по назначению и применению в лечебно диагностическом процессе / Е. Е Зуева, Е. Б. Русанова, А. В. Куртова, А. П. Рыжак, М. В. Горчакова, О. В. Галкина – СПб. – Тверь: ООО “Издательство “Триада”, 2008. – 60 с.
- Кетлинский, С. А. Иммунология для врача / С. А. Кетлинский, Н. М. Калинина. СПб. : Гиппократ, 1998. – 156 с. Ярилин, А. А . Иммунология : учебник / А. А. Ярилин. – М. : ГЭОТАР-Медиа, 2010. – 752 с.
- Хаитов, Р. М. Иммунология : атлас / Р. М. Хаитов, А. А. Ярилин, Б. В. Пинегин.М. : ГЭОТАР-Медиа, 2011. – 624 с.
- Хаитов, Р. М. Иммунология : учебник / Р.М. Хаитов. – М. : ГЭОТАР-Медиа, 2009. – 320 с.
- Хаитов, Р. М. Оценка иммунного статуса человека в норме и при патологии / Р. М. Хаитов, Б. В. Пинегин // Иммунология. – 2001. – N4. – С. 4-6.
- Whiteside, T. L. Role of Human Natural Killer Cells in Health and disease / T. L. Whiteside, R. B. Herberman // Clinical and Diagnostic Laboratory Immunology. – 1994. – Vol. 1, №2. – P. 125-133.
- Ginadi, L. Differential expression of T-cell antigens in normal peripheral blood lymphocytes : a quantitative analysis by flow cytometry / L. Ginadi, N. Farahat, E. Matutes [et al.] // J. Clin. Pathol. – 1996. – Vol. 49, № 1. – P. 539-544.
- Merser, J.C. Natural killer T-cells : rapid responders controlling immunity and disease / J.C. Merser, M.J. Ragin, A. August // International J. Biochemistry & Cell Biology. – 2005. – № 37. – P. 1337-1343.
- Никитин, В. Ю. Маркеры активации на Т-хелперах и цитотоксических лимфоцитах на различных стадиях хронического вирусного гепатита С / В. Ю. Никитин, И. А. Сухина, В. Н. Цыган [и др.] // Вестн. Рос. Воен.-мед. акад. – 2007. – Т. 17, № 1. – С. 65-71.
- Boettler, T. T cells with CD4+CD25+ regulatory phenotype suppress in vitro proliferation of virus-specific CD8+ T cells during chronic hepatitis C virus infection / T. Boettler, H.C. Spangenberg, C. Neumann-Haefelin [et al.] // J. Virology. – 2005. – Vol. 79, N 12. – P. 7860-7867.
- Ormandy, L.A. Increased Populations of Regulatory T Cells in Peripheral Blood of Patients with Hepatocellular Carcinoma / L.A. Ormandy, T. Hillemann, H. Wedemeyer [et al.] // J. Cancer Res. – 2005. –Vol. 65, N 6. – P. 2457-2464.
- Sakaguchi, S. Naturally arising FoxP3-expressing CD4+CD25+ regulatory T cells in immunological tolerance to self- and non-self / S. Sakaguchi // Nature Immunol. – 2005. – Vol. 6, N 4. – P. 345-352.
- Romagnani, S. Regulation of the T cell response / S. Romagnani // Clin. Exp. Allergy. – 2006. – Vol. 36. – P. 1357-1366.
- Хайдуков С. В., Основные и малые популяции лимфоцитов периферической крови человека и их нормативные значения (метод многоцветного цитометрического анализа) / Хайдуков С. В., Зурочка А. В., Тотолян А. А., Черешнев В. А. // Мед. иммунология. – 2009. – Т. 11 (2-3). – С. 227-238.
Источник