Положительная селекция т лимфоцитов это
Т-лимфоциты несут на себе поражающее воображение разнообразие рецепторов, позволяющее распознавать практически любые чужеродные субстанции, с которыми может столкнуться организм. Путь от гемопоэтической стволовой клетки к 107–109 клонов Т-лимфоцитов с уникальными антиген-связывающими последовательностями — удивительное достижение эволюции. Многостадийное развития Т-лимфоцитов может выглядеть пугающим и запутывающим со страниц учебников. Однако, если вы дадите ему второй шанс, вы увидите, что это красивый и слаженный процесс.
Как и остальные клетки крови, Т-лимфоциты берут свое начало в костном мозге от гемопоэтической стволовой клетки. Такие клетки-предшественницы имеют мало общего со зрелыми функциональными Т-лимфоцитами: они не имеют антигенных рецепторов (TCR) и не умеют узнавать чужеродные антигены. Их ждет сложный путь развития, который осилят немногие, однако те, которые выживут, создадут армию, готовую к любой угрозе. Для развития Т-лимфоцитов в нашем теле формируется специальный орган — тимус. Создав достаточный репертуар рецепторов, тимус подвергается инволюции и практически не детектируется после пубертатного периода. Численность Т-лимфоцитов во взрослом организме в основном поддерживается делением зрелых клеток.
Для миграции в тимус клетки, чья судьба — стать Т-лимфоцитом, используют хемокиновый рецептор CCR9, лиганд для которого — CCL25 — секретируют клетки тимуса. Достигнув тимуса, предшественники Т-лимфоцитов становятся тимоцитами. Первым делом они получают сигнал от эпителиальных клеток тимуса через рецептор Notch-1, который окончательно определяет их судьбу в пользу Т-лимфоцита.
Следующая задача тимоцитов — активная пролиферация. Скорость деления тимоцитов крайне высока, поскольку 95 %–98 % этих клеток погибает. Дело в том, что судьба развивающегося Т-лимфоцита по умолчанию — апоптоз, спасти от которого его может только успешное прохождение нескольких раундов отбора. Сигнал для первого раунда деления — интерлейкин 7, который выделяют эпителиальные и другие клетки тимуса. Мутации в гене ИЛ-7 или его рецептора приводят к тяжелым иммунодефицитам. Пролиферация приводит к созданию большого пула клеток, которые называют дважды негативными клетками, поскольку они не несут на себе корецепторы CD4 и CD8. Большинство из них (90 %) дадут начало αβ Т-лимфоцитам, а 10 % — γδ Т-лимфоцитам.
После этого тимоциты приступают к перестройке генов антигенных рецепторов. Это тот самый момент, когда из небольшого количества генов возникает всё разнообразие антигенных рецепторов — миллионы и миллиарды. В ходе этого процесса участки генов антигенных рецепторов перестраиваются случайным образом. Ключевое слово здесь — случайный, поскольку процесс формирования рецепторов, способных эффективно распознавать чужеродные антигены, никак не зависит от этих антигенов и происходит задолго до встречи с ними!
До сих пор тимоциты содержали гены TCR в зародышевой конфигурации, т. е. не подвергшиеся перестройке. Такие гены не могут образовать TCR. Тимоциты начинают с перестройки генов одной из двух цепей TCR — β-цепи. После этого тимоциты проходят через первую контрольную точку. В случае успешной перестройки клетка экспрессирует β-цепь, которая вместе с инвариантной α-цепью формирует на поверхности клетки pre-TCR. Такой рецептор активируется без участия лиганда и передает в клетку сигналы для дальнейшего развития. Остальные клетки не проходят отбор: в случае неудачной перестройки pre-TCR не экпрессируется и клетка подвергается апоптозу в отсутствие сигналов к выживанию.
Активация pre-TCR поставляет в клетку важные сигналы для дальнейшего развития:
- Останавливается перестройка локуса β-цепи во втором аллеле. Это называется аллельное исключение — зрелые Т-лимфоциты экспрессируют β-цепь TCR только с одного аллеля.
- Начинается экспрессия двух ко-рецепторов CD4 и CD8, теперь тимоциты называются дважды позитивными.
- Начинается второй раунд пролиферации. Через pre-TCR клетки получают мощный сигнал к делению, приводящий к еще более интенсивной экспансии, чем в первом раунде.
- После этапа деления запускается перестройка α-цепи рецептора.
В отличие от цепи-партнера, α-цепь может подвергаться многократной перестройке, и большинство тимоцитов успешно с ней справятся. После перестройки α-цепи тимоциты наконец экспрессируют на своей поверхности полный αβ TCR. Однако впереди главная проверка, пройти которую суждено немногим.
Задачи последнего этапа отбора:
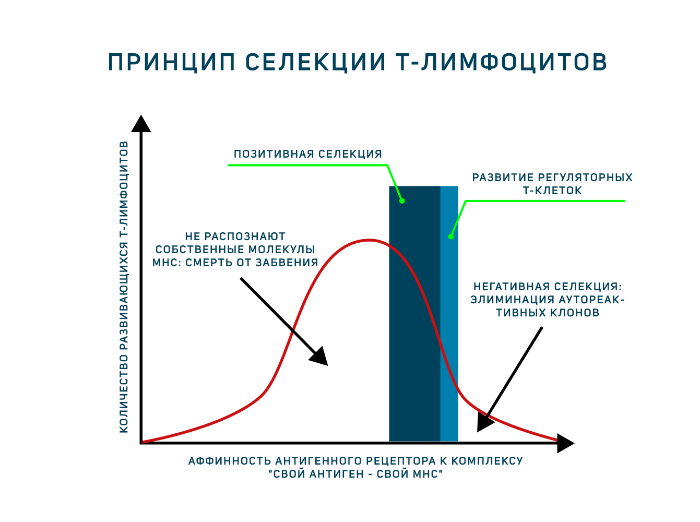
- Отобрать клетки, распознающие молекулы главного комплекса гистосовместимости (MHC) организма. Этот этап присутствует в развитии тимоцитов, поскольку зрелые Т-лимфоциты способны распознавать антигены только в составе МНС. Поэтому они должны знать МНС своего организма в лицо. Это называется позитивная селекция.
- Элиминировать клетки, распознающие собственные антигены. Это называется негативная селекция.
Однако антигенпрезентирующие клетки тимуса (эпителиальные клетки тимуса, дендритные клетки и макрофаги) располагают только комплексами «свой МНС — свой антиген». И позитивная, и негативная селекция осуществляется на основании взаимодействия TCR с такими комплексами! Для объяснения была предложена гипотеза аффинности. Тимоциты, чьи антигенные рецепторы проявят низкую аффинность к таким комплексам, продолжат развитие. Тимоциты, чьи рецепторы свяжутся с представленными антиген-МНС комплексами прочно, подвергнутся апоптозу как аутореактивные клоны (клональная делеция). Клетки, не распознающие МНС вовсе, т. е. не прошедшие позитивную селекцию, умрут особым способом, который называется смерть от забвения (death by neglect). Ещё один вариант развития — среднее связывание рецептора с антигенным комплексом, такие тимоциты могут дать начало регуляторным Т-клеткам. Таким образом, регуляторные Т-клетки — единственные лимфоциты, которые взаимодействуют со своим будущим антигеном в процессе развития! Развитию этого подтипа Т-лимфоцитов сейчас посвящено много исследований.

Особую роль в негативной селекции играет белок AIRE (аутоиммунный регулятор), который заставляет клетки тимуса экспрессировать в небольших количествах антигены, в норме присутствующие только в определенных тканях. Это позволяет сформировать толерантность к тканеспецифичным антигенам, встречающимся только за пределами тимуса. Мутация в белке AIRE приводит к развитию аутоиммунного полиэндокринного синдрома. AIRE содержится в эпителиальных клетках медуллы. При этом известно, что наиболее эффективно негативная селекция осуществляется при презентации антигена дендритными клетками и макрофагами, а не стромой тимуса. В новом исследовании был показан перенос антигенов из эпителиальных клеток тимуса в дендритные клетки, которые их и презентируют!
Одновременно с позитивной и негативной селекцией осуществляется проверка, соответствует ли корецептор распознаваемому классу МНС — т. е. происходит дифференцировка в функциональные подклассы. Выживают только клетки с правильной комбинацией: CD8 + MHC I — цитотоксические Т-лимфоциты и CD4 + MHC II — Т-хелперы.
Последнее, что должен сделать лимфоцит перед тем, как покинуть тимус — это изменить тип сигналинга через антигенный рецептор. Если незрелые Т-лимфоциты с высоким родством к антигену погибают, то зрелые — активируются (молекулярные основы такой принципиальной разницы не ясны). Теперь лимфоциты готовы заселить периферические лимфоидные органы и нести оборону. Зрелые Т-лимфоциты покидают тимус, используя градиент сфингозин-1-фосфата, — липида, присутствующего в высоких концентрациях в крови и лимфе, для хемотаксиса в кровяное русло. Для хоуминга во вторичные лимфоидные ткани они используют CD62L (L-селектин).
γδ Т-лимфоциты несут менее разнообразные антигенные рецепторы, по-видимому, не зависящие от МНС. Они не экспрессируют корецепторы CD4, CD8. γδ Т-лимфоциты выступают в роли первой линии обороны против часто встречающихся бактерий в эпителиальных и слизистых тканях и скорее относятся ко врожденной иммунной системе, чем к адаптивной.
Источники:
- Kenneth Murphy, Casey Weaver. Janeway’s Immunobiology 9th edition. Garland Science, 2017.
- Abul Abbas, Andrew H. Lichtman, Shiv Pillai. Cellular and Molecular Immunology 9th Edition. Elsevier, 2017.
- Perry J. S. et al. CD36 Mediates Cell-Surface Antigens to Promote Thymic Development of the Regulatory T Cell Receptor Repertoire and Allo-tolerance //Immunity. – 2018. – 923-936.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
В КМ формир-ся ранние предшественники Т-лимфоцитов. Раньше других Т-клеточных маркеров на поверхности развивающихся клеток Т-ряда человека экспрессируется (уже на стадии проТ) CD7. Эти клетки несут также мембранный маркер CD38, свойственный многим кроветворным клеткам на промежуточных этапах развития. Их размножение поддерж-ют фактор стволовых клеток и ИЛ-7, рецепторы которых присутствуют поверхности этих клеток. Пролиферация клеток может быть вызвана ИЛ-3, 2, 9, 1 и 6. На ранних этапах незрелые бластные предшеств попадают в тимус. Все этапы диф-ки будут связаны с изменением поверхностных маркеров для т-лимфоцитов.
Т-лимфоциты – CD2+ CD3- CD4- CD8-
С начала синтезир-ся β-цепь, затем α-цепь. Происходит сборка цепей и на пов-ть выходит αβTCR CD3+ CD4+ CD8+ – кортикальные тимоциты. Чувствит. К апоптозу, кот. индуцир. кортикостероиды и и.и.
С этого мом-та начин-ся этапы положит. и отрицат. селекции Т-лимфоцитов в тимусе. Положит селекция – процесс избирательного поддержания клонов лимфоцитов, отрицат селекция – процесс устранения клонов лимфоцитов. Эти процессы приводят к коррекции первичного антигенраспознающего комплекса (поддержание клонов, кот распознают пептиды в составе «своих» мол-л МНС, и устранение полностью аутореактивных клонов).
Более ранняя по времени положит. селекция осущ-тся в глубоких слоях коры тимуса. Ее основой служит взаимодействие тимоцитов с эпителиальными клетками, несущими на поверхности молекулы МНС II класса. На этом этапе поддерживаются клоны, способные распознать как полностью аутологичные комбинации молекул МНС и пептидов, так и аутологичные молекулы МНС, модифицированные чужеродными пептидами. Основой положительной селекции является контактное взаимодействие клеток вследствие комплементарности рецептора тимоцита и молекулы МНС эпителиальной клетки. В этом взаимодействии участвуют уже упоминавшиеся пары адгезивных молекул, стабилизирующие взаимодействие.
После осущ-ия фазы положит. отбора на пов-ти кл-к выживших клонов усилив-ся экспрессия CD3—TCR и вспомогат-ых мол-л CD4 и 8. Кл-ки, претерпевшие такие измен-ия, становятся субстратом для отрицат. селекции. Она осущ-ся в мозговом слое и кортико-медуллярной зоне тимуса в процессе взаимод-ия с дендритными кл-ами, богатыми продуктами МНС I и I классов. Если распознают высокоафинно собств. пептиды – ауто АГ – то уничтожаются путем апоптоза.
В рез-те 2 фаз отбора элиминируются те клоны тимоцитов, которые несут рецепторы, специфичные к АГ, не имеющим никакого отношения к аутологичным МНС, а также к комплексам аутологичных АГ-ых пептидов с аутологичными МНС.
Субпопуляции Т-лимфоцитов, основные функции. Т-хелперы, классификация, механизмы дифференцировки. Роль в развитии иммунного ответа Тх1, Тх2, Тх17 и регуляторных Т-лимфоцитов.
Лимфоциты, попадая из КМ в тимус, дифференцируются под влиянием тимических гормонов в зрелые лимфоциты. При этом они проходят разные стадии развития. Существуют 2 основные субпопуляции Т-лимфоцитов:
– Т-хелперы αβТСRCD4+ – субпопуляция =60%. В зав-ти от того, какие цитокины продуцир-ся этими лимфоцитами в ходе развития имм. ответа выделяют: Т-хелперы 1-го типа – продуцируют γ-интерферон, интерлейкин-2, ростовой фактор β. Они активируют макрофаги, участвуют в клеточном имм. ответе, принимают участие в воспалении, в реакциях ГЗТ; Т-хелперы 2-го типа –продуцируют интерлейкин-4,5,10,21,23. способны активировать В-лимфоциты, т.о. отвечают за развитие спец. гуморальных имм. реакций, осущ-ют защиту против гельминтов, парзитов, способств. реализации всех аллергич р-ций в орг-ме; Т-хелперы 17 – продуцир-ют интерлейкин-17,36, интерлейкин-17A, F – вовл. в развитие аутоимм. заболеваний, обеспечив. защиту против бактерий, кот имеют внеклеточный цикл размножения.
Все лимфоциты формируются из наивных Т-лимфоцитов. Дифференцировку обуславливает локальное микроокружение и цитокины, кот. влияют на дифф-ку.
Для Тх1 – Интерлейкин-12, Тх2 – интерлейкин-4, Тх-17 – интерлейкин-6,23. Трегулят – трансформир. ростовой фактор β.
– Цитотоксические лимфоциты – киллерные кл-ки αβТСRCD8+ =30%.
Осуществляют распознавание и уничтожение чужеродных или собственных измененных клеток. Кл-ки-предшественники Т-киллеров распознают АГ на пов-ти кл-ок в ассоциации с мол-ами МНС I-го класса. Секретируют перфорины, гранзимы, ФНО, кот вызывают повреждение мембраны и гибель кл-ки. Тк способны синтезировать интерферон альфа, обладающий противовирусной активностью.
Источник
В
процессе развития тимоцитов происходит
увеличение популяции клеток, экспрессирующих
Т-клеточные рецепторы, распознающие
чужеродные антигены (положительная
селекция), а также удаление популяций
тимоцитов, реагирующих с аутодетерминантами
(отрицательная селекция). В результате
только 5% клеток в тимусе созревают и
покидают этот орган (табл. 4.2.3).
Ключевым
моментом для понимания позитивной
селекции является то, что T-клетки CD4+
распознают антиген в комплексе с
молекулой ГКГ II класса, а T-клетки CD8+
распознают антиген в ассоциации с
молекулами ГКГ I
класса. Тимоциты, которые распознают
аутологичные детерминанты ГКГ классов
I
и II, представленные на эпителиальных
клетках тимуса, ускользают от апоптоза.
Стромальные клетки обеспечивают
тимическое “обучение” Т-лимфоцитов
посредством селекции.
При
негативной селекции T-клетки, которые
экспрессируют T-клеточные рецепторы,
связывающиеся с аутологичными протеинами,
удаляются. Негативная селекция,
по-видимому, осуществляется в медуллярном
веществе тимуса стромальными элементами,
происходящими из костного мозга.
Дендритные клетки и макрофаги представляют
аутоантигены тимоцитам в мозговом
веществе, и тимоциты, которые распознают
аутоантигены, подвергаются клональной
делеции. Остается невыясненным,
сталкиваются ли тимоциты со всеми
возможными аутоантигенами в течение
интратимического развития, или контакты
с аутоантигенами на периферии также
играют роль в запуске клональной делеции.
Клетки и цитокины, регулирующие развитие t-клеток.
Тимус
состоит из корковой и медуллярной
областей, различающихся по количеству
тимоцитов и составу стромальных клеток.
Стромальные клетки формируют трехмерную
сеть, которая обеспечивает структуру
для развития тимоцитов. Эпителиальные
клетки корковой области являются
дериватами эпителия третьего глоточного
кармана, а дендритные клетки и макрофаги,
являющиеся основными стромальными
элементами в медуллярной области, имеют
костномозговое происхождение. Стромальные
клетки тимуса влияют на развитие
тимоцитов как посредством прямых
межклеточных взаимодействий, так и
секрецией растворимых медиаторов.
Тимоциты
и клетки тимического эпителия экспрессируют
ряд поверхностных клеточных детерминант,
некоторые из них вовлечены в клеточную
адгезию. Рецептор CD2 на тимоцитах
определяет связывание с детерминантой
CD58 (LFA-3)
и молекулой межклеточной адгезии ICAM-1
(intercellular
adhesion molecule 1),
представленных на клетках тимического
эпителия. Взаимодействие
между развивающимися лимфоцитами и
стромой может активировать обе популяции.
Например, связывание тимоцитов со
стромой может стимулировать продукцию
ИЛ-1 стромальными клетками и повышать
экспрессию рецептора ИЛ-2 на тимоцитах.
ИЛ-7 стимулирует пролиферацию тимоцитов,
и фактор стволовых клеток увеличивает
этот эффект. Эпителиальные клетки тимуса
у человека являются источником цитокинов
ИЛ-1a
и b,
ИЛ-3, ИЛ-6, ИЛ-8, колониестимулирующих
факторов, лейкозингибирующего фактора
и TGF-a,
а также гормонов тимозина и тимопоэтина,
оказывающих влияние на пролиферацию и
дифференцировку тимоцитов.
Дополнительные
цитокины, необходимые для развития
T-клеток, могут продуцироваться самими
T-клетками. Тимоциты производят IFN-g,
TNF-a,
ИЛ-2 , ИЛ-3, и ИЛ-4.
Естественные
киллерные клетки.
Естественные
киллеры (NK) обладают способностью
спонтанно лизировать некоторые опухолевые
клетки-мишени. Человеческие NK-клетки
экспрессируют антигены CD16 и CD56, но не
имеют TCR или CD3. По морфологическим
характеристикам эти клетки представляют
собой большие гранулярные лимфоциты,
так как в них присутствуют крупные
цитоплазматические гранулы.
Дальнейшее развитие
лимфоцитов в зародышевых центрах.
Т-
и В-лимфоциты, которые покидают
соответственно тимус и костный мозг,
находятся на ранней стадии иммунологического
созревания. Когда антигенпрезентирующие
клетки представляют антиген этим Т- и
В-клеткам в первый раз, например, в
лимфатическом узле или селезенке, они
трансформируются в Т- или В- иммунобласт.
Иммунобласты
являются самыми крупными лимфоидными
клетками. Они имеют светлое ядро с
тонкоструктурированным хроматином и
крупными одиночными ядрышками. Цитоплазма
иммунобластов выглядит как широкий
базофильный ободок. Т-иммунобласты либо
выполняют свою первичную Т-клеточную
функцию и погибают, либо становятся
Т-клетками памяти. Клетки последнего
типа более интенсивно отвечают на
стимуляцию при контакте с тем же самым
антигеном. В-иммунобласты превращаются
в плазматические клетки, проходя перед
этим стадию плазмацитоидных клеток.
Первоначально плазмацитоидные клетки
имеют морфологические признаки,
промежуточные между малыми лимфоцитами
и зрелыми плазматическими клетками, на
этой стадии они секретируют преимущественно
IgМ. При дальнейшем развитии размер
клеток увеличивается, и они приобретают
черты типичных плазматических клеток,
продуцирующих иммуноглобулины различных
классов.
Плазматические
клетки крупнее, чем лимфоциты. Они имеют
эксцентрично расположенное круглое
ядро. Цитоплазма плазматических клеток
базофильна, за исключением светлой
перинуклеарной зоны, занятой комплексом
Гольджи. При первичном иммунном ответе
плазмацитоидные лимфоциты преобладают,
а ассоциированная с ними продукция
иммуноглобулинов невелика.
В
лимфатических узлах и других лимфоидных
органах в ответ на антигенную стимуляцию
Т-зависимыми антигенами образуются
зародышевые центры. В-клетки, из которых
формируется зародышевый центр,
первоначально получают активизирующий
сигнал вне фолликулов, в T-клеточных
зонах, при их ассоциации с интердигитальными
клетками и T-хелперами. Каждый фолликул
колонизируют в среднем три В-клеточных
бласта. Эти бласты подвергаются массивной
клональной экспансии, и в них активизируется
гипермутационный механизм, который
действует на вариабельные области генов
иммуноглобулинов. Зрелые зародышевые
центры разделены на темную и светлую
зоны. Пролиферирующие бласты, центробласты,
занимают темную зону, из них формируются
утратившие способность к делению
центроциты, которые ытесняются в светлую
зону. Два типа этих лимфоидных клеток
известны как клетки фолликулярных
центров (рис. 4.2.2). Центробласты – крупные
клетки, но обычно мельче иммунобластов.
Светлая зона содержит сеть фолликулярных
дендритных клеток, которые имеют
способность поглощать и процессировать
(обрабатывать) антиген. Антигенные
детерминанты могут удерживаться на
поверхности дендритных клеток более
года или в форме иммунного комплекса,
или в нативном необработанном виде.
Антиген может также поглощаться
В-клеткой, которая процессирует его и
представляет T-клеткам. Центроциты
селектируются по их способности
взаимодействовать с антигеном,
удерживаемым дендритными клетками. Для
центроцитов характерна высокая смертность
путем апоптоза. Перекрестное связывание
иммуноглобулиновых рецепторов со
специфическим антигеном при одновременном
проведении сигнала через рецептор CD40
отменяет апоптоз центроцитов. После
получения сигналов через перечисленные
рецепторы на центроцитах увеличивается
экспрессия поверхностных иммуноглобулинов,
и они приобретают характеристики
В-клеток памяти. Зародышевые центры
сохраняются около трех недель после
иммунизации, а после этого В-бласты
памяти продолжают пролиферировать в
фолликулах в течение месяцев, пока
длится T-зависимый иммуноглобулиновый
ответ. Эти клетки, вероятно, являются
источником и плазматических клеток, и
клеток памяти, необходимых для поддержания
долгосрочной продукции антител и
иммунологической памяти после первых
трех недель T-зависимого антительного
ответа.
Описанные
в данном разделе реактивные лимфоидные
клетки встречаются главным образом в
лимфоидных тканях, их также можно увидеть
в крови при инфекционном мононуклеозе
и других вирусных инфекциях, а также у
больных неходжкинскими лимфомами (в
случае лейкемизации).
Соседние файлы в папке Внутренние
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник