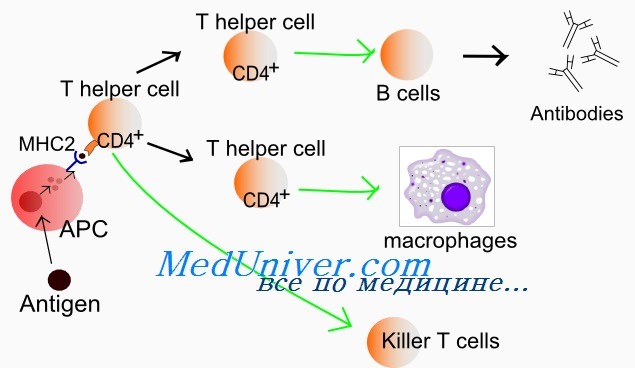
Положительная селекция т лимфоцитов
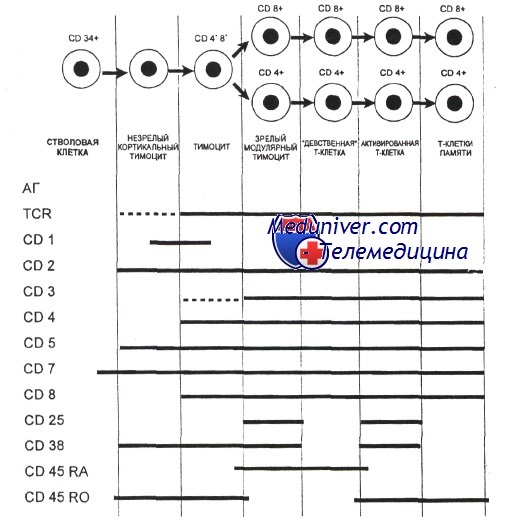
Гематология: Развитие Т-лимфоцитовПредшественники, прекоммитированные к развитию в Т-лимфоциты, непрерывно мигрируют от костного мозга в вилочковую железу, однако их число, по-видимому, очень мало. Незрелые предшественники Т-клеток поступают в область коры вилочковой железы, где созревают в функциональные субпопуляции Т-клеток. Особенностью развития тимоцитов является высокая скорость пролиферации. Различные стадии развития тимоцита можно определить по изменению экспрессии поверхностных и цитоплазматических молекул, рецепторов цитокинов и состояния реаранжировки генов Т-клеточного рецептора. Т-клеточный рецептор (TCR) распознает только короткие пептиды, которые заполняют полость в молекулах первого или второго класса главного комплекса гистосовместимости (МНС I и II, МНС комплекс у человека обозначается как HLA). Презентация таких пептидов Т-лимфоцитам обеспечивается антигенпредставляющими клетками. TCR — гетеродимерный комплекс, сформированный при ассоциации а-и бета- или у- и S-субъединиц. Каждая из этих субъединиц кодируется отдельным геном. Т-клетки с рецепторами типов ар и уq являются различными линиями, которые разделяются до начала реаранжировки гена TCR. Наименее зрелые клетки-предшественники в вилочковой железе экспрессируют антиген CD7. Некоторые из них экспрессируют также CD44. CD44, рецептор для гиалуроновой кислоты, — один из факторов, определяющих перемещение предшественников Т-клеток в вилочковую железу. Из этих предшественников далее образуются CD2+/CD7+ клетки, в цитоплазме которых присутствует CD3. Белковый комплекс CD3 обеспечивает передачу сигналов через TCR. Пептидные цепи CD3-комплекса начинают синтезироваться на стадии про-Т-лимфоцита, и их экспрессия предшествует появлению на мембране TCR. Т-лимфоциты уq-линии первыми начинают экспрессировать рецептор CD3, но на них нет молекул CD4 или CD8. Несколько позднее на поверхности клеток, экспрессирующих рецептор типа аb, начинают одновременно экспрессироваться антигены CD4 и CD8. К этому времени заканчивается реаранжировка генов а- и р-цепей, и на поверхности клеток экспрессируется рецепторный комплекс TCR ab/CD3. По мере того как клетки, экспрессирующие CD4+, CD8+ и TCR (так называемые дважды положительные клетки), проходят от коры к мозговому веществу вилочковой железы, они созревают в CD4+ хелперные или CD8+ цитотоксические Т-клетки. Клетки, которые созревают до стадии CD4+ или CD8+, составляют менее 5% тимоцитов. Эти лимфоциты покидают вилочковую железу и заполняют вторичные лимфоидные ткани (лимфатические узлы, селезенку, лимфоидную ткань, ассоциированную со слизистыми оболочками). Т-лимфоциты с рецептором уq и CD5+B1-клетки являются функционально аналогичными популяциями, которые развиваются параллельно. Т-клетки с рецептором типа уq найдены в различных тканях, включая селезенку, эпидермис и эпителий слизистой оболочки матки, влагалища и языка. Предполагается, что эта популяция клеток может исполнять роль иммунного надзора в перечисленных тканях.
Формирование комплекса Т-клеточного рецептора и положительная и отрицательная селекция в вилочковой железеКак и гены иммуноглобулинов, гены Т-клеточного рецептора собираются из различных сегментов, находящихся первоначально в зародышевой конфигурации. Гены Т-клеточного рецептора подвергаются процессу соматической реаранжировки, при которой кодирующие сегменты присоединяются друг к другу, а присутствующие между ними интронные последовательности удаляются. Вариабельность соединений и вставок обеспечивает возникновение различий TCR и приводит к огромному количеству различных последовательностей гипервариабельного участка TCR. Репертуар различных TCR считается даже большим, чем репертуар молекул Ig (по оценкам, репертуар ab-TCR составляет 1015, а для yq-TCR — 1018). В отличие от В-лимфоцитов, Т-лимфоциты не секретируют свои рецепторы. Дважды позитивный тимоцит проходит через многоступенчатый процесс, известный как тимическая селекция. На первой фазе, называемой положительной селекцией, TCR дважды позитивного тимоцита взаимодействуют с молекулами МНС, которые экспрессируются эпителиальными клетками в коре вилочковой железы. Тимоциты, способные распознавать комплекс антигена с молекулой HLA, ускользают от апоптоза и вступают в дальнейшую дифференцировку, в то время как тимоциты, не способные к такому взаимодействию, погибают. Поскольку рекомбинации, затрагивающие возникновение TCR, являются случайными, в вилочковой железе могут развиваться и пройти позитивную селекцию Т-клетки, экспрессирующие TCR, специфичные к чужеродным и собственным антигенам. Существует вероятность, что Т-клетки, реактивные к собственным структурам организма, будут взаимодействовать с аутоантигенами в тканях, что может привести к нежелательным аутоиммунным реакциям. Для предотвращения этого дважды положительные клетки подвергаются второй фазе отбора, которая называется негативной селекцией. В ходе этой фазы дважды положительные клетки взаимодействуют с комплексом МНС-пептид, экспрессированным на поверхности дендритной клетки. Т-клетки, TCR которых взаимодействует с комплексом МНС-пептид с высокой аффинностью, подвергаются апоптозу. В ходе негативной селекции удаляются Т-клетки, экспрессирующие TCR, обладающие реактивностью к собственным антигенам. Дважды положительные клетки, пережившие негативную селекцию, снижают экспрессию корецепторов CD4 или CD8, что приводит к развитию или CD4+CD8″ или CD4″CD8+ (моноположительных) Т-лимфоцитов. При этом Т-лимфоциты, распознающие антигены, представляемые молекулами МНС II класса, сохраняют экспрессию корецептора CD4+, a Т-лимфоциты, распознающие антигены, представляемые молекулами МНС I класса, сохраняют экспрессию корецептора CD8+. Эти клетки покидают вилочковую железу и образуют периферические зрелые CD4+ и CD8+ Т-клетки.
Клетки и цитокины, регулирующие развитие Т-клетокВилочковая железа состоит из корковой и медуллярной областей, различающихся по количеству тимоцитов и составу стромальных клеток. Стромальные клетки вилочковой железы влияют на развитие тимоцитов как посредством прямых межклеточных взаимодействий, так и секрецией растворимых медиаторов. Тимоциты и клетки тимического эпителия экспрессируют ряд поверхностных клеточных детерминант, некоторые из которых вовлечены в адгезию этих клеточных популяций друг к другу. Рецептор CD2 на тимоцитах определяет связывание с детерминантой CD58 (LFA-3) и межклеточной адгезионной молекулой-1 (ICAM-1), представленными на клетках тимического эпителия. Взаимодействия между развивающимися лимфоцитами и стромой могут активировать обе популяции. Например, связывание тимоцитов со стромой может стимулировать продукцию ИЛ-1 стромальными клетками и повышать экспрессию рецептора ИЛ-2 на тимоцитах. ИЛ-7 стимулирует полиферацию тимоцитов, и фактор стволовых клеток увеличивает этот эффект. Эпителиальные клетки вилочковой железы у человека являются источником цитокинов ИЛ- 1а и b, ИЛ-3, ИЛ-6, ИЛ-8, колониестимулирующих факторов (Г-КСФ и ГМ-КСФ), лейкозингибирующего фактора (LIF) и TGF-p, а также гормонов тимозина или тимопоэтина, оказывающих влияние на пролиферацию и дифференцировку тимоцитов. Цитокины, необходимые для развития Т-клеток, могут продуцироваться самими Т-клетками. Тимоциты производят IFN-y, ФНО-а, ИЛ-2, ИЛ-3 и ИЛ-4. Естественные киллерные клетки. Естественные киллеры (NK) обладают способностью спонтанно лизировать некоторые опухолевые клетки-мишени. Человеческие NK-клетки экспрессируют CD16 и CD56, но не имеют TCR или CD3. По морфологическим характеристикам эти клетки представляют собой большие гранулярные лимфоциты (в них присутствуют крупные цитоплазматические гранулы). NK-клетки имеют гемопоэтическое происхождение и развиваются в костном мозге, но пока мало известно об их предшественниках. – Также рекомендуем “Гематология: Развитие лимфоцитов в лимфатических узлах и селезенке” Оглавление темы “Гематология”:
|
Источник
Т-лимфоциты несут на себе поражающее воображение разнообразие рецепторов, позволяющее распознавать практически любые чужеродные субстанции, с которыми может столкнуться организм. Путь от гемопоэтической стволовой клетки к 107–109 клонов Т-лимфоцитов с уникальными антиген-связывающими последовательностями — удивительное достижение эволюции. Многостадийное развития Т-лимфоцитов может выглядеть пугающим и запутывающим со страниц учебников. Однако, если вы дадите ему второй шанс, вы увидите, что это красивый и слаженный процесс.
Как и остальные клетки крови, Т-лимфоциты берут свое начало в костном мозге от гемопоэтической стволовой клетки. Такие клетки-предшественницы имеют мало общего со зрелыми функциональными Т-лимфоцитами: они не имеют антигенных рецепторов (TCR) и не умеют узнавать чужеродные антигены. Их ждет сложный путь развития, который осилят немногие, однако те, которые выживут, создадут армию, готовую к любой угрозе. Для развития Т-лимфоцитов в нашем теле формируется специальный орган — тимус. Создав достаточный репертуар рецепторов, тимус подвергается инволюции и практически не детектируется после пубертатного периода. Численность Т-лимфоцитов во взрослом организме в основном поддерживается делением зрелых клеток.
Для миграции в тимус клетки, чья судьба — стать Т-лимфоцитом, используют хемокиновый рецептор CCR9, лиганд для которого — CCL25 — секретируют клетки тимуса. Достигнув тимуса, предшественники Т-лимфоцитов становятся тимоцитами. Первым делом они получают сигнал от эпителиальных клеток тимуса через рецептор Notch-1, который окончательно определяет их судьбу в пользу Т-лимфоцита.
Следующая задача тимоцитов — активная пролиферация. Скорость деления тимоцитов крайне высока, поскольку 95 %–98 % этих клеток погибает. Дело в том, что судьба развивающегося Т-лимфоцита по умолчанию — апоптоз, спасти от которого его может только успешное прохождение нескольких раундов отбора. Сигнал для первого раунда деления — интерлейкин 7, который выделяют эпителиальные и другие клетки тимуса. Мутации в гене ИЛ-7 или его рецептора приводят к тяжелым иммунодефицитам. Пролиферация приводит к созданию большого пула клеток, которые называют дважды негативными клетками, поскольку они не несут на себе корецепторы CD4 и CD8. Большинство из них (90 %) дадут начало αβ Т-лимфоцитам, а 10 % — γδ Т-лимфоцитам.
После этого тимоциты приступают к перестройке генов антигенных рецепторов. Это тот самый момент, когда из небольшого количества генов возникает всё разнообразие антигенных рецепторов — миллионы и миллиарды. В ходе этого процесса участки генов антигенных рецепторов перестраиваются случайным образом. Ключевое слово здесь — случайный, поскольку процесс формирования рецепторов, способных эффективно распознавать чужеродные антигены, никак не зависит от этих антигенов и происходит задолго до встречи с ними!
До сих пор тимоциты содержали гены TCR в зародышевой конфигурации, т. е. не подвергшиеся перестройке. Такие гены не могут образовать TCR. Тимоциты начинают с перестройки генов одной из двух цепей TCR — β-цепи. После этого тимоциты проходят через первую контрольную точку. В случае успешной перестройки клетка экспрессирует β-цепь, которая вместе с инвариантной α-цепью формирует на поверхности клетки pre-TCR. Такой рецептор активируется без участия лиганда и передает в клетку сигналы для дальнейшего развития. Остальные клетки не проходят отбор: в случае неудачной перестройки pre-TCR не экпрессируется и клетка подвергается апоптозу в отсутствие сигналов к выживанию.
Активация pre-TCR поставляет в клетку важные сигналы для дальнейшего развития:
- Останавливается перестройка локуса β-цепи во втором аллеле. Это называется аллельное исключение — зрелые Т-лимфоциты экспрессируют β-цепь TCR только с одного аллеля.
- Начинается экспрессия двух ко-рецепторов CD4 и CD8, теперь тимоциты называются дважды позитивными.
- Начинается второй раунд пролиферации. Через pre-TCR клетки получают мощный сигнал к делению, приводящий к еще более интенсивной экспансии, чем в первом раунде.
- После этапа деления запускается перестройка α-цепи рецептора.
В отличие от цепи-партнера, α-цепь может подвергаться многократной перестройке, и большинство тимоцитов успешно с ней справятся. После перестройки α-цепи тимоциты наконец экспрессируют на своей поверхности полный αβ TCR. Однако впереди главная проверка, пройти которую суждено немногим.
Задачи последнего этапа отбора:
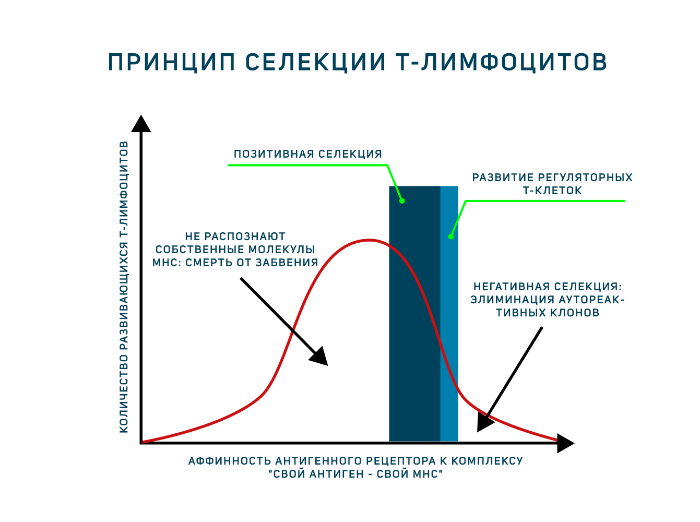
- Отобрать клетки, распознающие молекулы главного комплекса гистосовместимости (MHC) организма. Этот этап присутствует в развитии тимоцитов, поскольку зрелые Т-лимфоциты способны распознавать антигены только в составе МНС. Поэтому они должны знать МНС своего организма в лицо. Это называется позитивная селекция.
- Элиминировать клетки, распознающие собственные антигены. Это называется негативная селекция.
Однако антигенпрезентирующие клетки тимуса (эпителиальные клетки тимуса, дендритные клетки и макрофаги) располагают только комплексами «свой МНС — свой антиген». И позитивная, и негативная селекция осуществляется на основании взаимодействия TCR с такими комплексами! Для объяснения была предложена гипотеза аффинности. Тимоциты, чьи антигенные рецепторы проявят низкую аффинность к таким комплексам, продолжат развитие. Тимоциты, чьи рецепторы свяжутся с представленными антиген-МНС комплексами прочно, подвергнутся апоптозу как аутореактивные клоны (клональная делеция). Клетки, не распознающие МНС вовсе, т. е. не прошедшие позитивную селекцию, умрут особым способом, который называется смерть от забвения (death by neglect). Ещё один вариант развития — среднее связывание рецептора с антигенным комплексом, такие тимоциты могут дать начало регуляторным Т-клеткам. Таким образом, регуляторные Т-клетки — единственные лимфоциты, которые взаимодействуют со своим будущим антигеном в процессе развития! Развитию этого подтипа Т-лимфоцитов сейчас посвящено много исследований.
Особую роль в негативной селекции играет белок AIRE (аутоиммунный регулятор), который заставляет клетки тимуса экспрессировать в небольших количествах антигены, в норме присутствующие только в определенных тканях. Это позволяет сформировать толерантность к тканеспецифичным антигенам, встречающимся только за пределами тимуса. Мутация в белке AIRE приводит к развитию аутоиммунного полиэндокринного синдрома. AIRE содержится в эпителиальных клетках медуллы. При этом известно, что наиболее эффективно негативная селекция осуществляется при презентации антигена дендритными клетками и макрофагами, а не стромой тимуса. В новом исследовании был показан перенос антигенов из эпителиальных клеток тимуса в дендритные клетки, которые их и презентируют!
Одновременно с позитивной и негативной селекцией осуществляется проверка, соответствует ли корецептор распознаваемому классу МНС — т. е. происходит дифференцировка в функциональные подклассы. Выживают только клетки с правильной комбинацией: CD8 + MHC I — цитотоксические Т-лимфоциты и CD4 + MHC II — Т-хелперы.
Последнее, что должен сделать лимфоцит перед тем, как покинуть тимус — это изменить тип сигналинга через антигенный рецептор. Если незрелые Т-лимфоциты с высоким родством к антигену погибают, то зрелые — активируются (молекулярные основы такой принципиальной разницы не ясны). Теперь лимфоциты готовы заселить периферические лимфоидные органы и нести оборону. Зрелые Т-лимфоциты покидают тимус, используя градиент сфингозин-1-фосфата, — липида, присутствующего в высоких концентрациях в крови и лимфе, для хемотаксиса в кровяное русло. Для хоуминга во вторичные лимфоидные ткани они используют CD62L (L-селектин).
γδ Т-лимфоциты несут менее разнообразные антигенные рецепторы, по-видимому, не зависящие от МНС. Они не экспрессируют корецепторы CD4, CD8. γδ Т-лимфоциты выступают в роли первой линии обороны против часто встречающихся бактерий в эпителиальных и слизистых тканях и скорее относятся ко врожденной иммунной системе, чем к адаптивной.
Источники:
- Kenneth Murphy, Casey Weaver. Janeway’s Immunobiology 9th edition. Garland Science, 2017.
- Abul Abbas, Andrew H. Lichtman, Shiv Pillai. Cellular and Molecular Immunology 9th Edition. Elsevier, 2017.
- Perry J. S. et al. CD36 Mediates Cell-Surface Antigens to Promote Thymic Development of the Regulatory T Cell Receptor Repertoire and Allo-tolerance //Immunity. – 2018. – 923-936.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
Многие особенности селекции Т-клеток (по сравнению с селекцией В-лимфоцитов) характеризуются большей сложностью процесса распознавания антигена Т-клетками и их особой ролью в обеспечении толерантности к собственным антигенам организма. Схематично положительная и отрицательная селекция тимоцитов отражены на рис. 3.49.
Положительная селекция
Дважды положительные клетки очень чувствительны к апоптозу (в связи с низкой экспрессией ими антиапоптотических факторов, таких, как Bcl-2 и Bcl-XL). Для выживания дифференцирующимся Т-клеткам нужна поддержка микроокружения, особенно эпителиальных клеток коры тимуса, в которой локализуются CD4+CD8+ тимоциты. Сигнал, необходимый для выживания, тимоциты получают в ходе положительной селекции. Набор рецепторов, формируемый в ходе случайной перестройки генов, никак не связан с реальными потребностями иммунной системы. В то же время для нормального функционирования иммунной системы нужно, чтобы Т-клетки несли TCR, распознающие молекулы MHC, содержащие пептидные фрагменты антигенов. Положительная селекция обеспечивает отбор только тех тимоцитов, которые экспрессируют TCR, обладающие сродством к молекулам MHC.
Положительной селекции подвергаются дважды положительные тимо- циты фенотипа CD4+ CD8+ CD3l0 CD27-. В качестве «отбирающего фактора» выступают кортикальные эпителиальные клетки, экспрессирующие цито-

Рис. 3.49. Селекция клонов тимоцитов. Связь с особенностями распознавания комплекса «аутологичный пептид—MHC»
кератин СК8 и молекулы MHC обоих классов, но лишенные костимули- рующих молекул. Тимоциты, перемещаясь от периферии коры к кортикомедуллярной зоне, тесно контактируют с эпителиальным ретикулумом, образующим трехмерный каркас тимуса. При этих механических контактах TCR тимоцитов взаимодействуют с экспрессированными на поверхности эпителиальных клеток молекулами MHC как I, так и II классов, содержащими фрагменты различных эндогенных молекул (чужеродные молекулы в тимусе отсутствуют). Если TCR обладает сродством к молекуле MHC, тимо- цит получает поддерживающий сигнал, основными результатами которого служат повышение экспрессии антиапоптотического фактора Вс1-2 и продвижение тимоцита по клеточному циклу. Внешний признак успешного прохождения тимоцитом положительной селекции — экспрессия маркера активации клетки CD69, а также молекул CD5, CD27 и костимулирующей молекулы CD28, сопровождающаяся повышением плотности экспрессии рецепторного комплекса TCR—CD3 на поверхности клетки. Т-лимфоциты, рецепторы которых лишены сродства к МНС, подвергаются апоптозу «по умолчанию», т.е. не в силу сигнала извне, передаваемого через мембранные рецепторы, а вследствие срабатывания внутренних (митохондриальных) механизмов. Поскольку сродством к молекулам MHC обладают TCR лишь незначительной части клонов образующихся тимоцитов, на этапе положительной селекции погибает 90% CD4+ CD8+ тимоцитов.
Отрицательная селекция
Тимоциты, прошедшие положительную селекцию, мигрируют в кортикомедуллярное сочленение и в мозговой слой тимуса, где они проходят следующий этап отбора — отрицательную селекцию. На этом этапе тимоциты представлены дважды положительными клетками или «полузрелыми» моноположительными клетками фенотипа CD4+/CD8+ CD24hl. Отрицательную селекцию осуществляют медуллярные дендритные и эпителиальные клетки. Те и другие клетки экспрессируют молекулы MHC обоих классов и костимулирующие молекулы (CD80, CD86, CD40). Маркеры медуллярных эпителиальных клеток — цитокератин 5 и лектин улитки UEA1.
На этом этапе происходит дискриминация тимоцитов по степени сродства к комплексу MHC—пептид. Клетки, обладающие высоким сродством, подвергаются апоптозу как потенциально опасные (поскольку они хорошо распознают пептидные фрагменты аутологичных белков в составе аутологичных молекул MHC, они могут индуцировать аутоиммунные реакции). Сигналом к реализации апоптоза служит экспрессия ядерного фактора Nur77, который, таким образом, служит маркером клеток, подлежащих элиминации. В результате жизнеспособность сохраняют только тимоциты, рецепторы которых обладают умеренным (промежуточным) сродством к аутологичным комплексам MHC—пептид. Именно такие клетки мигрируют в периферический отдел иммунной системы и участвуют в развитии иммунного ответа и реализации антигенспецифической иммунной защиты.
Постоянно возникает вопрос, почему сигнал, поступающий в тимо- циты через TCR, в одном случае (положительная селекция) обеспечивает поддержание жизнеспособности клеток, а в другом (отрицательная селекция) вызывает их гибель. Основой этих различий являются особенности клеток, вступающих в соответствующую фазу селекции. В силу различной молекулярной конститутции внутриклеточная сигнализация при аналогичных внешних сигналах и использовании практически одних и тех же сигнальных путей приводит к доминированию различных факторов и включению различных результирующих механизмов, приводящих в одном случае к поддержанию жизнеспособности, в другом — к развитию апоптоза. Полностью детали внутриклеточной сигнализации при положительной и отрицательной селекции тимоцитов не выяснены. Однако известно, например, что при положительной селекции в передачу сигнала в большей степени вовлекаются ферменты MAP-каскада, приводящие к образованию транскрипционного фактора c-Fos, а также Са2+-зависимый сигнальный путь, обеспечивающий формировнаие фактора NF-AT. В то же время при отрицательной селекции доминируют JNK- и p38-ветви MAP-каскада, приводящие к образованию транскрипционного фаткора с-Jun. Маркером отрицательной селекции является киназа MINK.
Из сказанного выше следует, что Т-клетки как бы «натаскиваются» на распознавание собственных антигенов, а не чужеродных молекул, но степень агрессивности Т-клеток в отношении собственных молекул ограничивается отрицательной селекцией. Этим клеткам предстоит распознавать комплексы аутологичных молекул МНС с пептидными фрагментами чужеродных белков, что осуществляется в силу высокой перекрестной реактивности TCR. Тем не менее, риск аутоагрессивности сохраняется и для его ограничения требуются дополнительные механизмы, такие как контроль со стороны регуляторных Т-клеток (см. 3.6.6.4).
При отрицательной селекции удаляются клоны, распознающие с высоким сродством антигены, представленные в тимусе. В связи с этим возникает вопрос, насколько набор антигенов, экспрессируемых в тимусе, является представительным для всего организма. Общеизвестно, что существуют органоспецифические антигены — белки, характерные для того или иного органа и выполняющие специфические функции. Из этого следует, что в популяции тимоцитов, прошедших отрицательную селекцию, должны сохраняться клоны, способные распознавать органоспецифические антигены других органов (не тимуса).
Однако такие клетки элиминируются при отрицательной селекции (если не полностью, то в значительной степени) благодаря эктопической экспрессии в тимусе небольших количеств органоспецифических антигенов. Этот процесс контролирует продукты гена AIRE (от Autoimmunity regulator). Белок, кодируемый геном AIRE, содержит домены, предназначенные для взаимодействия с ДНК (т.е. он является транскрипционным фактором), домены, ответственные за взаимодействие с ядерными рецепторами, а также 2 домена со структурой «цинковых пальцев» (zink finger). Механизмы действия белка AIRE неизвестны. Результат его активности — экспрессия генов органоспецифических антигенов различных органов (прежде всего эндокринных) в клетках мозговой зоны тимуса — эпителиальных, в меньшей степени — дендритных и В-лимфоцитах (редких, но тем не менее выявляемых в тимусе). Всего в тимусе экспрессируется 2000—3000 генов внетимусных белков, для экспрессии 500 из них доказана роль AIRE. Эта экспрессия мозаична: обычно в каждой клетке может экспрессироваться один из белков, причем каждый белок экспрессируется всего примерно в 100 клетках. В связи этим возникает вопрос, как столь незначительное количество антигена может обеспечить элиминацию аутореактивных клонов. Считают, что в этом принимают участие дендритные клетки, утилизировавшие продукты распада эпителиальных клеток или получившие антиген путем «откусывания» фрагментов эпителиальных клеток. О результативности такого механизма отрицательной селекции свидетельствует резкое возрастание аутоиммунных патологий при мутациях гена AIRE, ведущих к развитию синдрома APECED (Autoimmune polyendocrinopathy, candidiasis, endodermal dystrophy — аутоиммунная полиэндокринопатия, кандидоз, энто- дермальная дистрофия).
На этапе отрицательной селекции гибнет почти 50% тимоцитов, прошедших положительную селекцию (около 5% от числа незрелых дважды положительных тимоцитов). Однако в действительности достаточно много аутоспецифических Т-клеток не элиминируется в процессе отрицательной селекции и пополняет пул зрелых Т-лимфоцитов, создавая угрозу аутоагрессии. Для предотвращения этой угрозы необходимы дополнительные механизмы защиты в виде редактирования генов a-цепей TCR, индукции анергии и контроля иммунного ответа регуляторными Т-лимфоцитами (вопросы формирования и нарушения аутотолерантности будут специально рассмотрены в разделах 4.3.2.1 и 4.4.1.1).
Дифференцировка CD4+ и CD8 тимоцитов
Одновременно с селекцией тимоцитов происходит разделение их на субпопуляции, основанное на избирательной экспрессии корецепторов CD4 или CD8. Поскольку зрелые моноположительные тимоциты локализуются в мозговом слое тимуса, можно предположить, что разделение на субпопуляции происходит на этапе отрицательной селекции, однако не исключено, что этот процесс может быть связан с положительной селекцией. Дифференцировка Т-клеток регулируется как внутренними (диф- ференцировочные факторы), так и внешними (сигналы, генерируемые при контактах между клетками) стимулами. Несмотря на то, что факторы группы Notch действуют на этом этапе развития тимоцитов, они не оказывают решающего влияния на выбор пути дифференцировки. Считают, что для дифференцировки Т-лимфоцитов в CD8+ клетки нужен сигнал большей интенсивности, чем для дифференцировки CD4+ Т-клетки. Более специфично действие других факторов: сочетанная экспрессия в клетках факторов Th-POK и GATA-3 направляет Т-клетку по CD4+-пути, тогда как экспрессия факторов Tox и Runx3 — по CD8+ пути (рис. 3.50).
Сложнее объяснить механизмы, с помощью которых достигается соответствие корецептора, остающегося на Т-клетке при ее переходе на стадию моноположительных клеток, и специфичности TCR, который различает структуру не только пептида, но и молекулы MHC, в которую пептид встроен (рис. 3.51). Установлено, что на CD4CD8+ клетках в определенный момент ослабляется экспрессия корецептора CD8 (фенотип СD4+CD8lo). Если TCR специфичен к MHC-II, как и доминирующий корецетор (CD4), то в клетке генерируется сильный сигнал, и она переходит на стадию CD4CD8-. Если TCR обладает более высоким сродством к комплексу

Рис. 3.50. Факторы, контролирующие дифференцировку арТ-клеток

Рис. 3.51. Проверка специфичности корецептора при дифференцировке CD4+ и CD8+ Т-лимфоцитов (селекционная модель). Клетка выживает, если специфичность корецептора к молекулам главного комплекса гистосовместимости совпадает со специфичностью T-клеточного рецептора (на схеме в таких вариантах рецептор и корецептор окрашены одним цветом). Несовпадение специфичностей рецептора и корецептора приводит к апоптозу клетки
пептид-MHC-I, т.е. специфичность TCR и CD4 не совпадает, формируется слабый сигнал. Это приводит к усилению экспрессии CD8 и утрате CD4, т.е. к развитию CD4-CD8+ Т-клеток.
После такой селекции путем подтверждения адекватности корецеп- тора клетка приобретает функциональные свойства, соответствующие ее назначению. Так, CD8+ T-клетки (Т-киллеры) приобретают способность формировать цитолитический молекулярный комплекс, что обеспечивает функционирование такой Т-клетки в качестве цитотоксического Т-лимфо- цита. В CD4+ T-лимфоцитах (Т-хелперах) формируются внутриклеточные механизмы, необходимые для выполнения «хелперной» функции, прежде всего — способность активно вырабатывать цитокины при активации. В результате Т-клетки дифференцируются в функционально полноценные субпопуляции цитотоксических и хелперных Т-лимфоцитов.
В результате описанных выше процессов в тимусе образуется популяция функционально полноценных арТ-лимфоцитов, способных участвовать в иммунном ответе и обеспечивать антигенспецифическую иммунную защиту организма. Популяция зрелых Т-клеток гетерогенна по двум параметрам — специфичности TCR и функциональной активности. Разнообразие специфичностей TCR служит основой клональной структуры популяции Т-клеток. Тимоциты, сформировавшие уникальный по составу и специфичности рецептор, пройдя селекцию, образуют клон — группу потомков родоначальной клетки с рецепторами той же специфичности. В результате селекции клонов сохраняются и поддерживаются только клетки, распознающие комплексы аутологичных молекул MHC и эндогенных пептидов с умеренным сродством, недостаточным для развития ответа на аутоантигены, но достаточным для распознавания чужеродных пептидов в составе молекулы MHC на основе перекрестной реактивности.
Созревшие тимоциты довольно долго (7—14 сут) не покидают тимус, пребывая преимущественно в наружных слоях мозгового слоя, богатых дендритными клетками. В этот период завершается формирование аутотолерантности и Т-клетки приобретают свойства, важные для поддержания их жизнеспособности вне тимуса. Так, вследствие активации сиалилтранс- фераз происходит сиалирование мембранных гликопротеинов, защищающее лимфоциты от поглощения макрофагами. Созревшие Т-лимфоциты начинают экспрессировать набор мембранных молекул адгезии и рецепторов для хемокинов, необходимые для направленной миграции клеток в специализированные участки иммунной системы и для последующей рециркуляции. Например, под влиянием фактора KLF2 (Kruppel-like factor 2) на тимоцитах экспрессируются селектин L (CD62L), р7-интегрины, хемокиновый рецептор CCR7 и рецептор SIP-1 для сфингозин-1-фосфата. Последнему фактору приписывают основную роль в эмиграции зрелых Т-клеток из тимуса: созревшие клетки мигрируют в кровяное русло, т.к. их привлекает присутствующий в нем сфингозин-1 фосфат, который выступает в роли хемотаксического фактора.
Развитие Т-клеток в тимусе длится около 20 сут. За это время, с одной стороны, происходит массовая (до 99%) гибель тимоцитов в процессе их созревания (главным образом, на разных этапах селекции), а с другой — пролиферация выживших клеток с образованием клонов. В зрелом возрасте из тимуса ежедневно эмигрируют Т-клетки в количестве, равном 1% от общей численности тимоцитов.
Помимо рассмотренных выше субпопуляций CD4+ и CD8+ Т-лимфоци- тов в тимусе дифференцируются «неклассические» субпопуляции Т-клеток. Определенные успехи в изучении этих субпопуляций были достигнуты только в последние годы. Свойства этих клеток представлены в табл. 3.14.
Таблица 3.14. Естественные субпопуляции перферических Т-лимфоцитов
| Название | TCR | Корецепторы | Распознава емые лиганды | Локализация, содержание | Функции |
| Т-хелперы | р4 и Н со. б | CD4+ CD8- | Пептид- MHC-II | Кровь (35-40%), лимфатические узлы (30-40%), селезенка (20-25%), тимус (8-10%), кожа, слизистые | Предшест венники Т-хелперов |
| Т-килле- ры | CD4- CD8ap+ | Пептид- MHC-I | Кровь (20-25%), лимфатические узлы (15-20%), селезенка (10-15%), тимус (4-5%), слизистые, кожа | Предшест венники цитотокси ческих Т-лимфоци- тов | |
| Дважды положи тельные (DP) | CD4+ CD8+ | Нет данных | Кровь (около 1%) | Нет данных | |
| Дважды отрица тельные (DN) | CD4- CD8- | Нет данных | Печень, брюшная полость, костный мозг | Нет данных | |
| NKT- клетки | CD4+/- CD8- | Липид- CD1d | Печень (gt;10%), селезенка, слизистые | Первая линия защиты — источник IFNy | |
| Регуляторные T-к летки | CD4+ CD8- CD25hi | Пептид- MHC-II | Кровь (5-6%), лимфатические узлы, селезенка, тимус (3-6%), слизистые, нелимфоидные органы | Предот вращение аутоагрессии, иммунорегу ляция | |
| убТ-клет- ки | a н ‘f. | CD4- CD8- | Фосфопро- теины и др. | Лимфатические узлы, селезенка, кровь (2-3%), тимус (1%), слизистые, кожа (до 20%) | Первая линия защиты, иммунорегуляция |
| CD8aa- клетки | CD4- CD8aa+ | Вероятно, пептид- Qа-1/TL | Слизистые, особенно кишечника | Первая линия защиты, иммунорегуляция |
Источник