Почему не уменьшаются лимфоузлы после химиотерапии
анонимно, Женщина, 31 год
Юлия Александрова, добрый день.
В мае 2018 года после 2-х родов (мне 31 год, дням 4 года и 1 год) и прекращения гв (в феврале 2018) заметила уплотнение в левой груди. Было сделано УЗИ в 2-х клиниках в Екатеринбурге. В обеих был поставлен диагноз нелактационный мастит и прошла лечение. После физиопроцедур (лазер на участки груди) произошло покраснение и опухание груди.
В июне 2018 поступила на обследование в областную больницу, была сделана мамография, но аппарату не удалось сделать снимок груди во второй проекции, причиной была не болезненность как указано, а именно сбой, так как пытались неоднократно.
Взята биопсия опухоли. По данным обнаружили рак груди T4N2M0. Трижды негативный, на рецепторы HER по 0. ki67-90%.
Лечение врачи начали сразу (по плану было 8 курсов химиотерапии), пока я прошла 7 курсов химиотерапии.
Красная химия дала прекрасный результат (как и говорил врач, при таком высоком Кi67 химия должна помочь именно на эти растущие клетки), спал отек, ушла краснота и грудь приняла одинаковые размеры с правой молочной железой. Я очень была обрадована таким результатом и надеялась на возможную операцию либо полную гибель клеток опухоли.
Химию в целом переносила неплохо (была тошнота, бессонница), при этом сохранился аппетит и пока месячный цикл.
Но, после 5 химии (белая, паклитаксел) заметила при самостоятельной пальпации увеличение уплотнения. Врачу при следующем приёме соообщила. Было принято решение продолжить лечение паклитакселом. После 6 химии опухли лимфоузлы в подмышечной впадине. По моим ощущениям 2 лимфоузла.
7-я химия проводилась CMF (инъекциями в вену). Сейчас грудь снова стала краснеть, но при пальпации узелок кажется меньше.
Подскажите, лимфоузлы могли опухать из-за химиотерапии или снова опухоль дала рост?
На УЗИ между курсами не отправляли, рекомендовали сделать после всех химий.
Я очень переживаю, ведь после 4 Красных химий был такой замечательный эффект, а сейчас я не знаю в каком состоянии опухоль.
Порекомендуйте пожалуйста, что сделать для контроля за состоянием? Сделать УЗИ в платной клинике? Как проверить именно лимфоузлы?
Делать ли маммография?
Нужно ли делать УЗИ других органов (есть покалывание в правом боку и в районе левого яичника).
По поводу возможных метастазов, также изначально было поставлено М0, но ПЭТ КТ или УЗИ других органов не делали.
Врач на прошлом приёме сказал, что возможно сделаем ещё 2 курса красной химии, если в прошлый раз она дала эффект.
По поводу операции подскажите пожалуйста, при таком диагнозе так понимаю предстоит мастэктомия. У нас в больнице делают только удаление. В платных центрах возможно с одномоментный реконструкцией, знаю что и в Москве делают ее по квотам.
Врачам я доверяю, но вместе с тем понимаю, что у них поток пациентов, едут со всей Свердловской области.
Заранее благодарю Вас за помощь и ответы.
Успехов в Вашей профессиональной деятельности и благодарных пациентов!
Здравствуйте. Раз есть подозрение на продолженный рост опухоли, нужно, конечно, делать обследование. Опухать от химиотерапии лимфоузлы не должны. УЗИ брюшной полости, лимфоузлов подмышечных и над-подключиных, левой молочной железы, малого таза. Но тут же еще важна оценка в динамике. Новый УЗИст вам не оценит динамику. Это может только врач, который видел начало заболевания и эффект после первого блока ХТ. Если не делалось, в первичный объем обследования еще входит рентгенография легких (или в идеале КТ грудной клетки и брюшной полости с контрастированием, что показано при тройном негативном типе) и определение мутаций BRCA1 / 2 . Если в настоящий момент опухоль операбельна, то, возможно, стоит предпочесть мастэктомию
По поводу операции возможны 2 варианта. Можно одновременную реконструкцию. А можно мастэктомию с установкой эспандера, прохождение лучевой терапии и потом восстановление железы. Хирурги даже больше любят второй вариант, т.к. результат лучше по эстетичности обычно и нет осложнений в процессе лучевой терапии, которые возможны для одномоментной. Но это, конечно, затянуто по времени около года на все про все. Ну и окончательное решение, безусловно, за хирургом. В Блохина, последний раз докладывали, что одновременной пластикой занимаются 2 хирурга сразу: онколог и пластический.
Если в настоящий момент опухоль операбельна, то, возможно, стоит предпочесть мастэктомию с лимфаденэктомией уже сейчас, а после рассмотреть вариант адъювантной терапии капецитабином.
Источник
Скорость гибели опухолевых клеток при химиотерапии
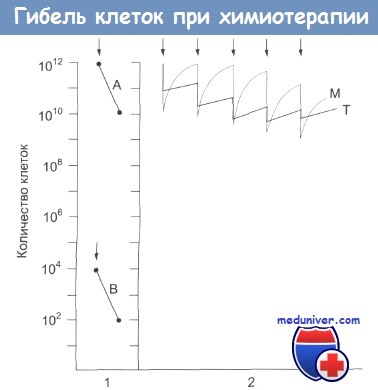
В экспериментальных исследованиях установлено, что некоторая доза цитотоксического препарата вызывает гибель определенной части клеточной популяции, а не определенного количества клеток. Рисунок схематически иллюстрирует эту гипотезу гибели фракции клеток. Например, введение однократной дозы препарата может привести к гибели 99% клеточной популяции, причем эта же доля клеток погибнет независимо от общего их количества: оно может быть, например, 1012 (тогда останется 1010 клеток) или 104 (останется 10 клеток).
Если это положение справедливо для солидных опухолей человека, то приходим к выводу о том, что для небольших опухолей более эффективной оказывается схема с применением меньшего количества циклов лечения, чем для более крупных опухолей. Поскольку в этом случае препарат назначается ограниченное количество раз, вероятность развития к нему лекарственной устойчивости снижается. Прием препарата может быть спланирован таким образом, чтобы обеспечить максимальный цитотоксический эффект.
Последний зависит от скорости репопуляции клеток опухоли и восстановления тканей здоровых органов, наиболее сильно поврежденных цитотоксическим препаратом. У человека обычно к этим органам относятся кишечник и костный мозг. По сравнению с большинством опухолей, они быстро регенерируют. По этой причине химиотерапевтические препараты назначают в ритмическом режиме через определенные интервалы, необходимые для протекания восстановительных процессов.
Такой подход имеет некоторые теоретические и практические ограничения.
Справедливость гипотезы гибели фракции клеток оценивалась на экспериментальной модели гомогенных быстрорастущих опухолей, и экстраполяция ее положений на медленнорастущие опухоли человека выявляет очевидные недостатки.
Предполагается, что для экспериментальных опухолей, растущих в виде асцита или развивающихся в жидкой среде организма (например, лейкозы), противоопухолевые препараты распределяются равномерно. Очевидно, что этого не происходит в случаях плохо васкуляризованных солидных опухолей, и кинетика гибели клеток при этом описывается гораздо более сложной функцией, чем уравнение первого порядка, справедливое для экспериментальных систем.
Доля резистентных опухолевых клеток может являться функцией размера опухоли (см. «Лекарственная устойчивость при химиотерапии рака» ниже) и возрастать с ее увеличением.
При повторных курсах химиотерапии скорость репопуляции опухоли может изменяться. Хотя для экспериментальных асцитных моделей этого не наблюдается, в случае солидных опухолей ситуация меняется.
Степень восстановления здоровых тканей, например, если судить по данным анализа крови, может оказаться полной после первых нескольких циклов лечения. Однако, по мере продолжения лечения, восстановление замедляется, что накладывает ограничения на дозы препарата, назначаемые в последующих циклах.
Существует крайне ограниченный клинический материал о характере зависимости доза-эффект для конкретных цитотоксических агентов и определенного типа опухолей. Клиническая фармакология химиотерапевтических препаратов крайне сложна и отличается от препарата к препарату. Существуют клинические данные, согласно которым противоопухолевый эффект препарата проявляется только при его назначении в максимальной дозе, и на практике различие между неэффективной и максимально-переносимой дозой может быть незначительным.
Тем не менее, несмотря на высказанные соображения, в химиотерапии широко используется ритмический режим назначения препаратов через определенные интервалы времени. Этот режим был разработан на основании экспериментальных исследований и клинических испытаний.

Фракционированная гибель клеток.
В первой части рисунка обозначена определенная доза препарата, вызывающая гибель 99% клеток как в случае А, так и в случае В.
В случае А количество клеток в опухоли снижается с 1012 до 1010, а в случаев с 104 до 102. Во второй части рисунка кривая Т иллюстрирует эффект повторных введений препарата (показаны стрелкой) на рост опухоли.
С введением каждой повторной дозы препарата гибель клеток снижается, что указывает на развитие у них устойчивости к препарату.
Кривая М иллюстрирует действие препарата на клетки-предшественницы в костном мозге. Эти клетки быстро восстанавливаются, однако по мере введения повторных доз препарата темпы восстановления снижаются и появляются клинические признаки подавления миелопоэза.
Гибель опухолевых клеток при применении комбинации химиотерапевтических препаратов
Даже в случаях таких чувствительных опухолей, как болезнь Ходжкина, назначение одного препарата редко приводит к излечению. Поэтому логично попытаться увеличить эффективность лекарственных средств и продолжительность их действия, одновременно назначая несколько препаратов. Цель применения рецептур заключается в попытке преодолеть возможно больше механизмов, ответственных за устойчивость опухоли к цитотоксическим агентам. Очень скоро такой подход оказался эффективным в лечении детских лейкозов и лимфом у взрослых, а также стал применяться для лечения больных с другими опухолями.
При разработке режима комбинированной химиотерапии необходимо соблюдать следующие общие принципы.
• Следует назначать только те препараты, которые оказываются эффективными при изолированном применении.
• По возможности необходимо назначать препараты, токсичность которых не перекрывается.
• Следует применять ритмический режим назначения препаратов с тем, чтобы обеспечить протекание восстановительных процессов в кишечнике и костном мозге.
• В идеале, каждое лекарственное средство должно назначаться в оптимальной дозе и по оптимальной схеме.
• По возможности, следует назначать препараты, характеризующиеся синергическим действием (правда, на практике такие агенты неизвестны).
• Если возможно, необходимо применять препараты, влияющие на различные фазы клеточного цикла.
• Большинство схем лечения разработаны эмпирически с учетом опыта врача.
Повышение эффективности, которое достигается при использовании рецептур, объясняется несколькими причинами.
• Опухоль подвергается воздействию нескольких препаратов, и вероятность развития лекарственной устойчивости снижается.
• Максимальный цитотоксический эффект достигается без увеличения токсичности.
• Существует меньшая возможность раннего появления популяции клеток, устойчивых к препаратам.

– Также рекомендуем “Причины устойчивости опухолевых клеток к химиотерапии”
Оглавление темы “Лучевая и химиотерапия онкологических заболеваний (рака)”:
- Планирование и выбор метода лучевой терапии (радиотерапии)
- Эффективность сочетания лучевой терапии и химиотерапии
- История химиотерапии онкологических заболеваний (рака)
- Мишени клетки для противоопухолевых препаратов (для химиотерапии)
- Принципы и фазы разработки противоопухолевых препаратов (для химиотерапии)
- Влияние противоопухолевых препаратов на клеточный цикл
- Скорость гибели опухолевых клеток при химиотерапии
- Причины устойчивости опухолевых клеток к химиотерапии
- Клеточные механизмы устойчивости к цитостатикам
- Индукция ремиссии и поддерживающая терапия в химиотерапии рака
Источник
Схемы химиотерапии
Схема химиотерапии зависит от множества факторов (стадия заболевания, тип и размеры опухоли, наличие/отсутствие метастаз, возраст пациента и сопутствующие заболевания и т.п.) и опирается на несколько принципов:
Лекарства должны быть подобраны так, чтобы уничтожить все виды раковых клеток в организме;
Сочетание лекарств подбирается таким образом, чтобы побочные эффекты не усиливались;
Злокачественные клетки не должны адаптироваться к применяемым химпрепаратам;
Дозировка зависит от возможностей пациента перенести терапию.
Схема химиотерапии обычно называется по первым буквам используемых в курсе лекарственных препаратов (если их несколько). Например, ECF (эпирубицин, цисплатин и 5-FU) или EOX (эпирубицин, оксалиплатин и капецитабин) и др. Иногда может потребоваться лечение лишь одним лекарственным средством.
Курс химиотерапии
Перед химиотерапией: как подготовить организм?
Химиотерапия действует на всех по-разному, даже если используются одни и те же лекарства. Это связано с возрастом пациента, его состоянием, спецификой опухоли, наличием сопутствующих заболеваний.
Однако существует ряд рекомендаций, которые позволят легче перенести предстоящий курс лечения.
Отказаться от вредных привычек – курение, прием алкоголя.
Пролечить сопутствующие заболевания, находящиеся в стадии обострения (в том числе кариес и пульпиты).
Желательно проконсультироваться с психологом или пройти подготовку к побочным эффектам.
Сдать необходимые анализы (их назначает врач).
Проведение химиотерапии
Химиотерапия может проводиться в условиях стационара или амбулаторно, реже – дома.
Лекарственные препараты могут вводиться в организм по-разному, что зависит от диагноза, локализации опухоли и наличия метастаз.
наружно: при раке кожи;
перорально в виде таблеток и капсул (самый простой способ, не требующий присутствия медицинского персонала);
внутривенно (самый распространенный путь введения): препарат попадает в кровь и действует системно;
локально: интраперитонеально (то есть через живот – используется при лечении онкологии органов брюшной полости), интраплюрально (в грудную клетку), интравесциально (через уретру) и т.д.;
непосредственно в опухоль (как правило, проводится во время операции при прямом доступе к злокачественному образованию).
Сколько длится химиотерапия?
Лечение химпрепаратами достаточно длительное, так как лекарства воздействуют не только на больные клетки, но и на здоровые, и, значит, требуются перерывы между курсами лечения. Чаще всего курс лечения состоит из нескольких циклов в несколько дней с «отдыхом» в несколько недель. В среднем химиотерапия занимает 3-6 месяцев.
После химиотерапии
Восстановление после химиотерапии
Период восстановления у всех проходит по-разному. Кому-то достаточно нескольких месяцев, а у кого-то может уйти несколько лет. Обычно под «восстановлением» понимают возвращение нормального функционирования органов и тканей, которые подверглись побочным эффектам, нормализация веса и т.п.
Традиционно лечащий врач назначает ряд восстанавливающих препаратов, которые способствуют восстановлению функций почек, печени, состава крови, расписывает сбалансированную диету и рекомендует обильное питье.
Опухоль после химиотерапии
При диагностике заболевания на ранней стадии зачастую полностью уничтожается, однако это происходит не всегда. Но это не свидетельствует о неудачном лечении, так как все зависит от целей курса. Например, зачастую терапия помогает уменьшить злокачественное образование, что позволяет успешно провести ее хирургическое удаление, или с помощью химпрепаратов можно повысить чувствительность раковых клеток к последующей лучевой терапии.
Кровь после химиотерапии
Меняет свой состав. Обычно лекарственные препараты снижают количество клеток крови, что ведет к негативным последствиям.
Лейкоциты после химиотерапии
Чрезвычайно снижены, поэтому их количество необходимо поднять, ведь именно эти белые кровяные тельца выполняют защитную функцию организма, повышают иммунитет.
Тромбоциты после химиотерапии
Также снижены по сравнению с нормой, что влечет нарушения свертываемости крови.
Снижение эритроцитов чревато анемией.
Волосы после химиотерапии
начинают отрастать чере 3-4 недели после проведения последней процедуры химиотерапии. Для роста волос необходимо использовать репейное масло, ополаскивание головы натуральными отварами трав, втирание масел.
Боли после химиотерапии
Возникают не у всех, однако это довольно частое явление. Боли возникают на месте опухоли, вследствие поражения раковых клеток. В случае появления сильных болей необходимо поставить лечащего врача в известность: он не только пропишет обезболивающие, но и порекомендует соответствующую диету (например, при болях во время опорожнения кишечника или при болях в области гортани), режим дня. Также рекомендуется консультация сопутствующего специалиста и наблюдение у него (стоматолог, невролог, кардиолог и т.д.).
Температура после химиотерапии
Связана со снижением защитных функций организма, что способствует проникновению инфекций и развитию воспалительного процесса. Необходимы консультация специалиста и последующее лечение.
Печень после химиотерапии
Зачастую находится в наименее выгодном положении в сравнении с другими органами, ведь именно она способствует переработке токсинов и их выведению. Необходимо помочь ей восстановиться, вывести остатки токсических веществ и тяжелых элементов. Признаками поражения печени является желтизна кожи и белков глаз, появление или увеличение количества сосудистых звездочек.
Лимфоузлы после химиотерапии
У некоторых пациентов склонны к отечности и увеличению, что связано с реакцией на препараты химиотерапии. Но также это может свидетельствовать о прогрессировании заболевания. Потому необходимо посетить врача.
Тошнота после курса лечения химпрепаратами
Частое явление. Зачастую врач назначает специальные противорвотные средства.
Отеки после химиотерапии
Возникают из-за обильного питья, необходимого для улучшения самочувствия и выведения из организма продуктов распада препаратов химиотерапии и мертвых клеток. Преимущественно отекают конечности. Отеки являются частым побочным действием многих биогенных препаратов и химиотерапевтических лекарств.
Возникающие отеки после химии не свидетельствуют о сбое функций почек, через несколько недель после завершения курса химиотерапии все восстанавливается. Первостепенная помощь организму достигается за счет диеты, которая помогает почкам в их работе, а также пополняет запасы необходимых веществ.
Лимфома — это злокачественная опухоль, которая поражает лимфатическую систему. Проявляется она увеличением лимфатических узлов и поражением внутренних органов из-за инфильтрации бесконтрольно размножающимися злокачественными лимфоцитами. Лимфомы делятся на два больших типа — ходжкинские лимфомы (или лимфогранулематоз) и неходжкинские лимфомы. Отличить один вид от другого можно только с помощью морфологического исследования опухолевой ткани.
Лимфома Ходжкина
Лимфома Ходжкина названа так в честь доктора, который впервые описал данное заболевание. Он предложил выделить его в отдельную нозологию. Отличительной чертой данной лимфомы является образование гранулем с гигантскими клетками Березовского-Штернберга.
Причиной развития лимфомы является злокачественное перерождение В-лимфоцитов — клеток иммунной системы, которые в больших количествах находятся в лимфоидной ткани. Соответственно, лимфома может развиться в любом месте, где есть такая ткань — лимфатические узлы, внутренние органы (печень, селезенка, легкие). Со временем из первичного очага опухоль диссеминирует по всему организму.
Обычно первым признаком лимфомы Ходжкина является увеличение лимфатических узлов, их может быть 1 или несколько. Чаще их можно заметить на затылке, над ключицами, в области подмышечных впадин или в паху . Узлы безболезненны и увеличиваются в размерах довольно медленно.
Нередко бывает так, что первичный очаг лимфомы располагается в недоступных для осмотра местах, например в грудной или брюшной полости, вдоль позвоночника, в области средостения. В этом случае первые симптомы возникают при сдавлении внутренних органов опухолевыми массами. Чем больше размер лимфоузлов, тем сильнее они давят и тем более выражены симптомы. Например, при локализации опухоли в средостении может быть кашель, при поражении внутрибрюшных лимфоузлов — боли в животе и др.
Также могут быть неспецифические симптомы:
- Повышение температуры, не связанное с инфекционными заболеваниями.
- Ночные поты.
- Необъяснимое снижение веса.
Триада этих признаков называется В-симптомом, и он имеет большое значение при определении стадии заболевания и планировании лечения.
При диагностике лимфомы необходимо пройти комплексное обследование, включающее методы лучевой диагностики и ряд лабораторных анализов. Подтверждение диагноза производится только с помощью морфологического исследования фрагмента опухоли под микроскопом, оно же помогает определить вид лимфомы. Для его проведения берут пораженный лимфоузел.
Далее необходимо определить стадию заболевания. С этой целью назначаются различные методы лучевой диагностики — УЗИ, КТ, МРТ. Для более полной визуализации очагов лимфомы используют позитронно-эмисионную томографию одновременно с проведением КТ или МРТ, такое исследование называется ПЭТ-КТ и ПЭТ-МРТ соответственно. ПЭТ-МРТ не оказывает лучевой нагрузки на организм и хорошо визуализирует мягкие ткани, соответственно его используют для обследования лимфатических узлов и внутренних органов. Метод является относительно новым и мало распространен.
ПЭТ-КТ достаточно широко используется и зачастую является ключевым методом, позволяющим выявить поражение лимфатической ткани в организме пациента. Если есть подозрение, что лимфома поразила кости, проводят сцинтиграфию.
На основании полученных данных определяют стадию лимфомы:
- 1 стадия — имеется поражение одной группы лимфатических узлов, либо одного нелимфатического органа.
- 2 стадия — поражены несколько групп лимфатических узлов по одну сторону диафрагмы, либо имеется поражение одного нелимфатического органа с метастазами в регионарных лимфоузлах.
- 3 стадия лимфомы генерализованная, при ней имеется поражение нескольких групп лимфатических узлов по обе стороны диафрагмы, плюс к этому может быть поражение одного нелимфатического органа и/или селезенки.
- 4 стадия лимфомы называется диссеминированной, поскольку при ней помимо лимфоузлов есть диффузное поражение внутренних органов — печени, костного мозга, ЖКТ и др.
Для лечения лимфом применяется лучевая терапия, химиотерапия и их комбинация. При лимфомах 1-2 стадии при отсутствии В-симптоматики применяется облучение пораженных групп лимфатических узлов. В подавляющем большинстве случаев (у 80-85% таких больных) удается добиться стойкой длительной ремиссии.
Остальным больным лимфомой проводится комбинированное лечение, включающее химиотерапию и облучение. Для больных со 2 стадией с поражением тазовых лимфоузлов и больных 3 стадией проводится химиотерапия с облучением только пораженных лимфоузлов по минимальной программе. Потом облучаются все группы лимфатических узлов в максимальных дозах, и в течение 2-3 лет проводится поддерживающая химиотерапия.
Для больных с 3-4 стадией лимфомы сначала проводится индукция ремиссии с помощью полихимиотерапии, и после выхода в ремиссию проводят поддерживающую химиотерапию или лучевую терапию по радикальным режимам.
Если не удается достичь ремиссии, или возник рецидив лимфомы, пациенту предлагают высокодозную полихимиотерапию. Это очень мощное лечение, которое помогает преодолеть резистентность опухоли и уничтожить злокачественные клетки в максимальном объеме. Однако оно разрушает костный мозг, поэтому после его проведения необходима трансплантация кроветворных стволовых клеток. Их могут взять у самого пациента до проведения высокодозной полихимиотерапии, или же использовать донора. Донорские клетки позволят не только восстановить кроветворение, но и дать больному противоопухолевый иммунитет, который дополнительно будет бороться с лимфомой. Однако есть риск развития реакции трансплантат против хозяина, которая в тяжелых случаях может привести к летальным исходам. Выбор метода трансплантации при лимфоме решается индивидуально для каждого больного.
Причины развития боли при лимфоме
Развитие боли при лимфоме может быть обусловлено как самой болезнью, так и действием химиотерапии или облучения. Наиболее выраженных болевой синдром наблюдается при поражении костей, которое развивается при метастазировании лимфомы. Другими причинами могут быть:
- Сдавление опухолевой массой нервных окончаний.
- Расширение капсулы пораженных лимфатических узлов и органов.
- Давление опухоли на рядом расположенные органы.
- Выделение опухолевыми клетками медиаторов воспаления, которые провоцируют развитие болевых ощущений.
- Нейропатия на фоне химиотерапии и лучевой терапии.
Как правило, пациенты, страдающие от лимфомы, имеют сразу несколько видов болей, которые требуют разных подходов. Вместе с тем, они не всегда сообщают об этом лечащему врачу, считая боль неизбежным спутником болезни. Это большая ошибка, поскольку хронический болевой синдром ухудшает общее самочувствие, изнуряет человека, не оставляя сил на борьбу с лимфомой.
Сейчас медицина располагает большим арсеналом эффективных методов лечения хронической боли у онкологических больных. Поэтому всегда сообщайте вашему лечащему врачу об изменении своего самочувствия.
Профилактика ходжкинской лимфомы
К сожалению эффективных мер профилактики ходжкинской лимфомы нет. Врачи дают только общие рекомендации:
- Придерживаться здорового образа жизни.
- Ограничить контакт с химическими канцерогенами в быту и на производстве.
- Соблюдать режим сна и отдыха.
- Избегать воздействия ионизирующего излучения.
- По возможности пройти вакцинацию против инфекций, которые могут спровоцировать развитие лимфом.
Прогноз при лимфоме
Прогноз при лимфоме Ходжкина зависит от стадии заболевания. Например, при 1-2 стадии возможно полное излечение у 90% пациентов. О выздоровлении говорят, если в течение пяти лет после окончания лечения не было рецидива. У пациентов с 3-4 стадией эти показатели хуже. Пятилетняя безрецидивная выживаемость при лимфомах 3 стадии составляет 60-80%, а при 4 — менее 45%.
К какому врачу обратиться
При подозрении на лимфому необходимо обратиться к онкологу и пройти соответствующее обследование. После постановки диагноза, лечением будут заниматься врачи-химиотерапевты и радиологи.
Источник