Плоскоклеточный рак с метастазами в шейных лимфоузлах
Симптомы метастаза рака в лимфатический узел и его лечение
Код по МКБ-10: С77.0
Наряду с первичными опухолями лимфоидной ткани (злокачественные лимфомы) весьма значительную группу составляют метастатические поражения лимфатических узлов шеи. Наиболее часто источником метастазов бывает плоскоклеточный рак слизистой оболочки верхних дыхательных путей и верхней части ЖКТ.
Кроме того, иногда встречаются метастазы опухолей редких гистологических типов, а также опухолей, локализующихся вне области головы и шеи. В особую форму выделяют метастазы в шейные лимфатические узлы при неустановленной первичной опухоли.
Лимфогенное распространение плоскоклеточного рака происходит при инвазивном росте первичной опухоли и проникновении ее клеток в лимфатические сосуды. Эти клетки затем через приносящие лимфатические сосуды достигают следующей группы лимфатических узлов. Лишь небольшой части опухолевых клеток удается избежать воздействия местных факторов иммунитета.
Эти клетки обычно пролиферируют в субкапсулярных синусах лимфатических узлов, прежде чем превратиться в микрометастазы (менее 3 мм), однако клинические признаки поражения на этой стадии еще отсутствуют. По мере дальнейшей пролиферации опухолевых клеток образуются макрометастазы с экстракапсулярной и экстранодальной экспансией опухоли и продолжается лимфогенное и гематогенное распространение опухоли.
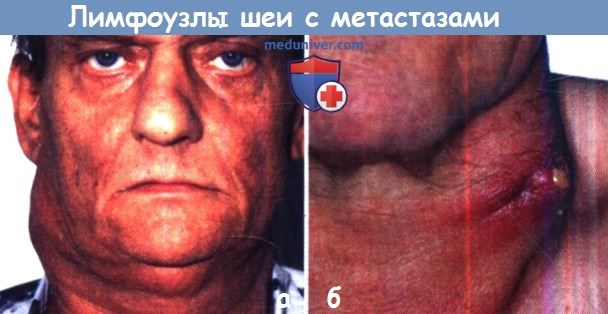
а Лимфатические узлы, пораженные метастазами, имеют вид плотных безболезненных опухолевидных образований, фиксированных к окружающим тканям.
б Изъязвление пораженного метастазами лимфатического узла характеризуется появлением геморрагического отделяемого и часто воспалительной реакцией со стороны окружающей кожи.
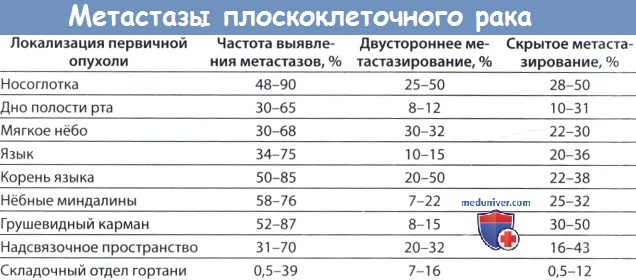
Вероятность лимфогенного распространения рака области головы и шеи зависит от локализации первичной опухоли и плотности лимфатической сосудистой сети. Вот почему, например, рак носоглотки и нёбной миндалины чаще дает метастазы, чем рак голосовой складки и гортаноглотки. Вероятность метастазирования зависит также от размеров первичной опухоли и глубины ее инвазии, степени дифференцировки (гистологическая градация I—IV), признаков наличия опухолевых клеток в лимфатических сосудах (карциноматозный лимфангиоз) и прорастания опухоли в оболочку нервов.
Возможно также, особенно при срединной локализации опухоли (например, рака носоглотки, корня языка, нёба, заперстневидного пространства) и при прогрессирующей опухолевой экспансии, двустороннее и перекрестное (в контралатеральные лимфатические узлы) метастазирование.
Лимфогенное распространение опухоли характеризуют с помощью классификации TNM, предложенной Американской объединенной комиссией по борьбе с раком и Американским противораковым союзом. Наряду с критерием Т, характеризующим степень распространения первичной опухоли, и M, отражающим наличие или отсутствие отдаленных метастазов, в классификации учитывается также состояние лимфатических узлов, наличие в них метастазов и степень распространения их по лимфатической системе (критерий N).
Номенклатура и топография шейных и лицевых лимфатических узлов была неоднократно модифицирована на основании результатов изучения особенностей метастазирования опухолей головы и шеи в зависимости от их локализации и характера выполненного хирургического вмешательства. В классификации Robbins и соавт. выделено шесть уровней лимфатических узлов.
В этой классификации помимо прочего не учтены позадиушные, предушные, заглоточные и затылочные лимфатические узлы. Цель классификации заключалась в том, чтобы облегчить хирургам выполнение лимфодиссекции с учетом преимущественных путей лимфогенного распространения опухоли верхних дыхательных путей и начального отдела ЖКТ, сохраняющих относительное постоянство и предсказуемых, хотя, разумеется, возможны индивидуальные особенности в характере дренирования лимфы из той или иной области.
P.S. Поражение регионарных лимфатических узлов метастазами достоверно снижает 5-летнюю выживаемость больных, если пораженные лимфатические узлы спаяны с окружающими тканями и подвижность их ограничена, то шансы больного на выживание резко снижаются.

Вирховский лимфатический узел пальпируют в левой надключичной ямке в месте впадения грудного протока в левый венозный угол, образованный внутренней яремной и подключичной венами.
Предлестничные лимфатические узлы располагаются в предлестничной жировой клетчатке, которая занимает пространство, ограниченное внизу подключичной веной, медиально – внутренней яремной веной, латерально-лопаточно-подъязычной мышцей. Дном этого пространства служит передняя лестничная мышца вместе с проходящим рядом диафрагмальным нервом. Количество лимфатических узлов в предлестничном пространстве колеблется от 3 до 30.
Метастазы в надключичных лимфатических узлах являются противопоказанием к хирургическому лечению злокачественных опухолей органов брюшной и грудной полости, а также женских половых органов.
Лимфа, оттекающая от тканей и органов шеи, прежде чем попасть в кровеносное русло, проходит три эшелона лимфатических узлов.
Хирургическое удаление лимфатических узлов шеи, пораженных метастазами, является важной частью лечения опухолей области головы и шеи.

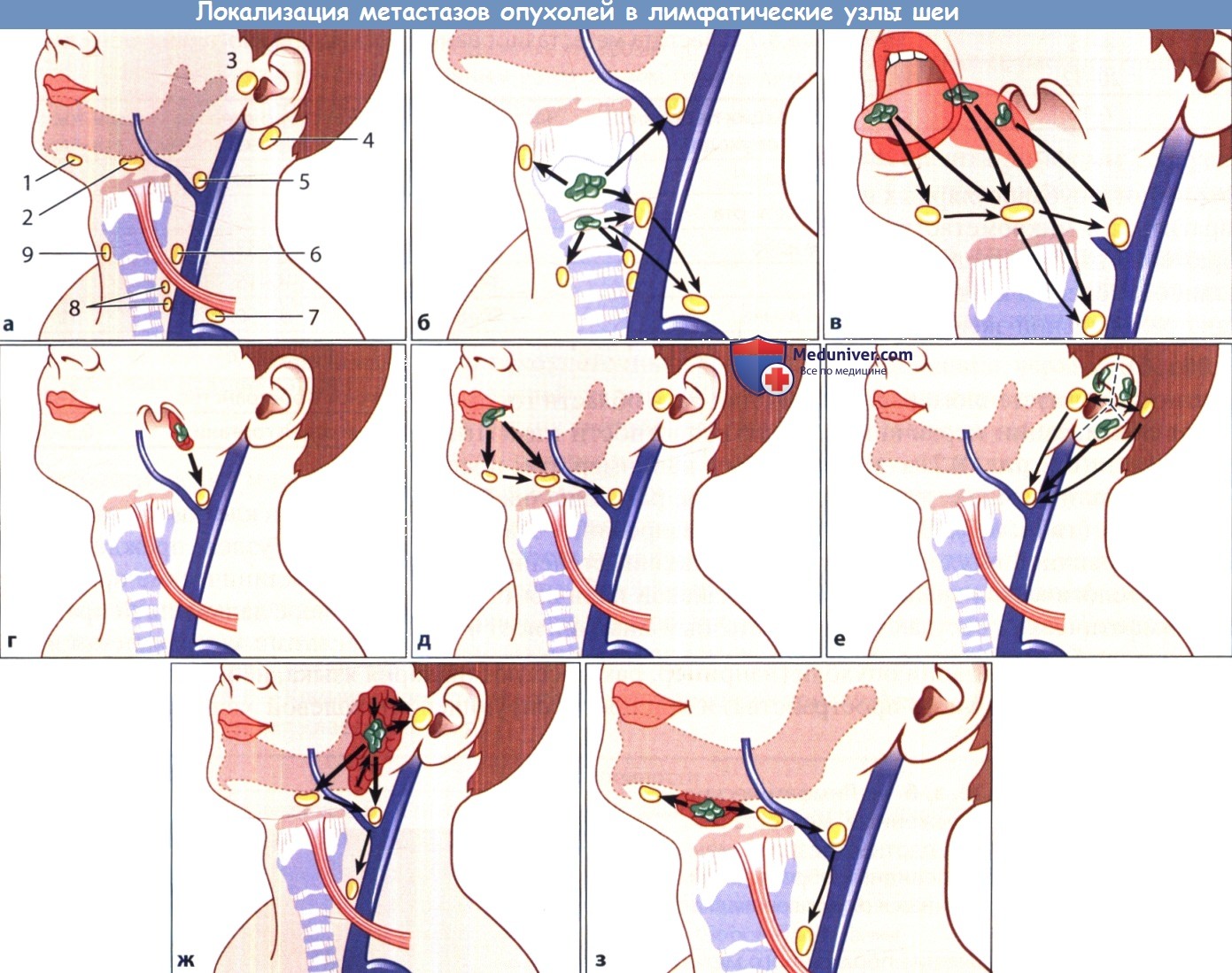
а Типичная локализация пораженных метастазами лимфатических узлов шеи.
1 – подподбородочные лимфатические узлы; 2 – подчелюстные лимфатические узлы; 3 – околоушные и предушные лимфатические узлы;
4 – позадиушные лимфатические узлы; 5 – лимфатические узлы яремно-лицевого венозного угла; 6 – глубокие шейные лимфатические узлы;
7 – лимфатические узлы области яремно-ключичного угла: нижние глубокие шейные и надключичные лимфатические узлы; 8 – претрахеальные и перитрахеальные лимфатические узлы; 9 – предгортанные лимфатические узлы.
б Рак гортани. в Рак языка различной локализации. г Рак нёбной миндалины.
д Рак нижней губы. е Рак наружного уха. Обратите внимание на сегментарный тип дренирования лимфы.
ж Рак околоушной железы (следует помнить о метастатическом поражении внутрижелезистых лимфатических узлов). з Рак подчелюстной железы.
Метастатические опухоли при неустановленном первичном очаге
Метастатические опухоли при неустановленном первичном очаге (CUP syndrome, Cancer of Unknown Primary) занимают особое место в диагностике и лечении злокачественных опухолей шеи, метастазирующих в регионарные лимфатические узлы. В этих случаях речь идет об одном метастазе или более, подтвержденных гистологическим исследованием, при невыделенной первичной опухоли несмотря на интенсивное обследование в полном объеме.
Метастазы в лимфатические узлы наиболее часто появляются в области головы и шеи. В 50-70% случаев первичная опухоль локализуется также в этой области. В 20-30% случаев первичная опухоль локализуется вне уха, носа и горла.
Даже после полного клинического обследования и исследования методами визуализации у 3-9% больных с метастатическим поражением шейных лимфатических узлов выявить первичную опухоль не удается. Чаще всего ею является плоскоклеточный рак, реже – аденокарцинома или недифференцированный рак. Менее чем в 10% случаев первичной опухолью оказывается скрытая меланома.

Согласно одной из гипотез, рост метастатической опухоли оказывается настолько быстрым, что первичная опухоль не успевает проявиться клинически. Возможно также, что речь идет о рецидиве первичной опухоли в силу изменения местного иммунитета. По-видимому, у некоторых больных с метастатической опухолью при неустановленном первичном очаге развитие первичной опухоли происходит «в обход» лимфогенной и гематогенной стадии, поэтому установить ее локализацию бывает трудно.
Диагноз метастатической опухоли при неустановленном первичном очаге ставят лишь после полноценного обследования, включая эндоскопию верхних дыхательных путей и верхнего отдела ЖКТ на фоне общей или местной анестезии, а также методы визуализации, такие как КТ и МРТ. Поскольку в большинстве случаев метастатического плоскоклеточного рака шейных лимфатических узлов первичная опухоль локализуется в нёбной миндалине, корне языка, глотке и грушевидном кармане, диагностика должна включать тонзиллэктомию, биопсию слизистой оболочки носоглотки, глубокую биопсию корня языка, а также слизистой оболочки гортаноглотки.
В зависимости от результатов гистологического исследования, особенно если метастазами поражена глубокая цепочка лимфатических узлов шеи, поиск первичной опухоли следует распространить на органы и ткани, расположенные ниже уровня ключицы, дополняя его при необходимости такими методами визуализации, как КТ и МРТ грудной клетки и живота, а также ПЭТ. Примерно в 30% случаев удается выявить скрытый бронхогенный рак легкого. При необходимости важно привлечь к обследованию и других специалистов (например, пульмонолога, гастроэнтеролога, гинеколога, уролога и др.). В целом, объем диагностических исследований, необходимых для выявления первичной опухоли, зависит от распространенности опухолевого процесса и прогноза, а также общего состояния больного.
Лечение и прогноз. Особенности лечения определяются результатом гистологического исследования и локализацией пораженных метастазами лимфатических узлов. При подозрении на скрыто протекающий плоскоклеточный рак обычно следует выполнить шейную лимфодиссекцию в сочетании с лучевой терапией. Обычно после модифицированной радикальной лимфодиссекции проводят лучевую терапию, включая в облучаемое поле область, дренируемую пораженными метастазами лимфатическими узлами. После такого комбинированного лечения 5-летняя выживаемость в среднем составляет 50-60% (если поражение охватывает верхнюю группу лимфатических узлов шеи и оценивается как N1 или N2).
Если первичной опухолью является аденокарцинома, то наличие метастазов в шейных регионарных лимфатических узлах всегда указывает на далеко зашедший опухолевый процесс, и тактику лечения в таком случае следует выбирать индивидуально с учетом потребностей и ожиданий больного. При поражении метастазами верхних шейных лимфатических узлов можно выполнить лимфодиссекцию с последующей лучевой терапией. При поражении глубоких шейных лимфатических узлов возможно только паллиативное лечение. Пятилетняя выживаемость больных с таким поражением составляет 0-28%.
При метастатическом поражении шейных лимфатических узлов скрытой меланомой выполняют модифицированную радикальную лимфодиссекцию шеи.

– Также рекомендуем “Методика биопсии предлестничных лимфатических узлов шеи”
Оглавление темы “Заболевания шеи”:
- Симптомы боковой кисты шеи (бранхиогенной кисты) и ее лечение
- Симптомы кривошеи и ее лечение
- Симптомы гемангиомы шеи и ее лечение
- Симптомы лимфангиомы шеи (кистозной гигромы) и ее лечение
- Симптомы аневризмы шеи и ее лечение
- Симптомы опухоли каротидного тельца (хемодектомы) и ее лечение
- Симптомы доброкачественной опухоли шеи – липомы, невриномы
- Симптомы лимфомы шеи и ее лечение
- Симптомы метастаза рака в лимфатический узел и его лечение
- Методика биопсии предлестничных лимфатических узлов шеи
Источник
В статье представлен обзор литературы по наиболее неизученной проблеме в онкологии опухолей головы и шеи — диагностике и лечению пациентов с метастазами в лимфатические узлы шеи без выявленного первичного очага.
Несмотря на доступность визуального исследования лимфатических узлов шеи, широкое распространение методов лучевой диагностики и эндоскопии, поиск первичной опухоли до сих пор остается не-решенной проблемой [1]. Даже при внедрении в онко-логию новых диагностических методик, таких как позитронная эмиссионная томография (ПЭТ), частота выявления данной патологии осталась на прежнем уровне. Что же касается методов лечения данной кате-гории больных, выбор тактики лечения зависит от предпочтений специалиста. Хотелось бы отметить, что на сегодняшний день не существует стандартов лечения этой сложной категории больных в связи с недостаточным числом пациентов и, следовательно, отсутствием рандомизированного исследования.
На долю больных с метастазами злокачественных опухолей без выявленного первичного очага (ВПО), по данным различных авторов, приходится от 0,5 до 15 % больных (8-е место в структуре онкологической заболеваемости) [2−5]. Эта нозологическая группа отража-ет наиболее агрессивный тип злокачественных опухо-лей, метастазирование которых возникает на самых ранних этапах развития [6]. Наиболее частая локали-зация метастатического поражения без ВПО: лимфа-тические узлы (ЛУ), легкие и кости [7]. Среди всех групп ЛУ наиболее часто поражаются шейные и над-ключичные ЛУ, при этом первичный опухолевый очаг находится в 40−62 % случаев в области головы и шеи [8]. Примерно у 5 % больных с доказанными опухолевыми очагами области головы и шеи первым симптомом заболевания является увеличение шейных ЛУ, причем в 10 % случаев отмечено двустороннее поражение [8].
Основная жалоба данной категории больных — появление увеличенных ЛУ на шее. Как правило, эти пациенты обращаются к врачам общей практики и по-лучают противовоспалительное лечение по поводу неспецифического лимфоденита с применением анти-бактериальных препаратов и физиотерапевтических процедур, что в свою очередь оказывает негативное влияние на течение опухолевого процесса. Это обусловлено тем, что у врачей первичного звена отсутствует онкологическая настороженность, и в результате пациенты обращаются за специализированной помощью в более поздние сроки и с более распространен-ным опухолевым процессом. Вследствие этого ухуд-шаются результаты лечения этой сложной группы больных, а как известно, чем раньше начато лечение, тем оно эффективнее.
При выявлении метастатического поражения ЛУ шеи проводят диагностический поиск, включающий в себя тщательный сбор анамнеза, клинический осмотр, панэндоскопию с биопсией подозрительных участков, ультразвуковое исследование шеи, брюшной полости, рентгенографию органов грудной клетки, компьютерную (КТ) и магнитно-резонансную томографии по показаниям, выполнение тонкоигольной аспирационной биопсии (ТАБ) ЛУ с цитологическим исследованием материала. Хотелось бы отметить, что чувствительность и специфичность цитологического метода составляют 81 и 100 % соответственно [9−12], хотя по данным некоторых авторов показатель чувс-твительности не превышает 57 % [13]. Цитологическая диагностика помогает клиницисту в определении морфологической структуры опухоли, что позволяет не-сколько сузить диагностический поиск, но, к сожалению, не может определить органоспецифичность.
В случаях неоднократных отрицательных результатов ТАБ показано выполнение открытой биопсии. В течение длительного времени обсуждался вопрос об ухудшении прогноза у пациентов, которым была вы-полнена открытая биопсия. Однако в исследовании E.R. Ellis et al. в данной группе больных ухудшения прогноза отмечено не было [14]. Хотя ряд авторов от-мечают, что при выполнении хирургических вмеша-тельств после ранее выполненных открытых биопсий ввиду рубцовых изменений чаще возникают техничес-кие трудности.
В последнее время активно обсуждается применение ПЭТ как рутинного метода диагностики, однако данные различных авторов противоречивы. Так, первые попытки показали неутешительные результаты при выявлении первичной опухоли [15−17]. Тем не менее усовершенствование ПЭТ и интеграция с КТ привели к улучшению клинического значения в поиске первич-ного очага [18]. Использование ПЭТ у пациентов с метастазами в ЛУ шеи позволяет выявить первичный очаг у 30 % больных после отрицательных клинических и рентгенологических исследований [19, 20].
Учитывая, что наиболее частой локализацией пер-вичной опухоли является ротоглотка, а именно миндалины, некоторые авторы предлагают после проведенного алгоритма обследования выполнять диагностические тонзиллэктомии на стороне поражения лимфатического коллектора [21]. Эта методика позволила диагностиро-вать первичную опухоль у 25 % пациентов [22−24]. В литературе также обсуждается вопрос о двусторонней тонзиллэктомии в качестве стандартной про-цедуры [25], ввиду возможности контралатерального распространения метастазов (10 %) [26]. Однако данная методика в настоящее время применяется не во всех клиниках.
Что же касается выбора метода лечения, то здесь возникает еще больше вопросов. В настоящее время нет единого подхода в выборе тактики лечения этой сложной категории больных. Некоторые авторы пред-лагают выполнять различные модификации шейных диссекций в самостоятельном варианте с последую-щим динамическим наблюдением. Однако данный метод лечения возможен только при ограниченном поражении и ввиду того, что пациенты обращаются в более поздних стадиях, хирургическое лечение не оправданно. В литературе встречаются лишь единичные публикации с ограниченным количеством наблюде-ний, и соответственно, отсутствуют достоверные ста-тистические данные исследуемой группы. Другие ав-торы описывают проведение комбинированного лечения на регионарных зонах с пред- или послеопе-рационным облучением шеи с ипсилатеральной сто-роны без превентивного облучения глотки, также есть сторонники применения лучевой терапии (ЛТ) в само-стоятельном варианте по радикальной программе. В последнее время активно обсуждается вопрос о про-ведении шейной диссекции с двусторонним облучени-ем шеи и глотки по радикальной программе. Этот до-вольно агрессивный подход, позволяющий снизить вероятность проявления первичного очага, был поддержан многими онкологическими центрами [27−32], но методика также была оспорена другими [33] ввиду ухудшения качества жизни данной категории больных повышения риска развития вторых опухолей. В на-стоящее время она считается спорной.
Применение полихимиотерапии в комплексном лечении освещено лишь в единичных публикациях и, как правило, применяется при распространенных процессах. Учитывая, что первичный очаг чаще локализу-ется в глотке, для которой характерен высокий индекс отдаленного метастазирования, добавление лекарственной терапии снижает риск гематогенного метастазирования и улучшает показатели выживаемости.
Представленные в мировой литературе отдаленные результаты лечения существенно разнятся в различных исследованиях. Так, 5-летняя выживаемость варьирует в пределах от 32 до 84 %, что в первую очередь определяется крайней неоднородностью сравниваемых данных [34−40].
Очевидно, что выбор тактики лечения зависит от общего состояния больного, предполагаемой локализации опухоли, морфологического строения и степени распространенности опухолевого процесса.
Поскольку для данной нозологической группы нет отдельной классификации, большинство авторов используют международную классификацию ТNM (а именно символ N), принятую для оценки распро-страненности регионарных метастазов опухолей головы и шеи.
В отечественной литературе этому вопросу по-священо лишь несколько работ. Так, С.П. Федотенко проанализировал 224 случая метастазов в ЛУ шеи без выявленной первичной опухоли, В.М. Медведев — 120 случаев. Выявляемость первичной опухоли в ранние сроки после диагностированных метастазов, преимущественно в течение первого года наблюдения, составила 62−67 %. Трехлетняя выживаемость больных с выявленной первичной опухолью в органах головы шеи составила 64,5 %, а при не выявленной первичной опухоли данный показатель составил лишь 22 % [9].
Столь низкие показатели выживаемости связаны с достаточно разнородной по морфологической структуре группой. Так, С.В. Зинченко и соавт. был проведен анализ 66 случаев, где наилучшие показатели выживаемости получены при комплексном лечении и комбинации ЛТ и полихимиотерапии. После комплексного лечения 1-и 3-летняя выживаемость составляют 91,7 и 64,8 %; после химиолучевой терапии (ХЛТ) — 87,5 и 72,9 %, при медиане выживаемости 44,6 мес при комплексном лечениии 29,9 мес при ХЛТ соответственно.
При ЛТ в сочетаниис хирургическим вмешательством средняя продолжительность жизни выше, чем при ХЛТ, — 34,5 мес против 29,9 мес, показатели 1- и 3-летней выживаемости составили 72,0 и 46,6 %, при использовании ЛТ показатели составили 60,6 и 26,9 % соответственно. Объяснить по-добные различия затруднительно, вероятно, причинав небольшом количестве наблюдений в группе ХЛТ(8 пациентов). Оценить показатели 5-летней выживае-мости сложно в связи с малым количеством пациентов,переживших этот срок. Хотелось бы отметить, что дис-танционная гамма-терапия проводилась по стандартнойметодике, классическим фракционированием на областьшеи по 2 Гр в сутки до суммарной очаговой дозы (СОД)36−40 Гр [1].Более высокие показатели 5-летней выживаемостибыли получены в исследовании (2004) Y. Yalin et al. [42].После проведения предоперационной ЛТ в СОД 40 Гр,без облучения орофарингеальной зоны, выполнялась шейная диссекция.
Пятилетняя выживаемость составила 54 %. В исследование было включено лишь 13 па-циентов и не учитывалась распространенность мета-стазов.По данным исследования W.M. Klop et al., кудабыло включено 39 пациентов с метастазами плоскок-леточного рака без ВПО, средний возраст заболевшихсоставил 59 лет. В 84 % случаев отмечено поражение ЛУ2 и 3 зон, у 6 больных метастазы соответствовали сим-волу N1, у 14 — N2 и у 19 — N3. Большинству пациен-тов (n = 37) были выполнены шейные диссекциис последующей дистанционной ЛТ с облучением реги-онарных ЛУ и орофарингеальных зон. При этом 5-лет-няя общая выживаемость составила 52 %, локорегио-нарный контроль был достигнут у 66 % и у 2 пациентовреализовался первичный очаг спустя 20 и 37 мес послелечения [43].R.C. Mistry et al. была изучена выживаемость 89 больных с метастазами плоскоклеточного рака, причем у 86 % больных метастазы соответствовали символам N2−N3. Всем пациентам первым этапом была выполнена шейная лимфодиссекция, затем 70 пациентов получили послеоперационную ЛТ на лимфо-коллекторы с обеих сторон и орофарингеальную зону до СОД 40 Гр. За период наблюдения первичный очаг в орофарингеальной зоне реализовался у 13 (14,6 %) пациентов. Рецидив метастазов диагностирован у 29 (32,6 %) пациентов. Общая 5-летняя выживаемость составила 55 % [44].
С учетом того, что чаще всего первичный очаг расположен в глотке, а, как известно, данная локализация высокочувствительна к консервативным методам лечения, в последнее время появились работы, в которых продемонстрированы сопоставимые с комбинированным лечением показатели выживаемости. Так, S. Iganej et al., анализируя эффективность различных методов лечения больных с метастазами плоскоклеточного рака в ЛУ шеи без ВПО, отметили, что профилактическая ЛТ на область предполагаемого первичного очага значительно уменьшает вероятность проявления последнего, а, следовательно, и рецидива болезни с 32 до 3 % (р = 0,006). Также при метастазах N1−N2а ЛТ может быть рекомендована как основной и единственный метод лечения. При этом общая 5-лет-няя выживаемость в группе (N1−N3) составила 53 % [45]. Так, ряд исследователей в 2009 г. опубликовали результаты лечения 140 больных, где пациенты были распределены на 2 группы в зависимости от метода лечения [46]. В 1-ю группу входили 76 пациентов, которым была проведена одномоментная ХЛТ, 2-ю группу, 64 пациента, составили пациенты, получившие дистанционную ЛТ.
Средняя доза ЛТ в 2 группах составила около 66 Гр. Всем больным проводилось облучение регионарных коллекторов и орофарингеальных зон, пациенты 1-й группы получали еженедельно цисплатин в дозе 35 мг/м2. В 1-й группе были отмечены лучшие показатели полного ответа (68,4 %), в то время как в группе ЛТ этот показатель был значительно ниже и составил 53,1 %. Общая выживаемость у пациентов группы лечения ЛТ составляет от 5 до 60 мес, средняя (± стандартное отклонение) 31,06 ± 21,01 мес, в то время как в группе лечения ХЛТ она колебалась от 6 до 60 мес, в среднем (± стандартное отклонение) 39,42 ± 21,33 мес. Ряд исследователей при анализе 73 случаев выяснили, что у 20,5 % больных выявлены жизнеспособные опухолевые клетки после проведенной ХЛТ по радикальной программе, что опровергает возможность излечения пациентов без шейной диссекции [47].
В исследовании A. Argiris et al. продемонстрированы более высокие показатели 5-летней выживаемости при проведении ХЛТ по радикальной программе (60 Гр) с использованием препаратов 5-фторурацила с гидроксимочевиной, платиной или таксанами, После проведенной ХЛТ 88 % пациентам была выполнена шейная диссекция. Пятилетняя выживаемость у данной группы больных составила 84 % [48]. Одна из последних работ, D. Beldi et al., включаларезультаты лечения 113 пациентов с метастазами в ЛУ шеи без ВПО, получавших лечение в 1980−2004 гг. У 87 пациентов диагностирован плоскоклеточный рак, из них 22 пациента получили лечение с паллиативной целью, ввиду распространенности опухолевого про-цесса, и лечение 91 пациента проведено по радикаль-ной программе. Комбинированный метод лечения был использован у 52,2 % больных, оставшимся 47,8 % бы-ла проведена только ЛТ. ЛТ проводилась на регионар-ные зоны и слизистую оболочку глотки у 67 пациентов, билатеральное облучение ЛУ шеи — у 45. Кроме того, 18 % больных была проведена химиотерапия (ХТ).
В 21 случае согласно классификации узлы соответствовали N1, в 64 — N2, в 28 — N3. Пятилетняя выживаемость в группе пациентов с метастазами плос-коклеточного рака, получивших ЛТ на регионарные зоны и область глотки (57,6 %), оказалась выше, чем в группе получивших меньшую лучевую нагрузку (24 %) [49]. Наиболее частой причиной прогрессиро-вания заболевания стала реализация первичного очага (24,6 %), на следующем месте — отдаленное метаста-зирование (10,1 %), и лишь затем — прогрессирование опухолевого роста в ЛУ. В литературе отмечаются раз-личные данные о причине и частоте прогрессирования, так, часть исследователей отмечают, что наиболее часто встречается рецидив заболевания в ЛУ, далее следуют отдаленные метастазы, являющиеся причиной рециди-ва вдвое чаще, чем первичный очаг. Так, в исследовании P.J. Colliter et al. прогрессирование в ЛУ составляет лишь 9 %, на отдаленные метастазы приходится около 18 % и на первичный очаг — 14 % [50]. S.P. Reddy et al. отмечают, что прогрессирование за счет реализации первичного очага происходит чаще, чем за счет реци-дива метастазов в ЛУ. Однако все исследования сходятся в том, что частота реализации первичного очага у пациентов, получавших двустороннее облучение шеи с включением слизистой оболочки глотки, значительно ниже, чем при одностороннем облучении шеи [51].
По данным различных авторов, больные с отдаленными метастазами плоскоклеточного рака представляют довольно большую группу: от 11 до 33 % [52, 53]. Столь высокий процент пациентов с отдаленными метастазами наводит на мысль о необходимости включения системного воздействия в схемы лечения. Одна-ко в литературе нет сведений о преимуществах при-менения ХТ при метастазах в ЛУ шеи без ВПО. Некоторые авторы утверждают, что эти пациенты должны получать такое же лечение, как предназначен-ное для лечения местно-распространенных плоско-клеточных раков головы и шеи, из чего можно сделать вывод, что применение ХТ должно улучшить результа-ты лечения [54, 55].
Что касается прогностических факторов, то авторы выделяют их несколько. Одним из важных прогности-ческих факторов, влияющих на выживаемость, служит символ N, эта закономерность была подтверждена многими авторами [43, 56, 57]. Так, в работах H.S. Erkal было установлено, что у больных со стадией N1−N2а отмечены более высокие показатели выживаемости, чем при стадиях N2б−N3. Также основным неблагоприятным прогностическим фактором плоскоклеточного рака, влияющим на 5-летнюю выживаемость, является экстракапсулярный рост [58, 52].
Кроме того, на выживаемость оказывает влияние уровень поражения шейных ЛУ. В опубликованных работах исследовательской группы под руководством M.J. Kirschner (1997) отмечены худшие показатели 5-летней выживаемости у пациентов с метастатичес-ким поражением ЛУ нижней трети шеи, которые со-ставляют 9 % против 63 % [59].
Несмотря на современные методы диагностики и лечения, остается много вопросов в отношении выявления первичной опухоли и выбора тактики лечения пациентов с метастазами в ЛУ шеи без ВПО. Так как группы больных немногочисленны и отсутствуют ран-домизированные исследования, до сих пор нет единой стратегии лечения.
На основании вышеперечисленного можно сделать выводы, что неблагоприятными прогностическими факторами данной патологии являются распространенность метастатического поражения, а также пора-жение ЛУ нижней трети шеи и наличие эктракапсулярной инвазии.
Тактика лечения, включающая лимфодиссекцию в ЛТ на область слизистой оболочки глотки и регионарные ЛУ шеи с двух сторон, дает возможность значительно улучшить показатели выживаемости. Учитывая, что частыми причинами прогрессирования является отдаленное метастазирование, оправданным выглядит применение системной терапии (ХТ, таргет-ная терапия) для лечения данной патологии.
Источник