Параректальные лимфоузлы что это такое

Метастазы рака прямой кишки. Пути метастазирования рака прямой кишки.
В отдаленных органах метастазы развиваются в результате переноса раковых элементов по лимфатическим путям или по кровяному руслу, главным образом по венам. Микроскопическое изучение лимфатических сосудов параректальной клетчатки дало нам возможность обнаружить в некоторых препаратах заполнение просвета раковыми клетками. Gririnell (1950) изучал характер распространения рака ободочной и прямой кишок. С этой целью он подверг тщательному изучению 164 радикально оперированных больных. У 86 из них был рак ободочной кишки и у 78 больных — рак прямой кишки. Все больные прослежены в сроки до 5 лет или до их смерти.
Всего исследовано 12 000 лимфатических узлов. Автор установил три главных пути распространения рака ободочной и прямой кишок: 1) непосредственное прорастание, 2) распространение по венозной сети, 3) распространение по лимфатическим путям.
Обследованные были распределены на три группы: 1) больные, у которых опухоль не прорастала мышечную стенку кишки; 2) больные, у которых опухоль прорастала всю толщу кишечной стенки; 3) больные с метастазами в лимфатические узлы. В группе больных, у которых опухоль не прорастала мышечную стенку, спустя 5 лет умер только один. Из больных второй группы спустя 5 лет умерли 10 человек от рецидивов. Из больных третьей группы спустя 5 лет остались живы только 25% больных.
Как известно, при радикальных операциях по поводу рака желудка и кишечника хирурги стремятся отступить от макроскопически видимой опухоли на 3—5, 6—8 см в пределах здоровых тканей. Это правило с особой тщательностью соблюдается на верхней и нижней границах сечения органа. Такого же принципа мы придерживались при хирургических вмешательствах на прямой кишке.
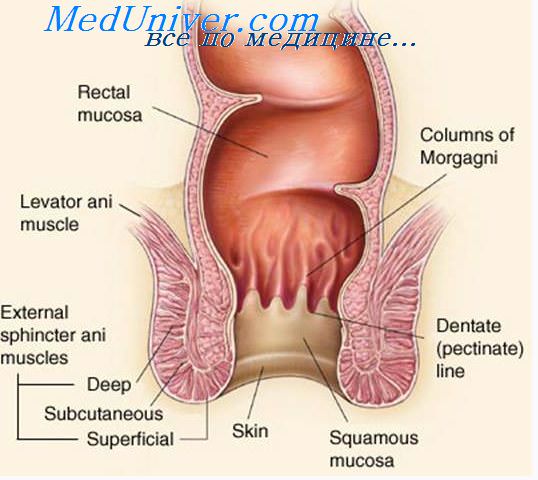
Ознакомившись с работами, посвященными распространению и метастазированию рака прямой кишки, а также изучив удаленные препараты, мы могли убедиться в том, что границы раковой опухоли прямой кишки в большинстве случаев бывают четко выражены. В 2—3 см от границ опухоли слизистая оболочка имеет нормальный вид. При микроскопическом изучении этих участков элементов раковой опухоли, как правило, нет. Даже в тех случаях, когда имелись две отдельные опухоли, расположенные на некотором расстоянии одна от другой, свободный участок между ними оставался интактным (С. А. Родкин).
При диффузных формах рака границу опухоли часто установить не удается. Прорастание опухоли в параректальную клетчатку наблюдается при запущенных формах, не подлежащих радикальному лечению. У таких больных следует ограничиваться паллиативными вмешательствами.
За последние годы внимание хирургов стала привлекать возможность ретроградного метастазирования рака прямой кишки. Необходимость его изучения возникла в связи с развитием сберегательных операций на прямой кишке. Такие операции в функциональном отношении являются более выгодными, однако важным является выяснение онкологической их обоснованности. Работами Black, Wugh и др. доказано, что рак прямой кишки не выходит далеко за пределы макроскопически видимой границы, а метастазирование совершается в основном в ортоградном направлении. В то же время у больных лишь как редкое исключение можно обнаружить метастазы в лимфатических узлах, расположенных ниже опухоли.
B. Н. Демин изучил 25 удаленных препаратов прямой кишки и путем препаровки выделил 936 лимфатических узлов. Метастазы были у 16 больных, причем ретроградные метастазы обнаружены на 2 препаратах и в 4 лимфатических узлах, расположенных на расстоянии 0,8—2,9 см дистальнее нижнего края опухоли. В обоих случаях имелись запущенные формы рака прямой кишки.
В нашей клинике исследовано 25 удаленных препаратов, ни разу не обнаружены метастазы ниже опухоли. С. А. Холдин, обобщивший имеющиеся литературные данные по ретроградному метастазированию, пришел к выводу, что эти метастазы развиваются примерно в 6,5% случаев. Несмотря на такой невысокий процент, следует учитывать возможность ретроградного метастазирования.
Метастазы в регионарных лимфатических узлах, по литературным данным, обнаруживаются в среднем в 53,5% случаев. С. А. Родкин изучил 60 удаленных препаратов, из них рак ампулярного отдела был у 54 и анального — у 6 больных. Из 54 ампулярных форм рака 5 были клинически отнесены ко второй стадии поражения, остальные 49 — к третьей. Соответственно разделены анальные формы рака: вторая стадия была у двух больных, третья — у 4 больных. Из 276 лимфатических узлов 61 (22,1%) оказался с метастазами.
Размеры опухоли и форма роста не всегда давали возможность исключить или признать существование метастазов. У одних больных при небольшой опухоли выявлялись метастазы, у других при опухолях большого размера они не определялись. Экзофитные опухоли, растущие более медленно, реже метастазируют, хотя у 4 больных мы наблюдали большое число метастазов при сравнительно небольших полипозных опухолях.
Что касается зависимости частоты регионарных метастазов от гистологической структуры опухоли, то, по данным Dukes (1950), они были обнаружены при аденокарциноме у 50% больных, при коллоидном раке—у 70%, при анапластических формах рака — у 82% больных. Сравнивая частоту регионарных метастазов в зависимости от гистологической структуры опухоли, можно отметить, что плоскоклеточные формы рака, которые встречаются значительно реже железистых форм, метастазируют чаще.
– Вернуться в оглавление раздела “Неотложная хирургия.”
Оглавление темы “Полипоз кишечника. Рак прямой кишки.”:
1. Лечение колита при полипозе прямой кишки. Электрокоагуляция при полипозе прямой кишки.
2. Колэктомия при сеймейном полипозе. Лечение полипоза у детей.
3. Чистотел в медицине. Свойства чистотела.
4. Клизмы при полипозе кишечника. Лечение полипоза клизмами чистотела.
5. Противопоказания для лечения чистотелом. Общие и местные противопоказания для лечения чистотелом.
6. Эффективность лечения полипоза чистотелом. Причины неэффективности лечения чистотелом.
7. Изменения полипов под воздействием чистотела. Патоморфология воздействия чистотела на полипы.
8. Препараты чистотела. Рак прямой кишки.
9. Эпидемиология рака прямой кишки. Формы рака прямой кишки.
10. Метастазы рака прямой кишки. Пути метастазирования рака прямой кишки.
Источник
МРТ методика и МРТ стадирование рака прямой кишки
Основным направлением в лечении колоректального рака в настоящее время является иссечение прямой кишки вместе с эмбриологически связанным с ней фасциальным футляром и параректальной клетчаткой содержащей лимфатические узлы, total mesorectal excision (TME). Другим направлением является переход от адъювантной к неоадъювантной химиолучевой терапии. Оба подхода кардинально изменили частоту местных рецидивов и выживаемость пациентов. Полная ремиссия может достигать до 30% у пациентов получающих неоадьювантную химиотерарию. Вопрос состоит в том, является ли пациент с раком прямой кишки кандидатом на TME или же необходима предоперационная химиолучевая терапия с последующей TME. МРТ, как наиболее точный метод для стадирования рака прямой кишки, может ответить на этот вопрос.
Max Lahaye, Regina Beets-Tan and Robin Smithuis [перевод оригинальной статьи ->]
Radiology Departement of the Maastricht University Hospital and the Rijnland Hospital in Leiderdorp, the Netherlands
Введение
Ранние методы хирургического лечения рака прямой кишки заключались в резекции опухоли с окружающей параректальной клетчаткой. Однако при использовании данных методик частота местных рецидивов достигала 40%. В 1982 году хирургом Richard John Heald была предложена техника TME. Широкое внедрение данной техники позволило снизить частоту местных рецидивов с 40% до 11% (1,2). Роль МРТ заключается в определении возможности TME операции, а в случае значительной распространенности опухолевого процеса назначения химиолучевой терапии как первого этапа лечения, с последующей TME.
Total mesorectal excision
TME техника является методом выбора при лечении колоректального рака при условии налиичия свободного края опухоли. Прямая кишка с опухолью «единым блоком» удаляется вместе с мезоректумом под контролем зрения до уровня анального канала острым путем в бессосудистой зоне. Собственная фасция остается неповрежденной. Сохраняются в целостности расположенные кнаружи пресакральная прослойка жировой ткани, париетальная фасция боковых стеной таза, предстательная железа у мужчин и влагалище у женщин вместе с нервными сплетениями. Это сводит к минимуму вероятность неполного удаления опухоли.
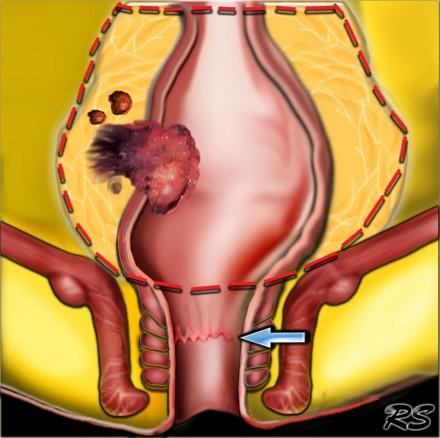
На схематическом изображении слева, опухоль прямой кишки с прорастанием в параректальную клетчатку и изменениями единичных лимфатических узлов. Край резекции по мезоректальной фасции без признаков инвазии, следовательно TME может быть выполнена. Обратите внимание на верхний край анального канала (зуючатая линия – синяя стрелка).
На МР изображениях параректальная клетчатка имеет высокую интенсивность сигнала на Т1 и Т2 взвешенных изображениях. Параректальная клетчатка отграниченна мезоректальной фасцией, которая виднка как тонкая линия с низкой интенсивностью МР сигнала (красные стрелки).
Роль мезоректальной фасции при планировании TME.
Наименьшая дистанция от края опухоли или лимфатических узлов называется circumferential resection margin (CRM/циркулярный край резеции/ проксимальный, дистальный и латеральный края резекции). Она является одим из главных факторов риска местного рецидива. Вовлеченный латеральный край резекции является отдельным прогностическим фактором общей и безрецидивной выживаемости, расстояние > 2 мм позволяет говорить о том, что мезоректальная фасция интактна, 1-2 мм с возоможной инвазией, и вовлечена в процесс если это расстояние ⩽1 mm.
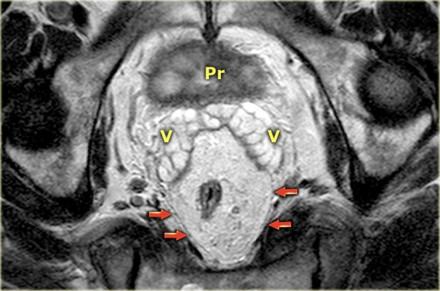
Прямая кишка окружена параректальной клетчаткой, отграниченной мезоректальной фасцией, помеченной красными стрелками. Р – простата V – семенные пузырьки
Сircumferential resection margin / циркулярный край резеции / латеральный край резекции
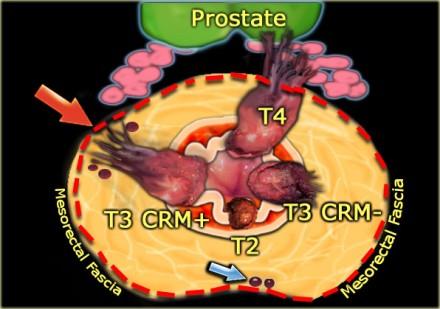
На иллюстрации слева:
- T2-опухоль ограниценная стенкой кишки
- T3-опухоль с широким circumferential resection margin или T3 CRM-
- T3-опухоль с вовлечениемм латерального края резекции или T3 CRM+ (красная стрелка)
- T4-опухоль с прорастанием в семенные пузырьки и простату
При наличии визуализируемых лимфатических узлов и “отсевов” опухоли в 2 мм от мезоректальной фасции, всегда необходимо отражать это в описании, так как они могут отражать вовлечение латерального края резекции (синяя стрелка).

МРТ исследование должно определить следующее:
- Расположение опухоли
- Уровень (нижне-, средне- или верхнеампулярный отдел прямой кишки), размер, окружость роста
- T-стадию: T1, T2, T3 или T4
- Расстояние от опухоли до мезоректальной фасции. Вовлечен или нет?
- Рост опухоли или лимфатических узлов в 1 мм от края резекции?
- N-стадию: Есть ли лимфатические узлы в пределах параректальной клетчатки или за ее пределами?
Локализация опухоли
Прямой кишкой называется сегмент толстой кишки к низу от сигмовидной ободочной кишки и до заднепроходного отверстия. Ректосигмоидный переход условно определяется на 15 см выше анального отверстия. Опухоли с локализацией более 15 см выше анального отверстия рассматриваются и рассматриваться как опухоли сигмовидной кишки. Поскольку на МР изображениях мы не можем обнаружить анального отверстия, лучше измерять это расстояние от аноректального угла. Таким образом опухоли на 15 см выше аноректального угла рассматриваютсякак опухоли сигмовидной кишки.
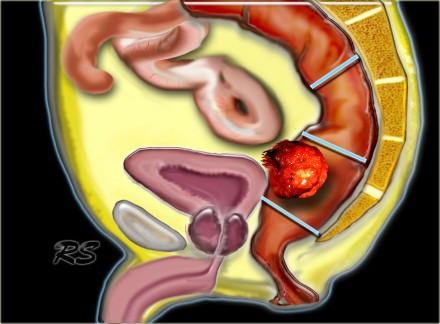
Рак прямой кишки может быть разделен на:
- Нижнеампулярный рак прямой кишки:
Дистальная граница от аноректального угла на 5 см. - Среднеампулярный рак прямой кишки:
Границы составляют 5-10 см от аноректального угла. - Верхнеампулярный рак прямой кишки:
Границы составляют 10-15 см от аноректального угла.
Нижнеампулярный рак прямой кишки
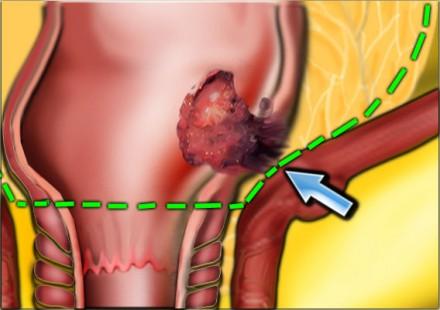
Нижнеампулярный рак прямой кишки имеет более высокую частоту местных рецидивов. Дистальное сужение параректальной клетчатки предрасполагает к тому, что нижнеампулярный рак прямой кишки более легко проникает в окружающие структуры и более трудоемок для получения свободного края резекции хирургом (см рисунок).
T-стадия и мезоректальная фасция.

Следующим шагом после определения локализации опухоли, необходимо определить Т-стадию. МРТ не может определить отграниченна ли опухоль подслизистым слоем или есть инвазия мышечного слоя, и следовательно, не может разграничить T1 и T2 стадию. Чтобы избежать рисков, тяжелых осложнений, связанных с обширными операциями, для ранних опухолей прямой кишки Т1 применяется трансанальное местное иссечение. Этот метод требует тщательной предоперационной диагностики с участием трансанального УЗИ, как более точного в дифференцировке на T1 и T2 стадиях.
T1 и T2
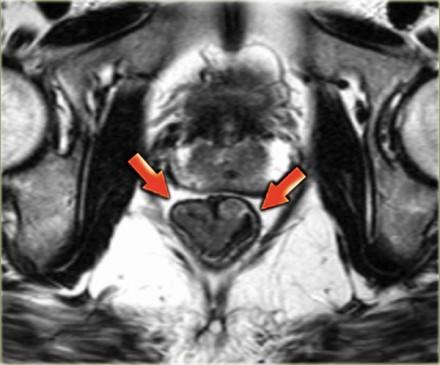
T1 и T2 опухоли ограничены стенкой кишечника и имеют хороший прогноз в лечении.
Они могут быть достаточно точно определены на МРТ, так как неизмененная стенка прямой кишки будет иметь вид линии с МР-сигналом низкой интенсивности, что означает что наружный мышечный слой окружает опухоль (3). На изображении, опухоль прямой кишки полностью окружена черной полоской наружной мышечной стенки. Это Т2 опухоль.
T3 MRF-
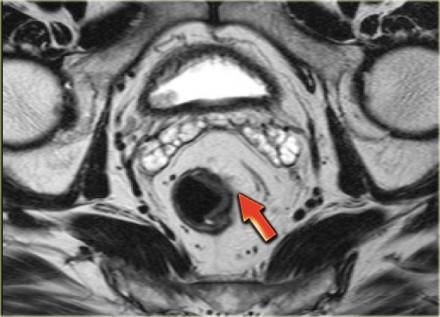
Т3 опухоли прорастают все слои кишечной стенки и проникают в параректальную жировую клетчатку. При данной стадии важно определить имеется ли вовлечение мезоректальной фасции или нет. Слева изображена опухоль с возможной инвазией в параректальную клетчатку т.е. Т3 (стрелка). Край резекции широкий и нет увеличения лимфатических узлов прилегающих к мезоректальная фасции . Эта опухоль классифицируется как Т3 MRF-. В Нидерландах, как и в большинстве европейских стран, этому пациенту будет проведен короткий предоперационный курс лучевой терапии с последующим TME.
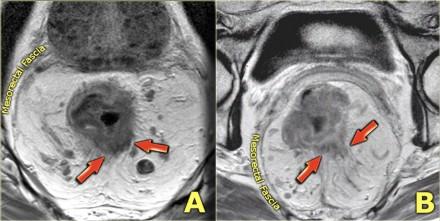
Периректальная инфильтрация/инвазия
Чувствительность МРТ в диагностике инвазии в периректальную клетчатку составляет 82%. Видимая лучистая инфильтрация периректальной клетчатки, может быть ловушкой, так как может быть как результатом опухолевого прорастания, так и местной десмопластической реакции. Что бы избежать неправильной трактовки, опухоли с инфильтрацией периректальной клетчатки рекомендуется стадировать как Т3. Степень экзофитного распространения является прогностическим фактором. На МР изображениях слева предствалены две опухоли со схожей МР картиной. На изображении А была выявленая инвазия периректальной клетчатки. На изображении В опухоль была отграничена стенкой кишечника, Т2 стадия, периректальная инфильтрация клетчатки в данном случае была результатом десмопластической реакции. На выбор лечебной тактики данный признак, при дифференцировке между T2 MRF- и T3 MRF- опухолями, не оказывает значимого влияния. Обе опухоли будут подвергнуты ТМЕ или предоперационному курсу низкодозной лучевой терапии 5х5 Гр с последующим TME
T3 MRF +
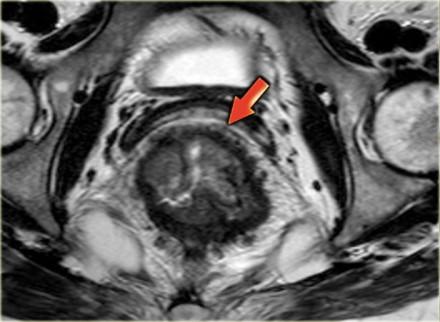
Слева опухоль с инвазией параректальной клетчатки и инвазией переднего края резекции (стрелка). Такая опухоль классифицируется как Т3 MRF +. Данный пациент будет проходить курс химиолучевой терапии, при положительном ответе на которую по результатам МРТ контроля будет проведено рестадирование с последующей ТМЕ.
T4
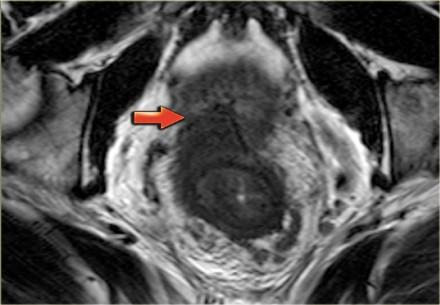
Т4 — опухоль инфильтрирует окружающие органы (влагалище, простату, семенные пузырьки или мочевой пузырь) и ткани. Пациенты с данной стадией требуют длительного курса химиолучевой терапии и обширной операции. Для определяется инвазии в окружающие органы все диагностические методы показывают схожую чувствительность: 70% для ТРУЗИ, 72% для КТ и 74% для МР-томографии. Слева T4-опухоль с инвазией предстательной железы.
N-стадия
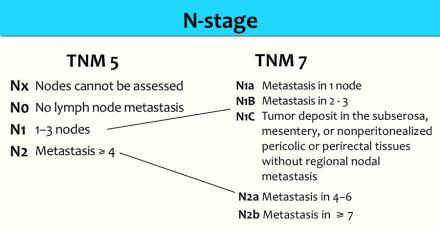
Наличие N-стадии является важным фактором риска развития локорегионарного рецидива. К сожалению МРТ, как и большинство других методов визуализации, имеет низкую чувствительность и специфичность для обнаружения метастазов в лимфатических узлах. Пораженными считаются лимфатические узлы с размерам по короткой ось > 5 мм, изменением формы, с лучистыми контурами и нечеткими границами или гетерогенной структурой. Однако не все пораженные лимфатические узлы отвечают этим критериям.
Более часто используется классификация TNM5 для определения N-стадии. N-стадии в TNM7 схожи с TNM5, но N1 и N2-стадии более дифференцированы.
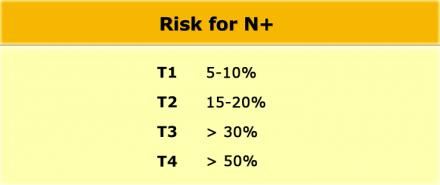
Даже в T1 и T2 стадии опухолевого процесса имеют значительный риск метастатическго поражения лимфоузлов (см. таблицу).
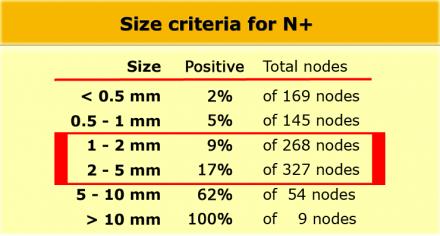
Низкая чувствительной использования для оценки только размеров, может быть объяснена тем фактом, что при колоректальном раке широко распространено наличие злокачественных изменений даже в мелких лимфатических узлах, до 9% в узлах размерами 1-2 mm nodes и до 17% у узлах размерами 2-5 mm (11). Как показано в таблице слева, большинство изменений выявляется в лимфатических узлах размерами 1-5 mm. Чтобы не занижать стадию все визуализируемые лимфатические узлы можно рассматривать как малигнезированные.
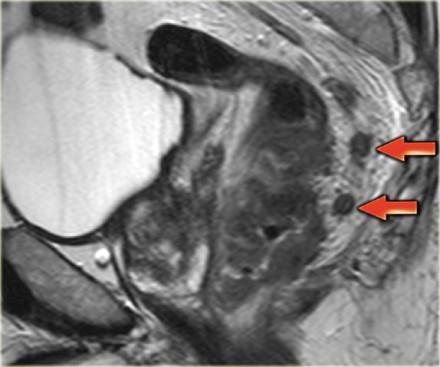
На изображении слева нижнеампулярный рак прямой кишки с множественными лимфатическими узлами в периректальной клетчатке кзади от ампулы. Это имеет огромное влияние на прогноз у пациента, основанное на MRF+ и N+ статусе, по этому пациент будет получать более агрессивное лечение с неоадъювантной химиолучевой терапией.
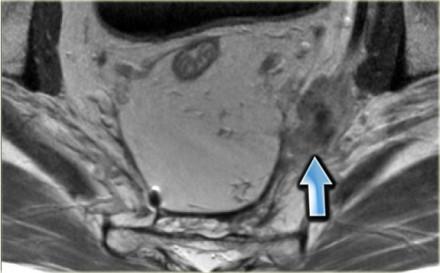
Важно обращать внимание на лимфатические узлы задней мезоректальной клетчатки (стрелка). Данные мезоректальные лимфатические узлы важны, так как могут быть причиной местных рецидивов. При их обнаружении с помощью МРТ, лучевая терапия и хирургическое планирование будут адаптированы.
Слева пациент после TME с рецидивом в узлах мезоректальной клетчатки (стрелка). Эти мезоректальные лимфатические узлы не были резецированы во время стандартной ТМЕ операции.
Определение малигнезированных мезоректальных лимфатических узлов как минимум влечет за собой более расширенную хирургическую тактику, так как необходимо удалить все опухолевые узлы или увеличение дозы лучевой терапии в зоне риска.
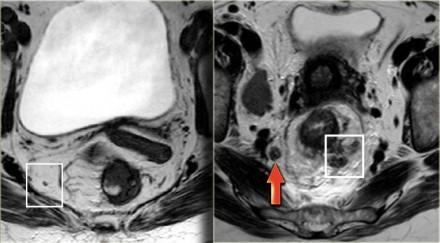
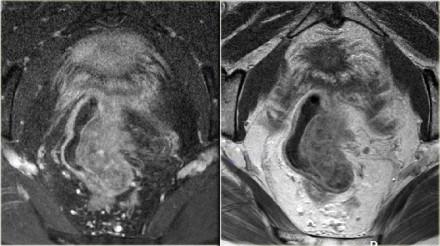
На аксиальных Т2-взвешенных изображениях слева представлены два пациента с раком прямой кишки. Эти примеры иллюстрируют сложности определяется N-статуса. На крайний слева определяется небольшой эктрамезоректальный лимфатический узел.
На изображении справа визуализируются многочисленные крупные мезоректальные лимфатические узлы, а также в правых отделах эктрамезоректальной клетчатки определяется лимфатический узел с нечеткими границами (красная стрелка). Хотя лимфатические узлы этих пациентов имеют разные характеристики по размерам, границам и гетерогенному внешнему виду, все они оказались малигнезированными.
Рак прямой кишки характеризуется метастатическим поражением мелких лимфатических узлов.
МР протокол
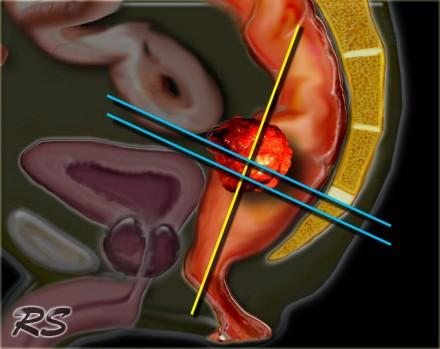
Только T2 FSE изображения, нет контрастное усиления.
Требуются только T2 FSE последовательности. Применение препаратов гадолиния не улучшает диагностическую точность и, следовательно, они не включены в стандартный протокол при данной патололгии. Изображения получают в сагиттальной, корональной и аксиальной плоскостях. Начинать необходимо с сагиттальной серии, по ней выстраиваются аксиальные изображения, перпендикулярные стенкам прямой кишки на уровне опухоли (синие линии). Коронарные изображения выстраиваются перпендикулярно аксиальной серии (желтая линия) через дистальные отделы опухоли и параллельно анальному каналу. Данный подход позволяет избежать артефакт частичного объема и позволяет точно оценить глубину инвазии опухоли, а так же оценить врастание опухоли в анальный канал. Кроме того правильно планировать МР последовательности помогает указание хирургом в направлении на исследование уровня опухоли. Верхней границей поля обследования (FOV) является L5, каудальная граница – ниже уровня анального канала. Рекомендуется использовать поверхностную катушку, в эндоректальной катушке нет необходимости. Единого мнения об использовании 1.5T или 3.0T систем нет. Диффузионно взвешенные изображения могут использоваться для переоценки стадии процесса. Высокий уровень сигнала на изображениях с B1000 указывает на неполный ответ.
Углы
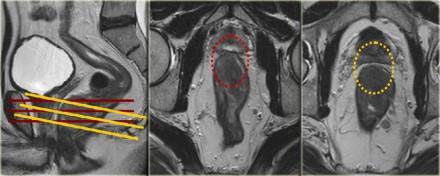
Аксиальные изображения должны быть под правильным углом, перпендикулярно оси опухоли, чтобы избежать усреднения объема.
На примере слева первое планирование аксиальных изображений было выполнено под неправильным углом, что создало ложное впечатление о вовлечении мезоректальной фасции (MRF, выделено красным кругом), при правильном изменении угла перпендикулярно оси опухоли видно, что мезоректальная фасция (MRF) не вовлечена в процесс (желтый круг).
Не используйте программы с подавлением сигнала от жира и ректальное контрастирование
Подавление сигнала жира не улучшает визуализацию границ опухоли. Пациенты не нуждаются в подготовке кишечника. Использование ректального контраста не рекомендуется, потому что растяжение стенок кишечника может привести ложноположительным результатам при отсутствии инвазии в мезоректальную фасцию.
Кроме того, это затрудняет оценку дистальных мезоректальных лимфатических узлов.
Описание исследования
Описание исследования
А. Первичное исследование
Радиологический отчет должен содержать следующие пункты:
- Положение опухоли в нижне-, средне- или верхнеампулярном отделе прямой кишки.
- Расстояние от аноректального угла до нижнего полюса опухоли.
- Длина опухоли.
- Циркулярная или полуциркулярная. Положении опухоли боковых, передней или задней стенке.
- T-стадии:
- T1 / T2: опухоль ограничена стенки кишечника
- T3: инвазия периректальной клетчатки с указанием степени прорастания в мм.
- T4: вторжение в окружающие органы и ткани, с указанием пораженных органов.
- Наименьшее расстояние (в мм) между опухолью и мезоректальной фасцией с указанием локализации.
- N-стадия: лимфатические узлы в параректальной клетчатке с указанием минимального расстояния к краю резекции, указание экстрамезоректальных лимфатических узлов . Обозначить количество подозрительных лимфатических узлов.
Б. Оценка ответа на неоадъювантную химиолучевую терапию
Контрольное исследование выполняется аналогичным образом как и первичное исследование, с добавлением префикса Y.
Например YT3 означает, что пациент с опухолевой инвазией в мезоректальную фасцию получает неоадъювантую терапию.
Лечение
Существуют различные подходы в лечении рака прямой кишки в разных странами и разных учреждениях. Общепринято, что TME является лучшим методом радикального лечения для всех опухолей со свободным краем резекции. В Нидерландах, как и в большинстве европейских стран, большинству пациентов до TME проводится краткий курс лучевой терапии 5×5 Гр. В отдельных учреждениях, при наличии хороших прогностических факторов (верхнеампулярные раки T1N0 и T2N0), предоперационный курс лучевой терапии не проводится. Короткие курсы лучевой терапии непосредственно перед TME не снижают распространенность и поэтому не подходят для местно распространенных опухолей.Все пациенты с Т4-опухолями, опухолями с инвазией края резекции, а так же опухолями с малигнезацией лимфатических узлов вблизи или за пределами края резекции, сначала получают высокодозную химиолучевую терапию. Дальнейшая тактика зависит от ответа на проводимое предоперационное лечение. В случае регрессии опухоли выполняется менее обширная резекция. В случаях уменьшения размеров опухоли и стерилизации узлов (yN0) следующим шагом выполняется TME. При полном исчезновение опухоли и лимфатических узлов может рассматриваться выжидательная тактика. Однако этот подход остается спорным и не является стандартным.
Литература
- Heald RJ, Ryall RD. Recurrence and survival after total mesorectal excision for rectal cancer. Lancet 1986; 1: 1479- 1482.
- R. J. Heald, E. M. Husband, R. D. H. Ryall. The mesorectum in rectal cancer surgery: the clue to pelvic recurrence?. British Journal of Surgery 1982; 69(10): 613-616. Смотр.
- Sagar PM, Pemberton JH. Surgical management of locally recurrent rectal cancer. J Surg 1996; 83: 293-304. Pubmed
- Regina Beets-Tan, Geerard Beets. Rectal Cancer: Review with Emphasis on MR Imaging. Radiology 2004; 232: 335-346. Смотр.
- Beets-Tan RG, Beets GL, Vliegen RF, et al. Accuracy of magnetic resonance imaging in prediction of tumour-free resection margin in rectal cancer surgery. Lancet 2001; 357: 497-504.
- Bipat S, Glas AS, Slors FJ, Zwinderman AH, Bossuyt PM, Stoker J. Rectal Cancer: Local Staging and Assessment of Lymph Node Involvement with Endoluminal US, CT, and MR Imaging; A Meta-Analysis. Radiology 2004; 232: 773-783. Смотр.
- Brown G, Richards CJ, Bourne MW, et al. Morphologic Predictors of Lymph Node Status in Rectal Cancer with Use of High-Spatial-Resolution MR Imaging with Histopathologic Comparison. Radiology 2003; 227: 371-377. Смотр.
- Kim JH, Beets GL, Kim MJ, Kessels AG, Beets- Tan RG. High-resolution MR imaging for nodal staging in rectal cancer: are there any criteria in addition to the size?. Eur J Radiol 2004; 52: 78-83. Pubmed
- Fiona Taylor et al. A Systematic Approach to the Interpretation of Preoperative Staging MRI for Rectal Cancer. AJR Am J Roentgenol 2008; 191: 1827-1835. Смотр.
- Kapiteijn E, Marijnen CA, Nagtegaal ID, et al. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer. N Engl J Med 2001; 345: 638-646. Смотр.
- Wang C, Zhou Z, Wang Z, et al. Patterns of neoplastic foci and lymph node micrometastasis within the mesorectum. Langenbecks Arch Surg 2005; 390: 311-318. Смотр.
- Maas M. Wait-and-see policy for clinical complete responders after chemoradiation for rectal cancer. J Clin Oncol 2010; 29(35): 4633-40. Pubmed
Источник