Основные дифференцировочные антигены лимфоцитов человека
Для клинической практики большое значение имеет определение разных маркеров лимфоцитов. Основная концепция дифференцировки лейкоцитов основана на существовании специфических мембранных рецепторов.
Так как такие рецепторные молекулы могут выступать в роли антигенов, существует возможность их выявления с помощью специфических антител, которые реагируют лишь с одним антигеном клеточной мембраны. В настоящее время существует огромное количество видов моноклональных антител к дифференцировочным антигенам лейкоцитов человека.
В связи с их важностью и для улучшения диагностики необходимы стандартизация специфичностей дифференцировочных антигенов.
В 1986 году предложена номенклатура дифференцировочных антигенов лейкоцитов человека. Это СД-номенклатура (cluster of differentiation – кластер дифференцировки). Она базируется на способности моноклональных антител реагировать с определенными дифференцировочными антигенами. СД-группы нумеруются.
На сегодняшний день имеются моноклональные антитела к целому ряду дифференцировочных антигенов Т-лимфоцитов человека.
При определении общей популяции Т-клеток используются моноклональные антитела специфичности СД2, 3, 5, 6 и 7.
СД2. моноклональные антитела специфичности СД2 направлены против антигена, который идентичен “рецептору эритроцитов барана”. Способность Т-лимфоцитов образовывать розетки с эритроцитами брана обеспечивает простую и надежную идентификацию этих клеток. СД2 обнаруживается на всех зрелых периферических Т-лимфоцитах, на большинстве тромбоцитов, а также на определенных популяциях клеток – О-лимфоцитов (ни Т- ни В-лимфоциты).
СД3. моноклональные антитела этого класса реагируют с тримолекулярным белковым комплексом, который ассоциирован с антигенспецифическим рецептором Т-клетки, являющийся основным функциональным маркером этой популяции. СД3 используется для идентификации зрелых Т-клеток.
СД5. антиген представляет собой гликопротеин, выявляемый на всех зрелых Т-клетках. Определяется на поздних стадиях дифференцировки клеток в тимусе. Часто маркер выявляется на клетках больных с В-клеточным типом хронического лимфолейкоза.
СД6.антитела специфичности СД6 реагируют с высокомолекулярным гликопротеином, присутствующим на мембране всех зрелых Т-клеток. Антиген выявляется также на небольшой части периферических В-клеток и присутствует у большинства лейкозных клеток В-клеточного типа хронического лимфолейкоза.
СД7. выявляется у 85 % зрелых Т-клеток. Присутствует также и на тимоцитах. Он считается наиболее надежным критерием диагностики острых Т-клеточных лейкозов.
Помимо этих основных Т-клеточных маркеров известны и другие дифференцировочные антигены Т-клеток, которые характерны либо для определенных стадий онтогенеза, либо для различающихся по функциям субпопуляций. Среди них наиболее широко распространены СД4 и СД8.
СД4. зрелые СД4+ Т-клетки включают Т-лимфоциты, обладающие хелперной активностью и индукторы. Особое значение имеет то, что СД4 связывается с вирусом СПИДа, что приводит к проникновению вируса внутрь клеток этой субпопуляции.
СД8. Субпопуляция СД8+ Т-клеток включает цитотоксические и супрессорные Т-лимфоциты.
Источник
| Антигены | Функциональные характеристики | Экспрессия |
| CD2 | Рецептор для Е-РОК, LFA-3 | Т-клетки, некоторые NK-клетки |
| CD3 | Комплекс Т-клеточного рецептора | Все Т-клетки |
| CD4 | Лиганд молекулы МНС II класса, рецептор для ВИЧ | Т-хелперы/эффекторы |
| CD5 | Лиганд CD72, активация продукции ИЛ-2 и экспрессии рецептора ИЛ-2 | Т-клетки, В1а-клетки |
| CD7 | Рецептор для IgM (Fc IgM) | Ранние Т-клетки, субпопуляция Т-клеток, некоторые NK-клетки |
| CD8 | Лиганд молекулы МНС I класса | Цитотоксические Т-клетки |
| CD9 | Молекула для активации и агрегации тромбоцитов | Пре-В-клетки, активированные Т-клетки |
| CD10 | Нейтральная эндопептидаза | Про-В-клетки, активированные В-клетки, CALLA |
| CD11a | а-цепь LFA-1, лиганд ICAM-1 (CD56), адгезионная молекула | Лейкоциты |
| CD11b | а-цепь Mac-1, рецептор С3bi | Гранулоциты, моноциты, NK-клетки |
| CD11c | Рецептор бета2-интегрина | Моноциты, NK-клетки, гранулоциты, волосатые клетки |
| CD13 | Аминопептидаза N | Гранулоциты, моноциты |
| CD14 | Мембранный протеин, связанный с фосфолипидом | Моноциты, гранулоциты |
| CD16 | Рецептор Fсy III, связывает IgG в составе иммунных комплексов | NK-клетки, моноциты, гранулоциты |
| CD19 | В-клеточный рецепторный комплекс | Ранние и зрелые В-клетки |
| CD20 | Мембранные ионные каналы | Ранние и зрелые В-клетки |
| CD21 | Рецептор C3d, рецептор ВЭБ | В-клетки, дендритные клетки |
| CD22 | Принадлежит к суперсемейству генов иммуноглобулинов | В-лимфоциты |
| CD23 | Fce RII, IgE связывающий фактор, участвует в регуляции синтеза IgE | Субпопуляция В-лимфоцитов |
| CD25 | Низкоаффинный рецептор ИЛ-2 | Активированные Т- и В-лимфоциты |
| CD28 | Лиганд CD80 (В7.1), адгезия | Субпопуляция Т-клеток |
| CD30 | Ki-1, рецептор к ФНО, проведение сигнала, запускающего апоптоз Т-клеток | Т-клетки, Ki-1+ лимфомы |
| CD32 | Рецептор Fcy II, связывает IgG в составе иммунных комплексов | Субпопуляция В-лимфоцитов, гранулоциты, тромбоциты, эндотелий |
| CD33 | на момент подготовки статьи для сайта – неизвестно | Миелоидные предшественники |
| CD34 | Лиганд L-селектина, прикрепление к строме костного мозга гемопоэтических клеток и лимфоцитов к эндотелию сосудов | Плюрипотентная стволовая клетка |
| CD40 | Лиганд CD40 на Т-клетках, индуцирует переключение синтеза иммуноглобулинов на другой изотип | В-клетки, интердигитальные клетки |
| CD44 | Лиганд CD58 | Рецептор, определяющий хоминг в лимфоузлы |
| CD45RO | Лиганд CD22 | Активированные Т-клетки, Т-клетки памяти |
| CD45RA,B | Лиганд CD22 | «Наивные» Т- и В-клетки |
| CD54 | Адгезионная молекула ICAM-1 | Все клетки |
| CD56 | Адгезионная молекула N-CAM | NK-клетки |
| CD58 | Адгезионная молекула LFA-3 | Лейкоциты, эндотелиальные клетки, эпителиальные клетки, фибробласты |
| CD79a, CD79b | Iga, IgB. Молекулы передачи сигнала, компоненты В-клеточного рецептора | В-клетки, пре-В-клетки |
Источник
[20-077]
Фенотипирование лимфоцитов (основные субпопуляции) – CD3, CD4, CD8, CD19, CD56
4200 руб.
Исследование включает в себя определение абсолютных и относительных значений субпопуляционного состава лимфоцитов (CD3, CD4, CD8, CD19, CD56). Рекомендуется к назначению для контроля показателей клеточного звена иммунной системы в динамике после комплексного иммунологического обследования.
Синонимы русские
Иммунофенотипирование, клеточный иммунитет, многоцветный клеточный анализ методом проточной цитометрии, субпопуляции лимфоцитов.
Синонимы английские
Human Immune System, Immunophenotyping, Multicolor Flow Cytometry Cell Analysis, Human Leukocyte Differentiation Antigens.
Метод исследования
Проточная цитометрия.
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь в течение 24 часов до исследования.
- Детям в возрасте до 1 года не принимать пищу в течение 30-40 минут до исследования.
- Детям в возрасте от 1 до 5 лет не принимать пищу в течение 2-3 часов до исследования.
- Не принимать пищу в течение 12 часов до исследования, можно пить чистую негазированную воду.
- Полностью исключить (по согласованию с врачом) прием лекарственных препаратов в течение 24 часов перед исследованием.
- Исключить физическое и эмоциональное перенапряжение в течение 24 часов до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Оценка клеточного состава (иммунофенотипирование) лимфоцитов крови человека – основной компонент в оценке иммунного статуса – выполняется методом проточной цитофлуориметрии.
Иммунофенотипирование – характеристика клеток при помощи моноклональных антител или каких-либо других зондов, позволяющих судить об их типе и функциональном состоянии по наличию того или иного набора клеточных маркеров.
Иммунофенотипирование лейкоцитов заключается в обнаружении на их поверхности маркеров дифференциации, или CD антигенов. Лейкоциты экспрессируют ряд поверхностных и цитоплазматических антигенов, уникальных для своей субпопуляции и стадии развития. CD антигены (англ. cluster of differentiation antigens) – это антигены на поверхности клеток, маркеры, отличающие одни типы клеток от других. Дифференциации этих антигенов изучены и стандартизованы, им присвоены определенные номера. CD могут быть распознаны с помощью соответствующих моноклональных антител. Используя флюоресцентно-меченые моноклональные антитела, связывающиеся с определенными CD, можно с помощью метода проточной цитометрии произвести подсчёт содержания лимфоцитов, относящихся к различным по функции или стадии развития субпопуляциям.
В основе проточной цитофлуориметрии лежит проведение фотометрических и флюоресцентных измерений отдельных клеток, пересекающих одна за другой вместе с потоком жидкости луч монохроматического света, обычно света лазера.
Метод позволяет не только определить количественное соотношение основных популяций лимфоцитов:
- Т-лимфоциты (CD3+CD19-);
- Т-хелперы/индукторы (CD3+CD4+CD45+);
- Т-цитотоксические лимфоциты (Т-ЦТЛ) (CD3+CD8+CD45+);
- истинные “натуральные киллеры” (NK-клетки) (CD3-CD56+CD45+);
- В-лимфоциты (CD19+CD3-);
– но и оценить малые клеточные популяции, а также изучить их функциональную активность:
- Т-лимфоциты, экспрессирующие маркеры NK-клеток(Т-NK-клетки) (CD3+CD56+CD45+);
- NK-клетки, экспрессирующие α-цепь антигена CD8 (CD3-СD8+CD45+).
Когда назначается исследование?
Рекомендовано для комплексного обследования пациентов, входящих в группу риска по четырем основным иммунопатологическим синдромам.
С инфекционным синдромом:
- частые ОРВИ, хронические инфекции ЛОР-органов (гнойные синуситы, отиты, периодически встречающиеся лимфадениты, пневмонии с тенденцией к рецидивированию, бронхоплевропневмонии);
- бактериальные инфекции кожи и подкожной клетчатки (пиодермии, фурункулез, абсцессы, флегмоны, септические гранулемы, рецидивирующий парапроктит у взрослых);
- урогенитальные инфекции;
- грибковые поражения кожи и слизистых оболочек, кандидоз, паразитарные инвазии;
- рецидивирующий герпес различной локализации;
- гастроэнтеропатия с хронической диареей неясной этиологии, дисбактериозом;
- длительный субфебрилитет, лихорадка неясной этиологии;
- генерализованные инфекции: сепсис, гнойные менингиты.
С аллергическим (атопическим) синдромом:
- атопический дерматит;
- нейродермит;
- экзема с инфекционным компонентом;
- тяжелая атопическая бронхиальная астма, поллиноз, хронический астматический бронхит.
С аутоиммунным синдромом:
- ревматоидный артрит;
- рассеянный склероз;
- диффузные заболевания соединительной ткани (системная красная волчанка, склеродермия, дерматомиозит);
- аутоиммунный тиреоидит;
- неспецифический язвенный колит.
С иммунопролиферативным синдромом:
- опухолевые процессы в иммунной системе (лимфомы, болезнь Ходжкина, острый и хронический лимфолейкоз, саркома Капоши).
Что означают результаты?
Изменения различных клеточных популяций лимфоцитов в сторону повышения или понижения развиваются при различных патологических процессах в организме, таких как инфекции, аутоиммунные и онкологические заболевания, иммунодефициты, в постоперационном периоде, при трансплантации органов.
Ниже представлена таблица с клиническими ситуациями, которые могут приводить к изменениям в субпопуляционном составе лимфоцитов.
Субпопуляция лимфоцитов | Повышение показателя | Снижение показателя |
T-лимфоциты (CD3+CD19-) |
|
|
Т-хелперы (CD3+CD4+CD45+) |
|
|
Т-цитотоксические лимфоциты (CD3+CD8+CD45+) |
|
|
В-лимфоциты (CD19+CD3-) |
|
|
“Натуральные киллеры” (CD3-CD56+CD45+), (CD3-CD16+CD45+) |
|
|
Т-“натуральные киллеры”, НК-Т (CD3+CD56+CD45+) |
| Не имеет диагностического значения. |
В совокупности с клиническими данными, симптоматикой, другими методами лабораторных исследований вышеуказанные изменения являются диагностическим признаком возникновения этих патологических процессов в организме человека.
Важные замечания
- Результаты данного исследования необходимо сопоставлять с клиническими данными и показателями других лабораторных анализов.
- Следует отметить, что оценка показателей в динамике существенно повышает клиническую значимость исследования.
Литература
- Хаитов, Р.М. Аллергология и иммунология : национальное руководство / под ред. Р.М. Хаитова, Н.И. Ильиной. – М. : ГЭОТАР-Медиа, 2009. – 656 с.
- Хаитов, Р.М. Руководство по клинической иммунологии. Диагностика заболеваний иммунной системы : руководство для врачей / Р.М. Хаитов, Б.В. Пинегин, А.А. Ярилин. – М. : ГЭОТАР-Медиа, 2009. – 352 с.
- Зуева Е.Е. Иммунная система, иммунограмма : рекомендации по назначению и применению в лечебно диагностическом процессе /Е.Е Зуева, Е.Б. Русанова, А.В. Куртова, А.П. Рыжак, М.В. горчакова, О.В. Галкина – СПб. – Тверь: ООО «издательство «Триада», 2008. – 60 с.
- Кетлинский, С.А. Иммунология для врача / С.А. Кетлинский, Н.М. Калинина. СПб. : Гиппократ, 1998. – 156 с. Ярилин, А.А. Иммунология : учебник / А.А. Ярилин. – М. : ГЭОТАР-Медиа, 2010. – 752 с.
- Хаитов, Р.М. Иммунология : атлас / Р.М. Хаитов, А.А. Ярилин, Б.В. Пинегин.М. : ГЭОТАР-Медиа, 2011. – 624 с.
- Хаитов, Р.М. Иммунология : учебник / Р.М. Хаитов. – М. : ГЭОТАР-Медиа, 2009. – 320 с.
- Хаитов, Р.М. Оценка иммунного статуса человека в норме и при патологии / Р.М. Хаитов, Б.В. Пинегин // Иммунология. – 2001. – N4. – С. 4–6.
- Whiteside, T.L. Role of Human Natural Killer Cells in Health and disease / T.L. Whiteside, R.B. Herberman // Clinical and Diagnostic Laboratory Immunology. – 1994. – Vol. 1, №2. – P. 125–133.
- Ginadi, L. Differential expression of T-cell antigens in normal peripheral blood lymphocytes : a quantitative analysis by flow cytometry / L. Ginadi, N. Farahat, E. Matutes [et al.] // J. Clin. Pathol. – 1996. – Vol. 49, № 1. – P. 539–544.
- Merser, J.C. Natural killer T-cells : rapid responders controlling immunity and disease / J.C. Merser, M.J. Ragin, A. August // International J. Biochemistry & Cell Biology. – 2005. – № 37. – P. 1337–1343.
- Никитин, В.Ю. Маркеры активации на Т-хелперах и цитотокси ческих лимфоцитахна различных стадиях хронического вирусного гепатита С / В.Ю. Никитин, И.А. Сухина, В.Н. Цыган [и др.] // Вестн. Рос. Воен.-мед. акад. – 2007. – Т. 17, № 1. – С. 65–71.
- Boettler, T. T cells with CD4+CD25+ regulatory phenotype suppress in vitro proliferation of virus-specific CD8+ T cells during chronic hepatitis C virus infection / T. Boettler, H.C. Spangenberg, C. Neumann-Haefelin [et al.] // J. Virology. − 2005. − Vol. 79, N 12. −P. 7860–7867.
- Ormandy, L.A. Increased Populations of Regulatory T Cells in Peripheral Blood of Patients with Hepatocellular Carcinoma / L.A. Ormandy, T. Hillemann, H. Wedemeyer [et al.] // J. Cancer Res. − 2005. − Vol. 65, N 6. − P. 2457–2464.
- Sakaguchi, S. Naturally arising FoxP3-expressing CD4+CD25+ regulatory T cells in immunological tolerance to self- and non-self / S. Sakaguchi // Nature Immunol. − 2005. −Vol. 6, N 4. − P. 345–352.
- Romagnani, S. Regulation of the T cell response / S. Romagnani // Clin. Exp. Allergy. – 2006. − Vol. 36. − P. 1357–1366.
- Хайдуков С.В., Основные и малые популяции лимфоцитов периферической крови человека и их нормативные значения (метод многоцветного цитометрического анализа) /Хайдуков С.В., Зурочка А.В., Тотолян А.А., Черешнев В.А. // Мед. иммунология. – 2009. -Т. 11 (2-3). – С. 227-238.
Источник
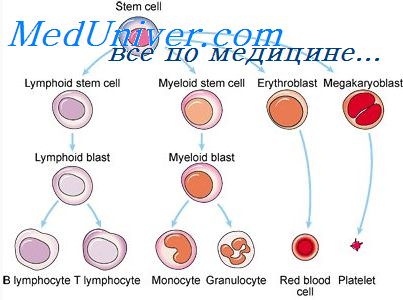
Дифференцировка лимфоидных клеток. ЛимфопоэзК сожалению, именно для этого, важнейшего в иммунологии направления дифференцировки стволовых клеток, пока нет данных, позволяющих сколько-нибудь детально охарактеризовать гистогенез лимфоцитов. Обусловлено это в первую очередь отсутствием клональных методов исследования. Только в последние два года удалось получить в культуре лимфоидные колонии, состоящие из В- (Metcalf е. а., 1975) или Т- (Rosenszajn е. а., 1975) лимфоцитов. Однако большая частота клеток, продуцирующих лимфоидные колонии, доказывает, что они не являются предшественниками лимфоцитов, занимающими в гистогенетическом ряду положение, аналогичное, например, эритропоэтинчувствительным клеткам. Речь идет о более зрелых членах ряда, пролиферация которых регулируется антигеном. Рассмотрение этих проблем не входит в задачу настоящего обзора. В гистогенезе лимфоидных клеток, видимо, есть стадия общей клетки-предшественника как Т-, так и В-лимфоцитов. Эмбриональная печень при трансплантации аллогенному реципиенту (гибриду F1) не вызывает у него вторичной болезни, так как возникающие иммунологически компетентные клетки оказываются иммунологически толерантными. Однако через 60 дней пролиферации в таком реципиенте продуцируются клетки, содержащиеся в селезенке и лимфатических узлах, которые способны вызывать при переносе к вторичному реципиенту того же генотипа реакцию «трансплантат против хозяина». Отсюда можно заключить, что существует какая-то стадия дифференцировки стволовой кроветворной клетки, промежуточная между последней и зрелой, иммунологически компетентной клеткой, характеризующаяся тем, что клетка не способна стать толерантной, и ее потомки оказываются иммунологически компетентными против антигенов реципиента (Туап, 1969). Дифференцируются эти клетки-предшественники в костном мозге и лишь оттуда поступают в периферические лимфоидные органы (Nossal, Pike, 1973), что подтверждает их гистогенетическую близость к стволовым кроветворным клеткам.
И, наконец, при разделении клеток в изопикнических или в изокинетических градиентах удалось показать, что предшественники как Т-, так и В-лимфоцитов имеют одинаковую плотность (порядка 1,064 г/см3), причем они тяжелее КОЕс (1,060 г/см3), легче зрелых Т-лимфоцитов (1,069 г/см3) и оседают в изокинетическом градиенте бычьего сывороточного альбумина с одинаковой скоростью — 3 мм/час. Подтверждается существование этого предшественника и наличием дифференцировочного антигена, общего для молодых Т- и В-лимфоцитов (Yutoku е. а., 1975). Неясно, идет ли речь о клетке-предшественнике лимфопоэза, возможной стволовой лимфоидной клетке, или это уже более поздний продукт ее дифференцировки. Трудно также сказать, на каком этапе происходит коммитирование лимфоидного предшественника на клетки родоначальницы Т- и В-лимфоцитов соответственно. Тем более нет данных о том, регулируется ли пролиферация и дифференцировка этих предшественников, есть ли гормональная регуляция в этом отделе (по аналогии со всеми остальными направлениями дифференцировки стволовой клетки), какие гормоны в ней участвуют, в частности не обладает ли такими свойствами один из гормонов тимуса, фабрициевой сумки и т. д. Поэтому схему дифференцировок в лимфоидном направлении сегодня можно рассматривать только как гипотетическую. В основу ее положены антигенные свойства предшественников, наличие различных рецепторов, аналогии с клетками злокачественных лимфопролиферативных заболеваний. Предполагается, что одно из первых мест в гистогенетическом ряду лимфоидных дифференцировок занимают так называемые 0-клетки, ненесущие поверхностных маркеров ни Т-, ни В-клеток. Видимо, 0-клетки очень быстро коммитируются и дифференцируются в клетки-предшественники Т- и В-лимфопоэза. Такое заключение основано на крайней клинической редкости гипогаммаглобулинемии при остром лимфолеккозе, поражающем преимущественно Т-клетки, и редкости снижения клеточного иммунитета в большинстве случаев агаммаглобулинемии, поражающей В-клетки (Davis, 1975). Несмотря на это, выявление в крови клеток, несущих как поверхностные иммуноглобулины, так и рецепторы для эритроцитов барана, т. е. обладающих свойствами и Т- и В-клеток, является аргументом в пользу наличия общего предшественника обоих этих направлений лимфопоэза. По морфологии 0-клетки похожи на малые и средние лимфоциты. – Также рекомендуем “Образование предшественников лимфоцитов. Поражения стволовой клетки” Оглавление темы “Регуляция пролиферации стволовых клеток”: |
Источник