Нарушение активности т лимфоцитов
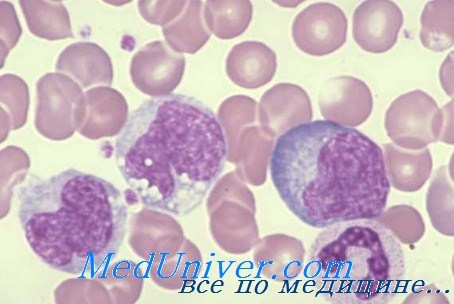
Нарушения Т-лимфоцитов. CD8 лимфопения
Для нарушения активации Т-лимфоцитов характерно присутствие в крови нормального или повышенного числа Т-клеток. Эти клетки сохраняют нормальный фенотип, но в них нарушено проведение сигнала от рецепторов в клетку. Поэтому они не пролиферируют и не продуцируют цитокины при стимуляции митогенами, антигенами или другими сигналами от TCR.
По клиническим проявлениям такие дефекты сходны с другими видами недостаточности Т-лимфоцитов и в ряде случаев неотличимы от тяжелого комбинированного иммунодефицита.
CD8 лимфопения при мутации гена zeta-ассоциированного протеина 70
У больных с нарушением активации Т-клеток в младенческом возрасте развиваются тяжелые, рецидивирующие и часто смертельные инфекции. Большинство случаев выявлено среди меннонитов. Число В-лимфоцитов в крови нормально или повышено; концентрация иммуноглобулинов в сыворотке вариабельна. Экспрессия поверхностных антигенов CD3 и CD4 на Т-лимфоцитах сохраняется, но СD8-клетки почти полностью отсутствуют.

Т-лимфоциты не реагируют на митогены или аллогенные клетки in vitro и не образуют цитоток-сических Т-лимфоцитов. Активность NK-клеток сохраняется. Тимус одного из больных имел нормальное строение, и в нем присутствовали клетки с обоими поверхностными маркерами — CD4 и CD8. Однако CD8-клетки отсутствовали. Это состояние обусловлено мутациями гена, кодирующего zeta-ассоциированный протеин 70 (ZAP-70) — тиро-зинкиназу, не принадлежащую к семейству Src и играющую важную роль в проведении сигнала в Т-лимфоциты.
Ген ZAP-70 расположен на длинном плече хромосомы 2 (участок ql2). Нормальное число Т-лимфоцитов с обоими маркерами (CD4 и CD8) объясняется возможностью использования для позитивной селекции другой тирозинкиназы — Syk. Уровень Syk в тимоцитах в 4 раза превышает ее содержание в периферических Т-лимфоцитах, что и определяет, по-видимому, отсутствие нормальной реакции СD4-клеток крови.
Недостаточность р56-Iск. У 2-месячного мальчика, страдающего бактериальными, вирусными и грибковыми инфекциями, была обнаружена лимфопения и гипогаммаглобулинемия. В- и NK-клетки в крови присутствовали, но число CD4 Т-лимфоцитов было низким. Реакции на митогены оказались непостоянными. Стимуляция TCR не приводила к экспрессии CD69. Однако при стимуляции форболмиристатацетатом и кальциевым ионофором CD69 (который является маркером активации) на Т-лимфоцитах она появлялась, что свидетельствует о дефекте проксимальных участков пути проведения сигнала в клетки.
Молекулярные исследования выявили альтернативный сплайсинг транскрипта, в результате чего в p56-lck отсутствовал киназный домен.
– Также рекомендуем “Тяжелый комбинированный иммунодефицит у ребенка. Клиника и лечение”
Оглавление темы “Врожденные нарушения иммунитета”:
- Нарушения Т-лимфоцитов. CD8 лимфопения
- Тяжелый комбинированный иммунодефицит у ребенка. Клиника и лечение
- Х-сцепленный тяжелый комбинированный иммунодефицит мальчиков. Иммунодефицит при недостаточности аденозиндезаминазы
- Иммунодефициты при недостаточности Jak3, ИЛ-7Ra, RAG1 или RAG2, CD45
- Ретикулярная дисгенезия. Недостаточность пуриннуклеозидфосфорилазы
- Имммунодефицит при мутации гена рецептора ИЛ-2. Метафизарная хондродисплазия – тип Мак-Кьюсика
- Синдром Оменна. Имммунодефицит при дефиците антигенов МНС
- Синдром Вискотта-Олдрича. Иммунодефицит с тромбоцитопенией и экземой
- Атаксия-телеангиэктазия у ребенка. Иммунодефицит при мутации генов рецепторов ИФН
- Синдром гиперпродукции IgE. Лечение иммунодефицитов у детей
Источник
У человека тяжелая комбинированная иммунная недостаточность впервые описана в 1950 г. в Швейцарии у нескольких младенцев с лимфопенией, умиравших от инфекций в течение первого года жизни. Именно поэтому в течение многих лет в литературе встречалось выражение «швейцарский тип ТКИН». В последующие годы было выявлено, что тяжелая комбинированная иммунная недостаточность включает множество синдромов, имеющих различную генетическую природу и различные типы наследования (X-сцепленное в 46% случаев и аутосомно-рецессивное в 54%). Общая частота ТКИН – 1:50 000 новорожденных. В настоящее время известна генетическая природа примерно 15 форм ТКИН, которые, на основании различий в иммунологическом фенотипе, могут быть разделены на 5 групп: T-B+ NK+, T-B- NK+,T-B+ NK-,T+B+NK- и Т-B-NK-.
Основные клинические проявления тяжелой комбинированной иммунной недостаточности практически не зависят от генетического дефекта. Для больных с ТКИН характерно раннее, в первые недели и месяцы жизни, начало клинических проявлений заболевания в виде гипоплазии лимфоидной ткани, упорной диареи, мальабсорбции, инфекций кожи и слизистых, прогрессирующего поражения респираторного тракта. Возбудителями инфекций являются бактерии, вирусы грибы, условно-патогенные микроорганизмы (в первую очередь Pneumocyctis carini). Цитомегаловирусная инфекция протекает в виде интерстициальной пневмонии, гепатита, энтеровирусы и аденовирус вызывают менингоэнцефалиты. Очень часть встречается кандидоз слизистых и кожи, онихомикоз. Характерно развитие регионарной и/или и генерализованной БЦЖ инфекции после вакцинации. На фоне тяжелых инфекций наблюдается отставание в физическом и моторном развитии. Следует помнить, что даже при наличии тяжелой комбинированной иммунной недостаточности у младенцев не сразу развиваются все вышеперечисленные симптомы, и в течение 2-3 месяцев они могут расти и развиваться почти нормально, особенно, если вакцинация БЦЖ не была сделана. Трансплацентарная передача материнских лимфоцитов может вызвать симптомы реакции «трансплантат против хозяина» (РТПХ), называемой в этом случае материнско-фетальной РТПХ. Она проявляется в основном а виде кожной эритематозной или папулезной сыпи и поражения печени.
При лабораторном обследовании в большинстве случаев выявляется выраженная лимфопения, гипогаммаглобулинемия и снижение пролиферативной активности лимфоцитов. Близкое к норме количество лимфоцитов может являться результатом трансплацентарной передачи лимфоцитов от матери. Как было отмечено выше, Т-лимфоциты значительно снижены при всех формах тяжелой комбинированной иммунной недостаточности, однако число и функции В лимфоцитов и NK клеток зависит от генетического дефекта, лежащего в основе ТКИН. В редких случаях отмечается нормальная концентрация иммуноглобулинов, однако их неадекватная специфичность ведет к полной неэффективности гуморального звена. Далее мы рассмотрим некоторые особенности патогенеза различных форм тяжелой комбинированной иммунной недостаточности.
Молекулярно-генетические особенности различных форм тяжелой комбинированной иммунной недостаточности
Т- В- NK- ТКИН
- Ретикулярная дисгенезия
Ретикулярная дисгенезия является редкой формой тяжелой комбинированной иммунной недостаточности, характеризующейся нарушением созревания лимфоидных и миелоидных предшественников на ранних этапах развития в костном мозге. Предполагается аутосомно-рецессивное наследование, однако в связи с редкостью заболевание оно не доказано. Молекулярно-генетические основы заболевания не известны. Заболевание характеризуется выраженной лимфопенией, гранулоцитопенией, тромбоцитопенией, тяжелыми инфекциями, проводящими к ранней гибели пациентов.
T- B+ NK- ТКИН
- Х-сцепленная тяжелая комбинированная иммунная недостаточность
Х-сцепленная ТКИН, или дефицит g цепи – наиболее часто встречающаяся форма (более 50% всех форм тяжелой комбинированной иммунной недостаточности). Она развивается в результате мутации гена общей у цепи (CD132) рецепторов интерлейкинов 2, 4, 7, 9,15. Мутация у цепи приводит к блокаде рецепторов, в результате чего клетки-мишени не способны ответить на действие соответствующих интерлейкинов. Иммунологические нарушения, развивающиеся у этих больных, характеризуются отсутствием Т-клеток и NK клеток и повышением количества В-клеток. В результате отсутствия T-клеточной регуляции продукция иммуноглобулинов В-клетками резко снижена.
- Дефицит Jak3
Тирозинкиназа семейства Janus – Jak3 необходима для передачи активационного сигнала от общей уцепи IL2, 4, 7, 9, 15 к ядру клетки. Дефицит jak3 вызывает такие же глубокие нарушения дифференцировки Т- и NK-клеток, как дефицит общей уцепи. Иммунологические нарушения и клинические проявления у больных с дефицитом Jak3 аналогичны таковым при X-сцепленной ТКИН.
- Дефицит CD45
Трансмембранная протеинтирозинкиназа CD45, специфичная для гемопоэтических клеток, необходима для передачи сигнала с антигенного рецептора T- и В-клеток. Мутации гена CD45 приводят к развитию ТКИН, характеризующейся резким снижение количества T клеток, нормальным содержанием В-клеток и прогрессирующим снижением концентраций сывороточных иммуноглобулинов. Число NK лимфоцитов снижено, однако не полностью.
Т- В- NK+ ТКИН
- Полный дефицит RAG1/RAG2
Белковые продукты активирующих рекомбинацию генов – recombination activating genes (RAG1 и RAG2) инициируют формирование иммуноглобулинов и T-клеточных рецепторов, необходимых для дифференцирован В- и T-клеток. Таким образом, мутации RAG генов приводят к формированию тяжелой комбинированной иммунной недостаточности. При этой форме иммунодефицита отсутствуют T- и В-клетки, в то время как количество NK-клеток нормально. Количество сывороточных иммуноглобулинов резко снижено.
- Радиочувствительная ТКИН (дефицит Artemis)
В 1998 году были идентифицированы пациенты с Т-B-NK+ тяжелой комбинированной иммунной недостаточности, не имеющие мутаций генов RAG1/RAG, отличающиеся высокой чувствительностью к ионизирующей радиации и имеющие нарушения восстановление двухцепочечных разрывов ДНК (DNA double strand break repair), T- и В-лимфоциты распознают антигены с помощью молекул Т-клеточных рецепторов (TCR) и иммуноглобулиноз. Антиген-специфичные участки этих рецепторов состоят из трех сегментов: V- (вариабельных), D (разнообразия) и J (объединения). Полиморфизм антиген-специфичных участков TCR и иммуноглобулинов обеспечивается процессом соматической реарранжировки и V(D)J рекомбинации. В процессе рекомбинации генов иммуноглобулинов и TCR RAG протеины индуцируют двухцепочечные разрывы ДНК. Восстановление индуцированных радиацией и спонтанных разрывов ДНК требует участия ряда протеинкиназ и недавно идентифицированного фактора, названного Artemis. Artemis необходим для остановки клеточного цикла в случае повреждения ДНК.
Мутации гена Artemis приводят к развитию аутосомно-рецессивной тяжелой комбинированной иммунной недостаточности с повышенной радиочувствительностью, характеризующейся отсутствием Т- и В-лимфоцитов и хромосомной нестабильностью. Отличительной чертой клинических проявлений, помимо характерных для scex ТКИН, является наличие номоподобных поражений слизистых рта и других локализаций.
T- B+ NK+ TKИH
- Дефицит IL-7R
Предшественники T- и В-клеток экспрессируют функциональный IL7R, состоящий из а цепи и общей у цепи. Экспрессия этого рецептора критична для созревания T-лимфоцитов, но не критична для развития В-лимфоцитов. Мутации гена альфа цепи IL-7R приводит к развитию ТКИН, с фенотипом T-B-NK+ и выраженным снижением концентраций сывороточных; иммуноглобулинов.
T+ B+ NK- ТКИН
В 2001 году, впервые, Gilmour KC et al. описали пациента с низким абсолютным количеством T-лимфоцитов, нормальным количеством В-клеток и полным отсутствием NK-клеток. И хотя никаких мутаций в генах общей у цепи или JAK3 обнаружено не было, функциональные исследования показали нарушение фосфорилирования JAK3 через комплекс IL2R. Последующий цитометрический анализ показал значительное снижение экспрессии beta цепи рецептора IL15 (IL15Rbeta). Однако, мутации гена IL15Rbeta выявить не удалось, что заставляет предполагать наличие дефектов транскрипции, которые оказались ответственными за отсутствие экспрессии цепи IL15Rbeta.
- Дефицит ферментов пуринового обмена
Дефицит двух ферментов, катализирующих пуриновый метаболизм – аденозиндезаминазы (ADA) и пуриннуклеозидфосфарилазы (PNP), ассоциирован с развитием комбинированной иммунной недостаточности. Вследствие отсутствия этих ферментов накапливаются токсичные для клеток продукты – деэоксиаденозин и дезоксигуанозин, которые частично фосфорилируются в лимфоидных клетках, превращаясь в соответствующие дезоксинуклеозидтрифосфаты. Токсичность этих продуктов особенно важна в быстро делящихся клетках и заключается в ингибировании синтеза ДНК, индукции апоптоза, нарушении метилирования и др. Оба эти состояния гетерогенны по клиническим проявлениям в зависимости от локализации мутации на протяжении генов итого, насколько в результате страдает функция соответствующего фермента.
- Дефицит аденозиндезаминазы (ADA)
Дефицит аденозиндезаминазы – одна из первых идентифицированных форм ТКИН. Ген аденозиндезаминазы находится на 20ql3.ll. Известно более 50 вариантов мутаций гена ADA. Существует зависимость между генетически детерминированной резидуальной активностью аденозиндезаминазы и метаболическим и клиническим фенотипом. ADA экспрессируется в различных тканях, особенно высока его экспрессия в незрелых тимоцитах и В лимфоцитах, по мере созревания клеток экспрессия АДА уменьшается. При дефиците аденозиндезаминазы в клетках накапливаются дезоксиаденозинтрифосфат и S-аденозилгомоцистеин. Эти метаболиты ингибируют пролиферацию ТT- и В-лимфоцитов.
У большинства пациентов с дефицитом аденозиндезаминазы в раннем возрасте проявляются все признаки ТКИН. Это, как правило, больные с самым низким число лимфоцитов и самыми ранними и тяжелыми проявлениями. У этих больных не отмечается приживление материнских лимфоцитов. Кроме иммунологических, нарушение пуринового обмена может вызывать скелетные нарушения. Так, при рентгенологическом исследовании выявляются увеличенные косто-хондральные сочленения (как при рахите), расширение концов ребер, тазовая дисплазия. У больных также описаны следующие неврологические изменения: нистагм, сенсорная глухота, спастические нарушения, нарушение психомоторного развития (независимо от инфекций). Частым признаком дефицита аденозиндезаминазы является повышение трансаминаз, вероятно свидетельствующее о наличии токсического гепатита.
В последние годы описаны варианты с «поздним началом» ADA-дефицита и выявлены даже здоровые индивидуумы с частичным дефицитом фермента.
Ведение больных тяжелыми проявлениями ADA-дефицита практически не отличается от терапии других ТКИН. Однако экспериментальным методом является назначение заместительной внутримышечной терапии ферментом PEG-ADA в дозе 15-30 мг/кг/неделю. Коррекция дефектов требует длительного и постоянного лечения. Число и функция Т лимфоцитов как правило улучшается к 6-12 недели терапии, однако даже после длительного лечение (10 лет) у большинства больных сохраняется лимфопения и нарушение митогенного ответа.
- Дефицит пурин-нуклеозндфосфорилазы (PNP)
Ген PNP расположен на 14ql3. В отличие от ADA, активность пурин-нуклеозндфосфорилазы увеличивается по мере созревания Т лимфоцитов. При дефиците PNP в клетках накапливается деэоксигуанозинтрифосфат, ингибирующий пролиферацию Т-лимфоцитов.
Также как и при дефиците аденозиндезаминазы, у большинства пациентов с дефицитом пурин-нуклеозндфосфорилазы клинические проявления ТКИН развиваются в младенческом возрасте, хотя в отдельных случаях описано более позднее начало. Сопутствующими синдромами при дефиците PNP являются урикемия и урикурия. Часто у больных с дефицитом пурин-нуклеозндфосфорилазы отмечаются аутоиммунные (гемолитическая анемия, тромбоцитопения, нейтроления, системная красная волчанка) и неврологические (плегии, парезы, атаксия, тремор, задержка умственного развития) проявления. У больных отмечается повышенная склонность к онкологическим заболеваниям. При лабораторном исследовании отмечается резкое снижение T лимфоцитов и как правило нормальное число В лимфоцитов. Проявлением дисрегуляции В лимфоцитов являются повышение уровня иммуноглобулинов, гаммапатия, наличие аутоантител.
- Дефицит МНС II
Синдром «голых лимфоцитов» является врожденным иммунодефицитом, развивающимся из-за отсутствия на поверхности клеток экспрессии молекул II класса главного комплекса гистосовместимости (МНС II). При этом заболевании из-за дефектов генов, контролирующих МНС II, не происходит экспрессии его молекул, необходимых для дифференцировки и активации CD4+клеток, нарушается селекция T-клеток в тимусе, и развивается тяжелый иммунодефицит. Поврежденные гены кодируют четыре высокоспецифичных транскрипционных фактора (RFXANK, RFX5, RFXAP и СИТА), регулирующих экспрессию МНС II. Первые три являются субъединицами RFX (Regulatory Factor X) – тримерного, присоединяющего ДНК комплекса, который регулирует все промоторы МНС II. CIITA {Class II Trans activator) является не связывающим ДНК ко-активатором, который контролирует экспрессию МНС II.
Заболевание характеризуется типичными клиническими признаками ТКИН, которые, однако, протекают легче. Так, а группе 9 нетрансплантированных больных с этим заболеванием средняя продолжительность жизни составила 7 лет.
При лабораторном исследовании отмечается значительное снижение CD4+ лимфоцитов, при как правило нормальном числе CD8+ лимфоцитов. У некоторых больных отмечается отсутствие экспрессии не только молекул МНС II, но и МНС I. В целом отмечается выраженная недостаточность T клеточного ответа, продукция иммуноглобулинов также резко снижена.
- Дефицит ТАР
ТАР {Transporter Associated Protein) необходим для транспорта антигенных пептидов в эндоллазматический ретикулум и присоединения их к молекулам МНС I класса. Выявлены дефекты 1 и 2 субъединиц ТАР (ТАР1 и ТАР2). Характерными лабораторными проявлениями у пациентов с дефицитом ТАР являются: отсутствие экспрессии МНС I класса, близкие к нормальным уровни иммуноглобулинов (у некоторых больных отмечены селективный дефицит IgM), отсутствие антительного ответа на полисахаридные антигены. У различных больных отмечалось нормальное или прогрессивно снижающееся число CD8 Т лимфоцитов, остальные субпопуляции лимфоцитов как правило были нормальными. При этой форме КИН существует высокая чувствительность к бактериальным инфекциям слизистых респираторного тракта, характерны гранулематозные поражения кожи. Вирусные инфекции и инфекции, вызванные внутриклеточными патогенами, встречаются редко. У отдельных пациентов описано бессимптомное течение и позднее начало клинических проявлений иммунодефицита.
- Дефицит CD25
Мутации гена альфа-цепи рецептора IL-2 (IL2Rct) {CD25) приводят к развитию КИН с снижением количества и нарушением пролиферации периферических T-клеток и нормальным развитием В-клеток. Дифференцировка тимоцитов не нарушена, но, несмотря на нормальную экспрессию CD2, CD3, CD4 и CD8, CD25, кортикальные тимоциты не экспрессируют CD1. Больные имеют повышенную чувствительность к вирусным инфекциям (ЦМВ и др.), также с раннего возраста страдают повторными бактериальными и грибковыми инфекциями, хронической диареей, У больных также отмечается лимфопролиферация, сходной с таковой при АЛПС. Предполагается, что в основе ее лежит нарушение регуляция апоптоза в тимусе, приводящая к экспансии аутореактивных клонов в различных тканях.
- Дефицит СВЗу и CD3е
Антиген-распознающий рецепторный комплекс T-клеток состоит из собственно T-клеточного рецептора (TCR) и молекулы CD3. Существует два типа TCR, каждый из которых состоит из двух пептидных цепей – аb и уv. Основной функцией- TCR является связывание антигенного пептида, ассоциированного с продуктами главного комплекса гистосовместимости, a CD3 – передача антигенного сигнала в клетку. CD3 включает молекулы 4-5 типов. Все цепи комплекса CD3 (у, v, e, £, t) являются трансмембранными белками. Мутации генов цепей у, v или £ приводят к снижению количества зрелых T-клеток с низкой экспрессией TCR. Мутации гена e цепи приводит к нарушению дифференцировки тимоцитов на уровне CD4-CD8-. У человека дефицит СD3 у приводит к снижению количества CD8+ Т-лимфоцитов и CD4+CD45RA+, содержание CD4+CD45R0+, В- и NК-клеток и концентрации сывороточных иммуноглобулинов – нормальны. Клинический фенотип при дефиците CD3y и CD3e варьирует даже среди членов одной семьи от проявлений до довольно мягкого течения заболевания.
- Дефицит ZAP70
Протеин-тирозинкиназы семейства ZAP70/Syk играют важную роль в передаче сигнала от антиген-распознающего рецептора, они необходимы для нормального развития Т-лимфоцитов. ZAP70 необходима для дифференцировки ab Т-лимфоцитов. При дефиците ZAP70 развивается селективный дефицит CD8+ клеток. Количество CD4+ циркулирующих клеток нормально, но они имеют выраженные нарушения функций в виде отсутствия продукции IL-2 и пролиферативной активности. Концентрации сывороточных иммуноглобулинов снижены.
Источник