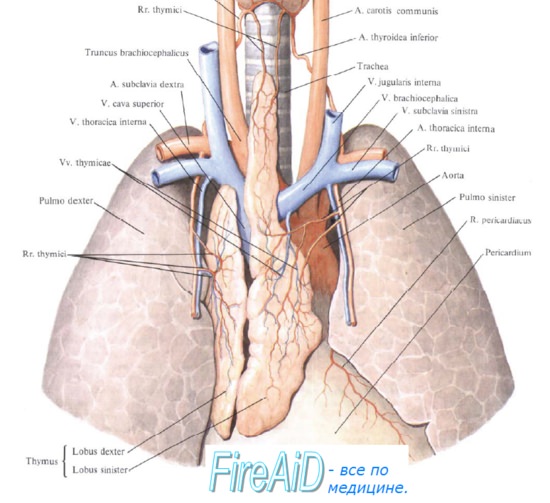
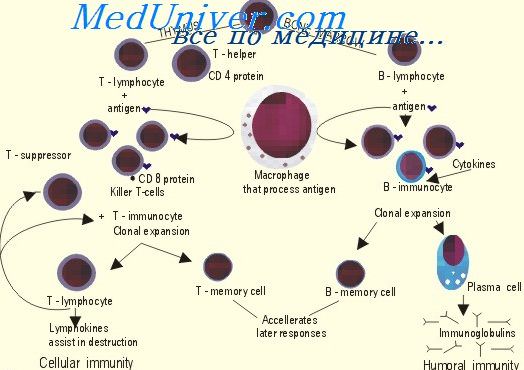
Миграция лимфоцитов из тимуса
Оглавление темы “Иммунная система. Функции клеток иммунной системы. Т-лимфоциты. В-лимфоциты. Структура и функции органов иммунной системы.”: Тимус (вилочковая железа). Тимоциты. Функции тимуса ( вилочковой железы ). Этапы отбора тимоцитов.Тимус в качестве одного из центральных органов иммунной системы является местом созревания Т-лимфоцитов из клеток-предшественниц и формирования огромного разнообразия зрелых Т-лимфоциов, способных распознать своими рецепторами любой антиген. Лимфоциты, находящиеся в тимусе, называют тимоцитами. В тимусе идут параллельно несколько процессов: Ранние клетки-предшественницы Т-лимфоцитов из костного мозга поступают в корковый слой тимуса. Постепенно они мигрируют из коркового слоя тимуса в мозговой, контактируя с тимическими эпителиальными клетками, макрофагами и дендритными клетками. На тимоциты влияют продуцируемые тимическими эпителиальными клетками гормоны: тимулин, al- и (34-тимозины, тимопоэтин, контролирующие их дифференцировку. В процессе продвижения в мозговой слой тимоциты созревают (дифференцируются), поэтапно приобретая характерные для зрелых Т-лимфоцитов поверхностные рецепторы и антигены.
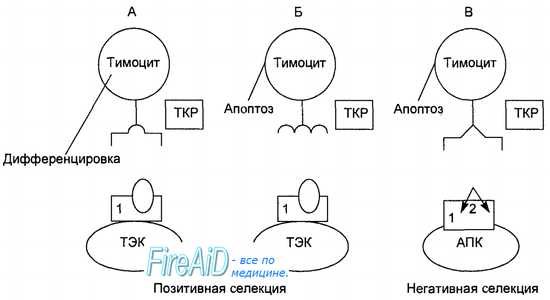
От стромальных клеток тимуса и продуцируемых ими молекул каждый тимоцит получает сигналы: усиления пролиферации, изменений поверхностного фенотипа (сочетания молекул, присутствующих на поверхности клеток), перестройки («реаранжировки») генов, ответственных за широкое разнообразие специфических антигенраспознающих рецепторов. Основная функция зрелых Т-лимфоцитов — это распознавание чужеродных антигенных пептидов в комплексе с собственными молекулами главного комплекса гистосовместимости на поверхности антигенпредстав-ляющих клеток. Для выполнения этой функции Т-лимфоциты располагают специфическими антигенраспознающими рецепторами. Отбор тимоцитов идет в два этапа (рис. 8.4). После того как на тимоците формируется Т-клеточный рецептор определенной специфичности, в следующие этапы развития вступают только те тимоциты, которые проявили способность распознавать собственные молекулы главного комплекса гистосовместимости, присутствующие на эпителиальных клетках коры тимуса данного организма. В отличие от зрелого Т-лимфоцита, который при встрече с антигенным пептидом, специфичным для его Т-клеточного рецептора, получает сигнал активации, незрелые тимоциты в тимусе при распознавании специфичных для их Т-клеточных рецепторов аутоантигенных пептидов получают сигнал генетически программированной гибели — апоптоза. Таким образом, идет «выбраковка» аутореактивных Т-лимфоци-тов, 95—98 % тимоцитов ежедневно погибают в тимусе этим путем. Только 2—5 % тимоцитов (1 • 10б) в виде зрелых Т-лимфоцитов ежедневно покидают тимус, поступая в кровь и расселяясь в лимфоидных органах.
A. Тимоцит, способный распознать своим рецептором (ТКР) собственные антигены главного комплекса гистосовместимости (1) на поверхности тимических эпителиальных клеток (ТЭК), вступает в дальнейшую дифференцировку. Б. Тимоцит, не способный распознать своим ТКР собственные антигены главного комплекса гистосовместимости (1) на поверхности ТЭК, получает сигнал апоптоза. B. Тимоцит, способный распознать своим ТКР пептидный фрагмент аутоантигена (2) на поверхности антигенпредставляющеи клетки в комплексе с собственными молекулами главного комплекса гистосовместимости (1), получает сигнал апоптоза. В результате в кровоток и в лимфоидные органы поступают только те Т-лимфоциты, которые несут рецепторы, распознающие чужеродные пептиды в сочетании с собственными молекулами главного комплекса гисто-совместимости. Тимус представляет собой единственный орган иммунной системы, подвергающийся быстрой возрастной инволюции, которая у людей начинается после первого года жизни. Человек ежегодно теряет до 3 % истинно тимической ткани, которая постепенно замещается жировой и соединительной тканью. Соответственно снижается и продукция Т-лимфоцитов. Высокая продукция Т-лимфоцитов сохраняется до двух лет, а затем быстро снижается. Однако количество Т-лимфоцитов в организме сохраняется на достигнутом уровне благодаря тому, что значительную часть популяции Т-лимфоцитов составляют долгоживущие клетки, которые не нуждаются в постоянном обновлении. Более того, зрелые Т-лимфоциты, распознавшие «свой» антиген в периферических органах иммунной системы, получают сигналы активации и избирательной пролиферации, за счет чего их численность возрастает. Перенесенная взрослым человеком тимэктомия не приводит к катастрофическому снижению количества циркулирующих Т-лимфоцитов. В качестве одного из центральных органов иммунной системы тимус выполняет следующие функции: а) контролирует пролиферацию, диффе-ренцировку, отбор и окончательное созревание Т-лимфоцитов, б) продуцирует тимические гормоны, влияющие на функции Т-лимфоцитов. – Вернуться в оглавление раздела “Физиология человека.” |
Источник
Образование Т-клеток в тимусе. Заселение тимуса предшественниками лимфоцитовОбразование Т-клеток в тимусе происходит из потомков костномозговых стволовых кроветворных клеток. Эмигрируя из костного мозга, они попадают по току крови в тимус и проникают в его ткань в области коркового слоя. В тимусе они активно пролиферируют и подвергаются дифференцировке и коммитированию. Их потомки перемещаются в корковый слой и либо гибнут внутри тимуса, либо покидают его, вновь поступая в кровоток. Стадии дифферепцировки, которые проделывают предшественники Т-клеток в тимусе, имеют антигенные, функциональные и морфологические маркеры. Наименее зрелые предшественники характеризуются высокой чувствительностью к кортизону, высокой концентрацией антигенов TL и Ly и низкой концентрацией Н2-антигенов. Морфологически эти клетки являются малыми лимфоцитами, содержащими монорибосомы и относительно мало органоидов. Они дают начало пролиферирующим в тимусе большим лимфоцитам с резко увеличенным количеством рибосом, собранных в полисомы в виде розеток. Наиболее зрелые в пределах тимуса Т-клетки находятся в его мозговом слое. Они резистентны к кортизону, имеют малые концентрации TL- и 8-антигенов, но много Н2-антигена. Морфологически — это малые лимфоциты, но содержащие полирибосомы и волокнистые цитоплазматические структуры. Таких клеток в тимусе содержится около 5% от всех тимоцитов, и именно они могут выходить из тимуса в кровоток и осуществлять колонизацию периферических лимфоидных органов в качестве антигенраспознающих, уже коммитированных Т-клеток. Окончательное дозревание Т-клеток происходит только после их попадания, во вторичные лимфоидные органы.
Гибель подавляющей части тимоцитов внутри тимуса позволяет предполагать, что избыточная пролиферация в нем Т-предшественников связана с апробированием их свойств и отбором еще до встречи с антигенами; последние практически не попадают в тимус благодаря наличию специального барьера. При заселении тимуса предшественниками Т-клеток ориентирами для них служат не лимфоциты (тимоциты) и не макрофаги (которые в тимусе крайне малочисленны), а клетки его стромы. На это указывают результаты типирования клеток в гетеротопных трансплантатах тимуса (Дидух, Фриденштейн, 1970). Стромальные клетки тимуса — ретикулярные клетки, или клетки его эктодермального эпителия,— создают и то микроокружение, которое необходимо для дифференцировки Т-клеток: в отсутствие тимической стромы Т-клетки в организме не образуются. Однако результаты, полученные на радиохимергх и при гетеротопной трансплантации тимуса, показали, что свойства образующихся в тимусе Т-клеток определяются генетической структурой заселяющих его предшественников, а не стромальными клетками, образующими территорию, на которой происходит их дифференцировка. Действительно, в случаях, когда тимэктомированный реципиент и донор тимуса, используемого для гетеротопной трансплантации, различаются по антигенам, тимоциты, которые образуются в пересаженном тимусе, имеют 6-антиген реципиента, а в случае, когда по 6-антигенам различаются донор клеток костного мозга и облученный реципиент, тимоциты радиохимеры имеют 6-антиген донора (Metcalf, Moore, 1971). Это показывает, что роль тимического микроокружения как индуктора образования Т-клеток состоит в создании возможности для реализации тех генетически закодированных в потомках стволовых кроветворных клеток свойств, которые характеризуют дифференцировку Т-клеток. Важный фактор тимического микроокружения — это секретируемый его стромальными клетками полипептид — тимозин (м. в. 35 000). Тимозин индуцирует созревание Т-клеток из костномозговых предшественников (в частности, синтез 6-антигена) как in vivo, так и in vitro (Scheid e. a., 1973). Исчерпывается ли специфическое действие тимического микроокружения секрецией тимозина, пока не выяснено. – Также рекомендуем “Колонизация периферических лимфоидных органов. Репопуляция лимфоцитов” Оглавление темы “Регуляция формирования антител”: |
Источник
Т-лимфоциты несут на себе поражающее воображение разнообразие рецепторов, позволяющее распознавать практически любые чужеродные субстанции, с которыми может столкнуться организм. Путь от гемопоэтической стволовой клетки к 107–109 клонов Т-лимфоцитов с уникальными антиген-связывающими последовательностями — удивительное достижение эволюции. Многостадийное развития Т-лимфоцитов может выглядеть пугающим и запутывающим со страниц учебников. Однако, если вы дадите ему второй шанс, вы увидите, что это красивый и слаженный процесс.
Как и остальные клетки крови, Т-лимфоциты берут свое начало в костном мозге от гемопоэтической стволовой клетки. Такие клетки-предшественницы имеют мало общего со зрелыми функциональными Т-лимфоцитами: они не имеют антигенных рецепторов (TCR) и не умеют узнавать чужеродные антигены. Их ждет сложный путь развития, который осилят немногие, однако те, которые выживут, создадут армию, готовую к любой угрозе. Для развития Т-лимфоцитов в нашем теле формируется специальный орган — тимус. Создав достаточный репертуар рецепторов, тимус подвергается инволюции и практически не детектируется после пубертатного периода. Численность Т-лимфоцитов во взрослом организме в основном поддерживается делением зрелых клеток.
Для миграции в тимус клетки, чья судьба — стать Т-лимфоцитом, используют хемокиновый рецептор CCR9, лиганд для которого — CCL25 — секретируют клетки тимуса. Достигнув тимуса, предшественники Т-лимфоцитов становятся тимоцитами. Первым делом они получают сигнал от эпителиальных клеток тимуса через рецептор Notch-1, который окончательно определяет их судьбу в пользу Т-лимфоцита.
Следующая задача тимоцитов — активная пролиферация. Скорость деления тимоцитов крайне высока, поскольку 95 %–98 % этих клеток погибает. Дело в том, что судьба развивающегося Т-лимфоцита по умолчанию — апоптоз, спасти от которого его может только успешное прохождение нескольких раундов отбора. Сигнал для первого раунда деления — интерлейкин 7, который выделяют эпителиальные и другие клетки тимуса. Мутации в гене ИЛ-7 или его рецептора приводят к тяжелым иммунодефицитам. Пролиферация приводит к созданию большого пула клеток, которые называют дважды негативными клетками, поскольку они не несут на себе корецепторы CD4 и CD8. Большинство из них (90 %) дадут начало αβ Т-лимфоцитам, а 10 % — γδ Т-лимфоцитам.
После этого тимоциты приступают к перестройке генов антигенных рецепторов. Это тот самый момент, когда из небольшого количества генов возникает всё разнообразие антигенных рецепторов — миллионы и миллиарды. В ходе этого процесса участки генов антигенных рецепторов перестраиваются случайным образом. Ключевое слово здесь — случайный, поскольку процесс формирования рецепторов, способных эффективно распознавать чужеродные антигены, никак не зависит от этих антигенов и происходит задолго до встречи с ними!
До сих пор тимоциты содержали гены TCR в зародышевой конфигурации, т. е. не подвергшиеся перестройке. Такие гены не могут образовать TCR. Тимоциты начинают с перестройки генов одной из двух цепей TCR — β-цепи. После этого тимоциты проходят через первую контрольную точку. В случае успешной перестройки клетка экспрессирует β-цепь, которая вместе с инвариантной α-цепью формирует на поверхности клетки pre-TCR. Такой рецептор активируется без участия лиганда и передает в клетку сигналы для дальнейшего развития. Остальные клетки не проходят отбор: в случае неудачной перестройки pre-TCR не экпрессируется и клетка подвергается апоптозу в отсутствие сигналов к выживанию.
Активация pre-TCR поставляет в клетку важные сигналы для дальнейшего развития:
- Останавливается перестройка локуса β-цепи во втором аллеле. Это называется аллельное исключение — зрелые Т-лимфоциты экспрессируют β-цепь TCR только с одного аллеля.
- Начинается экспрессия двух ко-рецепторов CD4 и CD8, теперь тимоциты называются дважды позитивными.
- Начинается второй раунд пролиферации. Через pre-TCR клетки получают мощный сигнал к делению, приводящий к еще более интенсивной экспансии, чем в первом раунде.
- После этапа деления запускается перестройка α-цепи рецептора.
В отличие от цепи-партнера, α-цепь может подвергаться многократной перестройке, и большинство тимоцитов успешно с ней справятся. После перестройки α-цепи тимоциты наконец экспрессируют на своей поверхности полный αβ TCR. Однако впереди главная проверка, пройти которую суждено немногим.
Задачи последнего этапа отбора:
- Отобрать клетки, распознающие молекулы главного комплекса гистосовместимости (MHC) организма. Этот этап присутствует в развитии тимоцитов, поскольку зрелые Т-лимфоциты способны распознавать антигены только в составе МНС. Поэтому они должны знать МНС своего организма в лицо. Это называется позитивная селекция.
- Элиминировать клетки, распознающие собственные антигены. Это называется негативная селекция.
Однако антигенпрезентирующие клетки тимуса (эпителиальные клетки тимуса, дендритные клетки и макрофаги) располагают только комплексами «свой МНС — свой антиген». И позитивная, и негативная селекция осуществляется на основании взаимодействия TCR с такими комплексами! Для объяснения была предложена гипотеза аффинности. Тимоциты, чьи антигенные рецепторы проявят низкую аффинность к таким комплексам, продолжат развитие. Тимоциты, чьи рецепторы свяжутся с представленными антиген-МНС комплексами прочно, подвергнутся апоптозу как аутореактивные клоны (клональная делеция). Клетки, не распознающие МНС вовсе, т. е. не прошедшие позитивную селекцию, умрут особым способом, который называется смерть от забвения (death by neglect). Ещё один вариант развития — среднее связывание рецептора с антигенным комплексом, такие тимоциты могут дать начало регуляторным Т-клеткам. Таким образом, регуляторные Т-клетки — единственные лимфоциты, которые взаимодействуют со своим будущим антигеном в процессе развития! Развитию этого подтипа Т-лимфоцитов сейчас посвящено много исследований.
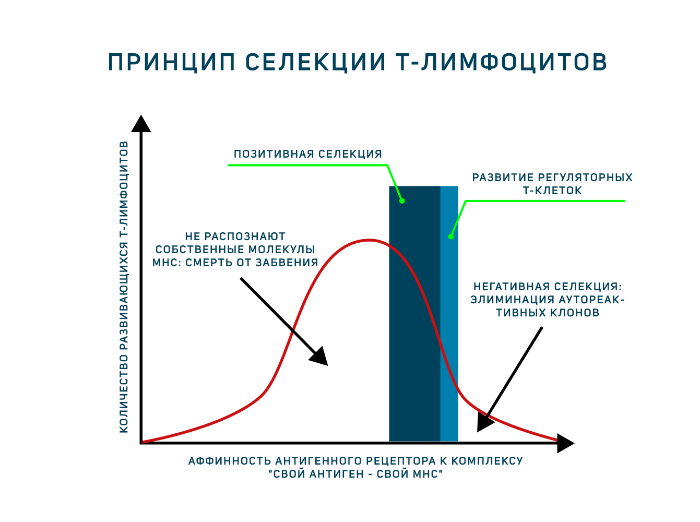
Особую роль в негативной селекции играет белок AIRE (аутоиммунный регулятор), который заставляет клетки тимуса экспрессировать в небольших количествах антигены, в норме присутствующие только в определенных тканях. Это позволяет сформировать толерантность к тканеспецифичным антигенам, встречающимся только за пределами тимуса. Мутация в белке AIRE приводит к развитию аутоиммунного полиэндокринного синдрома. AIRE содержится в эпителиальных клетках медуллы. При этом известно, что наиболее эффективно негативная селекция осуществляется при презентации антигена дендритными клетками и макрофагами, а не стромой тимуса. В новом исследовании был показан перенос антигенов из эпителиальных клеток тимуса в дендритные клетки, которые их и презентируют!
Одновременно с позитивной и негативной селекцией осуществляется проверка, соответствует ли корецептор распознаваемому классу МНС — т. е. происходит дифференцировка в функциональные подклассы. Выживают только клетки с правильной комбинацией: CD8 + MHC I — цитотоксические Т-лимфоциты и CD4 + MHC II — Т-хелперы.
Последнее, что должен сделать лимфоцит перед тем, как покинуть тимус — это изменить тип сигналинга через антигенный рецептор. Если незрелые Т-лимфоциты с высоким родством к антигену погибают, то зрелые — активируются (молекулярные основы такой принципиальной разницы не ясны). Теперь лимфоциты готовы заселить периферические лимфоидные органы и нести оборону. Зрелые Т-лимфоциты покидают тимус, используя градиент сфингозин-1-фосфата, — липида, присутствующего в высоких концентрациях в крови и лимфе, для хемотаксиса в кровяное русло. Для хоуминга во вторичные лимфоидные ткани они используют CD62L (L-селектин).
γδ Т-лимфоциты несут менее разнообразные антигенные рецепторы, по-видимому, не зависящие от МНС. Они не экспрессируют корецепторы CD4, CD8. γδ Т-лимфоциты выступают в роли первой линии обороны против часто встречающихся бактерий в эпителиальных и слизистых тканях и скорее относятся ко врожденной иммунной системе, чем к адаптивной.
Источники:
- Kenneth Murphy, Casey Weaver. Janeway’s Immunobiology 9th edition. Garland Science, 2017.
- Abul Abbas, Andrew H. Lichtman, Shiv Pillai. Cellular and Molecular Immunology 9th Edition. Elsevier, 2017.
- Perry J. S. et al. CD36 Mediates Cell-Surface Antigens to Promote Thymic Development of the Regulatory T Cell Receptor Repertoire and Allo-tolerance //Immunity. – 2018. – 923-936.
Источник