Механизм активации лимфоцитов в

Оглавление темы “Селезенка. Лимфатические узлы. Стадии иммунного ответа. Формы иммунного ответа. Воспаление. Механизмы, контролирующие иммунную систему.”: Активация Т- и В-лимфоцитов в иммунном ответе. Активация лимфоцитов. Формы специфического иммунного ответа.Передача сигнала активации от антигенраспознающего рецептора в ядро клетки приводит к активации конкретных генов, ответственных за митотическую активность клеток, контролирующих продукцию клеткой биологически активных молекул, участвующих в антимикробной защите (антитела, цитокины).
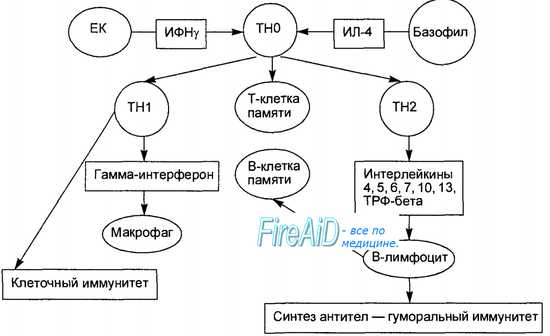
В-лимфоцит получает одновременно два сигнала активации: от антигенраспознающего рецептора при его соединении с антигеном и от связывания его поверхностных костимулирующих молекул с соответствующими лигандами на Т-лимфоцитах. После этого В-лимфоцит пролиферирует и потомки его превращаются в зрелые антителопродуцирующие плазматические клетки. Т-лимфоцит в ответ на контакт с антигеном начинает пролиферировать, потомки его приобретают способность продуцировать определенные цитокины или превращаются в зрелые цитотоксические клетки. В зависимости от того, какие дополнительные сигналы активации (цитокины, костимулирующие молекулы) получает Т-лимфоцит в момент контакта с антигеном, его потомки дифференцируются в двух разных направлениях, превращаясь в Т-хелперы, продуцирующие гамма-интерферон (Th1), или в Т-хелперы, продуцирующие интерлейкины-4, -5, -6, -10, -13 (Th2). Количественное преобладание Thl над Th2 является условием развития клеточного (кле-точно-опосредованного) иммунного ответа. В случае преобладания Th2 развивается гуморальный иммунный ответ, проявляющийся продукцией специфических антител (рис. 8.9). – Также рекомендуем “Клеточный иммунный ответ. Гуморальный иммунный ответ. Защитные функции иммуноглобулинов ( антител ).” |
Источник
Активация В-лимфоцитов. Влияние антигенов на В-лимфоцитыАктивация В-лимфоцитов связана с рядом специфических и неспецифических стимулов, которые приводят к глубоким биохимическим и морфологическим изменениям в этих клетках. Существуют теории, пытающиеся объяснить, каким образом антиген «запускает», активирует В-клетки. Хотя действие антигена и является наиболее важным для активации В-клеток, в процессе активации принимают участие и дополнительные факторы: 1) антигенспецифические Т-клетки, 2) медиаторы, секретируемые антигенспецифическими Т-клетками, 3) медиаторы, секретируемые неспецифическими Т-клетками, 4) продукт 1а-гена, 5) добавочные клетки (макрофаги, А-клетки), 6) антигенспецифические Т-супрессоры. 1. Активация В-клеток обусловлена внедрением липофильного блока в двойной липидный слой их мембраны. Это внедрение может происходить и без участия антигена, неспецифически, при большой концентрации соответствующего метаболита. Таким образом, например, действует, по-видимому, неспецифический стимулирующий фактор Т-клеток-помощников. Специфичность иммунологического процесса обусловлена наличием медиатора, который секретируется Т-лимфоцитами под влиянием антигена. Этот медиатор (секретируемый рецептор Т-клеток) состоит из трех частей: рецептора Т-клеток, специфически реагирующего с детерминантами несущей части антигена (носителя), Н-2-белка и «липофильного хвоста». Медиатор присоединяется своим рецептором к антигену, фиксированному на поверхности антигенсвязывающей клетки, и липофильный хвост внедряется в фосфолипидный слой мембраны.
2. Присоединение антигена к В-лимфоциту приводит к его обратимому параличу или инактивации благодаря возникновению сигнала 1. Сигнал 1 развивается при бимолекулярной реакции между одновалентным антигеном и соответствующим рецептором В-клетки. Он чрезвычайно быстро (возможно, уже через секунду) оказывает на клетку парализующее действие. Индукция иммунной реакции возникает в том случае, если на В-клетку после сигнала 1 подействует еще и сигнал 2. Первоначально предполагалось, что сигнал 2 вызывают антитела, которые фиксированы на поверхности Т-клеток и специфичны для антигена, присоединившегося к В-лимфоцитам. В дальнейшем была допущена возможность передачи сигнала 2 на небольшое расстояние при помощи образуемого Т-лимфоцитами медиатора. В некоторых случаях сигнал 2 обусловлен действием антител не против антигенов, присоединившихся к поверхности В-лимфоцитов, а против собственных антигенов его поверхности. 3. Для активации В-лимфоцитов необходим второй сигнал. Этот сигнал исходит от присоединившегося к клетке С3-компонента комплемента. В пользу этого взгляда говорят наличие на поверхности ПАОК рецепторов для активизированного С3-компонента и митогенность очищенных препаратов С3-компонента. Соответствует этой точке зрения и наличие в лимфатических клетках липосомальных протеаз, активирующих С3-компонент, и то, что эти протеазы выделяются как при действии на лимфатические клетки антигенов и иммуногенов, так и при взаимодействии Т- и В-лимфоцитов (Dukor, Hartman, 1973; Hartman, 1975). В связи с этой точкой зрения нельзя не упомянуть о митогенном действии протеаз. Действие на клетки селезенки трипсина стимулирует включение 3Н-тимидина в эти клетки почти так же сильно, как действие самых мощных митогенов. Действие трипсина направлено на В-клетки: более 80% трансформированных им клеток содержало на поверхности иммуноглобулины; он чрезвычайно сильно стимулирует включение 3Н-тимидина в клетки селезенок бестимусных мышей (Kaplan, Bona, 1974; Vischer, 1974). 4. По модели одного неспецифического сигнала присоединение антигена к иммуноглобулиновым рецепторам В-лимфоцитов индуцирует ряд процессов (например, образование «колпачка»), но не активирует эти клетки. В-лимфоциты активируются неспецифическим сигналом от участка на их поверхности, который не является иммуноглобулином. Эти сигналы исходят от самого антигена (но не от их антигенной детерминанты) в случае тимуснезависимых антигенов и от медиаторов Т-клеток или макрофагов (в случае тимусзависимых антигенов). – Также рекомендуем “Результаты активации В-лимфоцитов. Изменения В-клеток после активации” Оглавление темы “Антителообразующие клетки. Контроль образования антител”: |
Источник
С точки зрения роли в иммунологических процессах, В-лимфоциты являются клетками с двойственной функцией. С одной стороны, это анти- генраспознающие лимфоциты, способные дифференцироваться (обычно при участии Т-хелперов) в эффекторные клетки — антителопродуценты. С другой стороны, В-лимфоциты служат «профессиональными» АПК, способными активировать хелперые Т-лимфоциты. Схема их участия в гуморальном иммунном ответе, особенно при взаимодействии с Т-хелперами, очень сходна с аналогичной схемой участия макрофагов в клеточном ответе воспалительного типа.
Несмотря на то, что контакт В-лимфоцитов с патогенами и их продуктами возможен в очагах поступления патогенов в организм (в частности, в барьерных тканях), вовлечение этих клеток в первичный иммунный ответ возможно только во вторичных лимфоидных органах. Это обусловлено тем, что именно здесь создаются оптимальные условия для взаимодействия трех комопнен- тов пусковой реакции — антигена, наивной В-клетки и Т-хелпера типа Th2. Это взаимодействие происходит в межфолликулярном пространстве, или «короне» фолликула, где В- и Т-лимфоциты соседствуют друг с другом. Антиген доставляется в эти зоны (обычно с афферентной лимфой) не только в составе молекул MHC на поверхности дендритных клеток, но и в свободной форме.
Как было сказано выше, антигенсвязывающие рецепторы В-лимфоцитов — BCR — способны взаимодействовать как со свободным, так и мембраносвязанным антигеном в его нативной, нерасщепленной форме. Связывания антигена, самого по себе, недостаточно для активации В-клетки. Оно как бы обозначает те клоны В-лимфоцитов, которым предстоит участвовать в иммунном ответе. Для полноценной активации В-клетки требуется дополнительный сигнал, порождаемый контактным взаимодействием с Т-хелпе- ром (Th2).
При взаимодействии антигена с ВCR должен быть выполнен ряд условий, определяющих эффективность распознавания антигена. Прежде всего необходимо перекрестное сшивание иммуноглобулиновых рецепторов или иная форма их агрегации. Связывание антигеном двух и более рецепторов возможно при наличии в молекуле антигена повторяющихся эпитопов, что не характерно для белковых антигенов. Поэтому в действительности срабатывают другие, неспецифические механизмы агрегации мембранных рецепторов. Связывание антигена и агрегация BCR обусловливают кон- формационные изменения в мембранном иммуноглобулине. Эти изменения передаются на димер Iga/IgP (CD79a/b), а через него — на рецепторные киназы, которые при этом активируются. Важное усиливающее событие — взаимодействие антигена не только с мембранным IgM, но и с другими составляющими рецепторного комплекса. Доказан дополнительный вклад С3-компонента комплемента в активацию В-клеток антигеном (рис. 3.114). Образование комплекса антигена с мембранными рецепторами-антителами приводит к активации комплемента по классическому пути и расщеплению фактора С3 сначала до C3b, затем — до iC3b и C3d. Входящая в состав рецепторного комплекса В-клеток молекула CD21 является рецептором для комплемента (CR2), способным связывать фрагмент C3d. Возникающее при этом изменение конформации молекулы СD21 передается молекуле CD19 и вызывает активацию рецепторных тирозинкиназ, связанных с цитоплазматической частью CD19. Сочетанная активация тирозинкиназ, связанных с молекулами CD79 и CD19, формирует первый сигнал, ответственный за вовлечение в иммунный ответ клонов В-клеток, распознавших антиген.
За начальные этапы передачи сигнала о связывании антигена в В-клетках зответственны тирозинкиназы Lyn, Blk и Lck, фосфори- лирующие цитоплазматические части полипептидных цепей BCR и тирозинкиназу Syk. Этот фермент выполняет роль посредника между рецепторным аппаратом и внутриклеточными сигнальными факторами, подобно тирозинкиназе ZAP-70 Т-клеток, также относящейся к семейству Syk. Среди многочисленных молекул, активируемых Syk- киназой, важная роль принадлежит связанным с мембраной факторам, составляющим промежуточное звено передачи сигнала — адапторным и гуанозинсвязывающим (GEF) белкам, а также у-изоформе фосфолипазы С

Рис. 3.114. Межмолекулярные взаимодействия в рецепторном комплексе В-клеток, необходимые для запуска активации и пролиферации В-клеток. Для активации В-клетки важны конформационные изменения мембранного иммуноглоублина в результате связывания антигена. Другое событие реализуется с участием системы комплемента. Образование комплекса антигена с мембранными антителами приводит к активации комплемента по классическому пути и расщеплению фактора С3 до C3d, распознаваемого молекулой CD21 (см. текст). За счет этих двух источников генерируется сигнал, ответственный за вовлечение в иммунный ответ конкретного клона В-клеток
(PLCy). Эти факторы обеспечивают дальнейшую передачу сигнала — уже по нескольким параллельным путям (рис. 3.115).
Однако для полноценной активации В-клеток, определяющей их дальнейшее развитие и дифференцировку в антителообразующие клетки, необходим дополнительный второй сигнал, возникающий в процессе контактного взаимодействия с Т-хелперами. Это взаимодействие, как уже отмечалось, происходит в морфологических структурах, где соседствуют Т- и В-лимфоциты — прежде всего в межфолликулярных пространствах. Как и в случае презентации антитена дендритными клетками Т-хелперам при контакте Т- и В-клеток, распознающих эпитопы одного и того же анти-

Рис. 3.115. Схема сигнальных путей при активации В-клеток. Схема в принципе близка таковой для активации Т-клеток (см. рис. 3.94). Основное отличие состоит в различной природе костимулирующего сигнала, поставляемого в В-клетку через молекулу CD40
гена, возникают сложности, обусловленные наличием малого числа клеток, специфичных к конкретному антигену. Это препятствие удается преодолеть лишь благодаря процессу непрерывной рециркуляции Т- и В-лимфоцитов.
Схематически процесс взаимодействия наивных В-клеток и ^2-лим- фоцитов представлен на рис. 3.116. После связывания антигена с BCR в В-клетке комплекс антиген—рецептор интернализуется, как это происходит в любой АПК. По ряду свойств, необходимых для презентации антигена (уровень эндоцитоза, эффективность процессинга поглощенных молекул антигенов и т.д.), В-лимфоциты значительно уступают дендритным клеткам. Однако они имеют существенное преимущество, которое состоит в избирательности поглощения антигенов при их распознавании BCR. Захваченный антиген процессируется и включается в состав молекул MHC-II так же, как это происходит в других АПК. Однако если в составе MHC на поверхности дендритной клетки на долю конкретного эпитопа может приходиться не более 0,1% комплексов пептид—MHC-II, то мембранные комплексы поверхности В-клетки существенно обогащены эпитопами тех антигенов, которые распознаются их рецепторами.
Принципиально важно, что в состав MHC-II избирательно включаются не те эпитопы, которые распознаются BCR (как известно, структурные характеристики В- и Т-эпитопов различны), а другие — Т-клеточные эпитопы. Выше уже рассматривалась природа В- и Т-эпитопов и их различия между собой (см. раздел 3.2). Практически каждая молекула имеет уникальный набор детерминант, распознаваемых рецепторами В- и Т-клеток. Если

Рис. 3.116. Природа сигналов, генерируемых при взаимодействии В-клеток с Т-хелпе- рами и необходимых для активации и запуска пролиферации В-клеток. Связывание антигена с мембранным иммуноглобулином (mIg) В-клеточного рецептора служит источником 1-го активационного сигнала (1В), усиливающего экспрессию молекул MHC-II и костимулирующих молекул В7 (CD80 и CD86). Комплекс антиген-рецептор интернализуется, фрагменты антигена включаются в молекулы MHC-II, экспрессируемые на поверхности В-клетки. Т-клеточный рецептор ТИ2-клетки распознает комплекс MHC-II-пептид (индуцируется сигнал 1Т). Вместе с костимуляцией (сигнал 2Т) через CD28 это приводит к активации Т-клетки, экспрессии CD154 и секреции цитокинов. В результате взаимодействия CD40-CD154 возникает 2-й активационный сигнал для В-клеток (сигнал 2В), что приводит к экспрессии рецепторов для цитокинов. Цитокиновые сигналы, индуцируемые при связывании IL-2, IL-4, IL-5 с их рецепторами (3В), обеспечивают продвижение В-лимфоцитов по клеточному циклу и их пролиферацию
эти наборы и перекрываются, то только частично. В-лимфоцит распознает В-клеточные эпитопы своим ВCR и в то же время встраивает Т-клеточные эпитопы в состав молекул MHC-II, подготавливая лиганд для TCR. Эти лиганды распознают Т-клетки, принадлежащие к соответствующим клонам. Таким образом, в отношении В-эпитопов антигена В-клетка является распознающей, а в отношении Т-эпитопов — презентирующей.
На этом этапе иммунного процесса во взаимодействие с В-лимфоци- том вовлекаются не наивные Т-клетки (их могут активировать только
дендритные клетки), а ТИ2-лимфоциты, уже ранее получившие такой же антигенный сигнал от дендритных клеток в Т-зонах вторичных лимфоидных органов. Вовлечение во взаимодействие с В-лимфоцитами Th2-, а не TW-клеток, обусловлено направлением миграции этих типов Т-хелперов. Если TM-клетки из мест своего образования (Т-зоны) с эфферентным током лимфы попадают в рециркуляцию, то большинство ^2-клеток, экспрессирующих хемокиновый рецептор CXCR5, движется в сторону фолликулов и на этом пути встречается с В-лимфоцитами. В-лимфоцит и ^2-клетка взаимодействуют посредством иммунного синапса, принципиально аналогичного по своей структуре синапсу, формируемому между дендритной клеткой и Т-хелпером (см. раздел 3.4.1.3). Во время длительного существования синапса (часы) генерируются активационные сигналы, направленные в Т- и В-клетки (см. рис. 3.116). В ^2-клетки сигналы поступают через TCR и CD28, и это способствует экспрессии костимулирующей молекулы CD154 (лиганда молекулы CD40) и усилению секреции ^2-цитокинов. То и другое служит источником дополнительных сигналов для В-лимфоцита.
Принцип внутриклеточной передачи сигнала в В-лимфоцитах аналогичен таковому в Т-клетках. В активации В-клеток участвуют сходные сигнальные пути, приводящие к образованию тех же трех транскрипционных факторов — NF-AT, AP-1 NF-kB (см. раздел 3.5.2.1). Источником костимулирующих сигналов в случае В-клетки выступает молекула CD40, вовлекаемая в активацию в результате контактного взаимодействия с Т-хелпером. При связывании с ней CD40-лиганда (CD154) генерируется костимулирующий сигнал, в проведении которого основную роль играют молекулы TRAF1, TRAF2, и в меньшей степени TRAF6. Этот сигнал играет важную роль в формировании Rac-зависимых ветвей MAP-каскада, приводящих к активации киназ JNK и р38. Эти киназы нужны для экспрессии белка c-Jun, участвующего в формировании транскрипционного фактора АР-1. CD40/TRAF-зависимый путь необходим также для активации фосфатазы IKK, обеспечивающей дефосфорилирование ингибиторной субъединицы IkB, что приводит к ее расщеплению и активации транскрипционного фактора NF-kB. Подобно процессу активации Т-клеток, наименее зависим от костимуляции при активации В-клеток Са2+-зависимый путь, приводящий к формированию транскрипционного фактора NF-AT (см. рис. 3.115).
Последствия активации В-клеток аналогичны таковым при активации Т-лимфоцитов (см раздел 3.5.2.2). Они состоят в экспресси комплекса генов, необходимых для реализации первого этапа реакции клонов, вовлекаемых в иммунный ответ, — их пролиферативной экспансии. Для В-клеток это означает прежде всего появление на их поверхности рецепторов для цитокинов, которые обеспечивают сначала их пролиферацию, а затем дифференцировку: IL-4, IL-5, IL-6, IL-10, IL-1, IL-2. В отличие от Т-хелперов, В-лимфоциты не обеспечивают себя этими цитокинами, а зависят в этом отношении от других клеток. Ситуация облегчается тем, что почти все эти цитокины секретируются ^2-лимфоцитами, с которыми контактируют В-клетки. IL-2, не вырабатываемый ^2-клетками, присутствует в зоне активации в достаточном количестве. Его секретируют CD4+ Т-клетки (в том числе предшественники Th2-лимфоцитов), активируемые дендритными клетками. Источником IL-1 служат главным образом макрофаги.
Активацию и последующее развитие В-лимфоцитов контролирует целый комплекс цитокинов. Рецепторы для них появляются на поверхности В-клеток во время фазы G1 клеточного цикла. Среди факторов, индуцирующих пролиферацию активированных В-клеток, раньше других (в фазу G1a) свою активность проявляют IL-4 (основной ростовой фактор) и IL-1 (кофактор). Уже после преодоления точки рестрикции (в фазе G1b) основными факторами, обусловливающими продвижение клетки по циклу, становятся IL-2 и IL-5, при участии которых В-клетка вступает в митоз. Как правило, на активированную В-клетку одновременно действует не один, а несколько цитокинов, среди которых основной — IL-4. Из сказанного следует, что цитокины, участвующие в индукции пролиферации В-клеток, относятся к разряду заменимых и мутации генов каждого из них не сказываются на пролиферативной экспансии клонов В-лимфоцитов.
После завершения митоза клетки не возвращаются в фазу покоя (G0); для продолжения пролиферации им нужны сигналы от цитокинов, но не контакт с Т-лимфоцитами. Как и Т-клетки, стимулированные В-лимфоциты совершают 6—8 делений за 5—7 сут (продолжительность периода пролиферации определяется длительностью экспрессии рецепторов на поверхности В-клеток). Одновременно с делением происходит реализация дифференцировочной программы, запускаемой при активации В-клеток. Завершение этой программы в значительной степени зависит от микроокружения В-клеток.
Источник