Липиды транспортируются из энтероцитов в лимфу
Механизмы транспорта и метаболизма жиров (липидов)
После всасывания в эпителий кишки свободные жирные кислоты и 2-моноглицериды вновь образуют триглицериды и вместе с фосфолипидами и холестеролом включаются в хиломикроны. Хиломикроны транспортируются с током лимфы через грудной проток в верхнюю полую вену, попадая таким образом в общий кровоток.
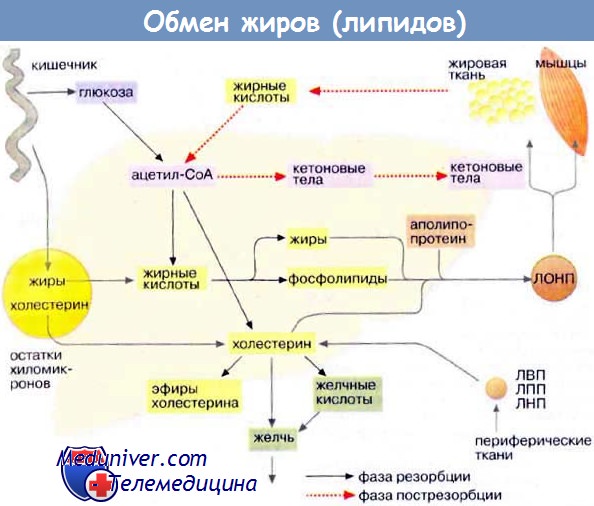
Внутри хиломикрона триглицериды гидролизуются липопротеинлипазой, что приводит к высвобождению жирных кислот на поверхности кровеносных капилляров в тканях. Это обусловливает транспорт жирных кислот в ткани и последующее образование остатков хиломикронов, обедненных триглицеридами. Эти остатки затем забирают эфиры холестерола из липопротеинов высокой плотности, и частицы быстро захватываются печенью. Данную систему транспорта жирных кислот пищевого происхождения называют экзогенной транспортной системой.
Также существует эндогенная транспортная система, предназначенная для внутриорганного транспорта жирных кислот, образованных в самом организме. Липиды транспортируются из печени в периферические ткани и обратно, а также переносятся из жировых депо к различным органам. Транспорт липидов от печени к периферическим тканям включает согласованные действия ЛПОНП, липопротеинов промежуточной плотности (ЛППП), липопротеинов низкой плотности (ЛПНП) и липопротеинов высокой плотности (ЛПВП). Частицы ЛПОНП подобно хиломикронам состоят из большого гидрофобного ядра, образованного триглицеридами и эфирами холестерола, и поверхностного липидного слоя, состоящего в основном из фосфолипидов и холестерола.
ЛПОНП синтезируются в печени, и отложение жира в периферических тканях является их основной функцией. После попадания в кровоток ЛПОНП подвергаются воздействию липопротеинлипазы, которая гидролизует триглицериды до свободных жирных кислот. Свободные жирные кислоты, происходящие из хиломикронов или ЛПОНП, могут быть использованы в качестве источников энергии, структурных компонентов фосфолипидных мембран или превращаться обратно в триглицериды и в таком виде сохраняться. Триглицериды хиломикронов и ЛПОНП также подвергаются гидролизу липазы печени.
Частицы ЛПОНП посредством гидролиза триглицеридов превращаются в более плотные, меньшие по размеру холестерол- и триглицерид-обогащенные остатки (ЛППП), которые удаляются из плазмы с помощью рецепторов печеночных липопротеинов или могут быть превращены в ЛПНП. ЛПНП являются основными липопротеинами-переносчиками холестерола.
Возврат липидов из периферических тканей в печень часто называют обратным транспортом холестерола. Частицы ЛПВП участвуют в этом процессе, забирая холестерол из тканей и других липопротеинов и перенося его в печень для последующей экскреции. Еще один вид транспортировки, существующей между органами, — перенос жирных кислот из жировых депо к органам для окисления.
Жирные кислоты, получаемые в основном в результате гидролиза триглицеридов жировой ткани, секретируются в плазму, где соединяются с альбумином. Связанные с альбумином жирные кислоты переносятся по градиенту концентрации в ткани с активным метаболизмом, где и используются преимущественно в качестве источников энергии.
В течение последних 20 лет только несколько исследований были посвящены вопросу транспорта липидов в перинатальном периоде (результаты этих исследований в данном издании не представлены). Очевидна необходимость более детального изучения этой проблемы.
Жирные кислоты используются в качестве строительного материала в составе липидов клеточной стенки, в качестве источников энергии, а также откладываются «про запас» в виде триглицеридов преимущественно в жировой ткани. Некоторые омега-6 и омега-3 ДЦПНЖК являются предшественниками биологически активных метаболитов, используемых в сигнальной системе клеток, регуляции генов и других метаболически активных системах.
Вопрос о роли ДЦПНЖК ARA и DHA в процессе роста и развития ребенка является одним из важнейших вопросов в исследованиях, проводимых в области детской нутрициологии в течение последних двух десятилетий.
Липиды являются одними из основных компонентов клеточных мембран. Значительное количество исследований в области физиологии липидов посвящено двум жирным кислотам — ARA и DHA. ARA обнаружена в составе клеточных мембран всех структур организма человека; она является предшественником эйкозаноидов 2-й серии, лейкотриенов 3-й серии и других метаболитов, которые включены в сигнальные системы клеток и процесс генной регуляции. Исследования, посвященные DHA, часто указывают на ее структурную и функциональную роль в составе клеточных мембран.
Эта жирная кислота обнаружена в высокой концентрации в сером веществе головного мозга, а также в палочках и колбочках сетчатки. Исследования постепенного исключения из диеты животных омега-3 жирных кислот показали, что содержащие 22 атома углерода омега-6 ДЦПНЖК (например, 22:5 п—6) способны структурно, но не функционально заменить 22:6 n-3. При неадекватном уровне 22:6 n-3 в тканях выявляются нарушения зрения и познавательных способностей. Было показано, что изменение содержания 22:6 n-3 в тканях влияет на нейротрансмиттерную функцию, активность ионных каналов, сигнальные пути и экспрессию генов.

– Вернуться в оглавление раздела “физиология человека”
Оглавление темы “Потребности новорожденных в нутриентах”:
- Физиология обмена витамина К и его эффекты
- Потребность в витамине К у новорожденных детей
- Дефицит витамина К у новорожденных детей – клиника, диагностика
- Влияние больших доз витамина К на недоношенных новорожденных детей
- Физиология обмена железа и его эффекты
- Потребность в железе у новорожденных детей
- Дефицит железа и его токсичность для новорожденных детей
- Характеристика жиров (липидов) и жирных кислот
- Механизмы переваривания и всасывания жиров (липидов)
- Механизмы транспорта и метаболизма жиров (липидов)
Источник
Поскольку липиды не растворимы в воде, для их переноса от слизистой кишечника в органы и ткани формируются особые транспортные формы: хиломикроны (ХМ), липопротеины очень низкой плотности (ЛПОНП), липопротеины низкой плотности (ЛПНП), липопротеины высокой плотности (ЛПВП). Непосредственно от слизистой тонкого кишечника транспорт всосавшихся и ресинтезированных липидов осуществляется в составе хиломикронов. ХМ – это белково-липидные комплексы диаметром от 100 до 500 нм, которые в связи с относительно большим размером не могут сразу проникать в кровь. Сначала они попадают в лимфу и в её составе попадают в грудной лимфатический проток, а затем – в верхнюю полую вену и с кровью разносятся по всему организму. Поэтому после приёма жирной пищи плазма крови становится мутной в течение 2 – 8 часов. Химический состав ХМ: Общее содержание липидов – 97-98%; в их составе преобладают ТАГ (до 90%), на содержание холестерина (Х), его эфиров (ЭХ) и фосфолипидов (ФЛ) суммарно приходится -7-8%. Содержание белка, стабилизирующего структуру ХМ – 2-3%. Т.о., ХМ – это транспортная форма «пищевого» или экзогенного жира. В капиллярах различных органов и тканей (жировой, печени, лёгких и др.) содержится липопротеидная липаза (ЛП-липаза), расщепляющая ТАГ хиломикронов до глицерина и жирных кислот. Плазма крови при этом просветвляется, т.е. перестаёт быть мутной, поэтому ЛП-липазу называют «просветвляющим фактором». Её активирует гепарин, который вырабатывается тучными клетками соединительной ткани в ответ на гиперлипидемию. Продукты расщепления ТАГ диффундируют в адипоциты, где они депонируются или поступают в другие ткани для покрытия энергозатрат. В жировых депо по мере необходимости организма в энергии происходит распад ТАГ до глицерина и жирных кислот, которые в комплексе с альбуминами крови транспортируются к периферическим клеткам органов и тканей.
Ремнантные ХМ (т.е. оставшиеся после расщепления ТАГ) поступают в гепатоциты и используются ими для построения других транспортных форм липидов: ЛПОНП, ЛПНП, ЛПВП. Их состав дополняется жирными кислотами ТАГ, фосфолипидами, холестерином, эфирами холестерина, сфингозинсодержащими липидами, синтезированными в печени «de novo». Размер ХМ и их химический состав изменяются по мере продвижения по сосудистому руслу. ХМ обладают наименьшей по сравнению с другими липопротеинами плотностью (0,94) и наиболее крупными размерами (их диаметр ~ 100нм). Чем выше плотность ЛП-частицы, тем меньше их размер. Диаметр ЛПВП наименьший (10 – 15нм), а плотность колеблется в диапазоне 1,063 – 1,21.
ЛПОНП формируются в печени, содержат в своём составе 55% ТАГ, поэтому они считаются транспортной формой эндогенного жира. ЛПОНП транспортируют ТАГ от клеток печени к клеткам сердца, скелетных мышц, лёгких и других органов, имеющим на своей поверхности фермент ЛП – липазу.
ЛП – липаза расщепляет ТАГ ЛПОНП до глицерина и жирных кислот, превращая ЛПОНП в ЛПНП (ЛПОНП – ТАГ = ЛПНП). ЛПНП могут также синтезироваться «de novo» в гепатоцитах. В их составе преобладает холестерин (~ 50%), их функция – транспорт холестерина и фосфолипидов к периферическим клеткам органов и тканей, имеющим на своей поверхности специфические рецепторы к ЛПНП. Холестерин и фосфолипиды, транспортируемые ЛПНП, используются для построения мембранных структур периферических клеток. Поглощаясь различными клетками, ЛПНП несут информацию о содержании холестерина в крови и определяют скорость его синтеза в клетках. ЛПВП синтезируются главным образом в клетках печени. Это наиболее устойчивые формы липопротеинов, т.к. содержат ~50% белка. Они отличаются высоким содержанием фосфолипидов (~20%) и низким содержанием ТАГ (~3%). ЛПВП (см. табл. №1) синтезируются гепатоцитами в виде плоских дисков. Циркулируя в крови, они поглощают избыток холестерина от различных клеток, стенок сосудов и, возвращаясь к печени, приобретают шаровидную форму. Т.О. , основная биологическая функция ЛПВП – транспорт холестерина от периферических клеток к печени. В печени избыток холестерина превращается в желчные кислоты.
Таблица №1. Химический состав транспортных липопротеинов (%).
| Химичесий состав | Хиломикроны | ЛПОНП | ЛПНП | ЛПВП |
| Белок | 2 -3 | |||
| ТАГ | ||||
| Холестерин | 3 -5 | |||
| Фосфолипиды | 3 – 4 |
ЛП – частицы крови: ХМ, ЛПОНП, ЛПНП, ЛПВП имеют общие закономерности строения. В центре располагаются неполярные (гидрофобные ) липиды: ТАГ и эфиры холестерина образуют гидрофобное ядро. В периферическом слое располагаются полярные липиды: глицерофосфолипиды, ганглиозиды и др., образуя гидрофильный слой ЛП-частицы. Свободный холестерин своей НО-группой обращён к поверхностному гидрофильному слою частицы. Белки липопротеидных частиц принято называть апопротеинами. Различают поверхностные, периферические и интегральные белки. Последние пронизывают гидрофильный слой частицы. Различают апопротеины А, В, С, которые делятся на подгруппы. В их составе ферменты, белки – рецепторы, активаторы ферментов, апо – белки. Они определяют растворимость ЛП – частиц, их устойчивость в кровеносном русле, связь с рецепторами клеточных мембран. Виды химических связей в ЛП- частицах, чаще всего, гидрофобные и ионные. Синтез различных апопротеинов происходит в гепатоцитах, в слизистой тонкого кишечника. Толщина гидрофильного слоя – 2,2 мкМ – одинакова у всех видов ЛП-частиц. Размер частиц определяется толщиной гидрофобного ядра.
Основными апопротеинами ХМ являются – апо В 48, ЛПОНП – апо В 100, ЛПНП – апо В 100, ЛПВП – апо А. Особую роль в составе ЛПВП выполняет фермент лецитинхолестеринацилтрансфераза (ЛХАТ), катализирующий реакцию: лецитин +свободный эфир холестерина + лизолецитин
Эфиры холестерина погружаются в гидрофобное ядро ЛП-частиц, при этом в поверхностном слое освобождается место для свободного холестерина. Забирая избыток свободного холестерина от клеток и стенок сосудов, ЛП-частицы постепенно приобретают шаровидную форму и возвращаются в печень. В печени избыток холестерина превращается в желчные кислоты. Ключевым ферментом этого процесса является 7-альфа гидроксилаза.
Источник
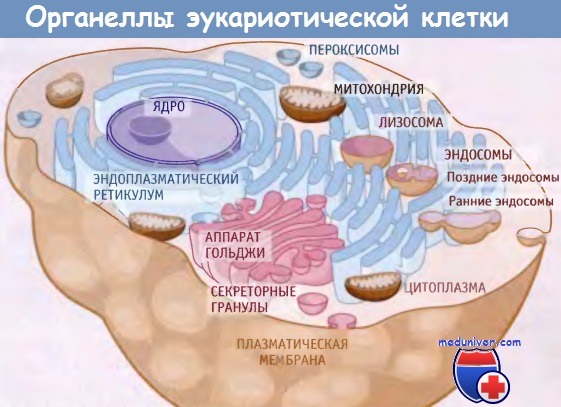
Механизм транспорта липидов между органеллами в клетке• Каждая органелла обладает уникальным составом липидов, что предполагает специфичность транспорта липидов из ЭПР в каждую органеллу. • Механизм транспорта липидов между органеллами неизвестен, но может включать прямой контакт между ЭПР и другими клеточными мембранами. • При перемещении липидов через бислой возникает асимметричность слоев мембраны. После синтеза липидов в ЭПР они должны транспортироваться на другие мембраны клетки. Этот процесс осложняется тем фактом, что мембранные органеллы различаются по составу липидов; таким образом, перенос должен представлять собой специфический процесс, а не просто обмен липидов. Поэтому должны существовать механизмы, которые обеспечивают не только движение липидов, но и направление этого процесса. Хотя механизм транспорта липидов остается невыясненным, предложено несколько схем движения. Одна схема подразумевает наличие прямого контакта между мембранами, как это, например, имеет место между ЭПР и митохондриями в МСМ. Вероятно, когда мембраны двух органелл непосредственно примыкают друг к другу, это облегчает движение фосфолипидами между ними. Такая схема распределения липидов кажется вероятной, поскольку известно, что ЭПР непосредственно контактирует со всеми основными клеточными органеллами. Последние включают плазматическую мембрану, транс-Гольджи сеть, пероксисомы, вакуоли и эндосомы/лизосомы. Хотя функциональное значение этих контактов выяснено не столь подробно, как для МСМ, но если они действительно имеют общую природу, то могут служить средством передвижения липидов из одной органел-лы в другую и обеспечивать специфичность этого процесса. Для объяснения механизма транспорта липидов были предложены также другие гипотезы. До недавнего времени общепризнанным считалось представление о белках-переносчиках фосфолипидов. Эти белки были обнаружены в экспериментах in vitro по их способности обменивать липиды между мембранами. Белки экстрагируют липиды из одной мембраны и помещают их в гидрофобный связывающий карман, где они находятся до того момента, как будут перенесены в другую мембрану. Хотя эти белки, возможно, участвуют в прямом переносе фосфолипидов между органеллами, они вряд ли обусловливают увеличение их липидного состава, поскольку при диссоциации липида от мембранного белка, его место занимает в белке другой липид этой же мембраны. Данные о роли этих белков в транспорте липидов in vivo отсутствуют. Предполагается также, что при транспорте везикул по секреторному пути наряду с белками переносятся новые липиды. Однако этот механизм кажется маловероятным, поскольку вещества, препятствующие движению везикул по секреторному пути, не блокируют транспорт липидов от ЭПР к плазматической мембране. Секреторные везикулы не могут доставлять липиды к митохондриям и хлоропластам, поскольку ЭПР даже не связан с этими оранеллами через секреторный путь. В некоторых случаях образующиеся в ЭПР липиды экспортируются в другие клетки. При этом некоторые специализированные клетки транспортируют по секреторному пути липиды, находящиеся в форме липопротеинов. Последние представляют собой крупные агрегаты, состоящие из белка и липидов, и используются для транспорта через кровоток водонерастворимых метаболитов, особенно холестерина и триацилглицеринов. Они состоят из ядра, содержащего холестерин и триацилглицерины, окруженного монослоем фосфолипидов и белка. Существует несколько типов липопротеинов, различающихся по плотности. Особый интерес представляют липопротеиды низкой плотности (ЛНП), поскольку они образуются в люмене ЭПР клеток печени и кишечника, а затем транспортируются из них по секреторному пути. Предшественниками ЛНП являются фосфолипиды очень низкой плотности (ЛОНП), которые синтезируются на цитозольной стороне ЭПР, а затем, вероятно, проходят через мембрану Там они реагируют с белком АроВ, по мере его транслокации в люмен ЭПР. Сформировавшиеся ЛОНП частицы транспортируются по секреторному пути. Если частица не была правильно собрана в люмене ЭПР, то за счет ретроградной транслокации белок АроВ возвращается в цитозоль, где деградирует.
– Также рекомендуем “Механизм перемещения липидов в мембране – флиппинг” Оглавление темы “Синтез белка в клетке”:
|
Источник
Липиды поступают в энтероциты как из
просвета кишечника, так и из тканей.
Большая часть липидов, поступивших в
энтероцит, подвергается ресинтезу.
1. 1-МГгидролизуется кишечной
липазой до глицерина и жирной кислоты.
2. Короткоцепочечные жирные кислоты,
ФЛ (кроме лецитина) и часть глицерина
без изменений направляются из
энтероцита в кровь.
3.Длинноцепочечные эндогенные
и экзогенные жирные кислотыпод
действием ацил-КоА-синтетазы (тиокиназы)
активируются, образуя Ацил~КоА:
RCOOH + HS-КоА + АТФ → Ацил~КоА + АМФ + ФФн
4. Моноацилглицероловый путь синтеза тг и фл
При ресинтезе ТГ Ацил~КоА с участием
ацилтрансферазы этерифицирует 2-МГ до
ДГ, а затем до ТГ: 2-МГ + Ацил~КоА → 1,2-ДГ
+ HS-КоА,
1,2-ДГ + Ацил~КоА → ТГ + HS-КоА
При ресинтезе ФЛ на 1,2-ДГ переносится
фосфохолин или фосфоэтаноламин с ЦДФ.
1,2-ДГ + ЦДФ-холин → лецитин + ЦМФ
1,2-ДГ + ЦДФ-этаноламин → кефалин + ЦМФ
В клетках слизистой оболочки тонкой
кишки синтезируются в основном
видоспецифичные ТГ. Однако при поступлении
с пищей ТГ с необычными жирными кислотами,
например бараньего жира, в адипоцитах
появляются ТГ, содержащие кислоты,
характерные для бараньего жира (насыщенные
разветвлённые жирные кислоты).
5.Глицерофосфатный путь синтеза тг и фл
глицерол + АТФ → глицеро-ф + АДФ
Фермент: глицерокиназа
глицеро-ф + Ацил~КоА → лизофосфатид +
HS-КоА Фермент: ацилтрансфераза
лизофосфатид + Ацил~КоА → фосфатид +
HS-КоА Фермент: ацилтрансфераза
фосфатид + Н2О → 1,2-ДГ + Фн
Фермент: фосфатидаза
1,2-ДГ + Ацил~КоА → ТГ + HS-КоА
Фермент: ацилтрансфераза
1,2-ДГ + ЦДФ-холин → лецитин + ЦМФ
Фермент: холинтрансфераза
1,2-ДГ + ЦДФ-этаноламин → кефалин + ЦМФ
6. При ресинтезе лецитина Ацил~КоА
с участием ацилтрансферазы этерифицирует
лизолецитин до лецитина: лизолецитин
+ Ацил~КоА → лецитин + HS-КоА
7. При ресинтез эфиров холестеринаАцил~КоА с участием ацилхолестеролацилтрансферазы
(АХАТ) этерифицирует холестерин до эфира
холестерина:
Ацил~КоА + ХС → ЭХС + HS-КоА
От активности АХАТ зависит скорость
поступления экзогенного холестерола
в организм.
Транспорт липидов в организме
Транспорт липидов в организме идет
двумя путями:
1) жирные кислоты транспортируются в
крови с помощью альбуминов;
2) ТГ, ФЛ, ХС, ЭХС и д.р. липиды транспортируются
в крови в составе липопротеинов.
Обмен липопротеинов
Липопротеины (ЛП)– это
надмолекулярные комплексы сферической
формы, состоящие из липидов, белков и
углеводов. ЛП имеют гидрофильную оболочку
и гидрофобное ядро. В гидрофильную
оболочку входят белки и амфифильные
липиды – ФЛ, ХС. В гидрофобное ядро входят
гидрофобные липиды – ТГ, эфиры ХС и т.д.
ЛП хорошо растворимы в воде.

В организме синтезируются несколько
видов ЛП, они отличаются химическим
составом, образуются в разных местах и
осуществляют транспорт липидов в
различных направлениях.
ЛП разделяют с помощью:
1) электрофореза, по заряду и размеру,
на α-ЛП, β-ЛП, пре-β-ЛП и ХМ;
2) центрифугирования, по плотности, на
ЛПВП, ЛПНП, ЛППП, ЛПОНП и ХМ.
Соотношение и количество ЛП в крови
зависит от времени суток и от питания.
В постабсорбтивный период и при голодании
в крови присутствуют только ЛПНП и ЛПВП.
Соседние файлы в предмете Биохимия
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник