Лимфоциты активные формы кислорода

Комикс на конкурс «био/мол/текст»: Услышав фразу «человек болен раком», мы понимаем, что рак — это сложно, и лечить раковые заболевания трудно. Клетки человеческого организма работают по определенной программе, которая с самого рождения человека заложена в их геноме. Со временем в клетке начинают появляться мутации, какие-то из них может ликвидировать система репарации, а какие-то остаются незамеченными и начинают накапливаться. При большом количестве мутаций клетка может либо погибнуть путем апоптоза, либо стать злокачественной. Злокачественная клетка делится независимо от факторов роста — это влечет за собой усиленные энерготраты и использование ресурсов организма. Клетки делятся постоянно, а свободного места не прибавляется — раковые опухоли начинают прорастать в здоровые ткани и тем самым вызывают болевой синдром. И вместе с этим злокачественные клетки генетически нестабильны на протяжении всей своей жизни. Все эти особенности опухолевых клеток определяют специфику и трудность лечения рака.
Егор Захаров
25 ноября 2019
Фотокомикс на конкурс «био/мол/текст»: Жизнь небольшой личинки мраморной бронзовки полна опасностей! Спасаясь от них, она всю жизнь проводила под землей или близко к ее поверхности. Но письмо с Дальнего Востока все изменило: оказалось, что со временем личинка вырастет в Супержука! Теперь она знает все свои сильные стороны и ничего не боится!
4
Ольга Черченко
03 ноября 2018
Статья на конкурс «био/мол/текст»: «Кто ест мало, живет долго, ибо ножом и вилкой роем мы могилу себе», — говорит граф Калиостро в фильме Марка Захарова. Связь между количеством еды и продолжительностью жизни обнаружена даже у тех организмов, которые ножом и вилкой пользоваться не умеют. Сразу возникают вопросы: насколько мало нужно есть? Как это работает? И главное — что делать, если есть всё равно хочется?
Полина Лосева
01 ноября 2018
Комикс на конкурс «био/мол/текст»: Большинство людей не задумывается о старении. Все просто живут, стареют, а самые мудрые при этом стараются радоваться каждому дню. Так происходит, потому что старение для всех — это естественный и неизбежный процесс. Естественный — разумеется. Но с какой стати неизбежный?! Оказывается, старение — это вовсе не обязательное свойство живых существ. Некоторые животные сумели устроить свою жизнь так, что с точки зрения развития их вида, эволюции, стареть им уже необязательно. Похоже, они сумели отключить зловредную генетическую программу, заставляющую организм дряхлеть, и с возрастом становятся только сильнее и жизнеспособнее.
21–22 сентября 2017 г. прошла Международная конференция «ФизтехБиоМед-2017». Эксперты обсудили идеи, связанные с «активным долголетием», неврологией и биотехнологиями. Рассказываем о самых интересных лекциях: чего достигла современная инженерия в кардиологии, почему медицина фокусируется не на том и как сделать виртуального человека своими руками.
Мария Комарова
25 декабря 2017
Комикс на конкурс «био/мол/текст»: Людям давно пора перестать воевать друг с другом и обратить внимание на сражения, которые разворачиваются в наших организмах. Эти сражения гораздо масштабнее и интереснее, а победа в них оборачивается не горечью потерь, а счастьем здоровой жизни.
Статья на конкурс «био/мол/текст»: Более полувека назад учёные усмотрели связь между процессом клеточного дыхания и старением. Сегодня известно как факт, что при окислении органики в клетке выделяются потенциально опасные метаболиты, играющие важную роль в развитии целого ряда заболеваний. Митохондриально адресованные антиоксиданты, также известные как ионы Скулачёва, предоставляют новые возможности в борьбе с такими патологиями, как инфаркт и инсульт. А в 2013 году лаборатория структуры и функций митохондрии под руководством Д. Б. Зорова из НИИ ФХБ им. Белозерского показала, что ионы Скулачёва могут помочь и больным острым пиелонефритом.
2
Федор Галкин
11 сентября 2014
При упоминании флуоресцентных белков люди чаще всего представляют себе разноцветные клетки, забавные рисунки бактериями на чашках Петри, в крайнем случае, целые флуоресцирующие организмы — от медуз до кошек, — эдакая цветная палитра. Однако область применения этого замечательного инструмента расширяется с каждым годом, — как и разнообразие самих белков. В этой статье мы поговорим о новых поколениях флуоресцентных белков и рассмотрим некоторые интересные методы на их основе.
Статья на конкурс «био/мол/текст»: Поиск соединений, способных продлить жизнь и отодвинуть старость — одна из самых актуальных задач современной науки. Сообщение о том, что исследователям из Франции удалось добиться почти двукратного увеличения продолжительности жизни экспериментальных животных при помощи фуллеренов (наночастиц углеродной природы), заставило ученых задуматься над молекулярными механизмами подобного эффекта. Эта статья повествует о компьютерном моделировании возможных механизмов биологической активности фуллеренов и о первых попытках подтвердить полученные модели в биологических экспериментах.
Статья на конкурс «био/мол/текст»: Долгое время активные формы кислорода считались вредными побочными продуктами обмена веществ. За последнее десятилетие, однако, учёные показали, что живые организмы не только могут использовать активный кислород в своих целях, но и целенаправленно его вырабатывают. Возникает вопрос: нужно ли бороться с активными формами кислорода с помощью антиоксидантов?
Михаил Матлашов
16 сентября 2013
Источник
Механизм работы лимфоцитов при воспалении в легких.Активированные воспалительные CD4+ T-лимфоциты выполняют свои эффекторные функции путем активации макрофагов: усиления их способности убивать захваченных бактерий, многие из которых в эволюциии приобрели стратегию выживания и размножения внутри клеток. Активация макрофагов проявляется приобретением ими способности убивать таких паразитов как: Pneumocystis carinii, Schyistosoma mansoni и др. Способность активированных макрофагов убивать внеклеточные мишени распространяется не только на некоторые опухолевые клетки, но и на собственные нормальные клетки организма, с чем связывают патогенетическую роль иммунного воспаления (гиперчувствительности замедленного типа – ГЗТ). Макрофаги получают от ТН1 два сигнала активации: IFNy секретируется ТН1 и действует через специфический рецептор, а второй сигнал активации исходит от мембрано-связанной формы TNF-a или секретируемого TNF-a. Хотя все макрофаги имеют рецепторы для IFNy, активироваться при контактах с CD4+ Т-клетками будут, в первую очередь, инфицированные макрофаги, несущие на мембране распознаваемый ТКР антиген. Активированные макрофаги могут оказывать выраженное разрушительное-действие на ткани организма. Поэтому важно, чтобы активирующее действие IFNy было сфокусировано на инфицированных макрофагах. Кроме того, необходимы механизмы выключения продукции цитокина немедленно после потери контакта с инфицированной клеткой. Для этого служат механизмы внутриклеточного разрушения информационной РНК данного цитокина, работающие в активированных Т-лимфоцитах. Активация макрофагов под влиянием воспалительных ТН1 проявляется серией биохимических реакций, превращающих макрофаг в эффекторную клетку с выраженной антибактериальной активностью. В активированных макрофагах повышена эффективность слияния лизосом с фагосомами, которое обеспечивает экспозицию захваченных бактерий с лизосомальными ферментами, обладающими бактерицидностью. Активированные макрофаги продуцируют супероксидные и нитроксидные радикалы и антибактериальные пептиды. Изменения активированных макрофагов способствуют амплификации иммунного ответа за счет повышения экспрессии МНС 2 класса молекул и рецепторов для TNF-a. TNF-a является синергистом IFNy в активации макрофагов, особенно при индукции продукции нитроксидных радикалов (NO), обладающих широкой антимикробной активностью. Эти и другие поверхностные и секретируемые молекулы активированных макрофагов участвуют в эффекторных функциях макрофагов в клеточно-опосредованном и гуморальном иммунных ответах и в рекрутировании других клеток в очаг инфекции или воспаления.
Макрофаги не могут постоянно поддерживаться в активированном состоянии, так как они при этом потребляют много энергии и могут повреждать ткани организма. Активация макрофагов in vivo, как правило, сопряжена с местным повреждением тканей в результате секреции молекул типа супероксидных радикалов, токсичных и для клеток хозяина. Способность секретировать токсичные молекулы очень важна как защита от внеклеточных патогенных агентов, не поддающихся фагоцитозу. Однако плата за это – повреждение тканей организма. Поэтому .нужна очень тонкая регуляция функций макрофагов со стороны ТН1. В этой регуляции участвуют и другие продукты Т-лимфоцитов. Так, макрофаги, хронически инфицированные внутриклеточными паразитами, теряют способность активироваться под действием IFNy и TNF-a. Такие макрофаги могут быть убиты под действием TNF-p в сочетании с IFNy. Такое сочетанное действие является цитотоксическим и для фибробластов. IL-2 индуцирует пролиферацию Т-лимфоцитов и потенцирует секрецию других цитокинов: IL-3 и GM-CSF, которые способствуют ускоренной продукции в костном мозге новых фагоцитирующих клеток. Рекрутирование новых макрофагов из кровяного русла в очаг воспаления идет под действием TNF-a и TNF-p, повышающих экспрессию адгезионных молекул на эндотелиальных клетках. Дальнейшей мобилизации макрофагов в очаг способствуют хемокины: макрофагальный хемотаксический протеин (МСР) в сочетании с миграциюингибирующим фактором (MIF). При персистенции инфекции развивается хроническое воспаление, которое морфологически часто проявляется формированием гранулемы. В центре гранулемы сконцентрированы макрофаги, их слияние приводит к образованию гигантских клеток. Макрофаги окружены активированными Т-лимфоцитами, среди которых обнаруживаются ТН1 и ТН2, возможно, для взаимной регуляции их активности. Клетки в центре грануломы могут погибать от недостатка кислорода или от цитотоксических продуктов самих активированных макрофагов и лимфоцитов. В результате – казеозный некроз. Таким образом проявляется патогенетическая роль иммунного воспаления, которое направлено на ограничение очага инфекции, но сопряжено с повреждением тканей организма. Аккумуляция СD4+ Т-лимфоцитов в выстилке альвеол и легочной паренхиме, резкое нарастание доли CD4+ клеток в легочных инфильтратах характерны для легочного саркоидоза. Эти клетки участвуют в развитии гранулематозного воспаления и последующего фиброза. Эти клетки несут черты активации: повышенная экспрессия HLA-DR и IL-2R, способность к спонтанной пролиферации, спонтанной секреции IL-2 и других цитокинов отличают их от нормальных легочных Т-лимфоцитов. Присутствие в легочной ткани больных саркоидозом такого клона активированных Т-лимфоцитов поддерживает состояние хронического воспаления и формирование гранулем. Хотя этиология саркоидоза до сих пор не уточнена, накоплено много данных в пользу антиген-индуцированного формирования гранулем, которое рассматривается как результат чрезмерного иммунного ответа на персистирующий антиген. Пусковым событием является накопление CD4+ Т-лимфоцитов, которые продуцируют свой ростовой фактор IL-2. В результате развивается Т-клеточный альвеолит. Альвеолярные макрофаги при этом приобретают все черты активированных клеток: они продуцируют и секретируют TNF-a, IL-1, IL-6, IL-8 и хемокины, GM-CSF, IL-15. Последний усиливает пролиферативный ответ легочных Т-лимфоцитов на IL-2 и TNF-a. На мембранах альвеолярных макрофагов у больных саркоидозом найдены IL-2R, позволяющие им получать сигналы активации от IL-2 и IL-15. – Также рекомендуем “Естественные киллеры при воспалении в легких.” Оглавление темы “Патогенез воспаления в легких.”: |
Источник
Статья на конкурс «био/мол/текст»: Ученые объединили методы иммунотерапии, цитотерапии и генотерапии для перепрограммирования Т-лимфоцитов в потенциальных «убийц» раковых клеток. Но и этого оказалось недостаточно — следующим шагом стало создание молекулярного «выключателя», с помощью которого можно регулировать время и силу действия активированных Т-клеток. Инновационный метод закладывает основу для резкого сокращения серьезных (а иногда и смертельных) побочных эффектов, вызванных терапией с использованием модифицированных Т-клеток.
Медицина перешла на новый уровень: клетки стали живым лекарством
В последнее время в терапии опухолевых заболеваний особое внимание уделяется адоптивной иммуноцитотерапии (от англ. adoptive — приемный). При этом часть клеток иммунной системы пациента искусственно «натравливают» на опухолевые клетки. Суть метода состоит в том, чтобы отобрать у пациента необходимые иммунные клетки, обработать их — например, иммунными цитокинами (небольшими белками, выполняющими функции регуляторов деления и дифференцировки специфических иммунных клеток), — а затем вернуть в организм уже активированные клетки, которые и будут помогать бороться с опухолями* (рис. 1).
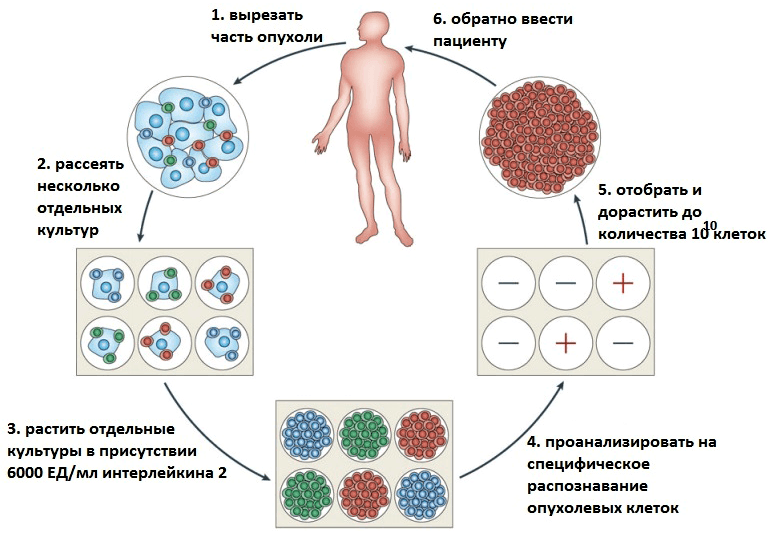
Рисунок 1. Схема получения антиопухолевых Т-клеток для адоптивной иммуноцитотерапии. Рисунок из [3].
Впервые метод адоптивной иммуноцитотерапии был описан еще в 1988 году — у пациентов с метастатической меланомой (то есть раком кожи на четвертой стадии) наблюдалась регрессия заболевания при терапии с помощью их TIL-клеток (лимфоцитов, инфильтрующих опухоль) [2]. В настоящее время терапия метастатической меланомы на основе TIL-клеток является наиболее эффективным способом лечения данного заболевания, поскольку регрессия опухоли наблюдается у половины пациентов [3].
Существует несколько вариантов клеток, которые используются в адоптивной иммунотерапии; из них три используются при терапии опухолевых заболеваний: уже знакомые нам TIL-клетки (лимфоциты, инфильтрующие опухоль), LAC-клетки (лимфокин-активированные киллеры) и CIK-клетки (цитокин-индуцированные киллеры). На самом деле собственные Т-клетки организма тоже стараются бороться с опухолевыми клетками, только зачастую опухолевые клетки им «не по зубам». Не то, чтобы совсем — ведь существует иммунный надзор, осуществляемый Т-клетками и естественными киллерами (NK-клетками), с помощью которых иммунная система старается защититься от опухолей, — однако это вовсе не стопроцентная защита. Однако случается, что иммунный надзор не всегда достаточно силен, чтоб предотвратить развитие опухолей: так, при длительном применении иммунодепрессантов после трансплантаций органов повышается частота развития многих опухолей [4].
Необходима система наведения
Несмотря на сложность получения модифицированных клеток, а также сопутствующий риск возникновения серьезных побочных эффектов, все же главной проблемой метода иммуноцитотерапии является отсутствие способов прицельной доставки вводимых модифицированных иммунных клеток в опухоль. Раковые клетки часто делаются практически «невидимыми» для иммунной системы, и они образуют микросреду, которая подавляет активность и миграцию Т-клеток [5]. Для того, чтобы сбросить мантию-невидимку с опухолевых клеток, Т-лимфоциты надо не только активировать, но и придать им способность прицельно узнавать опухолевые клетки. Т-клетки могут быть перепрограммированы методами генной инженерии путем введения генов, кодирующих рецепторы к опухолевым антигенам (TAA, tumour-associated аntigens) — оснащения собственной «системой наведения». Также можно заодно ввести гены для придания Т-клеткам устойчивости к иммуносупрессии для увеличения выживаемости или облегчения проникновения сконструированных Т-клеток в опухоль. В итоге, могут быть получены высокоактивные «наемные убийцы» раковых клеток [5].
Для получения эффективных «убийц» Т-лимфоциты модифицируют путем оснащения их искусственными химерными антигенными рецепторами (CAR, chimeric antigen receptors). Рецепторы химерные, поскольку одна часть (распознающая) была «позаимствована» у моноклональных антител, а часть, передающая сигнал, — у Т-клеточного рецептора (ТCR). В качестве внеклеточной «распознающей» части обычно служат вариабельные домены тяжелой и легкой цепи иммуноглобулинов необходимой специфичности (scFv), которые образуют специфичный к опухолевым клеткам антиген-связывающий участок [5] (рис. 2).
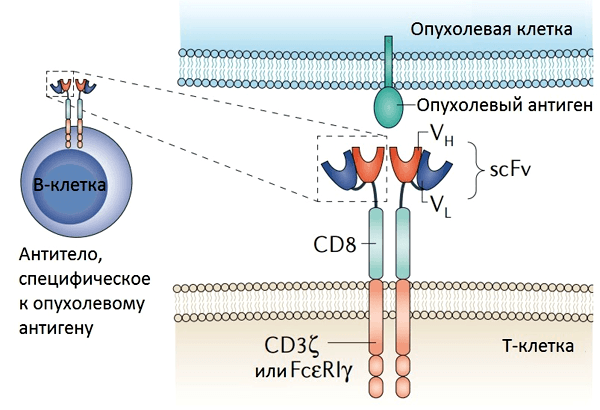
Рисунок 2. Структура химерного антигенного рецептора (CAR). CAR состоит из внеклеточного домена (одноцепочечного вариабельного фрагмента антитела (scFv)), соединенного с помощью цепей и трансмембранных доменов с цитоплазматической сигнальной областью. Гены, кодирующие scFv, получены из В-клеток, продуцирующих антитела, специфичные к опухолевому антигену. CAR существует в виде димера, и распознавание опухоли происходит напрямую (без участия MHC). Рисунок из [5].
Все новое — это хорошо забытое старое. Первые Т-клетки с химерным антигенным рецептором были получены командой ученых под руководством профессора Эсхара (Zelig Eshhar); результаты работы были опубликованы еще в 1989 году [6]. Эсхар понял, что, обладая данной техникой, Т-клетки можно запрограммировать на нацеленную атаку.
Однако с момента обнаружения химерных антигенных рецепторов до внедрения технологии в практику прошло больше 20 лет. За это время были улучшены химерные антигенные рецепторы — были созданы CAR 2-го поколения, в которые был внесен дополнительный сигнальный домен костимулирующей молекулы, который позволил улучшить активацию Т-клеток и их распространение. В CAR 3-го поколения был добавлен еще один сигнальный домен, что в конечном итоге повысило уровни выживания и размножения модифицированных Т-клеток [7] (рис. 3). В конечном итоге были улучшены способность к «выслеживанию» опухолевых клеток, а также уменьшены побочные эффекты.

Рисунок 4. Бутылка с питательной средой для Т-клеток, которые после введения в них нового рецептора выращивают около 10 дней до достижения ими количества в несколько миллиардов. Тогда они могут быть введены в вены пациента. Рисунок из [9].
Первые клинические испытания генетически модифицированных Т-лимфоцитов, несущих химерные антигенные рецепторы, прошли в 2012 году. Они выпали на долю девочки по имени Эмили, больной острой лимфобластной лейкемией. После того, как генетически модифицированные Т-клетки были обратно введены девочке, ее состояние резко ухудшилось, и она провела несколько недель в отделении интенсивной терапии на искусственной вентиляции легких. В какой-то момент жизнь Эмили висела на волоске, но в итоге девочка поправилась, и уже три года в ее организме врачи не находят даже единичных раковых клеток [8].
Побочные эффекты новой терапии
Несмотря на то, что иммуноцитотерапия Т-клетками с CAR является прорывом в области лечения опухолевых заболеваний, есть еще ряд опасностей, которые могут поджидать за углом. Доктор Карл Джун (Carl June) из университета Пенсильвании был одним из первых, кто опубликовал успешные результаты лечения модифицированными Т-клетками, сравнил то, что происходит внутри тела пациента с «серийным убийством» и «массовым убийством». Когда миллиарды Т-клеток, которые были введены в организм, поделятся, то они смогут обнаружить и убить несколько фунтов опухоли. Но в этом тоже немало риска — многие пациенты страдают от синдрома высвобождения цитокинов (цитокинового шторма) — при борьбе Т-клетки с опухолевой клеткой высвобождается большое количество молекул цитокинов, что представляет угрозу для самого организма. Так, семь пациентов умерло вследствие этого синдрома [9].
Побочные эффекты связаны с мощной иммунной активностью модифицированных Т-клеток. Одним из камней преткновения является риск высокой токсичности, не позволяющий ввести подобное лечение на регулярной основе. «Т-клетки — действительно мощные создания», — говорит профессор Венделл Лим (Wendell Lim), заведующий отделом Департамента клеточной и молекулярной фармакологии Калифорнийского университета. — «Будучи активированными, они могут вызвать смерть. Нам необходима система удаленного контроля, которая сохранит силу этих модифицированных Т-клеток, и позволит специфично „общаться“ с ними и управлять Т-клетками, находящимися в организме» [10].
Т-клетки взяли под контроль
Ученые из Калифорнийского университета в Сан-Франциско создали молекулярный «включатель», с помощью которого можно управлять действиями генноинженерных Т-лимфоцитов. Как и обыкновенные Т-клетки, несущие CAR, новые Т-клетки с «включателем» будут взаимодействовать с опухолевыми клетками, но не будут переходить «в атаку», пока не будет введен специальный препарат. Данный препарат является своеобразным «химическим мостиком» внутри Т-клеток: он запускает иммунные реакции, «включает» их, переводя в активное состояние. Когда препарат перестает циркулировать в крови, Т-клетки снова переходят в «выключенное» состояние (рис. 5).
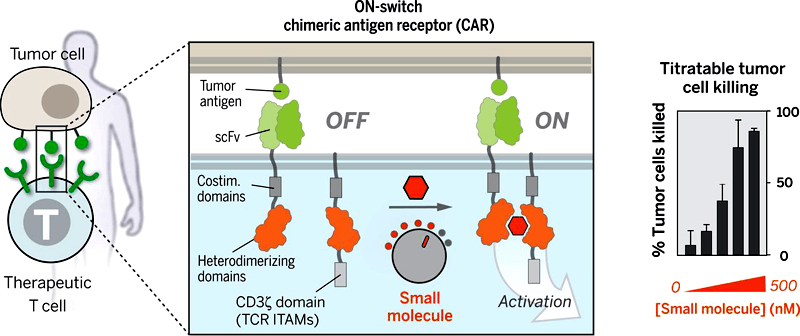
Рисунок 5. Титруемый контроль генноинженерных Т-клеток с помощью включаемого химерного антигенного рецептора. С обычным CAR Т-клетки активируются при соединении с клеткой-мишенью, при этом из-за очень сильного иммунного ответа есть риск высокой токсичности. «Включаемый» CAR требует небольшую стимулирующую молекулу для запуска терапевтической функции. Величину ответа (например, «убийства» клеток-мишеней) можно титровать, тем самым уменьшая токсичность при уменьшении количества небольшой стимулирующей молекулы. Рисунок из [11].
Внедрение «пульта управления» в Т-клетку с химерным антигенным рецептором — это пример простой и эффективной стратегии совмещения собственных и автономных решений клетки (например, обнаружение сигналов болезни) с контролируемыми пользователем из вне. Перегруппировка и расщепление основных частей CAR обеспечивает возможность «включения» и «выключения» химерных антигенных рецепторов. Данная работа также подчеркивает важность разработки оптимизированных биоинертных «пультов управления», таких как небольшие молекулы и свет, вместе с их клеточными компонентами реагирования, в целях повышения точности контролируемой терапии [11].
Таким образом, правильно дозируя препарат, можно управлять уровнем иммунной активности модифицированных Т-клеток. В частности, благодаря данной технологии можно снизить отрицательные последствия синдрома высвобождения цитокинов. Также иногда нормальные клетки экспрессируют небольшие количества белков, которые являются мишенью для Т-клеток с CAR. Поскольку модифицированные Т-клетки вводят в кровяное русло и они проходят через сердце и легкие, ткани этих органов могут быть повреждены прежде, чем Т-клетки достигнут своих намеченных целей в других частях тела. А с новой технологией Т-клетки будут в «выключенном» состоянии, пока не достигнут цели [10].
Иммунотерапия с помощью Т-клеток с CAR успешна против рака крови, но, когда дело доходит до твердых опухолей, которые образуются в толстой кишке, молочных железах, мозге и других тканях, модифицированные Т-клетки до сих пор не показывают высокой эффективности. Возможно, метод дистанционного управления Т-клетками позволит разработать более мощные версии химерных антигенных рецепторов, которые позволят Т-клеткам поражать твердые опухоли, при этом не обладая серьезными побочными эффектами.
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Rosenberg S.A., Packard B.S., Aebersold P.M., Solomon D., Topalian S.L., Toy S.T. et al. (1988). Use of tumor-infiltrating lymphocytes and interleukin-2 in the immunotherapy of patients with metastatic melanoma. A preliminary report. N. Engl. J. Med. 319, 1676–1680;
- Rosenberg S.A., Restifo N.P., Yang J.C., Morgan R.A., Dudley M.E. (2008). Adoptive cell transfer: a clinical path to effective cancer immunotherapy. Nat. Rev. Cancer. 8, 299–308;
- Ярилин А.А. Иммунология. М.: ГЭОТАР-Медиа, 2010. — 752 с.;
- Kershaw M.H., Westwood J.A., Darcy P.K. (2013). Gene-engineered T cells for cancer therapy. Nat. Rev. Cancer. 13, 525–541;
- Gross G., Waks T., Eshhar Z. (1989). Expression of immunoglobulin-T-cell receptor chimeric molecules as functional receptors with antibody-type specificity. Proc. Natl. Acad. Sci. USA. 86, 10024–10028;
- Urba W.J. and Longo D.L. (2011). Redirecting T cells. N. Engl. J. Med. 365, 754–757;
- Emily Whitehead Foundation;
- Regalado A. (2015). Biotech’s coming cancer cure. MIT Technology Review;
- Farley P. (2015). ‘Remote control’ of immune cells opens door to safer, more precise cancer therapies. University of California San Francisco;
- Wu C., Roybal K.T., Puchner E.M., Onuffer J., Lim W.A. (2015). Remote control of therapeutic T cells through a small molecule-gated chimeric receptor. Science. 350, aab4077..
Источник