Лейкоз из гранулярных лимфоцитов
Лейкоз из больших гранулярных лимфоцитов (БГЛ) – диагностика, лечениеСиндром, характеризующийся пролиферацией больших гранулярных лимфоцитов (БГЛ), в качестве самостоятельной нозологической формы был впервые описан в 1977 г. На тот момент точного терминологического определения заболеванию дано не было. R. McKenna и соавт. описали хроническое лимфопролиферативное заболевание с необычными клиническими, морфологическими, ультраструктурными и иммунологическими характеристиками. За последние три десятилетия в литературе это заболевание называли по-разному: Ту-лимфопролиферативное заболевание, хронический Т-клеточный лимфоцитоз с нейтропенией, Т-клеточный хронический лимфолейкоз (Т-ХЛЛ), Т8+ Т-ХЛЛ. Все эти термины в той или иной степени отражали морфологические, иммунологические и функциональные характеристики опухолевых клеток. Так, в работе J. Brouet с соавт. лейкоз из больших гранулярных лимфоцитов охарактеризован как Т-клеточный хронический лимфолейкоз. Одиннадцать случаев, описанных авторами, как показал последующий анализ, включали двух пациентов с Т-клеточным пролимфоцитарным лейкозом и девять с лейкозом из больших гранулярных лимфоцитов. По современным представлениям, существование Т-клеточного хронического лимфолейкоза оспаривается. Лишь в немногих исследованиях он охарактеризован как отдельное заболевание. J. Hoyer и соавт., опираясь в основном на морфологические критерии, описали 25 случаев Т-ХЛЛ. Следует ли эти случаи относить к Т-ХЛЛ или мелкоклеточному варианту Т-клеточного пролимфоцитарного лейкоза (Т-ПЛЛ), в большей степени является предметом семантических, а не терминологических дискуссий. Е. Matutes и соавт., изучив электронно-микроскопические, цитогенетические, иммунологические и клинические особенности Т-ХЛЛ у этой группы больных, небезосновательно относят его к мелкоклеточному варианту Т-ПЛЛ. Таким образом, данные литературы, посвященной Т-клеточным лимфопролиферативным заболеваниям, следует интерпретировать с большой осторожностью, учитывая весь спектр новых методов обследования и современные классификационные подходы. Выделению лейкоза из больших гранулярных лимфоцитов в отдельную нозологическую форму немало способствовало изучение функции и морфологии различных популяций Т-лимфоцитов. Большие гранулярные лимфоциты составляют 5—20 % от общего количества лимфоцитов крови (в абсолютных значениях от 250 до 450 в 1 мкл крови). Это клетки диаметром 12—15 мкм, с умеренным или широким ободком цитоплазмы слабобазофильного цвета, содержащей нежные или более грубые (плотные) азурофильные гранулы, размер и количество которых значительно варьируют. Ядра клеток округлые или овальные, располагаются в центре или несколько эксцентрично. Хроматин ядер конденсированный, ядрышки не просматриваются. Соответственно двум типам больших гранулярных лимфоцитов выделяют 2 варианта лейкоза из БЛГ (ЛБГЛ): из NK-клеток (CD3-) и цитотоксических Т-клеток (CD3+). NK-ЛБГЛ встречается значительно реже, чем Т-ЛБГЛ, в основном в азиатском регионе, характеризуется агрессивным течением с поражением лимфатических узлов, печени, селезенки и наличием В-симптомов. Клиническая характеристика лейкоза из больших гранулярных лимфоцитов
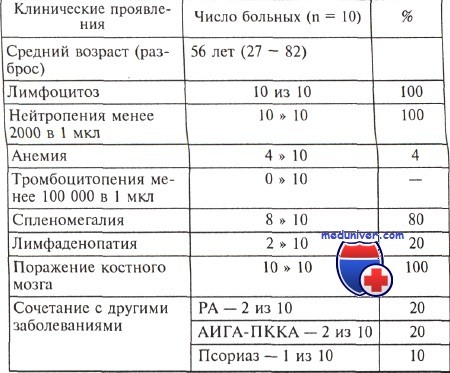
Подавляющее большинство случаев лейкоза из больших гранулярных лимфоцитов представлено его Т-клеточным вариантом. Болеют в основном люди пожилого возраста, несколько чаще женщины. Т-клеточный лейкоза из больших гранулярных лимфоцитов (Т-ЛБГЛ) характеризуется доброкачественным клиническим течением и нередко протекает бессимптомно. Диагноз может быть поставлен при рутинном клинико-лабораторном обследовании. К диагностическим критериям Т-клеточного лейкоза из больших гранулярных лимфоцитов относятся увеличение абсолютного количества больших гранулярных лимфоцитов более 2 • 109/л с CD3+CD8+-иммунофенотипом в течение 6 мес и более, нейтропения и/или анемия. Известны случаи Т-клеточного лейкоза из больших гранулярных лимфоцитов с меньшим содержанием больших гранулярных лимфоцитов. У большинства пациентов симптомы заболевания связаны с рецидивирующими инфекциями на фоне нейтропении. Приблизительно у 20 % больных развитию Т-клеточного лейкоза из больших гранулярных лимфоцитов (Т-ЛБГЛ) предшествует длительный анамнез ревматоидного артрита. В этих случаях при физикальном обследовании определяется увеличение селезенки, обычно выступающей менее чем на 10 см из-под края реберной дуги. У половины больных обнаруживают спленомегалию, менее чем у 20 % пациентов манифестация заболевания проявляется кожными поражениями в виде папулезной сыпи. В противоположность В-ХЛЛ лимфаденопатия является достаточно редким симптомом (менее 5 % от всех случаев). В клиническом анализе крови определяется нормальное или незначительно повышенное количество лейкоцитов (5—30•109/л) с абсолютным лимфоцитозом (>5•109/л), причем клетки с характерными морфологическими особенностями больших гранулярных лимфоцитов. В подавляющем большинстве случаев количество нейтрофилов составляет менее 1,5•109/л. Анемия и тромбоцитопения выявляются приблизительно у 20 % больных. Опухолевые клетки при Т-клеточном лейкозе из больших гранулярных лимфоцитов имеют характеристики антигенактивированных цитотоксических Т-лимфоцитов, однако их антигенная специфичность точно не установлена. По данным некоторых исследователей, в сыворотке больных Т-клеточным лейкозом из больших гранулярных лимфоцитов обнаружены антитела к HTLV-I/II, но убедительных свидетельств клональной интеграции ретровируса в геном лейкозных клеток не получено. Одним из основных механизмов персистенции лимфоцитов при Т-клеточном лейкозе из больших гранулярных лимфоцитов является нарушение регуляции апоптоза. Нормальные цитотоксические Т-лимфоциты, распознавая вирусные пептиды при участии главного комплекса гистосовместимости, имеют высокий уровень экспресии Fas/CD95 и Fas/CD95-лиганда. Инфицированные вирусом клетки-мишени затем элиминируются путем Fas-зависимого апоптоза. Fas-лиганд относится к семейству белков фактора некроза опухоли и индуцирует апоптоз путем связывания со своим рецептором, который также известен как APO-I или CD95. В уничтожении антигенактивированных цитотоксических Т-лимфоцитов задействован тот же самый механизм. Показано, что лимфоциты при Т-ЛБГЛ также имеют высокий уровень экспрессии Fas и Fas-лиганда и их накопление обусловлено нарушением Fas-зависимого апоптоза. Устойчивая экспрессия и экскреция Fas-лиганда Т-БГЛ может являться одним из возможных механизмов развития нейтропении, особенно при отсутствии четкой корреляции между степенью нейтропении и объемом поражения костного мозга. В норме нейтрофилы экспрессируют CD95 и подвергаются Fas-зависимому апоптозу, поэтому можно предположить, что избыточная секреция Fas-лиганда опухолевыми БГЛ может быть одной из причин нейтропении при Т-клеточном лейкозе из больших гранулярных лимфоцитов (Т-ЛБГЛ). Важной отличительной чертой Т-клеточного лейкоза из больших гранулярных лимфоцитов (Т-ЛБГЛ) является ассоциация с другими заболеваниями. По данным ряда авторов, около 20—30 % больных Т-ЛБГЛ имеют серологические и клинические признаки ревматоидного артрита. – Также рекомендуем “Синдром Рихтера – история изучения” Оглавление темы “Лейкозы”:
|
Источник
Хронический лимфоцитарный лейкоз — это злокачественная опухоль, произрастающая из малых В-лимфоцитов. Она характеризуется накоплением опухолевого клона клеток в костном мозге, лимфоидных тканях (лимфоузлы, селезенка) и крови. К этому же виду заболевания относится лимфома из малых лимфоцитов (ЛМЛ). Биологически она идентична ХЛЛ, но отличается клинической картиной. При хроническом лейкозе поражается костный мозг, и, как следствие, в крови повышается уровень лимфоцитов, а при ЛМЛ в основном поражаются лимфатические узлы и селезенка. Содержание опухолевого клона в крови менее 5×10 9 /л.
Классификация ХЛЛ
Хронический лейкоз классифицируется по стадиям и по группам риска.
Стадия заболевания определяется на основании клинического обследования и результатах анализа крови:
- Стадия А — уровень гемоглобина более 100 г/л, тромбоцитов более 100 × 10 9 /л, и поражено менее 3 областей лимфатических узлов.
- Стадия В — уровень гемоглобина более 100 г/л, тромбоцитов более 100 × 10 9 /л, и поражено более 3 областей лимфатических узлов.
- Стадия С уровень гемоглобина менее 100 г/л или уровень тромбоцитов менее 100 × 10 9 /л.
Классификация по группам риска
Для данной классификации был разработан международный прогностический индекс, учитывающий следующие параметры:
- мутация TP53 (17p).
- мутация IGHV.
- Уровень β2-микроглобулина >3,5 мг/л.
- Стадия B/С.
- Возраст старше 65 лет.
Каждому из этих параметров присваивается определенное количество баллов, при их суммировании пациент определяется в одну из 4 групп риска:
- 0-1 балл — группа с низким риском прогрессирования.
- 2-3 балла — промежуточный риск прогрессирования.
- 4-6 баллов — высокий риск прогрессирования.
- 7-10 баллов — очень высокий риск прогрессирования.
Симптомы ХЛЛ
Первоначально заболевание протекает бессимптомно, каких-то четких жалоб нет, но отмечаются частые респираторные инфекции, потливость, слабость. Может наблюдаться некоторое увеличение лимфатических узлов. Иными словами, ничего конкретного. На этой стадии хронический лейкоз обнаруживают случайно, когда пациент сдает общий анализ крови по поводу рутинного обследования или при диагностике другого заболевания. При доброкачественном течении такое состояние может продолжаться годами, но потом неизбежно наступает прогрессирование и наступает развернутая стадия процесса.
При развернутой стадии заболевания пациенты предъявляют следующие жалобы:
- Общая слабость.
- Снижение работоспособности.
- Ночная потливость.
- Резкое похудение без особых причин.
- Повышение температуры без признаков инфекции.
- Лимфаденопатия.
Развернутая стадия сменяется терминальной. Здесь уже наблюдается истощение, выраженная интоксикация, тяжелые генерализованные инфекции, нарушение работы внутренних органов (почечная недостаточность, кардиомиопатии и др). При инфильтрации головного мозга опухолевыми клетками, происходит нарушение сознания, вплоть до комы.
Причины возникновения хронического лимфоцитарного лейкоза
Причины возникновения хронического лимфолейкоза до конца не ясны. Многие факторы риска, которые имеют ключевое значение при развитии других злокачественных новообразований и гемобластозов, здесь не актуальны (воздействие ионизирующего излучения, химических канцерогенов, хронических инфекций). В то же время обнаружено увеличение заболеваемости среди лиц, занятых в обслуживании высоковольтных линий электропередач. Также доказана роль наследственной предрасположенности. Риски развития ХЛЛ при наличии в семье родственника с такой патологий увеличиваются в 30 раз по сравнению со среднепопуляционными показателями.
Диагностика хронического лимфолейкоза
Всем пациентам с подозрением на хронический лейкоз, а также с уже подтвержденным диагнозом во время каждого визита к гематологу проводят опрос и уточнение жалоб. Это важно не только для оценки текущего статуса, но и для прогнозирования тактики дальнейшего ведения больного. Особое внимание уделяется наличию неспецифических симптомов интоксикации (повышение температуры более 38 градусов в течение более, чем 2-х недель, ночная потливость и снижение массы тела более, чем на 10% за последние 6 месяцев). Также проводится физикальный терапевтический осмотр, включающий определение размеров печени и селезенки, а также пальпацию доступных лимфатических узлов. Для постановки диагноза назначается ряд специальных тестов:
- Иммунофенотипирование лимфоцитов. Диагноз хронический лимфоцитарный лейкоз выставляется, если уровень В-лимфоцитов в крови превышает 5000/мкл.
- При подозрении на ЛМЛ, когда нет специфической клинической симптоматики и увеличения лимфоцитов в крови, проводят биопсию увеличенного лимфатического узла с последующим морфологическим и иммуногистохимическим исследованием полученного материала.
- Для того чтобы оценить степень поражения костного мозга и отследить динамику изменений после терапии, проводят исследование его пунктата и биоптата. Аналогичные исследования проводят при подозрении на трансформацию лейкоза.
Для подбора терапии выполняются молекулярно-генетические исследования методом FISH для определения делеций 17р, мутаций ТР 53, а также других генетических аномалий.
После окончания терапии необходимо провести исследование крови методом проточной цитометрии для определения минимальной остаточной болезни. Полученные результаты позволят спрогнозировать время до рецидива и общую выживаемость. Например, уровень злокачественных клеток в крови, превышающий 1%, свидетельствует о высокой вероятности раннего рецидива и требует пересмотра протокола лечения. Если уровень опухолевых клеток находится в пределах 0.01-0.9%, ожидаемая продолжительность жизни без прогрессирования составляет 3 года. И при уровне опухолевых клеток менее 0.01% высока вероятность длительной безрецидивной выживаемости (более 5 лет).
Лечение хронического лимфоцитарного лейкоза
Лечение хронического лимфоцитарного лейкоза начинается только по показаниям. Это связано с тем, что около трети всех больных имеют вялотекущую форму заболевания, которая практически не сказывается на продолжительности их жизни.
Показаниями к назначению специфической терапии являются:
- Наличие симптомов интоксикации — повышение температуры более 38 градусов в течение 2 недель, снижение веса на 10% и более за пол года, ночные поты в течение месяца.
- Прогрессирующая анемия и/или тромбоцитопения.
- Прогрессирующее увеличение лимфатических узлов.
- Увеличение количества лимфоцитов в 2 раза и более в течение полугода.
- Увеличение селезенки (более 6 см по краю реберной дуги).
Цели лечения будут зависеть от возраста пациента и наличия у него сопутствующих заболеваний. В этой связи все пациенты с ХЛЛ делятся на три группы:
- 1 группа — пациенты младше 65 лет, у которых нет других серьезных заболеваний, и которые имеют благоприятный молекулярно-генетический профиль лейкоза. В этом случае ставится задача достижения полной ремиссии и редукции минимальной остаточной болезни.
- 2 группа — пациенты старше 65 лет либо молодые пациенты, у которых есть болезни, ограничивающие применение некоторых химиопрепаратов. Целью лечения данной группы является контроль над течением болезни при минимальной токсичности лечения.
- Третья группа — это пациенты с неблагоприятным молекулярно-генетическим профилем лейкоза (наличие делеции 17р, мутации ТР 53), независимо от возраста и общего статуса. Главным компонентом их лечения является ибрутиниб. Сохранным больным без тяжелых сопутствующих патологий может быть показана трансплантация аллогенных стволовых клеток (ТГСК).
Терапия первой линии пациентов первой группы
Стандартом лечения таких больных является режим FCR, включающий ритуксимаб, флударабин и циклофосфамид. Эта схема дает хорошие результаты, но сопряжена с высоким риском токсических и нейтропенических осложнений.
Пациентам, которым такой режим лечения провести невозможно, назначается схема RB — ритуксимаб и бендамустин. Этот режим менее токсичен, но вместе с тем и отличается чуть меньшей эффективностью. Также в качестве варианта лечения для достижения ремиссии может применяться ибрутиниб в качестве монотерапии.
Лечение пациентов второй группы
При терапии пациентов второй группы применяются менее токсические режимы и лечение таргетными препаратами. Могут использоваться следующие схемы:
- BR.
- FCR-lite.
- Хлорамбуцил + ритуксимаб.
- Монотерапия хлорамбуцилом.
- Хлорамбуцил + обинутузумаб.
- Монотерапия ибрутинибом.
Пациентам старше 80 лет, у которых ожидается невысокая продолжительность жизни, применяются максимально щадящие схемы. Как правило, это монотерапия хлорамбуцилом, ритуксимабом или ибрутинибом.
Лечение пациентов третьей группы
Пациентам из группы высокого риска может быть рекомендовано следующее лечение:
- Терапия ибрутинибом как в монорежиме, так и в составе полихимиотерапии с ритуксимабом или бендамустином. Лечение проводят до прогрессирования заболевания или развития токсических осложнений.
- Комбинированное лечение венетоклаксом и обинутузумабом в течение 12 месяцев.
- Молодым пациентам без сопутствующей патологии проводят лечение ибрутинибом до достижения объективного ответа, а затем рассматривается вариант донорской ТГСК для консолидации ремиссии.
- Пациентам, которым по каким-либо причинам невозможно назначение ибрутиниба, проводят монотерапию венетоклаксом.
Лечение рецидивов
При определении схемы лечения рецидива учитываются следующие данные:
- Схема лечения, выбранная для терапии первой линии.
- Время развития рецидива.
- Особенности течения рецидива.
Пациентам, у которых рецидив развился через 2 года после последней терапии (поздний рецидив), можно повторить выбранный режим, использовавшийся при предыдущем лечении или рассмотреть другой вариант ХТ первой линии, предусмотренной для лечения.
Пациентам с ранним рецидивом, который развился менее, чем через 2 года после окончания последней терапиии, не получавшим лечение ибрутинибом, рекомендовано назначать схемы лечения, содержащие этот препарат. Если они получали ибрутиниб, назначается схема венетоклакс+ритуксимаб. Пациентам младше 65 лет, при невозможности назначения ибрутиниба и неэффективнсти венетоклакса и ритуксимаба необходимо рассматривать аллогенную трансплантацию гемопоэтических стволовых клеток.
Лечение сопутствующих осложнений
Одной из основных причин смерти больных хроническим лимфоцитарным лейкозом являются инфекции. Их причиной является замещение нормальных иммунокомпетентных клеток опухолевым клоном и снижение уровня иммуноглобулинов. В этой связи пациентам с хроническим лимфолейкозом при уровне Ig G ниже 5 г/л рекомендуется заместительная терапия иммуноглобулином. Его вводят внутривенно раз в месяц в течение года. Также показана вакцинация против сезонных инфекций: гриппа, пневмококка, гемофильной инфекции, менингококковой инфекции.
Последствия хронического лимфоцитарного лейкоза
У 3-10% больных хроническим лимфоцитарным лейкозом возможна трансформация заболевания в крупноклеточную иммунобластную лимфому. Для подтверждения диагноза необходимо проведение биопсии пораженных лимфоузлов. Также возможна трансформация ХЛЛ в острый лимфобластный лейкоз. Вероятность такого события составляет менее 2%. Очень редко хронический лимфоцитарный лейкоз трансформируется в миеломную болезнь.
Прогноз при хроническом лимфоцитарном лейкозе
Хронический лимфоцитарный лейкоз на сегодняшний день является неизлечимым заболеванием. Однако возможности современной терапии позволяют существенно продлить жизнь таких больных, сохранив ее качество на приемлемом уровне. В целом продолжительность жизни таких пациентов стремится к общепопуляционным показателям.
В Европейской клинике лечение хронического лимфолейкоза проводится согласно современным стандартам с использованием новейших препаратов. Пациентами занимаются опытные врачи, в сложных случаях решение принимается коллегиально консилиумом специалистов. Благодаря такому подходу в каждом случае нам удается достичь максимально возможных результатов.
Источник