Лейкоз из больших гранулированных лимфоцитов
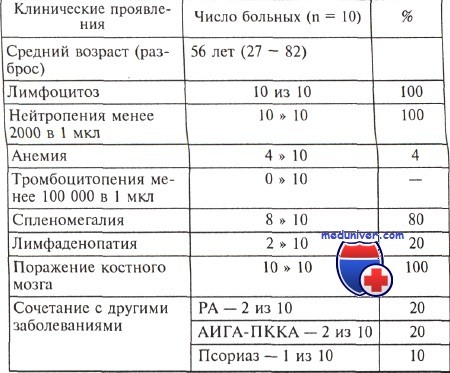
Лейкоз из больших гранулярных лимфоцитов (БГЛ) – диагностика, лечениеСиндром, характеризующийся пролиферацией больших гранулярных лимфоцитов (БГЛ), в качестве самостоятельной нозологической формы был впервые описан в 1977 г. На тот момент точного терминологического определения заболеванию дано не было. R. McKenna и соавт. описали хроническое лимфопролиферативное заболевание с необычными клиническими, морфологическими, ультраструктурными и иммунологическими характеристиками. За последние три десятилетия в литературе это заболевание называли по-разному: Ту-лимфопролиферативное заболевание, хронический Т-клеточный лимфоцитоз с нейтропенией, Т-клеточный хронический лимфолейкоз (Т-ХЛЛ), Т8+ Т-ХЛЛ. Все эти термины в той или иной степени отражали морфологические, иммунологические и функциональные характеристики опухолевых клеток. Так, в работе J. Brouet с соавт. лейкоз из больших гранулярных лимфоцитов охарактеризован как Т-клеточный хронический лимфолейкоз. Одиннадцать случаев, описанных авторами, как показал последующий анализ, включали двух пациентов с Т-клеточным пролимфоцитарным лейкозом и девять с лейкозом из больших гранулярных лимфоцитов. По современным представлениям, существование Т-клеточного хронического лимфолейкоза оспаривается. Лишь в немногих исследованиях он охарактеризован как отдельное заболевание. J. Hoyer и соавт., опираясь в основном на морфологические критерии, описали 25 случаев Т-ХЛЛ. Следует ли эти случаи относить к Т-ХЛЛ или мелкоклеточному варианту Т-клеточного пролимфоцитарного лейкоза (Т-ПЛЛ), в большей степени является предметом семантических, а не терминологических дискуссий. Е. Matutes и соавт., изучив электронно-микроскопические, цитогенетические, иммунологические и клинические особенности Т-ХЛЛ у этой группы больных, небезосновательно относят его к мелкоклеточному варианту Т-ПЛЛ. Таким образом, данные литературы, посвященной Т-клеточным лимфопролиферативным заболеваниям, следует интерпретировать с большой осторожностью, учитывая весь спектр новых методов обследования и современные классификационные подходы. Выделению лейкоза из больших гранулярных лимфоцитов в отдельную нозологическую форму немало способствовало изучение функции и морфологии различных популяций Т-лимфоцитов. Большие гранулярные лимфоциты составляют 5—20 % от общего количества лимфоцитов крови (в абсолютных значениях от 250 до 450 в 1 мкл крови). Это клетки диаметром 12—15 мкм, с умеренным или широким ободком цитоплазмы слабобазофильного цвета, содержащей нежные или более грубые (плотные) азурофильные гранулы, размер и количество которых значительно варьируют. Ядра клеток округлые или овальные, располагаются в центре или несколько эксцентрично. Хроматин ядер конденсированный, ядрышки не просматриваются. Соответственно двум типам больших гранулярных лимфоцитов выделяют 2 варианта лейкоза из БЛГ (ЛБГЛ): из NK-клеток (CD3-) и цитотоксических Т-клеток (CD3+). NK-ЛБГЛ встречается значительно реже, чем Т-ЛБГЛ, в основном в азиатском регионе, характеризуется агрессивным течением с поражением лимфатических узлов, печени, селезенки и наличием В-симптомов. Клиническая характеристика лейкоза из больших гранулярных лимфоцитов
Подавляющее большинство случаев лейкоза из больших гранулярных лимфоцитов представлено его Т-клеточным вариантом. Болеют в основном люди пожилого возраста, несколько чаще женщины. Т-клеточный лейкоза из больших гранулярных лимфоцитов (Т-ЛБГЛ) характеризуется доброкачественным клиническим течением и нередко протекает бессимптомно. Диагноз может быть поставлен при рутинном клинико-лабораторном обследовании. К диагностическим критериям Т-клеточного лейкоза из больших гранулярных лимфоцитов относятся увеличение абсолютного количества больших гранулярных лимфоцитов более 2 • 109/л с CD3+CD8+-иммунофенотипом в течение 6 мес и более, нейтропения и/или анемия. Известны случаи Т-клеточного лейкоза из больших гранулярных лимфоцитов с меньшим содержанием больших гранулярных лимфоцитов. У большинства пациентов симптомы заболевания связаны с рецидивирующими инфекциями на фоне нейтропении. Приблизительно у 20 % больных развитию Т-клеточного лейкоза из больших гранулярных лимфоцитов (Т-ЛБГЛ) предшествует длительный анамнез ревматоидного артрита. В этих случаях при физикальном обследовании определяется увеличение селезенки, обычно выступающей менее чем на 10 см из-под края реберной дуги. У половины больных обнаруживают спленомегалию, менее чем у 20 % пациентов манифестация заболевания проявляется кожными поражениями в виде папулезной сыпи. В противоположность В-ХЛЛ лимфаденопатия является достаточно редким симптомом (менее 5 % от всех случаев). В клиническом анализе крови определяется нормальное или незначительно повышенное количество лейкоцитов (5—30•109/л) с абсолютным лимфоцитозом (>5•109/л), причем клетки с характерными морфологическими особенностями больших гранулярных лимфоцитов. В подавляющем большинстве случаев количество нейтрофилов составляет менее 1,5•109/л. Анемия и тромбоцитопения выявляются приблизительно у 20 % больных. Опухолевые клетки при Т-клеточном лейкозе из больших гранулярных лимфоцитов имеют характеристики антигенактивированных цитотоксических Т-лимфоцитов, однако их антигенная специфичность точно не установлена. По данным некоторых исследователей, в сыворотке больных Т-клеточным лейкозом из больших гранулярных лимфоцитов обнаружены антитела к HTLV-I/II, но убедительных свидетельств клональной интеграции ретровируса в геном лейкозных клеток не получено. Одним из основных механизмов персистенции лимфоцитов при Т-клеточном лейкозе из больших гранулярных лимфоцитов является нарушение регуляции апоптоза. Нормальные цитотоксические Т-лимфоциты, распознавая вирусные пептиды при участии главного комплекса гистосовместимости, имеют высокий уровень экспресии Fas/CD95 и Fas/CD95-лиганда. Инфицированные вирусом клетки-мишени затем элиминируются путем Fas-зависимого апоптоза. Fas-лиганд относится к семейству белков фактора некроза опухоли и индуцирует апоптоз путем связывания со своим рецептором, который также известен как APO-I или CD95. В уничтожении антигенактивированных цитотоксических Т-лимфоцитов задействован тот же самый механизм. Показано, что лимфоциты при Т-ЛБГЛ также имеют высокий уровень экспрессии Fas и Fas-лиганда и их накопление обусловлено нарушением Fas-зависимого апоптоза. Устойчивая экспрессия и экскреция Fas-лиганда Т-БГЛ может являться одним из возможных механизмов развития нейтропении, особенно при отсутствии четкой корреляции между степенью нейтропении и объемом поражения костного мозга. В норме нейтрофилы экспрессируют CD95 и подвергаются Fas-зависимому апоптозу, поэтому можно предположить, что избыточная секреция Fas-лиганда опухолевыми БГЛ может быть одной из причин нейтропении при Т-клеточном лейкозе из больших гранулярных лимфоцитов (Т-ЛБГЛ). Важной отличительной чертой Т-клеточного лейкоза из больших гранулярных лимфоцитов (Т-ЛБГЛ) является ассоциация с другими заболеваниями. По данным ряда авторов, около 20—30 % больных Т-ЛБГЛ имеют серологические и клинические признаки ревматоидного артрита. – Также рекомендуем “Синдром Рихтера – история изучения” Оглавление темы “Лейкозы”:
|
Источник
Хронический лимфолейкоз — злокачественное лимфопролиферативное заболевание, при котором опухолевыми клетками являются патологические В-лимфоциты, способные накапливаться в костном мозге, периферической крови и лимфатических узлах. В норме В-лимфоциты в течение своей жизни превращаются в иммуноглобулинсекретирующую клетку, которая обеспечивает приобретённый иммунитет. Опухолевые В-лимфоциты такой функции лишены, и, таким образом, иммунитет больного страдает, и повышается риск присоединения инфекционных заболеваний. Помимо этого, по мере прогрессирования заболевания нарушается выработка эритроцитов, нейтрофилов и тромбоцитов, возможно развитие аутоиммунных процессов. Наконец, хронический лимфолейкоз может трансформироваться в В-клеточный пролимфоцитарный лейкоз, в высокодифференцированную неходжкинскую лимфому, в частности — в диффузную В-крупноклеточную лимфому.
Причины развития лимфолейкоза
Хронический лейкоз является самым распространённым видом лейкоза, составляя до 30% в общей структуре заболеваемости. Частота встречаемости составляет 4 случая на 100 тысяч населения; у лиц старше 80 лет частота составляет более 30 случаев на 100 тысяч населения.
Факторами риска развития хронического лимфолейкоза являются:
- Пожилой возраст. До 70% всех выявленных случаев приходится на людей старше 60 лет,
- Мужской пол. Мужчины заболевают в два раза чаще женщин,
- Воздействие ионизирующего излучения,
- Контакт с бензолом и бензином.
Симптомы
Для хронического лимфолейкоза характерно длительное бессимптомное течение; основной причиной обращения к врачу являются изменения в общем анализе крови, сданном в рамках профилактического осмотра или по поводу иного заболевания. Активных жалоб на момент первичного осмотра пациент может и не предъявлять, но при этом зачастую даже в этой ситуации уже выявляется увеличение лимфатических узлов и изменение их консистенции до тестоватой. Сами лимфоузлы не уплотнены, сохраняют подвижность относительно окружающих тканей. В случае присоединения инфекции лимфатические узлы значительно увеличиваются; по мере прогрессирования хронического лимфолейкоза лимфоузлы — в первую очередь брюшной полости — способны
образовывать конгломераты.
Первые возникающие жалобы обычно не носят специфического характера: повышенная утомляемость, слабость, выраженная потливость. По мере развития заболевания могут возникнуть аутоиммунные проявления, в первую очень гемолитические анемии (в 10-25% случаев) и тромбоцитопении (в 2-3% случаев). Гемолитическая анемия развивается в связи с разрушением самим организмом эритроцитов; чаще всего развивается, как и сам хронический лимфолейкоз, постепенно, но может проявиться и острым кризом — с повышением температуры, появлением желтухи, потемнения мочи. Тромбоцитопения может быть гораздо более опасным состоянием в связи с развитием кровотечений, в том числе и жизнеугрожающих (например, кровоизлияния в головной мозг).
Кроме того, так как В-лимфоциты относятся к клеткам, обеспечивающим иммунитет, типичным является присоединение инфекционных осложнений, в том числе оппортунистических, то есть вызванных микроорганизмами, постоянно находящимися в человеческом организме и не проявляющими себя при адекватном иммунном ответе. Чаще всего оппортунистическими инфекциями поражаются лёгкие.
Диагностика хронического лимфолейкоза
Диагноз хронического лимфолейкоза может быть заподозрен при оценке результатов обычного клинического анализа крови — обращает на себя внимание увеличение абсолютного количества лимфоцитов и лейкоцитов. Основным диагностическим критерием является абсолютное количество лимфоцитов, превышающее 5×10 9 л и прогрессивно увеличивающееся по мере развития лимфолейкоза, достигая цифр 100-500×10 9 л. Важно обращать внимание не только на абсолютное число, — если в начале заболевания лимфоциты составляют до 60-70% от всего количества лейкоцитов, то при его дальнейшем развитии они могут составлять 95-99%. Другие показатели крови, такие, как гемоглобин и тромбоциты, могут быть в норме, но при прогрессировании заболевания может быть выявлено их снижение. Абсолютным критерием для установки диагноза «хронический лимфолейкоз» является выявление более 5000 клональных В-лимфоцитов в 1 мкл периферической крови.
В биохимическом анализе крови может быть выявлено снижение общего белка и количества иммуноглобулинов, но это характерно для более поздних стадий заболевания. Обязательным этапом в диагностическом поиске является трепанбиопсия костного мозга. При гистологическом исследовании полученного пунктата на ранних этапах заболевания так же, как и в общем анализе крови, обнаруживается небольшое содержание лимфоцитов (40–50%), но при высоком лейкоцитозе лимфоциты могут составлять 95–98% костномозговых элементов.
Так как изменения в костном мозге являются неспецифическими, окончательный диагноз хронического лимфолейкоза устанавливается на основании данных иммуногистохимического исследования. Характерный иммунофенотип хронического лимфолейкоза включает экспрессию антигенов CD19, CD5, CD20, CD23, также отмечается слабая экспрессия на поверхности клеток иммуноглобулинов IgM (нередко одновременно с IgD) и антигенов CD20 и CD22. Главным цитогенетическим маркером, непосредственно влияющим на выбор терапии, является делеция 17p. Желательно выполнять анализ, направленный на выявлении этой делеции, до начала лечения, так как её выявление приводит к изменению тактики ведения пациента. Помимо биопсии костного мозга, в случае значительного увеличения отдельных лимфатических узлов показана пункция и их с целью исключения лимфомы.
Из инструментальных методов диагностики проводятся рентгенография органов грудной клетки и УЗИ наиболее часто поражаемых групп лимфоузлов и органов брюшной полости – в первую очередь печени и селезёнки, так как именно эти органы чаще всего поражаются при хроническом лимфолейкозе.
Стадии заболевания
В настоящее время стадирование осуществляется согласно классификации, предложенной Binet:
- A — содержание гемоглобина более 100 гл, тромбоцитов — более 100×10 9 л, поражено менее трёх лимфатических областей (к ним относятся: шейные лимфоузлы, подмышечные лимфоузлы, паховые лимфоузлы, печень, селезёнка),
- B — содержание гемоглобина более 100 гл, тромбоцитов — более 100×10 9 л, поражено более трёх лимфатических областей,
- C — содержание гемоглобина менее 100 г или тромбоцитов — менее 100×10 9 л.
Помимо классификации по Binet, используется классификация по Rai, используемая преимущественно в США. Согласно ей, выделяют четыре стадии заболевания:
- 0 — клинические проявления включают в себя только повышение лимфоцитов более 15×10 9 в периферической крови и более 40% в костном мозге,
- I — повышено количество лимфоцитов, диагностируется увеличение лимфоузлов,
- II — повышено количество лимфоцитов, диагностируется увеличение печени иили селезёнки вне зависимости от увеличения лимфоузлов,
- III — наблюдается повышение количества лимфоцитов и снижение уровня гемоглобина менее 110 гл вне зависимости от увеличения селезёнки, печени и лимфоузлов,
- IV — наблюдается повышение количества лимфоцитов и снижение числа тромбоцитов менее 100×10 9 вне зависимости от уровня гемоглобина, увеличения органов и лимфоузлов.
0 стадия характеризуется благоприятным прогнозом, I и II — промежуточным, III и IV — неблагоприятным.
Лечение
В настоящее время хронический лимфолейкоз хорошо поддаётся лечению благодаря широкому спектру химиотерапевтических препаратов. Важно отметить, что современные руководства не рекомендуют начинать агрессивное лечение сразу же после установки диагноза — в случаях, когда клинические проявления минимальны, возможно активное динамическое наблюдение до момента возникновения показаний к проведению специфического лечения, к коим относятся:
- Возникновение или нарастание интоксикации, которая проявляется потерей массы тела более чем на 10% за полгода, ухудшением общего состояния; появление лихорадки, субфебрильной температуры, ночных потов.
- Нарастание явлений анемии и/или тромбоцитопении;
- Аутоиммунная анемия и/или тромбоцитопения — в случае, если состояние не корректируется преднизолоном;
- Значительные размеры селезёнки — нижний край на расстоянии >6 см и более ниже рёберной дуги;
- Размер поражённых лимфатических узлов более 10 см или его прогрессивное увеличение;
- Увеличение количества лимфоцитов более, чем на 50% за 2 месяца, или вдвое за 6 месяцев.
Основным методом лечения хронического лимфолейкоза на данный момент является химиотерапия. Один из первых химиотерапевтических агентов, показавших свою эффективность в лечении хронического лимфолейкоза, хлорамбуцил, используется и в настоящее время, хоть и ограниченно. С течением времени вместо хлорамбуцила стали использовать циклофосфамид, в комбинации с другими препаратами, и соответствующие схемы (например, CHOP, COP, CAP) на данный момент применяются у пациентов молодого возраста с хорошим соматическим статусом.
Впервые введённый в клиническую практику в 80-х годах прошлого века флударабин показал эффективность в отношении достижения стойкой ремиссии, превышающую эффективность хлорамбуцила, особенно в сочетании с циклофосфамидом. Важно отметить, что эта схема эффективна даже в случае развития рецидива заболевания. Последним словом в лечении хронического лейкоза в настоящее время является применение иммунотерапевтических средств — препаратов из группы моноклональных тел. В рутинную клиническую практику прочно вошел ритуксимаб. Данный препарат взаимодействует с антигеном CD20, который ограниченно экспрессируется при хроническом лимфолейкозе, поэтому для эффективного лечения требуется сочетание ритуксимаба с какой-либо из принятых схем химиотерапии, чаще всего с флударабином или COP. Ритуксимаб в монорежиме может применяться как поддерживающая терапия при частичном ответе на лечение.
Перспективным выглядит применение препарата алемтузумаб, который взаимодействует с антигеном CD52. Его также используют как в монорежиме, так и в комбинации с флударабином.
Отдельно хотелось бы упомянуть хронический лимфолейкоз с делецией 17p. Этот подтип лимфолейкоза часто бывает резистентен к стандартным схемам химиотерапии.
Определённые успехи в лечении этого подвида лимфолейкоза достигнуты благодаря применению упомянутого выше алемтузумаба. Кроме того, перспективным средством в этой ситуации является ибрутиниб. В настоящее время этот препарат применяется в монорежиме, сочетание его с различными схемами химиотерапии исследуется; определённое преимущество показала схема, включающая ибрутиниб, ещё одно моноклональное тело — ритуксимаб, и бендамустин.
Лучевая терапия, которая столетие назад была практически единственной возможностью лечения таких больных, и по сей день не утратила актуальности: рекомендуется её проведение в рамках комплексного подхода на область поражённых лимфоузлов, если наблюдается их продолженный рост на фоне стабилизации остальных проявлений заболевания. В этом случае необходимая суммарная доза составляет 20-30 Гр. Также лучевой метод может быть применён при рецидивах заболевания.
В лечении хронического лимфолейкоза нашёл своё место и хирургический метод, заключающийся в удалении поражённой селезёнки. Показаниями к данному вмешательству являются:
- Увеличение селезёнки в сочетании с тяжелой анемией и/или тромбоцитопенией, особенно если наблюдается химиорезистентность,
- Массивное увеличение селезёнки при условии отсутствия ответа на химиотерапию,
- Тяжёлая аутоиммунная анемия и/или тромбоцитопения при резистентности к медикаментозному лечению.
При развитии резистентности к применяемым ранее химиотерапевтическим агентам или же при быстром прогрессировании после проведённого лечения может быть проведена трансплантация костного мозга. Трансплантация костного мозга показана в первой ремиссии пациентам из группы высокого риска, молодым пациентам в отсутствие эффекта от проводимого лечения, пациентам с делецией 17p/мутацией TP53 при наличии прогрессии заболевания. Важно отметить, что после проведённой трансплантации рекомендуется применение ритуксимаба и леналидомида в качестве поддерживающей терапии с целью предотвращения рецидива.
Наконец, пациентам требуется проведение и поддерживающей терапии, которая включает:
- Переливание эритроцитарной массы при анемии;
- Переливание тромбоцитарной массы при кровотечении, вызванном тромбоцитопенией;
- Противомикробные средства при присоединении бактериальной, грибковой или вирусной инфекции, а также для её профилактики;
- Применение преднизолона в дозе 1-2 мг/кг при развитии аутоиммунных процессов.
В случае развития рецидива заболевания тактика лечения зависит от ряда факторов, таких как: проведённая ранее терапия, срок наступления рецидива, клиническая картина. В случае раннего (то есть возникшего в периоде 24 месяцев и ранее) рецидива основным препаратом является ибрутиниб. Он применяется как самостоятельно, так и в составе упомянутой выше схемы лечения (ибрутиниб+ритуксимаб+бендамустин).
Альтернативным препаратом выбора может быть алемтузумаб. Демонстрируя сопоставимую с ибрутинибом эффективность, он, однако, демонстрирует значительно большую токсичность.
Наконец, у ряда пациентов по поводу раннего рецидива хронического лимфолейкоза может быть выполнена трансплантация костного мозга.
В случае позднего (возникшего в срок более 24 месяцев с момента завершения лечения) рецидива основным критерием выбора является проведённая ранняя терапия.
- Если проводимая ранее терапия на основе флударабина не сопровождалась значительной токсичностью, то можно вернуться к этой схеме, а также дополнить её ритуксимабом.
- В случае выявления цитопении возможно применение ритуксимаба в сочетании с высокими дозами глюкокортикостероидов.
- При проведённом ранее лечении хлорамбуцилом показано применение схем с флударабином или сочетанием бендамустина и ритуксимаба.
- Монотерапия ибрутинибом или его сочетание с одной из схем полихимиотерапии также может быть эффективна при рецидиве хронического лимфолейкоза.
Оценка эффективности лечения
Диагностические исследования, направленные на оценку эффекта от проведённого лечения, проводятся не ранее, чем через 2 месяца после окончания последнего курса химиотерапии. Результат может быть оценён следующим образом:
- Полная ремиссия: уменьшение до нормальных размеров печени, селезёнки, лимфоузлов (допустимо их увеличение в размере не более чем 1,5 см), снижение числа лимфоцитов менее 4×10 9 л в периферической крови и менее 30% в костном мозге, повышение числа тромбоцитов более 100×10 9 л, гемоглобина — более 110 гл, нейтрофилов — более 1,54×10 9 л.
- Частичная ремиссия: уменьшение размеров лимфоузлов, печени и селезёнки на 50% и более, снижение количества лимфоцитов в периферической крови на 50%, повышение числа тромбоцитов более 100×10 9 л, гемоглобина — более 110 гл, нейтрофилов — более 1,54×10 9 л или же повышение любого из этих параметров более чем на 50% от исходного уровня.
- Признаками прогрессирования заболевания являются, напротив, увеличение размеров лимфоузлов, печени и селезёнки на 50% и более, а также уменьшение количества тромбоцитов на 50% и более от исходного уровня и уменьшение количества тромбоцитов на 20 гл и более.
Для установления полной ремиссии необходимо соблюдение всех перечисленных критериев, частичной — по крайней мере 2 критерия, касающихся состояния внутренних органов, и минимум одного критерия, касающегося клеточного состава крови.
Следует учитывать, что терапия ибрутинибом может привести к полному ответу со стороны лимфатических узлов и селезёнки, но с сохранением лейкоцитоза в периферической крови. Это состояние обозначается, как частичный ответ с лимфоцитозом.
Прогноз
Значительные успехи в терапии хронического лимфолейкоза позволили сделать это заболевание потенциально излечимым или же достаточно долго поддерживать жизнь человека без прогрессирования основного заболевания с сохранением её качества.
Напротив, без лечения заболевание медленно, но неуклонно прогрессирует, что способно стать причиной гибели пациента спустя несколько лет после дебюта заболевания, поэтому своевременное обращение к врачу и начало адекватной терапии очень важны.
Список литературы:
- Клинические рекомендации по обследованию и лечению больным хроническим лимфолейкозом. Рекомендации Национального Гематологического общества. 2014.
- Волкова М.А. Хронический лимфолейкоз и его лечение. Лечащий врач. 2007, № 4.
- Michael Hallek. Хронический лимфолейкоз. Онкогематология. 2010, том 3, № 1. С. 181-182.
- Федоров А.Б. В-клеточный хронический лимфолейкоз. Клиническая онкогематология. Фундаментальные исследования и клиническая практика. 2008. С.275-277.
- Фиясь А.Т., Френкель Б.И. Хронический лимфолейкоз: диагностика и лечение. Журнал Гродненского государственного медицинского университета. 2011. № 4. С. 93-97.
- Никитин Е.А. Ибрутиниб в лечении хронического лимфолейкоза. Клиническая онкогематология. 2017. 10(3), с. 282-286.
- Кравченко Д.В., Свирновский А.И. Хронический лимфоцитарный лейкоз: клиника, диагностика, лечение. Практическое пособие для врачей. Гомель, 2017.
Источник