Кровь лимфа регенерация крови
Физиологическая регенерация крови (постэмбриональный гемоцитопоэз). В красном костном мозге (ККМ) образуются эритроциты, гранулоциты, моноциты, В-лимфоциты, предшественники Т-лимфоцитов, естественные (натуральные) киллеры (NK).
В тимусе происходит образование Т-лимфоцитов из костномозговых предшественников, их антигеннезависимая пролиферация и селекция.
В селезенке, лимфатических узлах и лимфоидных фолликулах, ассоциированных со слизистыми оболочками пищеварительного тракта, дыхательной системы и других органов, происходит антигензависимая пролиферация и дифференциация субпопуляций лимфоцитов.
Еще в 1908 г. А. А. Максимов высказал предположение о существовании единой клетки – родоначальницы всех популяций клеток крови и лимфы, но лишь только в 1961 году (J. E. Till a. E. A. McCulloch) были получены достоверные доказательства существования такой клетки, которая получила название стволовой клетки крови (СКК).
Стволовые клетки крови представляют собой своеобразный «золотой неприкосновенный запас» кроветворных органов, который расходуется только в особых случаях. На каждые 1000 ядросодержащих клеток красного костного мозга приходится одна стволовая клетка крови. В периферической крови СКК составляют 0,1% от общего количества клеток крови. Морфология СКК весьма напоминает лимфоциты (диаметр 8-10 мкм) и на светооптическом уровне их нельзя идентифицировать среди лимфоцитов. СКК относительно редко делятся, в среднем 1 раз за 10 сут. Они являются более радиорезистентными по сравнению с их потомками. Они более устойчивы к действию цитостатиков.
С возрастом общее количество СКК не меняется. Процесс преобразования СКК в зрелые форменные элементы крови и лимфы состоит из пролиферации, дифференцировки и созревания. На каждом из этих этапов происходит экспрессия генов, ответственных за синтез специфических белков, характерных для тех или иных клеточных субпопуляций. Так, в клетках эритробластического ряда синтезируется и постепенно накапливается гемоглобин, в зернистых лейкоцитах – целый набор гидролитических ферментов и других биологически активных веществ и т. д.
Гемоцитопоэз регулируется ростовыми факторами, кейлонами, гормонами, метаболитами и др. При этом среди регуляторов гемоцитопоэза имеются как стимуляторы, так и ингибиторы.
В настоящее время широкое распространение получила схема кроветворения, предложенная И. Л.Чертковым и А. И.Воробьевым, согласно которой кроветворные клетки разделены на 6 классов (компартментов) (табл. 3).
К I классу относятся полипотентные СКК;
II класс составляют коммитированные (полустволовые клетки – ПСК), частично детерминированные клетки-предшественницы лимфопоэза и миелопоэза;
III класс – унипотентные предшественники, колониеобразующие единицы (КОЕ);
IV класс – бласты;
V класс – дифференцирующиеся (созревающие) клетки;
VI класс – дифференцированные (зрелые) клетки.
Если полипотентные клетки могут давать начало всем видам клеток крови, то из унипотентных клеток-предшественниц образуется только один конкретный вид (компартмент) созревающих (Класс V) и зрелых (класс VI) клеток (см. табл. 3). Зрелые клетки представляют последний компартмент.
Клетки V и VI классов (компартментов) в отличие от предыдущих можно морфологически идентифицировать.
Дифференцировка полипотентных и мультипотентных клеток в унипотентные клетки происходит под влиянием специфических факторов – эритропоэтинов (для эритробластов), гранулопоэтинов (для миелобластов), лимфопоэтинов (для лимфобластов), тромбопоэтинов (для мегакариобластов).
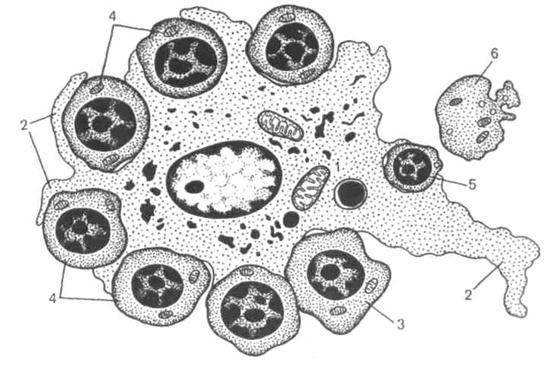
Процесс образования эритроцитов из стволовой клетки в красном костном мозге осуществляется в особых морфофункциональных ассоциациях, которые называются эритробластическими островками (рис. 9).
Таблица 3. Схема кроветворения | ||||||||
I. стволовая клетка Крови | СКК | |||||||
II. полустволовые частично детерминиро-ванные Клетки | КОЕ-ГЭММ | КОЕ-Лимф | ||||||
КОЕ-ГМ | КОЕ-Мгц-Эр; КОЕ-Гн-Эр | |||||||
III. унипотентные предшествен-ники | КОЕ-М | КОЕ-Б | КОЕ-Эо | КОЕ-Н | КОЕ-Эр | КОЕ-Мгц | Пре-Т-лимф | Пре-В-лимф |
IV. бласты | Моно-бласт | Базофиль-ный миелобласт | Эозинофиль-ный миелобласт | Нейтрофиль-ный миелобласт | Проэритро-бласт | Мегакарио-бласт | Т-лимфо-бласт | В-лимфо-бласт |
V. дифференцирующиеся клетки (созревающие) | Промоноцит | Базфиль-ный промиело-цит | Эозинофиль-ный промиело-цит | Нейтрофиль-ный промиело-цит | Базофильный эритробласт | Промега-кариоцит | Т-пролим-фоцит | В-пролимфоцит |
Базофиль-ный миелоцит | Эозинофиль-ный миелоцит | Нейтрофиль-ный миелоцит | Полихромато-фильный эритробласт | |||||
Базофиль-ный метамиело-цит | Эозинофиль-ный метамиело-цит | Нейтрофиль-ный метамиело-цит | Оксифильный эритробласт | |||||
Палочко-ядерный базофил | Палочко-ядерный зозинофил | Палочко-ядерный нейтрофил | Ретикулоцит | Мегакарио-цит | ||||
VI. дифференцированные клетки (зрелые) | Моно-цит | Сегменто-ядерный базофил | Сегменто-ядерный эозинофил | Сегменто-ядерный нейтрофил | Эритроцит | Тромбоцит | Т-лимфо-цит | В-лимфоцит ↓ Плазмо-цит |
СКК – стволовая клетка крови; КОЕ-ГЭММ – колониеобразующая единица гранулоцитов, эритроцитов, моноцитов, мегакариоцитов; КОЕ-ГМ – колониеобразующая единица гранулоцитов и моноцитов; КОЕ-Мгц-Эр – колониеобразующая единица мегакариоцитов и эритроцитов; КОЕ-Гн-Эр – колониеобразующая единица гранулоцитов и эритроцитов; КОЕ-Эр – колониеобразующая единица эритроцитов; КОЕ-Мгц – колониеобразующая единица мегакариоцитов; КОЕ-М – колониеобразующая единица моноцитов; КОЕ-Б – колониеобразующая единица базофилов; КОЕ-Эо – колониеобразующая единица эозинофилов; КОЕ-Н – колониеобразующая единица нейтрофилов; КОЕ-Лимф – колониеобразующая единица лимфоцитов (Т и В); пре-Т-лимф – клетка-предшественница Т-лимфоцитов; пре-В-лимф – клетка-предшественница В-лимфоцитов.

Рис. 9. Схема строения эритробластического островка (по М. Бесси).
1 – макрофаг; 2 – отросток макрофага; 3 – базофильные эритробласты; 4 – полихроматофильные эритробласты; 5 – эозинофильный эритробласт; 6 – ретикулоцит.
В центре такого островка находится макрофаг, вокруг которого с помощью специальных рецепторов – сиалоадгезинов удерживаются эритроидные клетки, дифференцирующиеся из унипотентной КОЕ-Э.
Источник
Регенерация клеток крови
План
1. Регенерация
2. Виды регенерации:
физиологическая, репаративная (полная,
неполная) и патологическая.
3. Регенерация
крови
4. Количественные
и качественные изменения эритроцитов
5. Изменения
количества гемоглобина
Регенерация (от лат. regeneratio – возрождение)
– восстановление (возмещение) структурных
элементов ткани взамен погибших. В биологическом
смысле регенерация представляет собой приспособительный процесс, выработанный
в ходе эволюции и присущий всему живому.
В жизнедеятельности организма каждое
функциональное отправление требует затрат
материального субстрата и его восстановления.
Следовательно, при регенерации происходит самовоспроизведение
живой материи, причем это самовоспроизведение
живого отражает принцип ауторегуляции и автоматизации жизненных отправлений
Регенераторное
восстановление структуры может
происходить на разных уровнях – молекулярном,
субклеточном, клеточном, тканевом и
органном, однако всегда речь идет о
возмещении структуры, которая способна
выполнять специализированную функцию.
Регенерация – это восстановление как структуры, так и
функции. Значение регенераторного
процесса – в материальном обеспечении
гомеостаза.
Различают три вида регенерации:
физиологическую, репаративную и патологическую.
Физиологическая регенерация совершается
в течение всей жизни и характеризуется
постоянным обновлением клеток, волокнистых
структур, основного вещества соединительной
ткани. Нет таких структур, которые не
подвергались бы физиологической регенерации.
Там, где доминирует клеточная форма регенерации,
имеет место обновление клеток. Так происходит
постоянная смена покровного эпителия
кожи и слизистых оболочек, секреторного
эпителия экзокринных желез, клеток, выстилающих
серозные и синовиальные оболочки, клеточных
элементов соединительной ткани, эритроцитов,
лейкоцитов и тромбоцитов крови и т.д.
В тканях и
органах, где клеточная форма
регенерации утрачена, например в сердце,
головном мозге, происходит обновление
внутриклеточных структур. Наряду с обновлением
клеток и субклеточных структур постоянно
совершается биохимическая регенерация, т.е. обновление
молекулярного состава всех компонентов
тела.
Репаративная или восстановительная
регенерация наблюдается при различных
патологических процессах, ведущих к повреждению
клеток и тканей. Механизмы репаративной
и физиологической регенерации едины,
репаративная регенерация – это усиленная
физиологическая регенерация. Однако
в связи с тем, что репаративная регенерация
побуждается патологическими процессами,
она имеет качественные морфологические
отличия от физиологической. Репаративная
регенерация может быть полной и неполной.
Полная регенерация, или реституция, характеризуется возмещением
дефекта тканью, которая идентична погибшей.
Она развивается преимущественно в тканях,
где преобладает
клеточная регенерация. Так, в соединительной
ткани, костях, коже и слизистых оболочках
даже относительно крупные дефекты органа
могут путем деления клеток замещаться
тканью, идентичной погибшей.
При неполной регенерации, или субституции, дефект замещается соединительной
тканью, рубцом. Субституция характерна
для органов и тканей, в которых преобладает
внутриклеточная форма регенерации, либо
она сочетается с клеточной регенерацией.
Поскольку при регенерации происходит
восстановление структуры, способной
к выполнению специализированной функции,
смысл неполной регенерации не в замещении
дефекта рубцом, а вкомпенсаторной гиперплазии элементов
оставшейся специализированной ткани,
масса которой увеличивается, т.е. происходит гипертрофия ткани.
О патологической регенерации говорят
в тех случаях, когда в результате тех
или иных причин имеется извращение регенераторного процесса,
нарушение смены фаз пролиферации
и дифференцировки. Патологическая регенерация
проявляется в избыточном или недостаточном
образовании регенерирующей ткани (гипер- или гипорегенерация), а также в превращении
в ходе регенерации одного вида ткани
в другой. Примерами могут служить гиперпродукция
соединительной ткани с образованием келоида, избыточная
регенерация периферических нервов и
избыточное образование костной мозоли
при срастании перелома, вялое заживление
ран и метаплазия эпителия в очаге хронического
воспаления. Патологическая регенерация
обычно развивается при нарушениях общих и местных условий регенерации (нарушение
иннервации, белковое и витаминное голодание,
хроническое воспаление и т.д.).
Репаративная
регенерация крови отличается от физиологической
прежде всего своей большей интенсивностью.
При этом активный красный костный мозг
появляется в длинных трубчатых костях
на месте жирового костного мозга (миелоидное
превращение жирового костного мозга).
Жировые клетки вытесняются растущими
островками кроветворной ткани, которая
заполняет костномозговой канал и выглядит
сочной, темнокрасной. Кроме того, кроветворение
начинает происходить вне костного мозга
-внекостномозговое, или экстрамедуллярное,
кроветворение. Очаги экстрамедуллярного
(гетеротопического) кроветворения в результате
выселения из костного мозга стволовых
клеток появляются во многих органах и
тканях – селезенке, печени, лимфатических
узлах, слизистых оболочках, жировой клетчатке
и т.д.
Регенерация
крови может быть резко угнетена (например,
при лучевой болезни, апластической анемии,
алейкии, агранулоцитозе) или извращена (например, при
злокачественной анемии, полицитемии,
лейкозе). В кровь при этом поступают незрелые,
функционально неполноценные и быстро
разрушающиеся форменные элементы. В таких
случаях говорят о патологической регенерации крови.
Регенерация кровеносных и лимфатических
сосудов протекает неоднозначно в
зависимости от их калибра.
Микрососуды обладают
большей способностью регенерировать,
чем крупные сосуды. Новообразование микрососудов
может происходить путем почкования или
аутогенно. При регенерации сосудов путем почкования, в их стенке появляются
боковые выпячивания за счет усиленно
делящихся эндотелиальных клеток (ангиобласты).
Образуются тяжи из эндотелия, в которых
возникают просветы и в них поступает
кровь или лимфа из «материнского» сосуда.
Другие элементы: сосудистой стенки образуются
за счет дифференцировки эндотелия и окружающих
сосуд соединительнотканных клеток, В
сосудистую стенку врастают нервные волокна
из предсуществующих нервов. Аутогенное новообразование сосудов
состоит в том, что в соединительной ткани
появляются очаги недифференцированных
клеток. В этих очагах возникают щели,
в которые открываются предсуществующие
капилляры и изливается кровь. Молодые
клетки соединительной ткани, дифференцируясь,
образуют эндотелиальную выстилку и другие
элементы стенки сосуда.
Регенерация сосудов путем почкования
Крупные сосуды не обладают
достаточными пластическими свойствами.
Поэтому при повреждении их стенки восстанавливаются
лишь структуры внутренней оболочки, ее
эндотелиальная выстилка; элементы средней
и наружной оболочек обычно замещаются
соединительной тканью, что ведет нередко
к сужению или облитерации просвета сосуда.
Изменения красной крови могут
быть количественными и качественными.
К первым относятся изменения в общем
количестве эритроцитов и в содержании
гемоглобина. Вторые касаются величины
эритроцитов, формы, наличия в них ядра
и его остатков, отношения их к окраске.
Количественные и качественные
изменения эритроцитов
У здоровых людей
количество образующихся в костном
мозге эритроцитов равно числу
выходящих из циркуляции (гемолизирующихся)
клеток, в связи с чем уровень их в крови
практически постоянен. При различных
заболеваних эритроцитарный баланс может
нарушаться, что приводит к увеличению
числа эритроцитов в крови (эритроцитозу)
или к его уменьшению (анемии).
При анемиях
в периферической крови на фиксированных
или суправитально окрашенных мазках
могут встречаться эритроциты и эритроидные
формы костного мозга, не выделяемые у
здоровых людей. Появление их свидетельствует
либо о компенсаторных усилиях эритропоэза
или о нарушении созревания клеток эритроидного
ряда в костном мозге (регенеративные
формы эритроцитов), либо о дегенеративных
изменениях эритроцитов, возникающих
при действии на организм повреждающих
факторов в результате извращения эритропоэза
(дегенеративные формы эритроцитов).
К группе регенеративных
форм эритроцитов относят незрелые
формы эритропоэза — ядросодержащие
эритроциты (нормобласты, мегалобласты),
эритроциты с остатками ядерной субстанции
(тельца Жолли, кольца Кебота, азурофильная
зернистость, азурофильная штрихованность).
Цитоплазматическую природу (остатки
базофиль-ной субстанции) имеют полихроматофильные
эритроциты, ретику-лоциты (выявляются
на суправитально окрашенных препаратах),
базофильная зернистость эритроцитов.
К группе дегенеративных
форм эритроцитов относят клетки
с измененной величиной (анизоцитоз),
с измененной формой (пойкилоцитоз), различным
содержанием гемоглобина в эритроцитах
(анизохромия), гемоглобулиновую дегенерацию
Эрлиха, вакуолизацию эритроцитов; на
суправитально окрашенных мазках в эритроцитах
обнаруживаются тельца Гейнца, а также
иссиня-темные эритроциты — дегенеративная
полихромазия.
Анизоцитоз — наличие в крови эритроцитов
различной величины: нормоцитов (7,0-8,0 мкм),
микроцитов (6,9-5,7 мкм), макроцитов (8,1-9,35
мкм), мегалоцитов (10-15 мкм).
Пойкилоцитоз — наличие на мазках
крови эритроцитов различной формы: вытянутой,
грушевидной, овальной, веретеновидной
и др.
Анизохромия — появление гипохромных
и гиперхромных эритроцитов.
Гемоглобиновая дегенерация Эрлиха
— неравномерное распределение гемоглобина
в эритроцитах в результате его коагуляции.
Тельца Гейнца
субстанционально тождественны гемоглобиновой
дегенерации Эрлиха, но выявляются в виде
2-3 голубых телец при суправитальной окраске
мазков крови.
Изменения количества гемоглобина
В норме гемоглобина
содержится в крови около 15г на
100 см3 крови, и это количество для
клинических определений принимается
за 100%. Таким образом, проценты гемоглобина
соответствуют определенному количеству
его (1% = 0,15 г, 10% = 1,5 г). Физиологические
колебания в содержании гемоглобина
происходят в общем параллельно колебаниям
количества эритроцитов. Таковы колебания,
связанные с полом и конституциональным
типом. У женщин гемоглобина процентов
на 10 меньше, чем у мужчин. Если у нормостеников
среднее содержание гемоглобина в крови
принять за 100, то у гиперстеников оно будет
110, а у астеников 90.
В патологических
случаях увеличение и уменьшение
количества гемоглобина обычно идет
также параллельно количеству эритроцитов.
Но не всегда: в одних случаях
наблюдается большее или меньшее
отставание гемоглобина от количества
эритроцитов при хлорозе, так называемых
вторичных анемиях, кровопотерях (выработка
костным мозгом бедных гемоглобином эритроцитов),
в других, наоборот, относительное преобладание
количества гемоглобина над числом эритроцитов
при злокачественном малокровии (в связи
с большей величиной эритроцитов).
Поэтому большое
значение приобретает определение
так называемого цветового показателя,
показывающего среднее содержание
гемоглобина в каждом отдельном
эритроците (смотрите Исследование крови).
В норме и в тех случаях,
когда число эритроцитов и
содержание гемоглобина в единице
объема изменяются параллельно, этот показатель
равен 1. Если содержание гемоглобина
ненормально низко, то цветовой показатель
ниже 1. Анемии с таким показателем
называются гипохромными. При несоответственно
(количеству эритроцитов) высоком содержании
гемоглобина цветовой показатель выше
1 (например 1,3 – 1,7). Анемии с таким показателем
называются гиперхромными (злокачественное
малокровие, конституциональная гемолитическая
анемия).
Литература:
1. А. И. Струков,
В. В. Серов. Патологическая
анатомия.
2. А. И. Березнякова,
В.М. Кузнецова, Н. И. Филимонова, М. Е. Березнякова,
И. Ю. Тищенко. Патологическая физиология.
3.https://www.blackpantera.ru/diagnostika/15730/
Источник