Контроль иммунного ответа т лимфоцитами
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Пандемия COVID-19 продолжается и усиливается. Все больше людей в мире встречается с данным вирусом. Уже давно стало понятно, что SARS-CoV-2 не исчезнет из человеческой популяции. Вероятность встречи с ним возрастает для каждого.
Тем не менее, многие люди, неоднократно и длительно контактировавшие с заболевшими COVID-19 – сами не заболевают, никаких клинических симптомов не появляется. Почему так происходит – один из самых насущных вопросов на всех уровнях попыток понимания текущей пандемии, от бытового до научно-медицинского.
Наиболее вероятный ответ на него – особенности иммунного ответа части населения. В предыдущих публикациях описывались варианты протекания инфекционного процесса при COVID-19, механизмы и сроки антителообразования В-лимфоцитами, с учетом того, что известно про эту инфекцию на данном этапе ее изучения. Однако, «не антителами едиными жив наш иммунитет…». В механизмах специфического иммунного ответа на патогены выделяют гуморальный иммунный ответ (опосредуемый присутствующими в плазме крови антителами) и клеточный иммунный ответ (опосредуемый клетками иммунной системы без участия антител). Клеточное звено иммунной системы (прежде всего, Т-клеточное звено) также играет немаловажную роль в появлении резистентности макроорганизма к той или иной инфекции. Как «вырисовывается» понимание – к COVID-19 тоже.
Т-клеточное звено состоит из различных пулов Т-лимфоцитов (обозначаемых общепринятой в иммунологии для указания их характерных маркеров аббревиатурой CD и цифрой/числом – CD-3, CD-4, CD-8, CD-16 и другие). Если ОЧЕНЬ упрощенно, то основные задачи Т-клеточного звена:
Опознать и изучить антиген – передать информацию о нем другим звеньям иммунной системы – уничтожить антиген – запомнить его.
У части людей, в силу особенностей иммунитета (а также, видимо, при инфицировании низкой дозой возбудителя), Т-клеточное звено элиминирует вирус из организма без значимой активации В-клеточного звена, то есть – с низким уровнем антителообразования, нередко не детектируемым (не определяемым) рутинными лабораторными методами. При этом, клинических симптомов часто не развивается. Иными словами, человек может перенести инфекционный процесс без развития болезни, уровень антител у него не определяется, но организм приобретает защиту от повторного заражения. Насколько стойкую и долгую – вопрос остается открытым.
Однако, недавние, достаточно объемные исследования группы ученых из нескольких стран выявили:
- Образование устойчивого Т-клеточного ответа на SARS-CoV-2 у большинства пациентов, встречавшихся с данным вирусом
- При этом у части пациентов, никогда не встречавшихся с SARS-CoV-2 – уже имеются Т-лимфоциты, реагирующие на данный вирус и элиминирующие его из организма.
До конца данный феномен пока не изучен, но наиболее вероятной является теория о том, что Т-лимфоциты у данных пациентов перекрестно активированы предыдущим воздействием широко циркулирующих в популяции «простудных» коронавирусов.
Подробнее –
здесь.
То есть: у части людей есть приобретенная невосприимчивость к SARS-CoV-2, обусловленная, вероятнее всего Т-клетками, которые ранее «активировались» другими коронавирусами и сохранили иммунологическую память.
Данное утверждение сложно проверить массовым лабораторным скринингом. Изучение Т-клеточного ответа к инфекциям – достаточно трудоемкий процесс и чаще удел специализированных научно-исследовательских лабораторий. Однако, уже опубликованные результаты и продолжающиеся работы по изучению Т-клеточного иммунитета при COVID-19 – дают определенную почву для осторожного оптимизма.
А.С. Поздняков, к.м.н.,
инфекционист, главный врач ООО «Инвитро-Сибирь»
Статистика INVITRO по пациентам с выявленными антителами к коронавирусу
Анализы для выявления антител в организме
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Информация проверена экспертом

Лишова Екатерина Александровна
Высшее медицинское образование, опыт работы – 19 лет
Источник
Т-клетки это фактически приобретенный иммунитет, способный защитить от цитотоксического повреждающего воздействия на организм. Чужеродные клетки-агрессоры, попадая в организм вносят “хаос”, который внешне проявляется в симптомах заболеваний.
Клетки-агрессоры повреждают по ходу своей деятельности в организме все, что могут, действуя в своих интересах. А задача иммунной системы найти и уничтожить все чуждые элементы.
Специфическая защита организма от биологической агрессии (чужеродных молекул, клеток, токсинов, бактерий, вирусов, грибов и т.д.) осуществляется при помощи двух механизмов:
- продуцирования специфических антител в ответ на чужеродные антигены (потенциально опасных для организма веществ);
- выработки клеточных факторов приобретённого иммунитета (Т-клетки).
Как осуществляются иммунные реакции
При попадании в организм человека «клетки-агрессора», иммунная система распознаёт чужеродные и собственные измененные макромолекулы (антигены) и удаляет их из организма. Также при первичном контакте с новыми антигенами происходит их запоминание, что способствует их более быстрому удалению, в случае вторичного попадания в организм.
Процесс запоминания (презентация) происходит благодаря антиген-распознающим рецепторам клеток и работе антиген представляющих молекул (МНС молекул- комплексов гистосовместимости).
Что такое Т-клетки иммунной системы, и какие функции они выполняют
Функционирование иммунной системы обуславливается работой лимфоцитов. Это клетки иммунной системы, являющиеся
разновидностью лейкоцитов и способствующие формированию приобретённого иммунитета. Среди них выделяют:
- В-клетки (распознающие «агрессора» и вырабатывающие к нему антитела);
- Т-клетки (выполняющие функцию регулятора клеточного иммунитета);
- NК- клетки (разрушающие отмеченные антителами чужеродные структуры).
Однако, помимо регуляции иммунного ответа, Т-лимфоциты способны выполнять эффекторную функцию, разрушая опухолевые, мутировавшие и чужеродные клетки, участвовать в формировании иммунологической памяти, распознавать антигены и индуцировать иммунные реакции.
Справочно. Важной особенностью T-клеток является их способность реагировать только на презентированные антигены. На одном T-лимфоците находится только один рецептор к одному конкретному антигену. Это обеспечивает отсутствие реакции T-клеток на собственные аутоантигены организма.
Разнообразие функций Т-лимфоцитов обусловлено наличием в них субпопуляций, представленных Т-хелперами, Т-киллерами и Т-супрессорами.
Субпопуляция клеток, их стадия дифференцирования (развития), степень зрелости и т.д. определяется при помощи специальных кластеров дифференцировки, обозначаемых как СD. Наиболее значимыми являются СD3, СD4 и СD8:
- СD3 находится на всех зрелых T-лимфоцитах, он способствует передаче сигнала от рецептора к цитоплазме. Это важный маркер функционирования лимфоцитов.
- СD8 – это маркер цитотоксических T-клеток.
- СD4 является маркером T-хелперов и рецептором к ВИЧ (вирус иммунодефицита человека)
Т-хелперы
Около половины Т-лимфоцитов имеют антиген CD4, то есть являются Т-хелперами. Это помощники, стимулирующие процесс секреции антител В-лимфоцитами, стимулируют работу моноцитов, тучных клеток и предшественников Т-киллеров к «включению» в иммунную реакцию.
Справочно. Функция хелперов осуществляется за счёт синтеза цитокинов (информационных молекул, регулирующих взаимодействие между клетками).
В зависимости от продуцируемого цитокина, их разделяют на:
- T-хелперные клетки 1-го класса (продуцируют интерлейкин-2 и гамма-интерферон, обеспечивая гуморальный иммунный ответ на вирусы, бактерии, опухоли и трансплантанты).
- T-хелперные клетки 2-го класса (секретируют интерлейкины-4,-5,-10,-13 и отвечают за образование IgЕ, а также иммунного ответа, направленного на внеклеточные бактерии).
Т-хелперы 1-го и 2-го типа всегда взаимодействуют антагонистически, то есть повышенная активность первого типа угнетает функцию второго типа и наоборот.
Работа хелперов обеспечивает взаимодействие между всеми клетками иммунитета, определяя какой тип иммунного ответа будет преобладать (клеточный либо гуморальный).
Важно. Нарушение работы клеток-помощников, а именно недостаточность их функции, наблюдается у больных с приобретённым иммунодефицитом. Т-хелперы являются основной мишенью ВИЧ. В результате их гибели нарушается иммунная реакция организма на стимуляцию антигенов, что приводит к развитию тяжёлых инфекций, росту онкологических новообразований и летальному исходу.
Т-киллеры
Это так называемые T-эффекторы (цитотоксические клетки) или клетки убийцы. Такое название обусловлено их способностью уничтожать клетки-мишени. Осуществляя лизирование (ли́зис (от греч. λύσις — разделение) — растворение клеток и их систем) мишеней, переносящих чужеродный антиген или мутировавший аутоантиген (трансплантанты, опухолевые клетки), они обеспечивают реакции противоопухолевой защиты, трансплантационного и противовирусного иммунитета, а также аутоиммунные реакции.
Т-киллеры при помощи собственных МНС-молекул распознают чужеродный антиген. Связываясь с ним на поверхности клетки, они продуцируют перфорин (цитотоксический белок).
После лизирования клетки «агрессора» Т-киллеры остаются жизнеспособными и продолжают циркулировать в крови, разрушая чужеродные антигены.
Т-киллеры составляют до 25-ти процентов от всех Т-лимфоциотов.
Справочно. Помимо обеспечения реакций нормального иммунного ответа, Т-эффекторы могут участвовать в реакциях антителозависимой клеточной цитотоксичности, способствуя развитию гиперчувствительности второго типа (цитотоксической).
Это может проявляться лекарственными аллергиями и различными аутоиммунными заболеваниями (системные заболевания соединительной ткани, гемолитическая анемия аутоиммунного характера, злокачественная миастения, аутоиммунные тиреоидиты, и т.д.).
Подобным механизмом действия обладают некоторые лекарственные средства, способные запускать процессы некроза опухолевых клеток.
Важно. Препараты с цитотоксическим действием используют в химиотерапии онкологических заболеваний.
Например, к таким медикаментам относится Хлорбутин. Это средство применяют для лечения хронического лимфолейкоза, лимфогранулематоза и рака яичников.
Т-супрессоры и клетки памяти
Супрессоры подавляют функцию хелперов и В-лимфоцитарного звена. Однако современная классификация не выносит супрессоры в отдельную субпопуляцию. Поскольку доказано, что решающую роль в угнетении иммунной реакции играют апоптоз и специфические цитокины.
Помимо основных T-лимфоцитов, в организме человека существуют потомки клеток, контактировавших с антигеном и имеющих к нему рецепторы. Это клетки обеспечивающие иммунологическую память. Они способны в течение от десяти до 15 лет сохранять память об антигене, передавая её другим клеткам.
Справочно. Благодаря клеткам памяти обеспечивается быстрый иммунный ответ при повторном попадании «агрессора» в организм.
Нулевые лимфоциты
К ним относят лимфоциты, не имеющие T и B маркеров. Они составляют до 10% от всей популяции лимфоцитов. К ним относят NК-клетки (естественные киллеры) и K-клетки (киллерные).
Справочно. Основным отличием NK-клеток от T-киллеров является способность уничтожать не сенсибиллизированные клетки-мишени.
K-клетки отвечают за антителозависимую клеточную цитотоксичность. Они отражают взаимодействия гуморального и клеточного звеньев иммунитета, а также выступают в качестве «наводчиков» эффекторных (выполняющих функцию – в данном случае уничтожение) клеток на мишень.
NК- клетки обеспечивают контроль за качеством клеток и участвуют в формировании противовирусного иммунитета, обеспечиваютзащиту от роста опухолей и размножения мутировавших (дефектных) клеток.
Диагностика клеточного иммунитета
Диагностика T- и B-лимфоцитарного звена позволяет оценить состояние клеточного иммунитета. Базовое исследование с определением процентного содержания Т-, В- и нулевых клеток проводится с целью выявления первичных или вторичных иммунодефицитов, а также при контроле иммуностимулирующего лечения.
Исследование основных популяций при помощи маркеров CD3, 8, 19, 16+5б, а также соотношение между хелперами и киллерами, позволяет комплексно оценить иммунный статус. Для исследования используют венозную кровь.
Диагностика проводится при выявлении и контроле течения:
- аутоиммунных заболеваний (увеличено содержание CD3, CD4 хелперов);
- лимфолейкозов (повышено количество Т-лимфоцитов CD3);
- злокачественных новообразований (увеличено количество NK);
- ВИЧ (CD3, CD8);
- хронических инфекций, аллергических реакций, бронхиальной астмы и т.д.
Справочно. В зависимости от результатов анализа пациенту может быть рекомендована консультация иммунолога, гематолога, аллерголога, онколога или инфекциониста. С дальнейшим лечением у профильного специалиста по основному заболеванию.
Источник
Специалисты НМИЦ гематологии создают тест, чтобы выявлять Т-клетки, защищающие от COVID-19 даже при отсутствии антител. Технология позволит подтверждать перенесенную коронавирусную инфекцию в спорных случаях и будет использована для оценки эффективности вакцинации от COVID-19. В Национальной медицинском исследовательском центре МедПорталу рассказали об особенностях разработки.
Антитела исчезают, Т-клетки остаются
Т-клетки (Т-лимфоциты) хранят информацию о ранее выявленных иммунной системой в организме антигенах и формируют долговременный иммунитет к перенесенным инфекционным заболеваниям. Из разных стран поступают сообщения о том, что Т-клетки, специфичные к SARS-Cov-2, есть даже у людей, которые перенесли инфекцию бессимптомно и не выработали антитела. Ученые НМИЦ гематологии выяснили, что Т-клетки, которые «узнают» коронавирус, обнаруживаются даже в образцах крови, взятых еще до пандемии. Этот феномен исследователи объясняют перекрестным иммунитетом, вызванным ранее перенесенными коронавирусными инфекциями.
«Мы получаем все больше сведений, что Т-клетки, как минимум, не менее важный защитный механизм против COVID-19, чем антитела. Это подтверждается тем, что у многих, особенно легко и бессимптомно переболевших, не вырабатываются антитела, а Т-клетки присутствуют. Исследования показывают, что уже через полгода у значительной части переболевших количество антител сильно снижается, а у некоторых они и вовсе исчезают. Т-клеточный ответ потенциально сохраняется гораздо дольше», – сообщил МедПорталу сотрудник лаборатории трансплантационной иммунологии НМИЦ гематологии Алексей Титов.
Массово протестировать людей на Т-клеточный иммунитет пока технически невозможно: такие исследования проводятся только в специализированных лабораториях практически вручную. Специалисты НМИЦ-гематологии работают над созданием тестов на Т-клетки, которые позволят выявлять переболевших на более длительной временной дистанции, чем антитела.
«Технология основана на зарекомендовавшем себя методе выявления реагирующих на вирус Т-клеток, однако нашим ноу-хау является конкретный набор фрагментов коронавирусных белков, который мы тщательно отбираем, отсекая те, что могут дать ложно-позитивную реакцию Т-клеток, – рассказал Алексей Титов, – Эти тесты смогут в спорных случаях подтвердить факт прошлой коронавирусной инфекции, а также использоваться для оценки эффективности вакцинации».
Как найти «границу» Т-клеточного иммунного ответа
В своей работе ученые опираются на единственное на сегодняшний день длительное проспективное наблюдение за людьми с Т-клеточным иммунитетом, результаты которого представила британская компания Oxford Immunotech. Она разрабатывает схожую тест-систему, которая отличается от ноу-хау НМИЦ гематологии набором фрагментов вируса, на которые детектируется ответ. Ученые Oxford Immunotech в течение четырех месяцев отслеживали состояние здоровья добровольцев, которых протестировали на наличие Т-клеточного ответа SARS CoV-2. В выборке пациентов с низким уровнем Т-лимфоцитов заболело около 1%, в то время как высокий Т-клеточный ответ обеспечил надежную защиту: в этой группе не заболел никто, при том, что антитела к SARS CoV-2 были далеко не у всех. Это позволяет надеяться, что часть людей из группы с высоким Т-клеточным ответом, которые ранее не болели, не заболеет COVID-19 и в будущем.
«В перспективе мы сможем установить «границу» Т-клеточного ответа, при пересечении которой, человек, скорее всего, не заболеет. А для тех, кто ее не пересек, возможно, болезнь будет протекать легче. Но для того, чтобы провести такие исследования, требуется время», – отметил Алексей Титов.
Ученые НМИЦ гематологии планируют завершить разработку теста уже зимой 2021 года. В ближайшее время он будет использоваться только в исследовательских целях. Однако на основе той же технологии работают некоторые тесты на латентный туберкулез (Т-спот), поэтому не исключено, что как минимум те же лаборатории, которые предоставляют такую услугу, смогут проводить тестирование.
Разработкой теста на определение Т-клеточного иммунитета занимается, например, компания Adaptive Biotechnologies в США. В основе их технологии лежит совсем другой принцип, чем в разработке НМИЦ гематологии: американцы намерены выявлять Т-клетки, специфичные к вирусу по присущим им уникальным молекулам. Какой из подходов окажется более совершенным, покажет время, считает Титов.
Источник
С помощью технологии отключения (нокаута) генов показано, что для реализации иммунного ответа необходимо функционирование большого числа генов. О том же свидетельствуют данные оценки экспрессии генов при активации клеток иммунной системы — в этом процессе участвуют сотни генов. Генетический контроль в более узком смысле подразумевает возможность варьирования выраженности различных звеньев иммунного ответа в зависимости от аллельных форм тех или иных генов. Наибольшее внимание уделяют двум направлениям изучения генетического контроля иммунных процессов — анализу генетических основ контроля иммунного ответа безотносительно к его специфичности и в зависимости от специфичности вызывающих его антигенов.
Исследования в первом направлении крайне немногочисленны. В этом русле проведены работы по выведению линий мышей с высоким и низким уровнем отвечаемости на антигены (линии Biozzi). Они были получены путем инбридинга мышей с высоким или низким уровнем гуморального иммунного ответа на эритроциты барана. Такой отбор привел к созданию линий с различной конституцией иммунной системы, причем оппозитный уровень иммунного ответа наблюдали при иммунизации не только эритроцитами барана, но и многими другими антигенами, включая тимусне- зависимые (например, бактериальные эндотоксины). В формирование этих альтернативных типов иммунореактивности оказалось вовлечено более 10 генов, в том числе С-гены иммуноглоублинов и некоторые гены, контролирующие активность макрофагов. У мышей этих линий с уровнем антителообразования коррелирует концентрация сывороточных ^М и IgG, степень ее нарастания при иммунном ответе и интенсивность пролиферативного ответа В-лимфоцитов на стимуляцию митогенами и антигенами. В то же время не найдено соответствия уровня гуморального иммунного ответа мышей этих линий и различных характеристик Т-лимфоцитов. В отношении макрофагов были получены неожиданные данные: высокому уровню иммунного ответа соответствовала способность макрофагов подавлять размножение фагоцитированных листерий, но в то же время — низкая способность презентировать антигены Т-хелперам. Высокая резистентность к инфицированию сальмонеллами и листериями сочеталась с низким уровнем антителообразования. Вероятно, в данном случае проявляется оппозит- ный характер Th1- и ^2-зависимых форм иммунного ответа.
Значительно полнее разработана вторая линия исследований — изучение генетической детерминации уровня иммунного ответа на конкретные антигенные эпитопы. Главные результаты в этой области получены при изучении ответа мышей и морских свинок различных линий на синтетические пептиды с известной структурой эпитопов. Примером
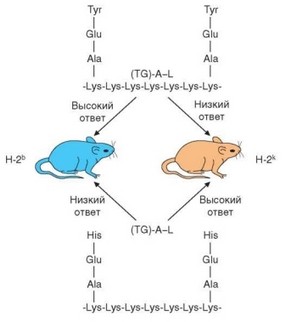
Рис. 3.133. Уровень гуморального иммунного ответа на синтетические пептиды детерминирован генами MHC (у мышей — Н-2). Структурно сходные пептиды индуцируют гуморальный иммунный ответ при оппозитном по направленности контроле со стороны молекул MHC-II
таких результатов могут служить данные о линейных различиях уровня ответа на два синтетических полипептида — (TG)—A—L и (HG) — A — L (см. раздел 3.2.1.3). Оказалось, что генетический контроль иммунного ответа индивидуален для каждого антигена. Контрастным характером ответа отличаются мыши линий C57BL/6 (H-2b) и CBA (H-2k): первые сильно отвечают на (TG)—A—L и слабо — на (HG)—A—L, вторые (CBA) — наоборот (рис. 3.133). Уровень иммунного ответа на названные антигены контролирует один ген, первоначально обозначенный как Ir-1 (Immune response 1). Аллель, детерминирующий высокий уровень ответа, является доминантным. Ген Ir-1 оказался сцепленным с генетическим комплексом MHC, точнее локализуется в области генов MHC класса II. Позже была установлена идентичность гена Ir-1 генам H-2I у мышей. Это подтверждают данные о том, что мутация, затрагивающая экзон гена H-2I-A, кодирующий аминокислотную последовательность в вариабельной области молекулы I-A, приводит к смене высокой отвечаемости на низкую.
Дальнейший анализ показал, что действие гена реализуется на уровне АПК, экспрессирующих молекулы MHC-II. Его механизм состоит в различной способности антигенных пептидов (Т-эпитопов) встраивать
ся в антигенсвязывающую щель в молекуле MHC-II. Хорошее встраивание соответствует высокому уровню отвечаемости, плохое встраивание — низкому. Таким образом, среди многочисленных событий, составляющих иммунный ответ, ключевым для детерминации его количественных показателей является этап презентации антигенного эпитопа Т-хел- перу. Эффективность презентации зависит от степени соответствия между конфигурациями иммунодоминантного эпитопа и антигенсвязывающе- го желобка молекулы MHC-II, свойственной реагирующему организму. Так, у мышей C57BL/6 этот желобок в составе молекулы Н-2ь имеет конфигурацию, в которую хорошо встраивается эпитоп молекулы (TG)—A—L и плохо встраивается эпитоп молекулы (HG)—A—L. Соответствующая полость в составе молекулы Н-2к мышей СВА имеет большее сродство к (HG)—A—L, чем к (TG)—A—L. Понятен и доминантный характер высокого уровня отвечаемости: для успешной презентации антигена достаточно экспрессии одного подходящего типа молекул MHC-II и на эффективность связывания им антигенного пептида не оказывает влияния аллельная молекула MHC-II, плохо связывающая пептид.
Ir-1/MHC-II — основной, но не единственный локус, определяющий уровень иммунного ответа. Описаны локализованные в других участках MHC гены, определяющие уровень ответа (практически всегда — через влияние на презентацию антигена). К генам иммунного ответа относят гены, контролирующие процессинг антигенов, например LMP и ТАР (оба они также расположены в регионе II комплекса MHC). Гены группы LMP кодируют компоненты протеасом, в которых происходит расщепление белков на пептиды, встраивающиеся в молекулы MHC-I, а гены группы ТАР — компоненты транспортной системы, перемещающей эти пептиды из цитозоля в эндоплазматический ретикулум. Регуляция уровня иммунного ответа этими генами обусловлена сродством их продуктов к соответствующим белкам или пептидам и, следовательно, полнотой выполнения ими функций (расщепления, транспорта) и в конечном счете эффективностью доставки пептидов к молекулам MHC-I. Сродство пептидов к антигенсвязывающей щели молекулы MHC-I также служит одним из факторов генетической детерминации уровня ответа, в частности против вирусов (рис. 3.134).
У человека связь генетического контроля иммунного ответа с генами MHC класса II (HLA-DR, HLA-DQ, HLA-DP) четко проявляется при аутоиммунных заболеваниях, развитие которых (т.е. развитие иммунного ответа на аутоантигены) четко контролируют названные гены (подробнее см. раздел 4.4.1.2). На этой связи основана проблема «HLA и иммунозависимые болезни». У людей с определенным генотипом величины относительного риска развития аутоиммунных заболеваний (отношение частоты развития заболевания у носителей данного аллеля и у лиц, не имеющих его) бывают повышены (равны 10—20). В отдельных случаях они значительно выше, достигая 208 при анкилозирующем спондилартрите (связь с аллелем HLA- В27 у ориентов). Доказательством реальности этой связи являются результаты переноса (трансфекции) мышам человеческого гена В27, который приводит к развитию у этих мышей патологии, сходной с анкилозирующим спондилартритом. Проявление эффекта гена (пенетрантность) зависит от ряда обстоятельств, в том числе генетического фона: у людей различных

Рис. 3.134. Сродство пептидов вируса гриппа к аллельным вариантам молекул главного комплекса гистосовместимости I класса (MHC-I). В разные аллельные варианты молекулы MHC-I встраиваются различные пептиды белка NP вируса гриппа, распознаваемые CD8+ Т-клетками, что определяет специфичность иммунного ответа
этнических групп величина относительного риска развития заболевания при наличии аллеля В27 варьирует. Молекулярная основа подобных ассоциаций понятна — она также сводится к сродству пептидных эпитопов аутоантигенов с антигенсвязывающей полостью молекулы HLA (в рассмотренном случае — I класса).
Очевидно, что MHC-зависимый генетический контроль уровня иммунного ответа распространяется также на регуляцию устойчивости к инфекциям. Предпочтительная презентация на конкретных аллельных продуктах MHC пептидных фрагментов возбудителей инфекционных заболеваний служит предпосылкой отрицательной связи данного заболевания с наличием соответствующего аллеля. Так, пептиды вируса гриппа с наибольшим сродством встраиваются в молекулы HLA-B27 и HLA^2, в результате чего носители названных аллелей и особенно гаплотипа А2В27 оказываются устойчивыми к гриппу. В то же время преимущественное встраивание в молекулы HLA-B8 и HLA-DR3 аутоантигенных пептидов из белков щитовидной и поджелудочной желез обусловливает наличие положительной корреляции заболеваемости базедовой болезнью, тиреоидитом Хашимото и ювенильным сахарным диабетом с наличием этих аллелей.
Показана роль в контроле уровня иммунного ответа локуса IGH, детерминирующего не только структуру константных доменов иммуноглобулинов, но и некоторые перекрестно-реагирующие идиотипы, связанные с синтезом антител определенной специфичности. С этим генетическим локусом связан контроль уровня гуморального ответа на а(1-3)-декстран, а также IgE-ответа на некоторые аллергены. В случаях МНС-сцепленного контроля он не всегда реализуется через гены МНС: так, предрасположенность к аутоиммунному синдрому новозеландских мышей линии BW1 реализуется через ген TNF.
Генетическая детерминация иммунного ответа не ограничивается контролем его уровня. Генетические факторы определяют также качественные показатели иммунного ответа, в частности, преобладание Th1- и ТИ2-зависимых процессов. Впервые это было четко показано на линейных мышах. У мышей линии BALB/c преобладают ^2-зависимые процессы. У них максимально выражен гуморальный иммунный ответ. Мыши линии C57BL/6 склонны развивать иммунный ответ клеточного типа с преобладанием хелперов Thl-типа. Гены, контролирующие ^1/^2-направленность иммунного ответа, не сцеплены с MHC. Детально изучена генетика аллергического (^2-зависимого) ответа (атопии). Установлено, что наибольшее число генов атопии у человека локализовано в хромосомах 5 и 6 (в хромосоме 5 расположен кластер цитокиновых генов, в том числе генов IL4, IL5, IL3, IL13, IL9, GMCSFи т.д., а в хромосоме 6 — комплекс MHC, контролирующий уровень иммунного ответа). Среди генов, отвечающих за предрасположенность к аллергии, выявлены гены, кодирующие цитокины, способствующие развитию аллергии немедленного типа (IL-4, IL-5, IL-13), гены транскрипционных факторов ^2-клеток (STAT6, GATA-3) и ряд других.
Источник