Клетки лангерганса в лимфоузле
Гистиоцитоз — это клональное пролиферативное заболевание, при котором происходит активное размножение патологических иммунных клеток гистиоцитов и эозинофилов, которые инфильтрируют органы, вызывая в них фиброзные изменения и, как следствие, нарушение их работы.
Причины развития гистиоцитоза
Причины развития гистиоцитоза остаются предметом исследований. Наследственная теория не нашла своего подтверждения. Предполагается, что сбой в работе иммунной системы и развитие аутоагрессии может быть спровоцировано вирусом герпеса 6 типа. Также есть данные о том, что развитие болезни может быть спровоцировано курением табака. Об этом свидетельствует тот факт, что около 90% взрослых больных являются курильщиками, а отказ от курения уменьшает симптомы гистиоцитоза даже без применения терапии. У 50% больных гистиоцитозом в клетках Лангерганса обнаруживается мутация V600E в гене, который кодирует белок BRAF.
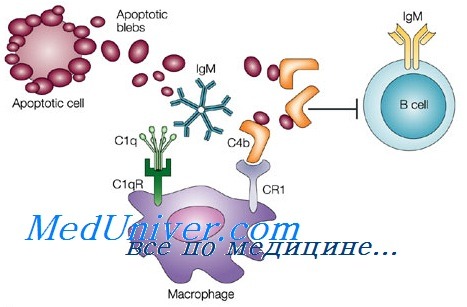
Патогенез заболевания также до конца не изучен. Основным звеном считается накопление в тканях патологически измененных дендритных клеток. В норме они синтезируются в костном мозге и оттуда мигрируют в некоторые органы. Там они занимаются поглощением чужеродных агентов (антигенов), которые поступают в организм из внешней среды, а также «обучением» лимфоцитов для формирования иммунного ответа.
При гистиоцитозе в гистиоцитах нарушается процесс запрограммированной гибели (апоптоз). В свою очередь, медиаторы воспаления, которые синтезируются лимфоцитами, стимулируют рост и интенсивную пролиферацию гистиоцитов, что приводит к их активному размножению и слиянию с эозинофилами. Итогом является образование гигантоклеточных гранулем, которые замещают нормальную ткань органов и приводят к нарушению его работы.
Классификация гистиоцитоза
В зависимости от локализации очагов поражения выделяют:
Моносистемный гистиоцитоз:
- Гистиоцитоз с единичным поражением одной анатомической области. Например, может иметься единичный очаг в коже, кости, легком или лимфатическом узле.
- Множественная форма с поражением одной анатомической области — в одном органе может быть несколько очагов поражения.
Мультисистемный гистиоцитоз:
- С вовлечением 2 и более органов, но без нарушения их функции.
- С вовлечением нескольких органов с нарушением их функции.
Симптомы гистиоцитоза
В клиническом течении выделяют 2 вида заболевания: моносистемный и мультисистемный. При моносистемном варианте страдает один орган, во втором случае — 2 и более.
Моносистемный гистиоцитоз
Наиболее часто при моносистемном гистиоцитозе отмечается поражение костей. В первую очередь, страдают кости черепа, реже гранулемы локализуются в трубчатых костях, костях таза и позвонках. Нередки случаи, когда болезнь протекает бессимптомно, но бывают и клинические проявления, например, болезненная отечность в зоне поражения, изъязвления кожи. Поражение костей может спонтанно регрессировать или трансформироваться в системный процесс.
Второе место после поражения костей при моносистемной форме гистиоцитоза занимает кожа. Проявления имеют вид узловых образований, множественных папул или язвенных бляшек. Локализуются они чаще в генитальной и перианальной области. Может отмечаться и экстрагенитальная локализация, например, на лице, туловище или руках.
Поражение легких. Это проявление чаще встречается у взрослых людей. Симптомами служат сухой кашель, боли в грудной клетки, ночная потливость, повышение температуры. Может отмечаться снижение массы тела.
Мультисистемный гистиоцитоз может развиваться в любом возрасте, но чаще страдают дети. Наиболее сложная форма заболевания (диссеминированный гистиоцитоз) приходится на первые 2-6 лет жизни человека.
Болезнь Леттера-Сиве. Начинается с повышения температуры и/или сыпи на коже. Чуть реже начало характеризуется поражением внутренних органов. Кожные проявления очень вариабельны и диссеминированы. На голове, груди и между лопаток располагаются жирные корки, напоминающие себорею. На коже туловища и в паховых складках образуются обильные папулы коричневого, красного или желтого цветов, в их центре могут быть пузырьки.
В дальнейшем возможно мокнутие, изъязвление и даже некротизация. Симптомы поражения внутренних органов вариабельны, от бессимптомного течения, до грубой патологии. При поражении костного мозга отмечается анемия, тромбоцитопения, которая может привести к геморрагической сыпи. Костные и легочные проявления аналогичны моносистемному варианту гистиоцитоза.
Болезнь Хенда-Шюллера-Крисчена — это еще один вариант гистиоцитоза. Развивается в основном у детей. Характеризуется классической триадой: поражение костей, экзофтальм и несахарный диабет. Также могут иметься характерные для гистиоцитоза поражения кожи и внутренних органов. Экзофтальм (выпячивание глаза) развивается вследствие образования гранулем в области мягких тканей глаза или глазницы. Диабет образуется в следствие гипофизарно-питуитарного поражения. На этом фоне могут быть неврологические нарушения, которые обусловлены как поражением головного мозга, так и костей черепа.
При мультифокальных формах гистиоцитоза в процесс могут вовлекаться следующие органы:
- Лимфатические узлы — проявляется лимфаденопатией (увеличением лимфатических узлов), в ряде случаев лимфоузлы могут сливаться и образовывать конгломераты.
- Ухо. Характерны наружные отиты, которые плохо реагируют на антибиотики.
- Печень. Поражения печени проявляются гепатомегалией, желтухой, а также симптомами, которые свидетельствуют о тяжелой печеночной недостаточности (отеки, кровотечения, энцефалопатии).
- Селезенка. Проявляется спленомегалией.
- Костный мозг. Поражение костного мозга ведет к угнетению кроветворения и, как следствие, развитию пенических синдромов, например, анемии, тромбоцитопении с повышенной кровоточивостью, нейтропении и развитием тяжелых инфекций.
- Легкие. Симптоматически поражение легких аналогично монофокальному гистиоцитозу.
- Эндокринные железы. Нарушение работы эндокринных желез в основном связано с поражением гипофиза — железы, которая регулирует всю работу эндокринной системы. Проявляется это не только несахарным диабетом, но и нарушением работы щитовидной железы, надпочечников и др.
- Центральная нервная система. Симптомы будут зависеть от локализации патологических очагов. Это может быть, как общемозговая симптоматика (нарушение сознания, судороги), так и очаговые неврологические проявления.
- Желудочно-кишечный тракт. Для гистиоцитоза характерны симптомы энтероколита (тошнота, рвота, диарея, боль в животе.
Диагностика гистиоцитоза
Решающим методом диагностики гистиоцитоза является гистологическое исследование биопсийного материала из патологических очагов с проведением иммуногистохимии. Патогномическим признаком является экспрессия клетками CD1a и S100, также широкий интерес представляет определение CD207.
Кроме того, все больные гистиоцитозом должны проходить комплексное обследование для определения формы заболевания и оценки текущего состояния. Назначаются лабораторные анализы, проводится УЗИ внутренних органов, выполняется рентгенография костей. При необходимости, пациент получает консультацию узких специалистов.
Лечение гистиоцитоза
Лечение гистиоцитоза зависит от клинических проявлений заболевания. При поражении кожи назначаются следующие средства:
- Топические глюкокортикостероиды.
- PUVA-терапия.
- Хирургическое иссечение единичных новообразований.
- Лучевая терапия.
- Винбластин.
При поражении костей назначают следующее лечение:
- Кюретаж патологических очагов.
- Лучевая терапия в низких дозах.
- Назначение винбластина и бисфосфонатов.
При лечении мультифокальных и диссеминированных форм применяется полихимиотерапия, терапия 2-хлородеоксиаденозином, а также терапия аллогенными стволовыми клетками. Неплохие результаты показало лечение талидомидом и алемтизумабом, но эти препараты пока находятся в фазе клинических испытаний. При лечении резистентных форм гистиоцитоза применяют кладрибин.
Прогноз при гистиоцитозе
Прогноз при гистиоцитозе будет зависеть от вида заболевания. Локализованные формы в основном протекают доброкачественно и склонны к спонтанным ремиссиям. Диссеминированные формы гистиоцитоза могут быстро прогрессировать и приводить к летальному исходу. Прогностическим индикатором является реакция на полихимиотерапию. При хорошей реакции опухоли общая выживаемость составляет 89-91%, а при первичной резистентности она снижается до 17-34%.
В Европейской клинике для лечения гистиоцитоза используются новейшие лекарственные препараты согласно современным стандартам, а в сложных случаях решение принимается коллегиально консилиумом специалистов.
Источник
Меланоциты. Клетки Лангерганса.Меланоциты. В отличие от кератиноцитов, которые составляют приблизительно 90% клеточной популяции эпидермиса, на долю меланоцитов приходится приблизительно 5%. Меланоциты имеют большое количество отростков и располагаются, перемежаясь, среди клеток базального слоя, разветвленные отростки их распространяются до поверхности эпидермиса. Меланиновый пигмент транспортируется в кератиноциты, что происходит, прежде всего, через эти дендритические отростки. Эти данные объясняют происхождение нормальных ме-ланоцитарных отростков. Большинство же меланоцитарных невусов и меланом не обладает этими структурам, поэтому меланоциты в них выявляются как безотростчатые округлые клетки, которые не напоминают нормальные структуры. При обычной световой микроскопии меланоциты определяются как отдельные клетки среди клеток базального слоя (приблизительно 1 меланоцит на 10 базальных кератиноцитов) с круглыми или овальными темными ядрами и слабо различимой цитоплазмой. Ультраструктурно меланоциты характеризуются относительно светлой цитоплазмой, отсутствием межклеточных контактов, или десмосом, но содержат различное количество меланосом в разных стадиях меланиза-ции. Ранние премеланосомы (не мела-низированные) представляют собой мелкие мембранозные, элипсоидные цитоплазматичес-кие вакуоли, часто с внутренними пластинками, которые выглядят как тонкие периодичности. После меланизации эти структуры становятся плотными непрозрачными тельцами Это — последний тип зрелых меланосом. которые обычно переходят в кератинопиты. Различные опухолевые клетки также могут фагоцитировать зрелые меланизированные меланосомы из лежащих выше или смежных кератиноцитов, и, таким образом, выявление ранних меланосом (премеланосом) необходимо для ультраструктурного подтверждения меланоцитарного или близкого к нему происхождения. Активные меланоциты можно отличить от клеток эпидермиса с помощью гистохимической ДОФА-реакции, которая основана на способности меланоцитов синтезировать меланин, что, в свою очередь, зависит от синтеза фермента тирозиназы.
Меланоциты содержат протеин S-100 в цитоплазме, определение которого является чувствительной реакцией, хотя не строго специфичной, так как нервные клетки и клетки Лангерганса также имеют положительную реакцию к S-100 протеину. Клетки ЛангергансаПодобно меланоцитам, клетки Лангерганса обладают большим количеством отростков и относительно светлой цитоплазмой. Они обычно располагаются в пределах шиповатого слоя средней части эпидермиса, хотя случайные клетки также могут встречаться и в самых нижних слоях эпидермиса. Клетки Лангерганса имеют костномозговое происхождение, это, так называемые, мо-нонуклеарные клетки которые находятся в эпидермисе. Они предназначены для приема, обработки и представления информации об антигенах окружающей среды (и, возможно, также об эндогенных антигенах) Т-лимфоци-там в коже и в лимфатических узлах, дренирующих кожу. Соответственно, они являются важными медиаторами таких столь разнообразных состояний, как контактные дерматиты и, потенциально, опухолевая регрессия. Резидентная популяция клеток Лангерганса и ассоциированные с ними иммунологически активные лимфоциты и мононуклеары были названы ассоциированной с кожей лимфоидной тканью — SALT (skin-associated lymphoid tissue). При обычной световой микроскопии клетки Лангерганса трудно различимы. Электронно-микроскопически в них выявляются характерные цитоплазматические структуры, которые формируют перепончатые диски, часто с внутренней периодичностью и маленькой перепончатой везикулой на поверхности (гранулы Birbeck). Эти гранулы клеток Лангерганса напоминают теннисные ракетки, когда срез исследуется в двумерном плане. Подобно меланоцитам, клетки Лангерганса обладают положительной иммуногистохимической реакцией на наличие протеина S-100. В замороженных срезах или в ткани, сохраненной в растворе Митчела, на их поверхности при иммуногистохимической реакции экспрессируется GDI-антиген. Было показано, что этот гликопротеин является высокоспецифичным маркером для клеток Лангерганса и их пролиферирующих форм, клеток гистиоцитоза X. – Также рекомендуем “Клетки Меркеля. Дерма. Строение дермы.” Оглавление темы “Основы дерматологии.”: |
Источник
Дендритные клетки и клетки Лангерганса при воспалении легких.За последние 10 лет наши представления о дендритных клетках, их происхождении и функциях значительно уточнились. Доказано костномозговое происхождение дендритных клеток. Однако конкретный этап начала дифференцировки дендритных клеток еще нуждается в уточнении. Возможны два пути дифференцировки: из отдельной клетки-предшественника дендритной клетки или из общего предшественника миело-моноцитарной серии, который дифференцируется до стадии моноцита, а моноцит может дифференцироваться либо в тканевой макрофаг, либо в дендритную клетку. Возможно, что предшественники дендритных клеток из костного мозга через кровяное русло заселяют различные нелимфоидные ткани: эпидермис кожи, слизистые оболочки воздухоносных путей, желудочно-кишечного и урогенитального трактов, интерстициальные ткани сердца, почек и других органов. В эпидермисе кожи и слизистых воздухоносных путей эти клетки носят название “клетки Лаигерганса”. Иммиграция дендритных клеток-предшественников из периферической крови в кожу может быть связана с тем, что на них усиливается экспрессия лиганд для селектинов эндотелия. Одновременно на эндотелиальных клетках дермальных капилляров усиливается экспрессия Е-селектинов. Заселение нелимфоидных тканей дендритными клетками стимулирует ростовой фактор – GM-CSF. Усиленная продукция GM-CSF в легочной ткани при воспалении ведет к рекрутированию в легочную ткань клеток типа Лангерганса. Самые ранние иммигранты в очаг бактериального воспаления в легких – это дендритные клетки-предшественники, экспрессирующие антигены МНС 2 класса. Прибывшие клетки остаются в связи с эпителиальными и дифференцируются в типичные дендритные клетки. Дендритные клетки рекрутируются в эпителий дыхательных путей в ответ на аэрозольное введение бактериального ЛПС. Тот же ЛПС, очевидно, через индукцию синтеза TNF-a может послужить сигналом ухода дендритных клеток из периферической ткани в дренирующий лимфоузел. В нелимфоидных тканях происходит начальная дифференцировка дендритных клеток с приобретением ими максимальной активности захвата антигенов, их переработки и формирования комплексов антигенных пептидов с собственными молекулами гистосовместимости. Провоспалительные цитокины (IL-1, TNF-a) вызывают ускоренное созревание дендритных клеток и их миграцию из нелимфоидных органов в кровь или в афферентную лимфу. Таким образом, дендритные клетки мигрируют в лимфоузлы, где их фенотип резко меняется: они превращаются в зрелые “презентирующие” клетки, экспрессирующие на мембранах костимулирующие молекулы и способные инициировать специфический ответ Т-лимфоцитов. К числу цитокинов, усиливающих дифференцировку дендритных клеток, относятся: TNF-a, GM-CSF, IL-4, IFNy. В отличие от этого, продуцируемый кератиноцитами 1L-10 угнетает антигенпрезентирующие функции дендритных клеток.
Дендритные клетки, наряду с макрофагами и В-лимфоцитами, являются профессиональными антиген-презентирующими клетками. Дендритные клетки наиболее активны в инициации первичного иммунного ответа. В легких дендритные клетки считаются основными антиген-презентирующими клетками. Дендритные клетки имеют многие черты сходства с макрофагами, но имеют и существенные отличия. Фагоцитарной активностью обладают лишь незрелые дендритные клетки на ранних стадиях дифференцировки в нелимфоидных тканях, например клетки Лангерганса. Основной путь захвата антигена, свойственный дендритным клеткам, – это макропиноцитоз, в результате которого антиген поступает в вакуоль, где перерабатывается, и образовавшиеся пептиды соединяются с молекулами МНС [54]. Как правило, дендритные клетки захватывают антиген на периферии (в нелимфоидных тканях), после чего они мигрируют в лимфоузлы, где презентируют этот антиген для распознавания Т-клеточными рецепторами и активации Т-клеток. При этом происходит переключение функций дендритных клеток с захвата антигена на стимуляцию Т-лимфоцитов, для чего на мембране дендритных клеток начинают экспрессироваться соответствующие адгезионные (ICAM-1, LFA-3) и костимулирующие (В7-1, В7-2, CD40) молекулы, а также молекулы CD44, контролирующие миграцию дендритных клеток в лимфоидные органы. Дендритные клетки могут презентировать переработанный в фаголизосомах антиген в комплексе с молекулами МНС 2 класса, а растворимые экзогенные антигены – в комплексе с молекулами МНС 1 класса. При этом захват антигена и его презентация разобщены во времени и пространстве. В отличие от макрофагов, дендритные клетки не способны выполнять функции “мусорщика” с перевариванием захваченных белков до отдельных аминокислот. У дендритных клеток эндоцитоз служит лишь первым этапом презентации антигена. Они считаются наиболее активными из профессиональных антиген-презентирующих клеток, способных презентировать и собственные аутоантигенные эпитопы, и туморассоциированные антигенные эпитопы. Кроме того, дендритные клетки способны к конститутивному синтезу физиологически значимых количеств биологически активного М1Р-1у, который опосредует хемотаксис и миграцию Т-лимфоцитов, т.е. дендритные клетки могут участвовать в рекрутировании Т-лимфоцитов (как CD4+, так и CD8+) перед их активацией. В эпителии воздухоносных путей (в частности, трахеи и бронхов) человека обнаружена сеть дендритных клеток, экспрессирующих антигены МНС 2 класса и сходных с клетками Лангерганса. Этот пул дендритных клеток постоянно истощается миграцией зрелых клеток в дренирующие лимфоузлы и постоянно обновляется за счет притока предшественников из костного мозга. Их полупериод жизни не более двух дней в отличие от клеток Лангерганса с полупериодом жизни 15 дней. Быстрый круговорот дендритных клеток слизистых отражает их адаптацию к постоянной экспозиции попадающих с вдыхаемым воздухом чужеродных антигенов, которые необходимо презентировать распознающим Тлимфоцитам в регионарных лимфоузлах. Популяция дендритных клеток воздухоносных путей увеличивается под влиянием бактериальных компонентов и продуктов. В коже и бронхиальной системе атопических больных обнаружено повышенное количество потенциально мобильных дендритных клеток. Часть из них несет на поверхности IgE, связанные рецепторами FceRl. Высокоаффинные FceRI на дендритных клетках могут участвовать в IgE-опосредованном захвате антигена и его презентации. У больных атопиями уровень экспрессии этих рецепторов на дендритных клетках повышен, т.е. они могут связать одномоментно большее количество IgE, разных по антигенной специфичности. – Также рекомендуем “Эпителиальные клетки и воспаление легких.” Оглавление темы “Клетки крови и воспаление легких.”: |
Источник