Кластеры дифференцировки в лимфоцитов
| Антигены | Функциональные характеристики | Экспрессия |
| CD2 | Рецептор для Е-РОК, LFA-3 | Т-клетки, некоторые NK-клетки |
| CD3 | Комплекс Т-клеточного рецептора | Все Т-клетки |
| CD4 | Лиганд молекулы МНС II класса, рецептор для ВИЧ | Т-хелперы/эффекторы |
| CD5 | Лиганд CD72, активация продукции ИЛ-2 и экспрессии рецептора ИЛ-2 | Т-клетки, В1а-клетки |
| CD7 | Рецептор для IgM (Fc IgM) | Ранние Т-клетки, субпопуляция Т-клеток, некоторые NK-клетки |
| CD8 | Лиганд молекулы МНС I класса | Цитотоксические Т-клетки |
| CD9 | Молекула для активации и агрегации тромбоцитов | Пре-В-клетки, активированные Т-клетки |
| CD10 | Нейтральная эндопептидаза | Про-В-клетки, активированные В-клетки, CALLA |
| CD11a | а-цепь LFA-1, лиганд ICAM-1 (CD56), адгезионная молекула | Лейкоциты |
| CD11b | а-цепь Mac-1, рецептор С3bi | Гранулоциты, моноциты, NK-клетки |
| CD11c | Рецептор бета2-интегрина | Моноциты, NK-клетки, гранулоциты, волосатые клетки |
| CD13 | Аминопептидаза N | Гранулоциты, моноциты |
| CD14 | Мембранный протеин, связанный с фосфолипидом | Моноциты, гранулоциты |
| CD16 | Рецептор Fсy III, связывает IgG в составе иммунных комплексов | NK-клетки, моноциты, гранулоциты |
| CD19 | В-клеточный рецепторный комплекс | Ранние и зрелые В-клетки |
| CD20 | Мембранные ионные каналы | Ранние и зрелые В-клетки |
| CD21 | Рецептор C3d, рецептор ВЭБ | В-клетки, дендритные клетки |
| CD22 | Принадлежит к суперсемейству генов иммуноглобулинов | В-лимфоциты |
| CD23 | Fce RII, IgE связывающий фактор, участвует в регуляции синтеза IgE | Субпопуляция В-лимфоцитов |
| CD25 | Низкоаффинный рецептор ИЛ-2 | Активированные Т- и В-лимфоциты |
| CD28 | Лиганд CD80 (В7.1), адгезия | Субпопуляция Т-клеток |
| CD30 | Ki-1, рецептор к ФНО, проведение сигнала, запускающего апоптоз Т-клеток | Т-клетки, Ki-1+ лимфомы |
| CD32 | Рецептор Fcy II, связывает IgG в составе иммунных комплексов | Субпопуляция В-лимфоцитов, гранулоциты, тромбоциты, эндотелий |
| CD33 | на момент подготовки статьи для сайта – неизвестно | Миелоидные предшественники |
| CD34 | Лиганд L-селектина, прикрепление к строме костного мозга гемопоэтических клеток и лимфоцитов к эндотелию сосудов | Плюрипотентная стволовая клетка |
| CD40 | Лиганд CD40 на Т-клетках, индуцирует переключение синтеза иммуноглобулинов на другой изотип | В-клетки, интердигитальные клетки |
| CD44 | Лиганд CD58 | Рецептор, определяющий хоминг в лимфоузлы |
| CD45RO | Лиганд CD22 | Активированные Т-клетки, Т-клетки памяти |
| CD45RA,B | Лиганд CD22 | «Наивные» Т- и В-клетки |
| CD54 | Адгезионная молекула ICAM-1 | Все клетки |
| CD56 | Адгезионная молекула N-CAM | NK-клетки |
| CD58 | Адгезионная молекула LFA-3 | Лейкоциты, эндотелиальные клетки, эпителиальные клетки, фибробласты |
| CD79a, CD79b | Iga, IgB. Молекулы передачи сигнала, компоненты В-клеточного рецептора | В-клетки, пре-В-клетки |
Источник
Оглавление темы “Факторы неспецифической резистентности организма. Интерферон (ифн). Иммунная система. Клетки иммунной системы.”:
1. Кислородзависимая микробицидная активность. Кислороднезависимые механизмы уничтожения микробов.
2. Завершённость фагоцитарных реакций. Завершение фагоцитоза. Персистирование микробов. Причины персистирования микроорганизмов. Другие защитные функции фагоцитов.
3. Факторы неспецифической резистентности организма. Система ИФН. Система интерферона (ифн). Функции интерферона (ифн). Механизм антивирусного действия интерферона (ифн).
4. Интерферон (ифн) первого типа. ИФН I. Функции интерферона (ифн) первого типа. Интерферон (ифн) второго типа. ИФН II (b-ИФН). Функции интерферона (ифн) второго типа.
5. Факторы выделяющиеся при разрушении клеток. Воспаление. Признаки воспаления. Классические признаки острого воспаления по Цельсу. Гистамин.
6. Кинины. Лейкотриены. Простагландины. Белки острой фазы воспаления. Цитокины. Реакции воспаления. Патогенез воспаления.
7. Иммунная система. Индуцибельные факторы защиты организма ( иммунная система ). Главный комплекс гистосовместимости ( МНС первого и второго класса ). Гены MHC I и MHC II.
8. Органы иммунной системы человека. Организация иммунной системы человека. Центральные органы иммунной системы. Периферические органы иммунной системы.
9. Клетки иммунной системы. Иммунокомпетентные клетки. Функция лимфоцитов. Классификация лимфоцитов. Какие бывают лимфоциты?
10. Т-лимфоциты ( Т-клетки ). Созревание Т-клеток. Основные цитокины иммунного ответа. Маркёры Т-клеток. CD-маркёры Т-лимфоцитов.
Т-лимфоциты ( Т-клетки ). Созревание Т-клеток. Основные цитокины иммунного ответа. Маркёры Т-клеток. CD-маркёры Т-лимфоцитов.
Т-лимфоциты (Т-клетки) выполняют различные функции, в связи с чем их подразделяют на субпопуляции. Т-клетки распознают Аг, в том числе переработанные Аг-представляющими клетками, обеспечивают реализацию клеточных иммунных реакций. Кроме того, Т-лимфоциты взаимодействуют с В-лимфоцитами в ходе выработки последними гуморальных иммунных реакций. Активация Т-клеток происходит под действием макрофагов.
Созревание Т-клеток
Предшественники Т-клеток (тимоциты) созревают в вилочковой железе. Их дифференцировку регулируют взаимодействия с эпителиальными и дендритными клетками стромы тимуса, а также гормоноподобные полипептидные факторы эпителиальных клеток тимуса (например, тимозины, тимопоэтины).
Таблица 10-7. Основные цитокины иммунного ответа
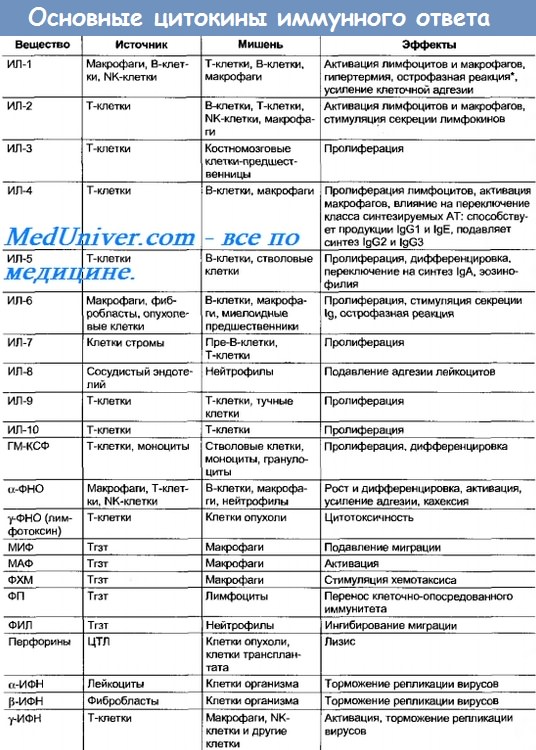
Маркёры Т-клеток
Т-клетки обладают маркёрами — специфическими поверхностными белковыми молекулами, присущими тем или иным субпопуляциям этих клеток.
CD-маркёры Т-лимфоцитов.
При дифференцировке Т-лимфоцитов на их плазмолемме появляются специфические Аг, выступающие в роли маркёров. Эти так называемые «кластеры дифференцировки» — CD-маркёры [от англ. cluster of differentiation] — указывают на функциональные способности лимфоцитов и некоторых других клеток. CD-маркёры идентифицируют с помощью моноклональных AT. После выхода зрелых клеток из тимуса они экспрессируют CD4 или CD8, а также CD3. При некоторых иммунодефицитах обнаруживают нарушения нормального содержания клеток с тем или иным маркёром (например, СD4+-клеток при СПИДе). Т-клетки подразделяют на субпопуляции в соответствии с их функцией и профилем мембранных маркёров, в частности CD-Aг.
– Вернуться в оглавление раздела “Микробиология.”
Источник
CD20 (B1, кластер дифференцировки 20) был открыт в 1980-м году как один из первых маркеров молодых и зрелых В-лимфоцитов. Он представляет собой продукт гена MS4A1 — негликозилированный мембранный белок группы тетраспанинов. Характерной особенностью всех тетраспанинов является наличие четырех схожих трансмембранных участков. В строении CD20 также выделяют две внеклеточные петли, на которых расположены эпитопы взаимодействия с CD20-специфичными антителами [1].
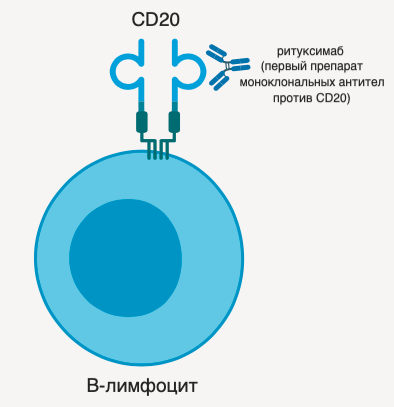 Рисунок 1 ❘ Схема строения CD20, связанного со специфичным антителом.
Рисунок 1 ❘ Схема строения CD20, связанного со специфичным антителом.
На поверхности неизмененных В-лимфоцитов CD20 обнаруживается с самых ранних этапов дифференцировки, начиная с пре-В-клеток. На этапе трансформации В-лимфоцитов в плазматические клетки CD20 утрачивается. Согласно современным представлениям, основная функция CD20 заключается в модификации высвобождения внутриклеточных запасов ионов кальция. Кроме того, с нормальным функционированием и достаточным количеством этого белка тесно связана функция В-клеточного рецептора. По этой причине дефицит корецептора CD20 снижает способность В-лимфоцитов отвечать на антигенную стимуляцию. При этом особую функциональную активность CD20 приобретает после перемещения в липидные рафты — мембранные участки, обогащенные гликосфинголипидами и координирующие работу рецепторных белков [2]. Специальный лиганд для CD20 пока не был обнаружен.
CD20 синтезируется на поверхности не только нормальных, но и неопластически трансформированных В-лимфоцитов, и потому обнаруживается при В-лимфопролиферативных заболеваниях. Этим ограничивается маркерная функция CD20. Посредством его обнаружения можно дифференцировать В- и Т-клеточные лимфомы, однако заболевания внутри В-пролиферативной группы невозможно различить лишь по экспрессии данного рецептора.
На сегодняшний день CD20 является одной из наиболее изученных мишеней воздействия таргетной терапии. Считается, что его использование в качестве терапевтического агента удобно по двум причинам. Во-первых, в случае CD20-положительных опухолей этот рецептор обнаруживается на поверхности В-лимфоцитов в огромном количестве — около ста тысяч молекул на одну клетку. Во-вторых, мембраны стволовых и плазматических клеток не содержат этот белок, что резко снижает количество нежелательных эффектов, связанных с изменениями гемопоэза и иммунореактивности, а также обусловливает высокую чувствительность препаратов [3].
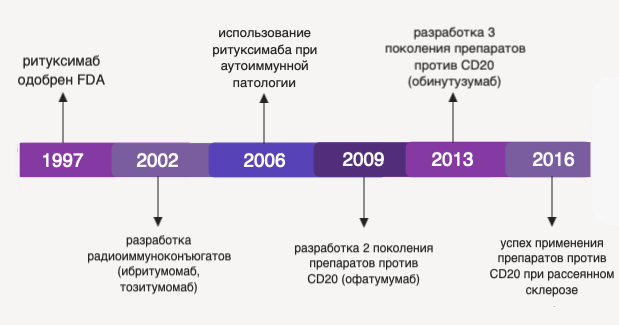
Ритуксимаб был одобрен к применению FDA (Food and Drug Administration, Управление США по санитарному надзору за качеством пищевых продуктов и медикаментов) в 1997 году. Для повышения клинической эффективности в терапии неходжкинских лимфом были разработаны второе и третье поколения аналогов ритуксимаба, а также созданы конъюгаты, используемые для радиоиммунотерапии В-лимфопролиферативных патологий. По мере разработки моноклональных антител, специфичных в отношении CD20, спектр их применения был расширен до терапии рассеянного (множественного) склероза и многих аутоиммунных патологий [3].
 Рисунок 2 ❘ История разработки и внедрения препаратов моноклональных антител против CD20.
Рисунок 2 ❘ История разработки и внедрения препаратов моноклональных антител против CD20.
С 1997 года не был окончательно установлен механизм, обусловливающий клинический эффект ритуксимаба и его аналогов. Однако известно, что действие моноклональных антител, специфичных к CD20, приводит к замедлению пролиферации клеток опухоли, их апоптозу и повышению хемочувствительности. Кроме того, эти препараты призваны модифицировать микроокружение опухоли путем повышения уровня цитотоксичности его клеток [4].
Некоторые ученые называют период с 1997 года по настоящее время “эрой после ритуксимаба”. Это название прижилось в связи с тем, что с 1997 года стремительно растет уровень резистентности опухолей к ритуксимабу и его аналогам. Участились рецидивы опухолей после проведения курсов таргетной терапии, появились группы опухолей, не отвечающих на воздействие известными моноклональными антителами. Среди механизмов резистентности опухоли к действию ритуксимаба наиболее значимы следующие:
- Снижение уровня экспрессии CD20 вплоть до полного ее прекращения;
- Затруднение доступа к опухоли путем модификации микроокружения;
- Изменение активности тирозинкиназ, ассоциированных с CD20;
- Инактивация антител путем изменения клеточного метаболизма [5].
Задачей “эры после ритуксимаба” является разработка новых препаратов и их комбинация с другими терапевтическими агентами. Современными задачами разработки средств, активных в отношении CD20, являются:
- Увеличение чувствительности препаратов;
- Преодоление резистентности опухоли;
- Увеличение скорости гибели опухоли;
- Разработка средств модификации микроокружения опухоли [3].
Как уже было сказано, препараты моноклональных антител против CD20 используются в основном для лечения неходжкинских лимфом. В последнее время эти препараты таргетной терапии нашли применение и в лечении хронического лимфолейкоза [4]. Известно, что в 20–40% случаев лимфомы Ходжкина также являются CD20-положительными. Некоторые исследователи предполагают, что CD20 может играть патофизиологическую роль в развитии лимфомы Ходжкина, однако достоверные подтверждения этому еще не были представлены, и эффекты монотерапии лимфомы Ходжкина препаратами моноклональных антител против CD20 неизвестны [6]. Для охвата большего числа лимфопролиферативных заболеваний разрабатывают также биспецифичные средства, действующие одновременно против CD20 и другого мембранного белка B-лимфоцитов — CD19 [7].
В современных условиях ритуксимаб и его аналоги пока не теряют своей клинической значимости и успешно используются. Однако случаи неэффективности применения таких дорогостоящих средств таргетной терапии заставляют искать новые возможности использования CD20 как терапевтического агента. Возможно, проводимые разработки в будущем решат ключевые вопросы патогенеза и терапии В-лимфопролиферативных заболеваний.
Источники
1. Tetraspanin proteins promote multiple cancer stages. / Martin E. Hemler. // Nat Rev Cancer. – 2014. – Vol. 14. – p. 49-60.
2. Functional role of lipid rafts in CD20 activity? / Janas E, Priest R, Malhotra R. // Biochem Soc Symp. – 2005. – Vol. 72. – p. 165-175.
3. Therapeutic Antibodies: What Have We Learnt from Targeting CD20 and Where Are We Going? / Michael J. E. Marshall, Richard J. Stopforth, Mark S. Cragg. // Front Immunol. – 2017. – Vol. 8. – p. 1245.
4. CD20-based Immunotherapy of B-cell derived Hematologic Malignancies. / Shanehbandi D, Majidi J, Kazemi T [et al.] // Curr Cancer Drug Targets. – 2017. – Vol. 17, №5. – p. 423-444.
5. Rituximab (monoclonal anti-CD20 antibody): mechanisms of action and resistance. / Mitchell R. Smith. // Oncogene. – 2003. – Vol. 22, №47. – p. 7359-7368.
6. CD20 role in pathophysiology of Hodgkin’s disease. / Santos MAO, Lima MM. // Rev Assoc Med Bras. (1992) – 2017. – Vol. 63, №9. – p. 810-813.
7. CD20-CD19 Bispecific CAR T Cells for the Treatment of B-Cell Malignancies. / Martyniszyn A, Krahl AC, Andre MC [et al.] // Hum Gene Ther. – 2017. – Vol. 28, №12. – p. 1147-1157.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
Оглавление темы “СD8 лимфоциты. Антиген ( Аг ) представляющие клетки. Классификация антигенов ( Аг ).”:
1. Рецептор Т-клеток. Активация Т-лимфоцитов. Субпопуляции Т-лимфоцитов. СD4+ лимфоциты.
2. СD8 лимфоциты. Т супрессоры. Цитотоксические Т-лимфоциты ( ЦТЛ ). Т-киллеры. Цитотоксический эффект Т-киллеров. Т-клетки памяти.
3. В-лимфоциты. В-клетки. Созревание В-лимфоцитов. Продолжительность жизни B-лимфоцитов. Маркеры В-клеток ( В-лимфоцитов ).
4. Естественные киллеры ( NK-клетки ). Перфорины. Функция естественных киллеров. Задачи NK-клеток.
5. Антиген ( Аг ) представляющие клетки. Иммунные реакции. Классификация имунных реакций. Антигены. Свойства антигенов. Структура антигенов ( Аг ). Валентность Аг.
6. Классификация антигенов ( Аг ). Иммуногены. Гаптены. Непреципитирующие гаптены. Преципитирующие гаптены. Полугаптены. Проантигены.
7. Адъюванты. Адъювант Фройнда. Толерогены. Природа антигенов (Аг). Происхождение антигенов. Молекулярная масса антигенов (Аг).
8. Специфичность антигенов (Аг). Видовые антигены. Групповые антигены (Аг). Гетерогенные антигены (Аг). Антиген Форссмана. Аллоантигены ( изоантигены ).
9. Патологические антигены. Аутоантигены. Врождённые аутоантигены. Приобретённые аутоантигены. Суперантигены.
10. Антигены ( Аг ) микроорганизмов. Антигены бактерий. Капсульные антигены ( К-антигены ( Аг )). Соматические антигены ( O-антигены ( Аг )). Жгутиковые антигены ( H-антигены ( Аг )). Vi-Ar ( Антиген вирулентности ).
Рецептор Т-клеток. Активация Т-лимфоцитов. Субпопуляции Т-лимфоцитов. СD4+ лимфоциты.
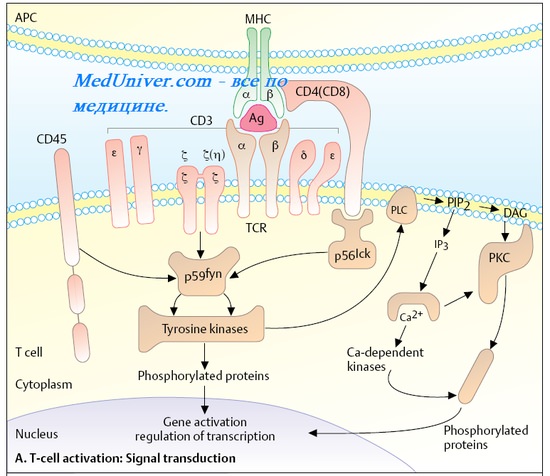
Рецептор Т-клеток. Т-клетки распознают Аг с помощью двух типов мембранных гликопротеинов — Т-клеточных рецепторов и CD3. Т-клеточный рецептор — гетеродимер, содержащий а- и р-цепи (примерно 98% всех Т-клеток) или 5-цепи (около 1,5-2% клеток) с молекулярной массой 40-50 кД. Т-клеточный рецептор входит в суперсемейство Ig-подобных молекул клеточной поверхности, участвующих в реакциях распознавания. Механизмы трансмембранной передачи с рецептора Т-клетки остаются неизвестными; предположительно они обусловлены CD3, нековалентно связанными с рецепторами Т-лимфоцитов.
Активация Т-клеток
Для активации Т-клеток необходимо два сигнала от макрофагов. Первый сигнал — представление Аг, второй— секреция активирующего фактора (ИЛ-1). Последний стимулирует синтез Т-лимфоцитами ИЛ-2, активирующего эти клетки (аутокринная регуляция). Одновременно на мембранах Т-клеток повышается экспрессия рецепторов к ИЛ-2 (CD25).
Субпопуляции Т-лимфоцитов
На основании поверхностных маркёров различают несколько субпопуляций Т-лимфоцитов, выполняющих различные функции. Для дифференцировки Т-клеток применяют набор моноклональных AT, выявляющих поверхностные маркерные CD-Aг [от англ. cluster of differentiation, кластер дифференцировки]. Все зрелые Т-клетки экспрессируют поверхностный CD3-Aг; помимо него субпопуляции Т-лимфоцитов также экспрессируют и другие CD-Aг.
СD4+ лимфоциты
Мембранные молекулы CD4 несут различные популяции клеток, условно разделяемые на регуляторные (хелперы) и эффекторные (Тгзт).
Т-хелперы [от англ. to help, помогать] специфически распознают Аг и взаимодействуют с макрофагами и В-клетками в ходе индукции гуморального иммунного ответа. Отношение CD4+/CD8+-клеток — важный параметр оценки иммунного статуса; в нормальных условиях отношение CD4+/CD8+ приблизительно равно двум и отражает доминирующее влияние на иммунный ответ стимулирующих факторов. При некоторых иммунодефицитных состояниях отношение обратное (менее I, то есть СD8+-клетки доминируют), указывая на преимущественное влияние иммуносупрессорных эффектов; лежит в основе патогенеза многих иммунодефицитов (например, СПИДа).
Аг распознающие Т-лимфоциты «узнают» чужеродный эпитоп вирусного или опухолевого Аг в комплексе с молекулой МНС на плазматической мембране клетки-мишени. Тгзт [Т-эффекторы реакций гиперчувствительности замедленного типа (ГЗТ)] опосредуют реакции ГЗТ.
– Также рекомендуем “СD8 лимфоциты. Т супрессоры. Цитотоксические Т-лимфоциты ( ЦТЛ ). Т-киллеры. Цитотоксический эффект Т-киллеров. Т-клетки памяти.”
Источник
Понятием кластер дифференцировки (от англ. cluster of differentiation, cluster designation; CD) обозначают номенклатуру дифференцировочных антигенов человеческих лейкоцитов. Данная классификация была принята с целью исследования и идентификации поверхностного мембранного белка лейкоцитов в 1982 году. CD-антигенами или, другими словами, CD-маркерами являются белки, которые служат лигандами, либо рецепторами, участвуют во взаимодействиях клеток и являются компонентами каскада установленных сигнальных путей. Данные белки способны выполнять и другие функции (в частности, белок клеточной адгезии). Перечень включенных в номенклатуру антигенов кластеров дифференцировки регулярно пополняется и на сегодня составляет свыше 320 CD-антигенов, а также их подтипов.
Рис. 1. Пример описания дифференцировки лейкоцитов по наличию различных CD на их поверхности
Номенклатура кластеров дифференцировки была разработана на первой конференции (Париж. 1982 г.) по антигенам дифференцировки человеческих лейкоцитов. Назначением созданной системы стало упорядочивание значительного числа моноклональных антител по отношению к поверхностным эпитопам лейкоцитов, выработанных во многих лабораториях мира.
Было решено, что каждый CD-антиген будет приписан к определенному ряду моноклональных антител (при наличии хотя бы двух неодинаковых клонов), способных распознавать определенный эпитоп на клетке. Название CD-антиген распространилось также и на белок-маркер, в реакцию с которым вступают антитела. Характерно, что описанная номенклатура производит классификацию кластеров дифференцировки, не касаясь клеточных функций белка. Нумерация ведется от антигенов описанных раньше к описанным позже в порядке хронологии.
Со временем данную классификацию значительно расширили, включив в нее и другие разновидности клеток помимо лейкоцитов. Было установлено, что многие из CD-антигенов относятся не к поверхностным, а к внутриклеточным белкам-маркёрам. Некоторые из CD-антигенов были отнесены не к белкам, а к поверхностным углеводам.
Кластеры дифференцировки являют собой моноклональные группы антител способные выявлять присутствие одноименных молекул на поверхностях клеток. Каждую молекулу мембраны принято обозначать как CD, ей присваивается соответствующий номер. Некоторые CD обозначаются символом ‘w’ (от workshop – рабочая группа, англ), свидетельствующим, что данный антиген охарактеризован не полностью.
Возможность идентификации кластеров дифференцировки появилась только с началом полномасштабного использования в опытах моноклональных антител – мАт, которые применяются в технологии проточной цитометрии. Исходя из того, что основная задача в исследованиях экспрессии антигена – обнаружение позитивных клеток различного происхождения, считается, что сходные картины мечения, которые показывают мАт, свидетельствуют о мечении ими одного и того же антигена.
Подобные исследования были начаты в 1980 году. Результатом их стало введение общей CD-номенклатуры не только для человеческих антигенов, но и для антигенов гомологичного характера различных видов животных. Вне сомнения, важнейшим и одним из первых следствий введения CD-номенклатуры явилась возможность обнаружения уникального ряда антигенов с последующим их изучением, клонированием, исследованием условий функциональных вариантов, экспрессии и т.д.
Появилась возможность как фундаментального использования CD-номенклатуры, так и направленного влияния на реализацию некоторых функций изучаемой клетки посредством применения мАт к определенному CD-антигену. Например, то, что CD4 является маркером (преимущественно) для Т-хелперов позволило показать значение данного маркера в процессе отмены смешанных лимфоцитарных реакций и блокады некоторых заболеваний аутоиммунного характера in vivo, используя aHTH-CD4 мАт. Другой пример: анти-СШ мАт успешно активирует Т-клетки.
Как видим, возможность определить экспрессию кластера дифференцировки антигенов для различных состояний определенных клеточных типов позволила установить причины подавляющих и активирующих воздействий, что открывает перспективы моделирования нужных состояний in vivo.
Задать вопрос, написать отзыв
Анастасия 2018-03-23 14:30:35
необходимы клестеры дифференциовки у лошади
Источник