Какие лимфоциты в тимусе
Оглавление темы “Иммунная система. Функции клеток иммунной системы. Т-лимфоциты. В-лимфоциты. Структура и функции органов иммунной системы.”: Тимус (вилочковая железа). Тимоциты. Функции тимуса ( вилочковой железы ). Этапы отбора тимоцитов.Тимус в качестве одного из центральных органов иммунной системы является местом созревания Т-лимфоцитов из клеток-предшественниц и формирования огромного разнообразия зрелых Т-лимфоциов, способных распознать своими рецепторами любой антиген. Лимфоциты, находящиеся в тимусе, называют тимоцитами. В тимусе идут параллельно несколько процессов: Ранние клетки-предшественницы Т-лимфоцитов из костного мозга поступают в корковый слой тимуса. Постепенно они мигрируют из коркового слоя тимуса в мозговой, контактируя с тимическими эпителиальными клетками, макрофагами и дендритными клетками. На тимоциты влияют продуцируемые тимическими эпителиальными клетками гормоны: тимулин, al- и (34-тимозины, тимопоэтин, контролирующие их дифференцировку. В процессе продвижения в мозговой слой тимоциты созревают (дифференцируются), поэтапно приобретая характерные для зрелых Т-лимфоцитов поверхностные рецепторы и антигены.
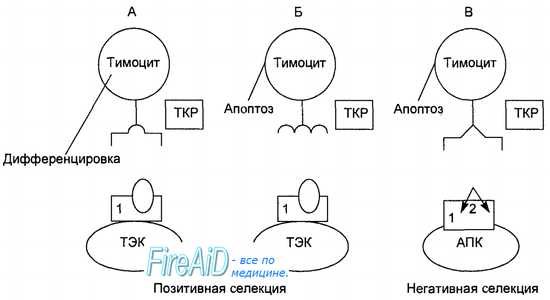
От стромальных клеток тимуса и продуцируемых ими молекул каждый тимоцит получает сигналы: усиления пролиферации, изменений поверхностного фенотипа (сочетания молекул, присутствующих на поверхности клеток), перестройки («реаранжировки») генов, ответственных за широкое разнообразие специфических антигенраспознающих рецепторов. Основная функция зрелых Т-лимфоцитов — это распознавание чужеродных антигенных пептидов в комплексе с собственными молекулами главного комплекса гистосовместимости на поверхности антигенпредстав-ляющих клеток. Для выполнения этой функции Т-лимфоциты располагают специфическими антигенраспознающими рецепторами. Отбор тимоцитов идет в два этапа (рис. 8.4). После того как на тимоците формируется Т-клеточный рецептор определенной специфичности, в следующие этапы развития вступают только те тимоциты, которые проявили способность распознавать собственные молекулы главного комплекса гистосовместимости, присутствующие на эпителиальных клетках коры тимуса данного организма. В отличие от зрелого Т-лимфоцита, который при встрече с антигенным пептидом, специфичным для его Т-клеточного рецептора, получает сигнал активации, незрелые тимоциты в тимусе при распознавании специфичных для их Т-клеточных рецепторов аутоантигенных пептидов получают сигнал генетически программированной гибели — апоптоза. Таким образом, идет «выбраковка» аутореактивных Т-лимфоци-тов, 95—98 % тимоцитов ежедневно погибают в тимусе этим путем. Только 2—5 % тимоцитов (1 • 10б) в виде зрелых Т-лимфоцитов ежедневно покидают тимус, поступая в кровь и расселяясь в лимфоидных органах.
A. Тимоцит, способный распознать своим рецептором (ТКР) собственные антигены главного комплекса гистосовместимости (1) на поверхности тимических эпителиальных клеток (ТЭК), вступает в дальнейшую дифференцировку. Б. Тимоцит, не способный распознать своим ТКР собственные антигены главного комплекса гистосовместимости (1) на поверхности ТЭК, получает сигнал апоптоза. B. Тимоцит, способный распознать своим ТКР пептидный фрагмент аутоантигена (2) на поверхности антигенпредставляющеи клетки в комплексе с собственными молекулами главного комплекса гистосовместимости (1), получает сигнал апоптоза. В результате в кровоток и в лимфоидные органы поступают только те Т-лимфоциты, которые несут рецепторы, распознающие чужеродные пептиды в сочетании с собственными молекулами главного комплекса гисто-совместимости. Тимус представляет собой единственный орган иммунной системы, подвергающийся быстрой возрастной инволюции, которая у людей начинается после первого года жизни. Человек ежегодно теряет до 3 % истинно тимической ткани, которая постепенно замещается жировой и соединительной тканью. Соответственно снижается и продукция Т-лимфоцитов. Высокая продукция Т-лимфоцитов сохраняется до двух лет, а затем быстро снижается. Однако количество Т-лимфоцитов в организме сохраняется на достигнутом уровне благодаря тому, что значительную часть популяции Т-лимфоцитов составляют долгоживущие клетки, которые не нуждаются в постоянном обновлении. Более того, зрелые Т-лимфоциты, распознавшие «свой» антиген в периферических органах иммунной системы, получают сигналы активации и избирательной пролиферации, за счет чего их численность возрастает. Перенесенная взрослым человеком тимэктомия не приводит к катастрофическому снижению количества циркулирующих Т-лимфоцитов. В качестве одного из центральных органов иммунной системы тимус выполняет следующие функции: а) контролирует пролиферацию, диффе-ренцировку, отбор и окончательное созревание Т-лимфоцитов, б) продуцирует тимические гормоны, влияющие на функции Т-лимфоцитов. – Вернуться в оглавление раздела “Физиология человека.” |
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 4 апреля 2020; проверки требуют 13 правок.
T-лимфоциты, или Т-клетки (от лат. thymus «тимус») — лимфоциты, развивающиеся у млекопитающих в тимусе из предшественников — претимоцитов, поступающих в него из красного костного мозга. В тимусе T-лимфоциты дифференцируются, приобретая Т-клеточные рецепторы (ТКР, англ. TCR) и различные корецепторы (поверхностные маркеры)[1]. Играют важную роль в приобретённом иммунном ответе. Обеспечивают распознавание и уничтожение клеток, несущих чужеродные антигены, усиливают действие моноцитов, NK-клеток, а также принимают участие в переключении изотипов иммуноглобулинов (в начале иммунного ответа B-клетки синтезируют IgM, позже переключаются на продукцию IgG, IgE, IgA).
Типы Т-лимфоцитов[править | править код]
Т-клеточные рецепторы являются основными поверхностными белковыми комплексами Т-лимфоцитов, ответственными за распознавание процессированных антигенов, связанных с молекулами главного комплекса гистосовместимости (ГКГ, англ. major histocompatibility complex (MHC)) на поверхности антигенпредставляющих клеток[2]. Т-клеточный рецептор связан с другим полипептидным мембранным комплексом, CD3. В функции комплекса CD3 входит передача сигналов в клетку, а также стабилизация Т-клеточного рецептора на поверхности мембраны. Т-клеточный рецептор может ассоциироваться с другими поверхностными белками, его корецепторами. В зависимости от корецептора и выполняемых функций различают два основных типа Т-клеток.
Т-хелперы[править | править код]
Антигенраспознающий рецепторный комплекс Т-хелперов
Т-хелперы (от англ. helper — помощник) — Т-лимфоциты, главной функцией которых является усиление адаптивного иммунного ответа. Активируют Т–киллеры, B-лимфоциты, моноциты, NK–клетки при прямом контакте, а также гуморально, выделяя цитокины. Основным признаком Т–хелперов служит наличие на поверхности клетки молекулы корецептора CD4. Т-хелперы распознают антигены при взаимодействии их Т-клеточного рецептора с антигеном, связанным с молекулами главного комплекса гистосовместимости II класса (англ. major histocompatibility complex II (MHC-II)).
Т-киллеры[править | править код]
Т-киллеры (от англ. killer «убийца»), цитотоксические T-лимфоциты, CTL — Т-лимфоциты, главной функцией которых является уничтожение повреждённых клеток собственного организма. Мишени Т-киллеров — это клетки, поражённые внутриклеточными паразитами (к которым относятся вирусы и некоторые виды бактерий), опухолевые клетки. Т-киллеры являются главным компонентом антивирусного иммунитета. Основным признаком Т-киллеров служит наличие на поверхности клетки молекулы корецептора CD8. Т-киллеры распознают антигены при взаимодействии их Т-клеточного рецептора с антигеном, связанным с молекулами главного комплекса гистосовместимости I класса (англ. major histocompatibility complex I (MHC-I)).
Т-хелперы и Т-киллеры образуют группу эффекторных Т-лимфоцитов, непосредственно ответственных за иммунный ответ. В то же время существует другая группа клеток, регуляторные Т-лимфоциты, функция которых заключается в регулировании активности эффекторных Т-лимфоцитов. Модулируя силу и продолжительность иммунного ответа через регуляцию активности Т-эффекторных клеток, регуляторные Т-клетки поддерживают толерантность к собственным антигенам организма и предотвращают развитие аутоиммунных заболеваний. Существуют несколько механизмов супрессии: прямой, при непосредственном контакте между клетками, и дистантный, осуществляющийся на расстоянии — например, через растворимые цитокины.
γδ Т-лимфоциты[править | править код]
Т-лимфоциты представляют собой небольшую популяцию клеток с видоизменённым Т-клеточным рецептором[3]. В отличие от большинства других Т-клеток, рецептор которых образован и субъединицами, Т-клеточный рецептор -лимфоцитов образован и субъединицами. Данные субъединицы не взаимодействуют с пептидными антигенами, презентированными белками ГКГ. Предполагается, что Т-лимфоциты участвуют в узнавании липидных антигенов.
Т-супрессоры[править | править код]
Т-лимфоциты, обеспечивающие центральную регуляцию иммунного ответа.
Дифференциация в тимусе[править | править код]
Стадии дифференциации Т-лимфоцитов
Все Т-клетки берут своё начало от гемопоэтических стволовых клеток красного костного мозга, которые мигрируют в тимус и дифференциируются в незрелые тимоциты[4]. Тимус создаёт микросреду, необходимую для развития полностью функционального репертуара Т-клеток, который является ГКГ-ограниченным и толерантным к самому себе.
Дифференциация тимоцитов разделяется на разные стадии в зависимости от экспрессии различных поверхностных маркеров (антигенов). На самой ранней стадии тимоциты не экспрессируют корецепторы CD4 и CD8 и поэтому классифицируются как двойные негативные (англ. double negative (DN)) (CD4-CD8-). На следующей стадии тимоциты экспрессируют оба корецептора и называются двойными позитивными (англ. double positive (DP)) (СD4+CD8+). Наконец на финальной стадии происходит селекция клеток, которые экспрессируют только один из корецепторов (англ. single positive (SP)): или (CD4+), или (CD8+).
Раннюю стадию можно разделить на несколько подстадий. Так, на подстадии DN1 (англ. double negative 1) тимоциты имеют следующую комбинацию маркеров: CD44+CD25-CD117+. Клетки с данной комбинацией маркеров ещё называют ранними лимфоидными предшественниками (англ. early lymphoid progenitors (ELP)). Прогрессируя в своей дифференциации, ELP активно делятся и окончательно теряют способность трансформироваться в другие типы клеток (например, В-лимфоциты или миелоидные клетки). Переходя на подстадию DN2 (англ. double negative 2), тимоциты экспрессируют CD44+CD25+CD117+ и становятся ранними Т-клеточными предшественниками (англ. early T-cell progenitors (ETP)). В течение DN3 подстадии (англ. double negative 3) ETP клетки имеют комбинацию CD44-CD25+ и вступают в процесс β-селекции.
β-селекция[править | править код]
Гены Т-клеточного рецептора состоят из повторяющихся сегментов, принадлежащих к трём классам: V (англ. variable), D (англ. diversity) и J (англ. joining). В процессе соматической рекомбинации генные сегменты, по одному из каждого класса, соединяются вместе (V(D)J-рекомбинация). Случайное объединение последовательностей сегментов V(D)J приводит к появлению уникальных последовательностей вариабельных доменов каждой из цепей рецептора. Случайный характер образования последовательностей вариабельных доменов позволяет генерировать Т-клетки, способные распознавать большое количество различных антигенов, и, как следствие, обеспечивать более эффективную защиту против быстро эволюционирующих патогенов. Однако этот же механизм зачастую приводит к образованию нефункциональных субъединиц Т-клеточного рецептора. Гены, кодирующие β-субъединицу рецептора, первыми подвергаются рекомбинации в DN3-клетках. Чтобы исключить возможность образования нефункционального пептида, β-субъединица образует комплекс с инвариабельной α-субъединицей пре-T-клеточного рецептора, формируя т. н. пре-T-клеточный рецептор (пре-ТКР)[5]. Клетки, неспособные образовывать функциональный пре-ТКР, погибают в результате апоптоза. Тимоциты, успешно прошедшие β-селекцию, переходят на подстадию DN4 (CD44-CD25-) и подвергаются процессу позитивной селекции.
Позитивная селекция[править | править код]
Клетки, экспрессирующие на своей поверхности пре-ТКР, все ещё не являются иммунокомпетентными, так как не способны связываться с молекулами главного комплекса гистосовместимости. Для узнавания молекул ГКГ T-клеточным рецептором необходимо наличие корецепторов CD4 и CD8 на поверхности тимоцитов. Образование комплекса между пре-ТКР и корецептором CD3 приводит к ингибированию перестроек генов β-субъединицы и в то же время вызывает активацию экспрессии генов CD4 и CD8. Таким образом тимоциты становятся двойными позитивными (DP) (CD4+CD8+). DP-тимоциты активно мигрируют в корковое вещество тимуса, где происходит их взаимодействие с клетками кортикального эпителия, экспрессирующими белки обоих классов ГКГ (MHC-I и MHC-II). Клетки, неспособные взаимодействовать с белками ГКГ кортикального эпителия, подвергаются апоптозу, в то время как клетки, успешно осуществившие такое взаимодействие, начинают активно делиться.
Негативная селекция[править | править код]
Тимоциты, прошедшие позитивную селекцию, начинают мигрировать к кортикомедуллярной границе тимуса. Попадая в медуллу, тимоциты взаимодействуют с собственными антигенами организма, презентированными в комплексе с белками ГКГ на медуллярных тимических эпителиальных клетках (мТЭК). Тимоциты, активно взаимодействующие с собственными антигенами, подвергаются апоптозу. Негативная селекция предотвращает появление самоактивирующихся Т-клеток, способных вызывать аутоиммунные заболевания, являясь важным элементом иммунологической толерантности организма.
Активация[править | править код]
Механизм действия Т-хелперов и Т-киллеров
Т-лимфоциты, успешно прошедшие позитивную и негативную селекцию в тимусе, попавшие на периферию организма, но не имевшие контакта с антигеном, называются наивными Т-клетками (англ. Naive T cells). Основной функцией наивных Т-клеток является реакция на патогены, прежде не известные иммунной системе организма. После того как наивные Т-клетки распознают антиген, они становятся активированными. Активированные клетки начинают активно делиться, образуя клон. Некоторые из клеток этого клона превращаются в эффекторные Т-клетки, которые выполняют функции, специфичные для данного типа лимфоцита (например, выделяют цитокины в случае Т-хелперов или же лизируют поражённые клетки в случае Т-киллеров). Другая часть активированных клеток трансформируется в Т-клетки памяти. Клетки памяти сохраняются в неактивной форме после первичного контакта с антигеном до тех пор, пока не наступает повторное взаимодействие с тем же антигеном. Таким образом, Т-клетки памяти хранят информацию о ранее действовавших антигенах и обеспечивают вторичный иммунный ответ, осуществляющийся в более короткие сроки, чем первичный.
Взаимодействие Т-клеточного рецептора и корецепторов (CD4, CD8) с главным комплексом гистосовместимости важно для успешной активации наивных Т-клеток, однако его самого по себе недостаточно для дифференциации в эффекторные клетки. Для последующей пролиферации активированных клеток необходимо взаимодействие т. н. костимулирующих молекул. Для Т-хелперов такими молекулами являются рецептор CD28 на поверхности Т-клетки и иммуноглобулин B7 на поверхности антигенпрезентирующей клетки.
Примечания[править | править код]
- ↑ Murphy K., Travers P., Walport M. Janeway’s Immunobiology. — New York: Garland Science, 2011. — 888 p. — ISBN 0-8153-4123-7. Архивная копия от 20 октября 2014 на Wayback Machine
- ↑ Alberts B., Johnson A., Lewis J., Raff M., Roberts K., Walter P. Molecular Biology of the Cell. — New York: Garland Science, 2002. — 1367 p. — ISBN 0-8153-3218-1.
- ↑ Holtmeier W., Kabelitz D. Gammadelta T cells link innate and adaptive immune responses // Chemical immunology and allergy. — 2005. — Т. 86. — С. 151–83. — ISBN 978-3-8055-7862-2. — doi:10.1159/000086659. — PMID 15976493.
- ↑ Schwarz B. A., Bhandoola A. Trafficking from the bone marrow to the thymus: a prerequisite for thymopoiesis (англ.) // Immunol. Rev.. — 2006. — Vol. 209. — P. 47–57. — doi:10.1111/j.0105-2896.2006.00350.x. — PMID 16448533.
- ↑ Sleckman B. P. Lymphocyte antigen receptor gene assembly: multiple layers of regulation (англ.) // Immunol Res. — 2005. — Vol. 32. — P. 153-8. Архивировано 27 января 2008 года.
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 29 ноября 2020; проверки требуют 5 правок.
У этого термина существуют и другие значения, см. Зоб.
Ти́мус (лат. thymus, ви́лочковая железа, зо́бная железа[2][3]) — лимфоэпителиальный орган лимфопоэза человека и многих видов животных, в котором происходит созревание, дифференцировка и иммунологическое «обучение» T-клеток иммунной системы.
У человека редуцирован, развит у птиц, название происходит от кости — вилочка.
Строение[править | править код]
Анатомия[править | править код]
Тимус в центре. Изображение 1906 г.
Вилочковая железа — небольшой орган розовато-серого цвета, мягкой консистенции, поверхность её дольчатая. У новорождённых его размеры составляют в среднем 5 см в длину, 4 см в ширину и 6 мм в толщину, масса — около 15 граммов. Рост органа продолжается до начала полового созревания (в это время его размеры максимальны — до 7,5—16 см в длину, а масса достигает 20—37 граммов). С возрастом тимус подвергается атрофии и в старческом возрасте едва отличим от окружающей его жировой ткани средостения; в 75 лет средняя масса тимуса составляет всего 6 граммов. По мере инволюции он утрачивает белый цвет и за счёт увеличения в нём доли стромы и жировых клеток становится более жёлтым[4].
У представительниц женского пола, размеры железы больше, что связано с разным воздействием на неё половых гормонов[5].
Топография
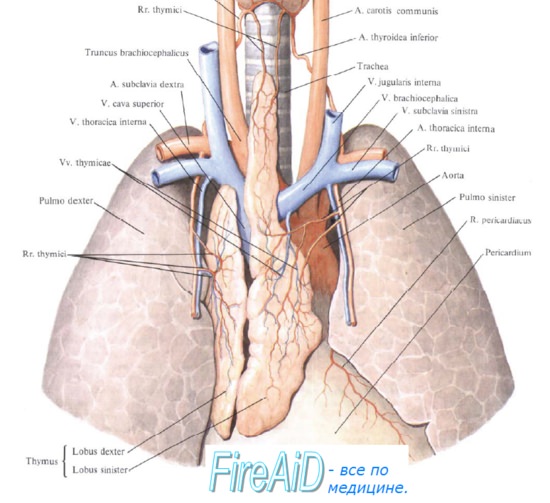
Тимус расположен в верхней части грудной клетки, сразу за грудиной (верхнее средостение). Спереди к нему прилежит рукоятка и тело грудины до уровня IV реберного хряща; сзади — верхняя часть перикарда, покрывающего начальные отделы аорты и лёгочного ствола, дуга аорты, левая плечеголовная вена; с боков — медиастинальная плевра.
Отдельные группы долек тимуса встречаются вокруг или в толще ткани щитовидной железы, в мягких тканях шеи, в области миндалин, в жировой клетчатке переднего, реже заднего средостения. Частота выявления аберрантного тимуса достигает 25 %. Такие аномалии чаще наблюдаются у женщин, в основном с левой стороны шеи и средостения. В литературе имеются единичные сообщения об эктопии ткани тимуса у детей грудного возраста. Такая патология сопровождалась у них одышкой, дисфагией, дыхательной недостаточностью. По данным P. Nowak и соавт., из 91 случая эктопии вилочковой железы в 76 определяется шейная локализация, преимущественно у лиц мужского пола и слева. Отмечается также связь эктопии тимуса со врождёнными пороками сердца в 71 % случаев[6].
передняя поверхность
задняя поверхность
Внешний вид на фото тимуса человека
Внешний вид
У человека тимус состоит из двух долей, которые могут быть сращены или же просто плотно прилегать друг к другу. Нижняя часть каждой доли широкая, а верхняя узкая; таким образом, верхний полюс может напоминать двузубую вилочку (отсюда и название).
Орган покрыт капсулой из плотной соединительной ткани, от которой в глубину отходят перемычки, делящие его на дольки.
У животных (зобная железа) развита у плодов и молодых животных[7]. Она состоит из непарного грудного отдела, лежащего впереди сердца, и парного шейного отдела, проходящего в виде выростов по бокам трахеи. С возрастом железа начинает рассасываться, а затем исчезает.
Кровоснабжение, лимфоотток и иннервация
Кровоснабжение тимуса происходит из тимических, или тимусных ветвей внутренней грудной артерии, (rami thymici arteriae thoracicae internae), тимических ветвей дуги аорты и плечеголовного ствола и ветвей верхней и нижней щитовидных артерий. Венозный отток осуществляется по ветвям внутренних грудных и плечеголовных вен.
Лимфа от органа оттекает в трахеобронхиальные и парастернальные лимфатические узлы.
Иннервирована вилочковая железа ветвями правого и левого блуждающих нервов, спинномозговыми нервами C4-C7, а также симпатическими нервами, происходящими из верхнего грудного и звездчатого узлов симпатического ствола, находящимися в составе нервных сплетений, которые окружают питающие орган сосуды[8][9][10]. Капсула тимуса иннервируется ветвями диафрагмальных нервов[en][11].
Гистология[править | править код]
Микроскопическое строение вилочковой железы
Окрашенный гистологический препарат — видны концентрические тельца мозгового вещества тимуса
Вилочковая железа имеет дольчатое строение, в ткани дольки различают корковое и мозговое вещество. Корковое вещество расположено на периферии дольки и в гистологическом микропрепарате выглядит тёмным (в нём много лимфоцитов — клеток с крупными ядрами). В корковом веществе расположены артериолы и кровеносные капилляры, имеющие гемато-тимусный барьер, препятствующий заносу антигенов из крови.
Корковое вещество содержит клетки:
- эпителиального происхождения:
- опорные клетки: формируют «каркас» ткани, образуют гемато-тимусный барьер;
- звездчатые клетки: секретируют растворимые тимические (или тимусные) гормоны — тимопоэтин, тимозин и другие, регулирующие процессы роста, созревания и дифференцировки Т-клеток и функциональную активность зрелых клеток иммунной системы.
- клетки-«няньки»: имеют инвагинации, в которых развиваются лимфоциты;
- гематопоэтические клетки:
- лимфоидного ряда: созревающие T-лимфоциты;
- макрофагального ряда: типичные макрофаги, дендритные и интердигитирующие клетки.
Непосредственно под капсулой в клеточном составе преобладают делящиеся Т-лимфобласты. Глубже находятся созревающие Т-лимфоциты, постепенно мигрирующие к мозговому веществу. Процесс созревания занимает примерно 20 суток. В ходе созревания их происходит реаранжировка генов и формирование гена, кодирующего TCR (Т-клеточный рецептор).
Далее они претерпевают положительную селекцию: во взаимодействии с эпителиальными клетками отбираются «функционально пригодные» лимфоциты, которые способны взаимодействовать с HLA; в ходе развития лимфоцит дифференцируется в хелпер или киллер, то есть на его поверхности остаётся либо CD4, либо CD8. Далее в контакте с эпителиальными клетками стромы отбираются клетки, способные к функциональному взаимодействию: CD8+ лимфоциты, способные к рецепции HLA I, и CD4+ лимфоциты, способные к рецепции HLA II.
Следующий этап — отрицательная селекция лимфоцитов — протекает на границе с мозговым веществом. Дендритные и интердигитирующие клетки — клетки моноцитарного происхождения — отбирают лимфоциты, способные к взаимодействию с антигенами собственного организма, и запускают их апоптоз.
В мозговом веществе в основном содержатся дозревающие Т-лимфоциты. Отсюда они мигрируют в кровоток венул с высоким эндотелием и расселяются по организму. Предполагается также наличие здесь зрелых рециркулирующих Т-лимфоцитов.
Клеточный состав мозгового вещества представлен опорными эпителиальными клетками, звездчатыми клетками, макрофагами. Имеются также выносящие лимфатические сосуды и тельца Гассаля.
Физиология[править | править код]
Функции[править | править код]
Основная роль тимуса — дифференцировка и клонирование Т-лимфоцитов. В тимусе Т-лимфоциты проходят селекцию, в результате чего в кровоток и ткани выходят клетки, которые могут вовлекаться в иммунный ответ против определённых чужеродных антигенов, но не собственного тела. Вырабатывает гормоны: тимозин, тимулин, тимопоэтин, инсулиноподобный фактор роста-1 (ИФР-1), тимусный гуморальный фактор — все они являются белками (полипептидами). При гипофункции тимуса — снижается иммунитет, так как снижается количество Т-лимфоцитов в крови.
Рядом исследований продемонстрирован мнемотропный эффект пептидов тимуса: показано активирующее влияние интраназального введения тактивина и тимозина фракции 5 на процесс формирования условного рефлекса активного избегания, их стресспротекторные свойства и ноотропный эффект от введения в экспериментах на крысах[12]. Влияние пептидов тимуса на функциональную активность центральной нервной системы также заключается в снижении тревожности и увеличении исследовательской активности крыс[13]. Получены интересные результаты о связи состояния тимуса с долголетием человека: в ходе применения препаратов для продления деятельности вилочковой железы снизился биологический возраст девяти испытуемых[14].
Регуляция[править | править код]
Секреция тимических гормонов и функция тимуса регулируется глюкокортикоидами — гормонами коры надпочечников, а также растворимыми иммунными факторами — интерферонов, лимфокинов, интерлейкинов, которые вырабатываются другими клетками иммунной системы. Глюкокортикоиды угнетают иммунитет, а также многие функции тимуса, и приводят к его атрофии.
Пептиды шишковидной железы замедляют инволюцию тимуса[15]. Аналогичным образом действует её гормон мелатонин, способный даже вызывать «омоложение» органа[16]. «Омоложению» тимуса также может способствовать лимфопоэтический фактор роста интерлейкин 7[17], что в будущем может быть использовано для разработки методов восстановления иммунной функции у пожилых людей с помощью лечения рекомбинантным интерлейкином 7[18][19].
Морфогенез[править | править код]
Онтогенез[править | править код]
У эмбриона человека тимус закладывается на 6 неделе развития[20] в энтодерме третьего жаберного кармана. У новорождённого тимус развит до 15 г, к 15 годам увеличиваясь до 40 г. В дальнейшем, к 30 годам вес составляет около 25 г, к 70 годам — всего около 6 г. В исключительных случаях у взрослого человека может не происходить ярко выраженной инволюции вилочковой железы, такое состояние носит название лат. status thymicolymphaticus[11]. Инволюция железы задерживается также у кастрированных животных[21].
Строма тимуса имеет эпителиальное происхождение, происходит из эпителия передней части первичной кишки. Два тяжа (дивертикула) берут начало из третьей жаберной дуги и прорастают в переднее средостение. Иногда строма тимуса формируется также добавочными тяжами из четвёртой пары жаберных дуг. Лимфоциты происходят из стволовых клеток крови, мигрирующих в тимус из печени на ранних стадиях внутриутробного развития. Первоначально в ткани тимуса происходит пролиферация различных клеток крови, но вскоре его функция сводится к образованию Т-лимфоцитов.
Размеры тимуса максимальны в детском возрасте, но после начала полового созревания тимус подвергается значительной атрофии и инволюции. Дополнительное уменьшение размеров тимуса происходит при старении организма, с чем отчасти связывают понижение иммунитета у пожилых людей.
Филогенез[править | править код]
Заболевания тимуса[править | править код]
- Синдром MEDAC
- Синдром Ди Георга
- Миастения — может быть самостоятельным заболеванием, но часто ассоциирована с патологией тимуса и тимомой
Опухоли[править | править код]
- Тимома — из эпителиальных клеток вилочковой железы
- Т-клеточная лимфома — из лимфоцитов и их предшественников
- Пре-Т-лимфобластные опухоли в ряде случаев имеют первичную локализацию в тимусе и выявляются как массивный инфильтрат в средостении с последующей быстрой трансформацией в лейкоз.
- нейроэндокринные опухоли
- более редкие опухоли (сосудистого и нервного происхождения)
Опухоли вилочковой железы могут быть проявлением синдрома множественной эндокринной неоплазии I типа.[22]
Тимус в культуре[править | править код]
Тимус животных может употребляться в пищу человеком, к примеру в таких блюдах как: сладкое мясо, уйкулук[tr].
См. также[править | править код]
- Гемато-тимусный барьер
- Вилочка
- Сумка Фабрициуса
- Тимэктомия[en] — оперативное удаление тимуса[23]
Примечания[править | править код]
- ↑ 1 2 Foundational Model of Anatomy
- ↑ Ковальчук Л. В., Алёшин Б. В., Сорокин А. Ф., Юсфина Э. 3., Ивановская Т. Е., Кузин М. И., Пирогов A. И., Панов Н. А., Таболин B. А. Вилочковая железа // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3-е изд. — М. : Советская энциклопедия, 1977. — Т. 4 : Валин — Гамбия. — 576 с. : ил.
- ↑ Тимус // Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов. — М. : Большая российская энциклопедия, 2004—2017..
- ↑ Gray, H. 4c. The Thymus // (bartleby.com) Anatomy of the Human Body (неопр.). — Philadelphia: Lea & Febiger (англ.)русск., 1918.
- ↑ Миастенические расстройства: физиологииа, патофизиологииа, клиника / Под ред. Н. И. Гращенкова. Лаборатория по изучению нервных и гуморальных регуляции АН СССР // М.: Наука, 1965. — 308 с. (С. 56-60).
- ↑ Щербина В.И., Банина В.Б., Бородулина Л.Г., Полянская З.И., Степанова Е.А. ШЕЙНАЯ ЛОКАЛИЗАЦИЯ АБЕРРАНТНОЙ ВИЛОЧКОВОЙ ЖЕЛЕЗЫ // Детская хирургия.. — 2009. — № 1. — С. 52. — ISSN 1560-9510.
- ↑ Вилочковая железа // Ветеринарный энциклопедический словарь — М.: Советская энциклопедия, 1981. — 640 с.
- ↑ Parasympathetic innervation of the thymus: a histochemical and immunocytochemical study
- ↑ Noradrenergic and peptidergic innervation of lymph… [J Immunol. 1985] — PubMed — NCBI
- ↑ Innervation of the Human Thymus and Spleen — an Overview
- ↑ 1 2 Синельников Р. Д., Синельников Я. Р., Синельников А. Я. Атлас анатомии человека. Том 3: Учение о сосудах и лимфоидных органах / Изд. 7-е, перераб. В 4-х томах // М.: Новая волна, 2009. — 216 с. ISBN 978-5-7864-0201-9. С. 197, 201.
- ↑ Мнемотропный эффект интраназального введения пептидов тимуса. cyberleninka.ru. Дата обращения: 21 июня 2017.
- ↑ Medline.ru – Биомедицинский журнал | Влияние интраназального введения пептидов тимуса на поведение и обучение крыс. medline.ru. Дата обращения: 21 июня 2017.
- ↑ Gregory M. Fahy, Robert T. Brooke, James P. Watson, Zinaida Good, Shreyas S. Vasanawala. Reversal of epigenetic aging and immunosenescent trends in humans (англ.) // Aging Cell. — 2019. — Vol. 18, iss. 6. — P. e13028. — ISSN 1474-9726. — doi:10.1111/acel.13028.
- ↑ SpringerLink — Advances in Gerontology, Volume 1, Number 3 (недоступная ссылка)
- ↑ Rejuvenation of degenerative thymus by oral mel… [J Pineal Res. 2001] — PubMed — NCBI
- ↑ Aspinall, R., Pido-Lopez, J., Imami, N., Henson, S. M., Ngom, P. T., Morre, M., … & Heeney, J. L. (2007). Old rhesus macaques treated with interleukin-7 show increased TREC levels and respond well to influenza vaccination. Rejuvenation research, 10(1), 5-18. doi:10.1089/rej.2006.9098 PMID 17378748
- ↑ Aspinall, R., & Lang, P. O. (2018). Interventions to restore appropriate immune function in the elderly. Immunity & Ageing, 15(1), 5. doi:10.1186/s12979-017-0111-6 PMC 5785902
- ↑ Aspinall, R., & Lang, P. O. (2018). Interleukin-7 and Immunorejuvenation In: Fulop T., Franceschi C., Hirokawa K., Pawelec G. (eds) Handbook of Immunosenescence. Springer, Cham. https://doi.org/10.1007/978-3-319-64597-1_72-1
- ↑ Вилочковая железа // Вешин — Газли. — М. : Советская энциклопедия, 1971. — С. 60. — (Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров ; 1969—1978, т. 5).
- ↑ Зобная железа // Земля — Индейцы. — М. : Советская энциклопедия, 1952. — С. 140. — (Большая советская энциклопедия : [в 51 т.] / гл. ред. Б. А. Введенский ; 1949—1958, т. 17).
- ↑ Simultaneous double thymic carcinoids: a rare initial manifestation of multiple endocrine neoplasia type 1 – Springer. Дата обращения: 29 марта 2013. (недоступная ссылка)
- ↑ Морозов Ю. И. Тимэктомия // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3-е изд. — М. : Советская энциклопедия, 1985. — Т. 25 : Тениус — Углекислота. — 544 с. : ил.
Литература[править | править код]
- Гистология, цитология и эмбриология (учебник для вузов). Кузнецов С. Л., Мушкамбаров Н. Н. — М.: МИА, 2007.
- Анатомия человека. В двух томах. Т.2/Авторы: М. Р. Сапин, В. Я. Бочаров, Д. Б. Никитюк и др./Под редакцией М. Р. Сапина. — 5-е издание, переработанное и дополненное. — М.: Медицина, 2001. — 640 с.: ил. ISBN 5-225-04586-3
- Курс лекций по патологической анатомии. Частный курс. Часть II, книги 1,2. / Под ред. академика РАН и РАМН, профессора М. А. Пальцева. — М.: ООО «Издательский дом „Русский врач“», 2003. — 210 с.
- Горлова А. В., Павлов Д. А., Ольховик А. Ю., и др. Мнемотропный эффект интраназального введения пептидов тимуса // Здоровье и образование в XXI веке. — 2016. — Т. 18. — № 1. — С. 1—5. [Gorlova AV, Pavlov DA, Olkhovik AYu, et al. Mnemotropic effect of intranasal administration of thymus peptides. Health and Education Millennium. — 2016. — 18(1): 1—5.]
- Ольховик А. Ю., Новоселецкая А. В. Влияние интраназального введения пептидов тимуса на поведение и обучение крыс // Medline.ru. — 2015. — Т. 16. — С. 1106—1117.
- Зобная железа // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Источник