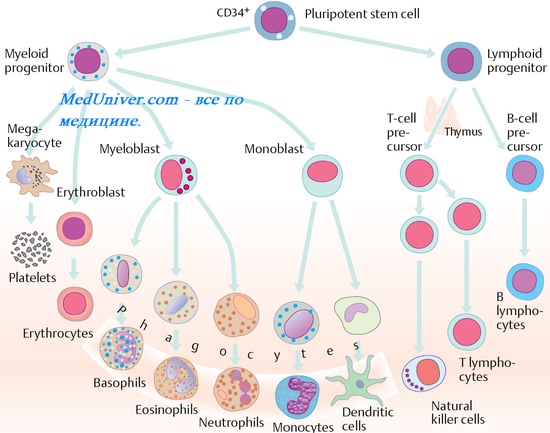
Этапы дифференцировки в лимфоцитов

Оглавление темы “СD8 лимфоциты. Антиген ( Аг ) представляющие клетки. Классификация антигенов ( Аг ).”:
1. Рецептор Т-клеток. Активация Т-лимфоцитов. Субпопуляции Т-лимфоцитов. СD4+ лимфоциты.
2. СD8 лимфоциты. Т супрессоры. Цитотоксические Т-лимфоциты ( ЦТЛ ). Т-киллеры. Цитотоксический эффект Т-киллеров. Т-клетки памяти.
3. В-лимфоциты. В-клетки. Созревание В-лимфоцитов. Продолжительность жизни B-лимфоцитов. Маркеры В-клеток ( В-лимфоцитов ).
4. Естественные киллеры ( NK-клетки ). Перфорины. Функция естественных киллеров. Задачи NK-клеток.
5. Антиген ( Аг ) представляющие клетки. Иммунные реакции. Классификация имунных реакций. Антигены. Свойства антигенов. Структура антигенов ( Аг ). Валентность Аг.
6. Классификация антигенов ( Аг ). Иммуногены. Гаптены. Непреципитирующие гаптены. Преципитирующие гаптены. Полугаптены. Проантигены.
7. Адъюванты. Адъювант Фройнда. Толерогены. Природа антигенов (Аг). Происхождение антигенов. Молекулярная масса антигенов (Аг).
8. Специфичность антигенов (Аг). Видовые антигены. Групповые антигены (Аг). Гетерогенные антигены (Аг). Антиген Форссмана. Аллоантигены ( изоантигены ).
9. Патологические антигены. Аутоантигены. Врождённые аутоантигены. Приобретённые аутоантигены. Суперантигены.
10. Антигены ( Аг ) микроорганизмов. Антигены бактерий. Капсульные антигены ( К-антигены ( Аг )). Соматические антигены ( O-антигены ( Аг )). Жгутиковые антигены ( H-антигены ( Аг )). Vi-Ar ( Антиген вирулентности ).
В-лимфоциты. В-клетки. Созревание В-лимфоцитов. Продолжительность жизни B-лимфоцитов. Маркеры В-клеток ( В-лимфоцитов ).
Известны субпопуляции В-клеток: предшественники антителообразующих (плазматических) клеток и В-клетки памяти (эффекторы вторичных иммунных реакций). Доминирующую субпопуляцию составляют предшественники антителообразующих клеток, дифференцирующиеся после антигенной стимуляции в плазматические клетки (плазмоциты), синтезирующие Ig.
Созревание В-лимфоцитов
Из костного мозга пре-В-клетки мигрируют в тимуснезависимые зоны лимфоидных органов. Так, в физиологических условиях в селезёнке В-лимфоциты располагаются в краевой зоне белой пульпы, в лимфатических узлах — в наружной зоне кортикального слоя, где они формируют зародышевые центры фолликулов. Сигналы, определяющие судьбу и дифференцировку этих иммунокомпетентных клеток, поступают из красного костного мозга, стромальных клеток и других клеток иммунной системы.
На периферии (вне костного мозга) В-лимфоциты приобретают характерные для них поверхностно-клеточные маркёры. Продолжительность жизни В-лимфоцитов различна — от многих лет (В-клетки памяти) до нескольких недель (клоны плазматических клеток).
После антигенной стимуляции В-лимфоциты дифференцируются в плазматические клетки (интенсивно синтезирующие и секретирующие AT) и В-клетки памяти. Плазматические клетки синтезируют Ig того же класса, что и мембранный Ig В-лимфоцита-предшественника.
Маркеры В-клеток ( В-лимфоцитов )
Основные маркёры В-лимфоцитов — мембранные Ig при этом клетки одного клона (быстро формирующегося в результате серии последовательных делений потом-ства одной В-клетки ) экспрессируют молекулы Ig, специфически связывающие только один эпитоп Аг. Такие клетки синтезируют моноклональные AT, способные распознавать и связывать только один Аг. Аг-связывающий участок мембранного Ig В-лимфоцита играет роль клеточного Аг-распознающего рецептора.
Помимо мембранных Ig, В-лимфоцит несёт другие маркёры; рецепторы Fc-фрагмента Ig, CD10 {на незрелых В-клетках), CD19, CD20, CD21, CD22, CD23 (вероятно, участвуют в клеточной активации), рецепторы к С3b и C3d, молекулы МНС классов I и И.
– Также рекомендуем “Естественные киллеры ( NK-клетки ). Перфорины. Функция естественных киллеров. Задачи NK-клеток.”
Источник
Инициация дифференцировки В-лимфоцитов. Схема начала дифференцировки В-клетокСодержание цАМФ и цГМФ в клетках в значительной мере определяется соотношением между активностью аденилциклазы и гуанилциклазы (катализирующих их образование из АТФ и ГТФ), с одной стороны, и активностью фосфодиэстераз, катализирующих их распад,— с другой. Гормоны, соединяясь с рецепторами поверхности клеток, активируют эти ферменты, фиксированные в клеточных мембранах. Это приводит к изменению внутри клеток как соотношения, так и уровня цАМФ и цГМФ и изменяет ход ряда внутриклеточных биохимических процессов (Chandra е. а., 1974). Было заманчиво предположить, что именно таким образом антигены и митогены, присоединившись к рецепторам поверхности В-лимфоцитов, «запускают» в них цепь биохимических процессов, приводящих к дифференцировке и пролиферации. Изучение этого вопроса проводилось в нескольких направлениях. Согласно этой схеме, антиген, реагируя с иммуноглобулиновыми рецепторами мембраны, активирует аденилциклазу, увеличивает синтез цАМФ и изменяет в ее пользу соотношение цАМФ/цГМФ. Это сдвигает биохимические процессы в сторону негативной реакции. В отличие от антигена сигнал Т-клеток и митогены, действуя на мембрану клеток, активируют гуанилциклазу и сдвигают соотношение цАМФ/цГМФ в пользу цГМФ. Это направляет биохимические процессы в сторону позитивной иммунной реакции, связанной с пролиферацией и дифференциацией соответствующих клеток. 1. Добавление митогенов как В-клеток (Watson, 1975a), так и Т-клеток (Hadden е. а., 1972, 1976) вызывает быстрое (за 15—30 мин) и резкое (в 5—50 раз) увеличение содержания цГМФ без значительного изменения уровня цАМФ (De Rubertis е. а., 1974). 2. Основная масса (свыше 90%, по данным Watson, 1975a) аденилциклазы и гаунилциклазы фиксирована в лимфоцитах на их клеточных мембранах. Митогены могут активировать эти ферменты (Watson, 1975b; Smith е. а., 1971). 3. Отношение цАМФ/ /цГМФ в медленно пролиферирующих культурах значительно выше, чем в быстро пролиферирующих. Так, оно в клетках селезенки бестимусных мышей после стимуляции митогеном липополисахаридом падало с 9,2 до 3,1 (Watson, 1975b).
4. Добавление цГМФ к клеткам селезенки бестимусных мышей вызывало резкое усиление синтеза ДНК. Ауторадиографически тимидиновая метка обнаруживалась после стимуляции в 10% клеток суспензии селезенки (вместо 1 % в контроле). В противоположность этому действие цАМФ тормозило синтез ДНК (Webb е. а., 1975; Watson, 1975b). Такое же действие оказывали вещества (например, токсин холеры, простагладин, теофиллин), повышавшие эндогенный уровень цАМФ вследствие активации аденилциклазы или ингибиции цАМФ-фос-фодиэстеразы (De Rubertis, 1974). В пользу значения изменения содержания цАМФ для развития антителообразования указывают опыты, в которых изучалось это изменение после иммунизации мышей эритроцитами барана. Уровень цАМФ в клетках селезенки сразу же (через 2 мин) после иммунизации резко (в 2— 3 раза) увеличивался, но затем снижался на весь период наиболее интенсивной пролиферации АОК (Plescia е. а., 1975; Yammamoto, Webb, 1975). При действии митогенов на Т-клетки увеличение содержания цГМФ или цАМФ наблюдали многие исследователи (например, Hadden е. а., 1976). Необходимо, однако, отметить, что как обсуждавшаяся схема, так и вообще изучение роли циклических 3′,5′-монофосфатнуклеотидов сталкивается со многими трудностями. Во-первых, повышение внутриклеточного содержания цГМФ вызывают многие вещества, не обладающие митогенным действием. Во-вторых, в определенных условиях добавление цАМФ резко стимулирует синтез ДНК (Mac Manus е. а., 1975). В-третьих, популяция лимфатических клеток очень геторогенна и опасно связывать изменения, выявленные при суммарном анализе популяции, с изменениями в изучаемом клоне АОК. Гетерогенность популяции лимфатических клеток делает очень сложным и изучение действия на них извне добавленного цАМФ или соединений, повышающих его внутриклеточный уровень. Некоторые исследователи при этом наблюдали подавление антителообразования (Chandra е. а., 1974; Watson, 1975а), а другие — стимуляцию (Ishizuka е. а., 1970; Winchurch, 1974). Кроме того, действие цАМФ и цГМФ может быть противоположным в зависимости от их концентрации (Webb е. а., 1973). И, наконец, имеются убедительные данные в пользу того, что участие цАМФ в регуляции клеточного цикла необязательно. На это указывает сохранение нормального клеточного цикла у мутантов мышиной лимфомы S49 несмотря на отсутствие у них зависимой от цАМФ протеинкиназы. Добавление к этим клеткам даже большого количества цАМФ не ингибировало их пролиферацию (Coffino е. а., 1975). Несмотря на все эти трудности, изучение роли циклических 3′-,5′-нуклеотидов в активации В-лимфоцитов является весьма перспективным. – Также рекомендуем “Длительность генерации антителообразующей клетки. Формирование АОК” Оглавление темы “Антителообразующие клетки. Контроль образования антител”: |
Источник
У взрослого человека и большинства млекопитающих, включая грызунов, В-лимфоциты развиваются в костном мозгу, а в период эмбрионального развития — в фетальной печени. У птиц В-клетки развиваются в бурсе Фабриция, у жвачных млекопитающих — в кишечнике (см. раздел 3.4.1.3).
Заключительные этапы развития В-клетки проходят вне костного мозга во вторичных лимфоидных органах.
Общий лимфоидный предшественник
В-клетки, как и другие популяции лимфоцитов, развиваются из общего лимфоидного предшественника — CLP (от англ. common lymphoid progenitor), который, в свою очередь, происходит от полипотентной кроветворной стволовой клетки (см. раздел 2.1.1). Наиболее ранним признаком обособления лимфоидного предшественника от общего ствола считают экспрессию транскрипционного фактора Icaros, обеспечивающего ремоделирование хроматина, что делает доступными для действия ядерных дифференциро- вочных факторов гены, важные для развития лимфоцитов.
Как и более ранние родоначальные клетки, а также общий миелоидный предшественник, CLP лишен маркеров, свойственных основным линиям кроветворных клеток (линейных маркеров) . Подобно стволовым клеткам, CLP экспрессируют молекулу CD34, но помимо нее несут мембранную молекулу CD45RA. Обычно CLP имеют также рецепторы для гемопоэтических факторов — c-Kit (для SCF) и Flt-3 (для лимфопоэтического фактора Flt-3L). Все это отличает CLP от общих миелоидных предшественников. Одна часть CLP несет на своей поверхности молекулу CD7, другая — CD10.
CD10+ CLP со временем дополнительно экспрессирует рецептор для IL-7 (CD127) — фактора роста для всех незрелых форм лимфоидных клеток. Они дают начало В-лимфоцитам и, частично, плазмоцитоидным дендритным клеткам.
Дифференцировка В-лимфоцитов
Основное событие дифференцировки В-клеток — формирование BCR, а точнее, лежащая в его основе перестройка V-генов иммуноглобулинов. Выделяют несколько стадий развития В-лимфоцитов: про-В (от англ. progenitor — предок), пре-В (от англ. precursor — предшественник), незрелые В и зрелые наивные В-клетки. Стадии про-В- и пре-В-клеток в свою очередь подразделяют на подстадии I и II (соответственно, ранние и поздние) На стадии про-В-II перестраиваются гены Н-цепей. На стадии пре-В «проверяется» правильность прошедшей реаранжировки и перестраиваются гены L-цепей. На стадии незрелой В-клетки белковый продукт перестроенных генов иммуноглобулинов экспрессируется на мембране клетки в виде мембранного IgM, на стадии зрелой В-клетки к нему присоединяется IgD.
Реаранжировка V-генов иммуноглобулина описана выше (см. раздел 3.1.4.1). В этом разделе рассмотрим осуществление этого процесса в связи со стадиями дифференцировки В-лимфоцитов. Перестройку V-генов в В-клетках контролирует микроокружение, индуцирующее экспрессию в них вышеупомянутых дифференцировочных факторов. Развитие лимфоцитов в направлении В-клеток направляют факторы E2A, EBF и Pax5 (см. рис. 3.35). Экспрессию Рах5 (Paired box protein 5) рассматривают как ключевой маркер обособления В-линии. Рах5 имеет прямое отношение к включению реаранжировки V-генов в В-клетках и экспрессии молекулы CD19. Фактор EBF отвечает за экспрессию гена корецептора Iga — наиболее раннего белкового маркера В-лимфоцитов, появляющегося (вначале внутриклеточно) уже на стадии про-В-I. Затем (на стадии про-В-II) на поверхности В-клетки экспрессируется молекула CD19.
Периоды экспрессии генов, участвующих в формировании зрелого BCR в процессе развития В-лимфоцитов, представлены на рис. 3.37. На стадии про-В-II экспрессируются гены RAG1 и RAG2, продукты которых (эндонуклеазы) отвечают за включение процесса реаранжировки V-генов, а также ген, кодирующий фермент терминальную дезоксинуклеотидилтрансфе- разу (TdT), обеспечивающий нематричное добавление нуклеотидов при D-J рекомбинации. Первыми перестраиваются V-гены Н-цепей (Vj-гены). Этот процесс осуществляется на стадии про-В-II. Сначала перестраиваются случайно выбранные D- и J-сегменты, в результате чего формируется объединенный участок D^fe. Этот процесс может происходить одновременно на обоих хромосомах. Неудачи при такой перестройке редки, поскольку обычная их причина — сдвиг рамки считывания последовательности ДНК — не влияет на копирование D-сегментов (они могут считыватья без ограничения конкретной рамкой). Второй наиболее ответственный этап состоит в соединении случайного зародышевого V-сегмента и перестроенного DJ-сегмента и формировании «зрелого» гена VDJ. Этот процесс проходит на стадии про-В-II клеток сначала только в одной из двух хромосом. Вероятность успешной перестройки на этом этапе (соответствия допустимой рамке считывания) составляет 1/3, поскольку кодон включает 3 нуклеотида. При успешном завершении этого процесса экспрессируется готовый продукт — перестроенная Н-цепь, а перестройка гомологичного гена на другой хромосоме блокируется. Если реаранжировка прошла неудачно, перестраивается Vj-ген на другой хромосоме. Частота успешных

Рис. 3.37. Динамика перестройки V-генов иммуноглобулинов и экспрессии генов, продукты которых участвуют в реализации этого процесса. Прямоугольники обозначают стадии, на которых экспрессируются указанные гены. Внизу указано состояние перестройки V-генов H- и L-цепей: Зар. — зародышевая конфигурация гена

Рис. 3.38. Структура пре-В-клеточного и пре-Т-клеточного рецепторов. Обращает на себя внимание присутствие необычных доменов в суррогатных L-цепях и продукте гена PТa
перестроек генов на обеих хромосомах составляет около 55% в соответствии с расчетом: 0,33+(0,33х0,67)=0,55, т.е. 55%. Неудачная реаранжировка гена на второй хромосоме приводит к гибели клетки по механизму апоптоза.
Успешная перестройка Vj-гена приводит к экспрессии p-цепи, что знаменует переход клетки-предшественника на стадию пре-В-I клеток. p-Цепь появляется в цитоплазме пре-В-клетки, а также в составе мембранного продукта, называемого pre-BCR (рис. 3.38). Экспрессия pre-BCR сигнализирует об успешном завершении перестройки ^-генов. Помимо p-цепи, пре-BCR содержит так называемую суррогатную L-цепь. Она состоит из продуктов двух генов — VpreB и А.5. Эти молекулы уже присутствуют в клетке на момент окончания перестройки гена p-цепи. Как и при построении нормального зрелого BCR, к пре^-рецептору присоединяются сигнальные корецепторные молекулы Iga и Igp. Полагают, что в данном случае сигнал от пре^-рецеп- тора возникает не вследствие связывания какого-то лиганда, а как результат правильной сборки и встраивания данной молекулы в мембрану клетки. Это событие представляет первую контрольную точку в процессе развития В-клетки. Сигнал от pre-BCR необходим для выживания пре-В-клеток (при этом усиливается экспрессия антиапоптотического фактора Bcl-2), их пролиферации (на стадиях пре-В-I и пре-В-II) и перехода к очередному этапу перестройки V-генов. В результате пролиферации число пре^-клеток увеличивается в 20 раз. Выполнив свою функцию, пре-B-рецептор исчезает с поверхности В-клетки и больше не экспрессируется.
Перестройка VL-reHOB происходит на стадии пре-В-II. Ей предшествует возобновление временно прекращавшейся экспрессии генов RAG1 и RAG2. Последовательность перестройки в принципе такая же, как и для Yj-гена, однако имеется 2 основных отличия. Во-первых, в комплексе зародышевого ^-гена отсутствует D-сегмент, поэтому соединяются сразу V- и J-сегменты зародышевого гена. Во-вторых, существует 2 гена L-цепей, кодирующие взаимозаменяемые к- и L-цепи. Они подвергаются перестройке в определенной последовательности. Сначала перестаивается V-ген к-цепи на одной их хромосом. При неудаче перестраивается ген к-цепи на другой хромосоме. Только при неудачной перестройке обоих ^-генов в процесс вовлекаются поочередно V^-гены сначала одной, затем другой хромосомы. В результате вероятность успешной перестройки ^-генов увеличивается в 2 раза. Кроме того, при неудачной перестройке ^-генов процесс повторяется с вовлечением «дистальных» (т.е. удаленных о J-сегмента) V-сегментов, редко вовлекаемых в перестройку при «первой попытке». То обстоятельство, что в перестройку сначала вовлекаются гены к- и лишь затем L-цепи, обусловливает более частое использование для построения молекулы иммуноглобулина к-, чем L-цепей. При перестройке генов L-цепей TdT не экспрессируется, а следовательно нематричной достройки олигонуклеотидов не происходит, т.е. N-вставки в V-генах L-цепей отсутствуют.
Успешная перестройка ^-генов завершается экспрессией L-цепей, которые, соединяясь с Н-цепями, формируют полноценную молекулу иммуноглобулина. «Зрелая» молекула иммуноглобулина, встроенная в мембрану эндоплазматического ретикулума, доставляется на поверхность В-клетки. При этом на поверхности лимфоцита уже присутствуют все остальные компоненты BCR. При успешной сборке и экспрессии зрелого рецептора, В-клетка получает второй контрольный сигнал, приводящий к прекращению экспрессии генов RAG1 и RAG2.
Первым типом Н-цепей, который синтезируется в созревающей клетке и появляется на ее поверхности, является IgM. Стадию, на которой на поверхности В-клетки присутствуют иммуноглоублины только этого изотипа, называют стадией незрелой В-клетки. Завершающее событие в созревании В-лимфоцита — экспрессия на его поверхности IgD (вместе с IgM, а не вместо него). Хотя суммарная экспрессия мембранных иммуноглобулинов и, в целом, BCR при этом возрастает, экспрессия IgM несколько снижается. Кроме того, при созревании В2-лимфоциты экспрессируют мембранные молекулы СD21 и СD23. Изменение экспрессии наиболее значимых мембранных молекул В-лимфоцитов в процессе их развития отражено на рис. 3.39.
Поскольку успешная перестройка каждого V-гена блокирует перестройку аллельных генов (т.е. осуществляется «аллельное исключение»), все молекулы иммуноглобулина, присутствующие на поверхности В-клетки, идентичны по изотипу L-цепей и по структуре V-генов. Это обусловливает одинаковую специфичность рецепторных иммуноглобулинов В-клетки, т.е. все рецепторы конкретного В-лимфоцита имеют одинаковое сродство к антигену. Поскольку перестройка V-генов происходит в каждой клетке автономно, все созревающие В-лимфоциты уникальны по специфичности их рецепторов. Последующая пролиферация В-клеток приводит к образованию клонов, в пределах каждого из которых В-клетки несут идентичные по специфичности

Рис. 3.39. Экспрессия мембранных маркерных молекул при созревании В-лимфоци- тов. Указаны стадии дифференцировки В-клеток, на которых они экспрессируют соответствующие молекулы
BCR, отличающиеся от таковой В-клеток других клонов. Таким образом формируется клональная структура — популяция В-лимфоцитов.
В процессе созревания В-лимфоциты подвергаются действию факторов, обеспечивающих их жизнеспособность и пролиферацию. В отсутствие таких факторов созревающие В-клетки погибают. Основной ростовый фактор В-лимфоцитов на ранних этапах их развития — IL-7 (у мышей), вырабатываемый клетками стромы костного мозга и лимфоидных органов. IL-7 поддерживает жизнеспособность и обеспечивает пролиферацию CLP, а также предшественников Т- и В-лимфоцитов. Все эти клетки несут на мембране рецепторы для IL-7, состоящие из а- и у-цепей (у-цепь — общая для рецепторов нескольких цитокинов, о чем уже упоминалось). Однако у человека IL-7 не играет такой важной роли в развитии В-клеток: мутации генов IL-7 или его рецептора приводят к блокированию развития Т-, но не В-лимфоцитов. Природа фактора-двойника IL-7, обеспечивающего развитие В-лимфоцитов человека в этой ситуации, неизвестна.
Установлено, что 55—75% В-клеток, образующихся в костном мозгу, специфичны к собственным антигенам организма — аутоантигенам. Уже в костном мозгу значительная часть новообразованных В-клеток распознает аутоантигены. Однако незрелые В-клетки не активируются при связывании их BCR с антигеном. Распознавание аутоантигенов служит сигналом к «редактированию» генов BCR. Этот процесс заключается в повторной перестройке V-генов с вовлечением сегментов, не задействованных
в предыдущей реаранжировке. При успешном редактировании В-клетка теряет аутореактивность. Если же этого не происходит, клетки выбраковываются путем апоптоза или подвергается очередным этапам селекции в периферическом отделе иммунной системы (рис. 3.40).
Переходные фазы развития и селекция В-клеток
В-клетки эмигрируют на периферию, полностью не завершив своего развития. Переходные стадии развития, которые они проходят на периферии, обозначают Т1, Т2 и Т3 (от англ. Transient). Фенотип В-клеток на стадии Т1 — IgMhi IgD-/l° CD23- CD21l° CD24hi (молекула CD24 показывает, что клетка недавно покинула костный мозг). T1 В-клетки получают через BCR-сигнал, обеспечивающий их выживание, по-видимому, без участия антигенов (положительная селекция) (табл. 3.11).
Затем В-клетки переходят на стадии Т2 и Т3, характеризующиеся фенотипом IgMhi IgDhi CD21int СD23+ (int — промежуточная экспрессия) и IgMl° IgDhi CD21int СD23+. На этих этапах выживаемость клеток и их пролиферацию регулирует комбинация сигналов, поступающих через BCR (теперь уже под действием антигенов) и рецепторов для BAFF — BAFF-R, TAC-1, BCMA. Активирующие сигналы через BCR и BAFF приводят к экспрессии транскрипционных факторов NFkB, (классический и альтернативный факторы, имеющие состав, соответственно, p50RelA и p52RelB). Взаимодействие этих факторов играет важную роль в поддержании жизнеспособности В-клеток. Особенность Т2 В-клеток —
Таблица 3.11. Селекция клонов лимфоцитов в процессе развития
| Тип селекции | Объект селекции | Клетки, осуществляющие селекцию | Локализация процесса | Содержание процесса | Назначение процесса |
| Селекция В-лимфоцитов | |||||
| Положи тельная селекция | Незрелые В-клетки, стадия Т1 | Клетки стромы костного мозга | Костный мозг, селезенка, лимфоузлы | Сигнал через В-клеточ- ный рецептор, обеспечивающий выживаемость | Выход незрелых клеток в периферический пул В-лимфоци- тов |
| Отрица тельная селекция | Незрелые В-клетки, стадия Т2 | Осуществляется без участия дополнительных клеток | Костный мозг, селезенка, лимфоузлы | Дефицит рецепции BAFF при ответе на аутоантиген | Элимина ция аутоспеци фических В-клеток |
| Селекция Т-лимфоцитов | |||||
| р-Селек- ция | DTO-тимо- циты (дважды отрицательные CD44- CD25+ тимоциты) | Осуществляется без участия дополнительных клеток | Субкапсулярный слой тимуса | Выживают и пролиферируют клетки, правильно перестроившие Vp-ген TCR | Выбраковка клеток с дефектным геном Vp. Подготовка к перестройке гена Va |
| Положи тельная селекция | Дважды положи тельные тимоциты | Кортикальные эпителиальные клетки тимуса | Кора тимуса | Выживают клетки, способные распознавать молекулы MHC | Удаление клеток, не способных распознавать пептиды в составе молекул MHC (до 90%) |
| Отрица тельная селекция | Дважды положи тельные/ монополо жительные тимоциты | Дендритные клетки, медуллярные эпителиальные клетки тимуса | Кортико- медуллярная зона, мозговой слой тимуса | Погибают клетки, распознающие аутологичные пептиды с высокой степенью сродства | Выбраковка потенциально аутоагрессивных Т-клеток (до 5% от числа незрелых тимоцитов) |
низкая экспрессия рецепторов для BAFF. В результате В-клетки, связавшие антиген, не получают дополнительного сигнала через BAFF-рецепторы и подвергаются апоптозу. Поскольку на этом этапе развития в лимфоидных органах В-клетки реагируют исключительно с аутоантигенами, гибнут преимущественно В-лимфоциты аутореактивных клонов. Описанный механизм представляет периферический этап отрицательной селекции клонов В-клеток. Усиленная экспрессия рецепторов для BAFF на стадии Т2 В-клеток приводит к индукции аутоиммунных процессов. Установлено, что наряду с механизмом апоптотической элиминации аутоспецифических В-клеток срабатывает менее радикальный механизм индукции анергии (т.е. неотвечаемости) аутореактивных В-лимфоцитов. Обычно срок жизни таких клеток укорачивается, и они в конечном счете элиминируются в процессе естественного обновления популяции В-клеток. Несмотря на «щадящий» режим селекции, на этом этапе сохраняется лишь 10—30% В-клеток, вышедших из костного мозга, общие же потери В-клеток в процессе их развития превышают 95%. Экспрессия хемо- кинового рецептора CXCR5 позволяет выжившим клеткам мигрировать в фолликулы по градиенту хемокина CXCL13 (BLC).
После завершения переходной стадии развития В-клеток на их поверхности устанавливается нормальная экспрессия рецепторов для BAFF/APRIL и в ответ на связывание BCR с антигеном они не гибнут, а активируются и пролиферируют (см. раздел 3.5.2). Выжившие клетки представляют собой зрелые наивные В-лимфоциты, в совокупности образующие антигенраспоз- нающий репертуар В-лимфоцитов, необходимый для обеспечения развития гуморального адаптивного иммунного ответа.
Источник