Эффекторные субпопуляции т лимфоцитов
Оглавление темы “СD8 лимфоциты. Антиген ( Аг ) представляющие клетки. Классификация антигенов ( Аг ).”:
1. Рецептор Т-клеток. Активация Т-лимфоцитов. Субпопуляции Т-лимфоцитов. СD4+ лимфоциты.
2. СD8 лимфоциты. Т супрессоры. Цитотоксические Т-лимфоциты ( ЦТЛ ). Т-киллеры. Цитотоксический эффект Т-киллеров. Т-клетки памяти.
3. В-лимфоциты. В-клетки. Созревание В-лимфоцитов. Продолжительность жизни B-лимфоцитов. Маркеры В-клеток ( В-лимфоцитов ).
4. Естественные киллеры ( NK-клетки ). Перфорины. Функция естественных киллеров. Задачи NK-клеток.
5. Антиген ( Аг ) представляющие клетки. Иммунные реакции. Классификация имунных реакций. Антигены. Свойства антигенов. Структура антигенов ( Аг ). Валентность Аг.
6. Классификация антигенов ( Аг ). Иммуногены. Гаптены. Непреципитирующие гаптены. Преципитирующие гаптены. Полугаптены. Проантигены.
7. Адъюванты. Адъювант Фройнда. Толерогены. Природа антигенов (Аг). Происхождение антигенов. Молекулярная масса антигенов (Аг).
8. Специфичность антигенов (Аг). Видовые антигены. Групповые антигены (Аг). Гетерогенные антигены (Аг). Антиген Форссмана. Аллоантигены ( изоантигены ).
9. Патологические антигены. Аутоантигены. Врождённые аутоантигены. Приобретённые аутоантигены. Суперантигены.
10. Антигены ( Аг ) микроорганизмов. Антигены бактерий. Капсульные антигены ( К-антигены ( Аг )). Соматические антигены ( O-антигены ( Аг )). Жгутиковые антигены ( H-антигены ( Аг )). Vi-Ar ( Антиген вирулентности ).
Рецептор Т-клеток. Активация Т-лимфоцитов. Субпопуляции Т-лимфоцитов. СD4+ лимфоциты.
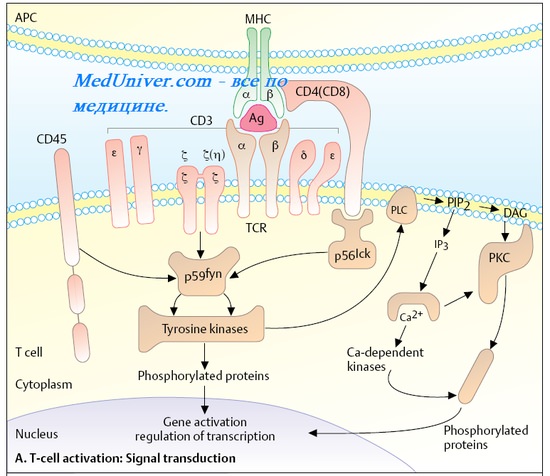
Рецептор Т-клеток. Т-клетки распознают Аг с помощью двух типов мембранных гликопротеинов — Т-клеточных рецепторов и CD3. Т-клеточный рецептор — гетеродимер, содержащий а- и р-цепи (примерно 98% всех Т-клеток) или 5-цепи (около 1,5-2% клеток) с молекулярной массой 40-50 кД. Т-клеточный рецептор входит в суперсемейство Ig-подобных молекул клеточной поверхности, участвующих в реакциях распознавания. Механизмы трансмембранной передачи с рецептора Т-клетки остаются неизвестными; предположительно они обусловлены CD3, нековалентно связанными с рецепторами Т-лимфоцитов.
Активация Т-клеток
Для активации Т-клеток необходимо два сигнала от макрофагов. Первый сигнал — представление Аг, второй— секреция активирующего фактора (ИЛ-1). Последний стимулирует синтез Т-лимфоцитами ИЛ-2, активирующего эти клетки (аутокринная регуляция). Одновременно на мембранах Т-клеток повышается экспрессия рецепторов к ИЛ-2 (CD25).

Субпопуляции Т-лимфоцитов
На основании поверхностных маркёров различают несколько субпопуляций Т-лимфоцитов, выполняющих различные функции. Для дифференцировки Т-клеток применяют набор моноклональных AT, выявляющих поверхностные маркерные CD-Aг [от англ. cluster of differentiation, кластер дифференцировки]. Все зрелые Т-клетки экспрессируют поверхностный CD3-Aг; помимо него субпопуляции Т-лимфоцитов также экспрессируют и другие CD-Aг.
СD4+ лимфоциты
Мембранные молекулы CD4 несут различные популяции клеток, условно разделяемые на регуляторные (хелперы) и эффекторные (Тгзт).
Т-хелперы [от англ. to help, помогать] специфически распознают Аг и взаимодействуют с макрофагами и В-клетками в ходе индукции гуморального иммунного ответа. Отношение CD4+/CD8+-клеток — важный параметр оценки иммунного статуса; в нормальных условиях отношение CD4+/CD8+ приблизительно равно двум и отражает доминирующее влияние на иммунный ответ стимулирующих факторов. При некоторых иммунодефицитных состояниях отношение обратное (менее I, то есть СD8+-клетки доминируют), указывая на преимущественное влияние иммуносупрессорных эффектов; лежит в основе патогенеза многих иммунодефицитов (например, СПИДа).
Аг распознающие Т-лимфоциты «узнают» чужеродный эпитоп вирусного или опухолевого Аг в комплексе с молекулой МНС на плазматической мембране клетки-мишени. Тгзт [Т-эффекторы реакций гиперчувствительности замедленного типа (ГЗТ)] опосредуют реакции ГЗТ.
– Также рекомендуем “СD8 лимфоциты. Т супрессоры. Цитотоксические Т-лимфоциты ( ЦТЛ ). Т-киллеры. Цитотоксический эффект Т-киллеров. Т-клетки памяти.”
Источник
24. Субпопуляции Т-лимфоцитов и их функции.
Варианты классификации лимфоцитов:
А. По происхождению:
– Т-лимфоциты (тимусзависимые) – предшественником является КОЕ КМ, ее дифференцировка происходит под влиянием тимозина (гормона тимуса),
– В-лимфоциты – происходят из КОЕ КМ, но развиваются под влиянием активаторов, не связанных с тимусом,
– В периферической крови выделяется третья сборная группа, не имеющая основных признаков (маркеров) Т- и В-лимфоцитов и обозначаемая как “ни Т- ни В-” или “0-субпопуляция”. Эти клетки морфологически сходны с лимфоцитами, но различаются по происхождению и функциональным особенностям.
Б. По функциональным особенностям, связанным с их участием в иммунологической реакции:
– лимфоциты, узнающие чужеродный АГ и дающие сигнал к началу иммунного ответа (антиген-реактивные клетки, клетки иммунной памяти),
– лимфоциты, осуществляющие непосредственный ответ – эффекторы (цитотоксические клети – киллеры, эффекторы ГЗТ, антителопродуценты),
– лимфоциты, помогающие образованию эффекторов – хелперы (помощники),
– лимфоциты, тормозящие начало и осуществляющие окончание иммунной реакции (супрессоры).
В. Иммуноморфологическая классификация – разграничение их по функциональной принадлежности и происхождению с помощью определения на мембране набора рецепторов и антигенов, различного у каждой субпопуляции. С помощью мембранных структур клетка “узнает” АГ и взаимодействует с другими иммунокомпетентными клетками. Комплекс антигенных и рецепторных структур мембраны лимфоцита является иммуноморфологической характеристикой клетки. В него входят иммуноглобулины, АГ гистосовместимости, рецепторы для компонентов комплемента, гетерогенных эритроцитов, митогенов и т.д.
Среди мембранных структур лимфоцита наиболее изученными являются АТ – Ig. По наличию поверхностных Ig (SmIg) различают SmIg+-лимфоциты и SmIg–лимфоциты.
Наиболее постоянно присутствуют на лимфоцитах антигены тканевой совместимости (Human Leukocytic Antigens – HLA). Кроме лимфоцитов HLA-АГ встречаются на многих других ядросодержащих клетках организма, но особое значение они имеют для иммунокомпетентных клеток.
Т-лимфоциты.
Т-лимфоциты представляют собой сложную систему различных в функциональном отношении клеток, объединяемых происхождением и присутствием на поверхности общего АГ – тимусного человеческого лимфоцитарного АГ.
Среди зрелых Т-лимфоцитов, образующихся после контакта с АГ, различают:
– антигенреактивные клетки,
– Т-хелперы,
– Т-киллеры,
– эффекторы ГЗТ,
– Т-супрессоры,
– клетки иммунологической памяти,
– особый тип Т-клеток, объектом действия которых является СКК КМ и первые этапы ее дифференцировки.
Антигенреактивные Т-лимфоциты первыми реагируют на присутствие АГ, запускают в реакцию хелперы и супрессоры и способствуют их пролиферации, но сами эффекторами не являются. Эти клетки представляют собой основную массу Т-лимфоцитов периферической крови и лимфы. Им свойственна высокая способность к миграции. После встречи с АГ эта клетка превращается в иммунобласт, который, выделяя медиаторы, способствует запуску иммунной реакции в ближайшем л/узле.
При отсутствии или резком снижении количества антигенреактивных клеток нарушается процесс распознавания, что проявляется снижением иммунного ответа на бактериальные, вирусные и грибковые АГ, появляются аутоиммунные расстройства. Это может быть следствием отсутствия тимуса, хронической потери лимфы из грудного протока, глубокой кахексии и др.
Клетки иммунологической памяти, относящиеся также к антигенреактивным клеткам, узнают АГ в фазу вторичного иммунного ответа, при повторном контакте с АГ, реагируя на АГ раньше и значительнее интенсивнее, чем при первом контакте.
Т-хелперы неоднородны по дифференцировке:
а) более зрелые – хелперы Т-В, функция которых заключается в воздействии на определенный клон В-лимфоцитов,
б) хелперы Т-Т более ранние по дифференцировке, способствуют пролиферации Т-киллеров и эффекторов ГЗТ.
Т-хелперы расположены преимущественно в селезенке и л/узлах. Их действие на другие клетки осуществляется как при непосредственном контакте, так и при помощи гуморальных медиаторов с обязательным участием макрофагов. Основная задача Т-хелперов – представить В-лимфоцитам АГ в специальной связанной форме. Рецепторы хелперов Т-В соединяются с АГ, образуя комплекс, названный иммуноглобулином Т (IgT).
Хелперы Т-Т вырабатывают хелперный фактор клеточного иммунитета. Его функция заключается в усилении цитотоксического действия и дифференцировки киллеров, увеличении противоопухолевой активности макрофагов.
Т-хелперы играют исключительно важную роль, определяя направление и силу иммунного ответа. Снижение их количества и угнетение функции наблюдается при старении и опухолях. Увеличение хелперов характерно для аутоиммунных заболеваний, СКВ, рассеянном склерозе, отторжении трансплантата.
Т-эффекторы ГЗТ – эта субпопуляция лимфоцитов предназначена в основном для секреции лимфокинов.
К лимфокинам относятся:
– фактор стимуляции бласттрансформации – усиливает сенсибилизацию к АГ, действует на незрелые клетки тимуса,
– фактор торможения бласттрансформации и синтеза ДНК – по действию близок к лимфотоксину,
– фактор переноса – усиливает сенсибилизацию ко всем видам АГ-нов, препятствует развитию толерантности,
– факторы, усиливающие цитотоксичность, бактериостатическую активность, бактерицидность, а также агрегацию макрофагов,
– фактор торможения миграции макрофагов – способствует концентрации фагоцитирующих клеток в районе внедрения АГ и усиливает их бактерицидность,
– фактор, тормозящий адгезию макрофагов, фактор пролиферации макрофагов, фактор усиления миграции макрофагов,
– фактор торможения миграции лейкоцитов,
– хемотаксические факторы – осуществляют хемотаксис макрофагов, нейтрофилов, базофилов, эозинофилов, фибробластов,
– колониестимулирующие факторы – влияют на рост гранулоцитарного и эритроцитарного ростков,
– фибробластактивирующий фактор – вызывает разрастание соединительной ткани вокруг зоны иммунной реакции.
Основная задача лимфокинов – обеспечить взаимодействия различных типов клеток и вовлечение их в иммунную реакцию. Большинство эффекторов ГЗТ находится в селезенке.
Т-супрессоры – регуляторы направления и объема иммунной реакции, главным образом за счет ограничения пролиферации клонов лимфатических клеток, угнетения АТ-образования, дифференцировки киллеров, аллергический процесс и развитие ГЗТ.
Под влияние супрессоров развивается состояние иммунологической толерантности (иммуноареактивности) к АГ.
Т-супрессоры делятся на Т-Т-супрессоры (более ранние) и Т-В-супрессоры (более зрелые). Супрессоры Т-В пролиферируют, образуя клон клеток, вырабатывающие супрессорные факторы, с помощью которых подавляются В-лимфоциты.
Количество Т-супрессоров увеличивается с возрастом (особенно у женщин), при инфекционном мононуклеозе, остром гепатите, приживлении трансплантата, при ряде врожденных иммунодефицитов, при опухолях.
Т-киллеры (цитотоксические Т-лимфоциты) являются основными эффекторными клетками, оказывающими цитотоксическое действие на клетки-мишени. Образуются из Т2 лимфоцитов после стимуляции клеточными АГ-ми. Основными АГ, на которые реагируют хелперы, являются АГ HLA системы (гистосовместимости) чужеродных или измененных клеток своего организма. Т-киллеры уничтожают клетки трансплантата и мутантные клетки организма, в том числе опухолевые. Кратковременного контакта чужеродной клетки с Т-киллерами достаточно, чтобы вызвать необратимые изменения в клетке-мишени за счет осмотических нарушений в них. Больше всего Т-киллеров в л/узлах.
Т-дифференцирующиеся – лимфоциты, непосредственно влияющие на стволовые и колониеобразующие гемопоэтические клетки.
25. Субпопуляции В-лимфоцитов.и их функции.
В-лимфоциты– система клеток, объединяемая происхождением из костномозгового предшественника В-лимфоцитов. В функциональном отношении В-клетки, как и Т-лимфоциты, очень разнообразны. Среди В-клеток различают антителопродуценты, киллеры, супрессоры, клетки иммунологической памяти. Все В-лимфоциты несут В-АГ, который исчезает при дифференцировке В-лимфоцита до плазмоцита.
Различают несколько этапов дифференцировки от стволовой клетки и общего предшественника лимфоцитов до зрелых. Первые этапы дифференцировки происходят в структурах КМ и являются антигеннезависимыми. Самой первой стадией считают пре-пре-В-лимфоцит, не имеющий цитоплазматических и поверхностных иммуноглобулиновых молекул, но обладающий В-АГ и общим АГ, свойственным острому лимфобластному лейкозу. Пре-В-лимфоцит, отличатся от предыдущего тем, что в цитоплазме определяются тяжелые μ-цепи. На стадии ранних В-лимфоцитов появляются молекулы иммуноглобулина на мембране клетки, принадлежащие к классу М. Следующие стадии дифференцировки В-лимфоцит проходит вне КМ (промежуточный и зрелый В-лимфоцит). Конечным этапом дифференцировки является плазматическая клетка, которая лишена всех В-АГ и поверхностных Ig и содержит в больших концентрациях цитоплазматический Ig.
Среди В-лимфоцитов наиболее многочисленны В-лимфоциты-антителопродуценты. Основная их функция синтез и секреция Ig (АТ) в ответ на АГ.
К иммуноглобулинам относятся белки животного происхождения, которые обладают активностью АТ, а также белки, сходные с ними по химической структуре. В эту группу включены также белки, не имеющие активности АТ – миеломные белки, белки Бенс-Джонса и др.
Молекула иммуноглобулина является тетрамером, состоящим из 4-х полипептидных цепей двух типов: тяжелых (Н) и легких (L), соединенных между собой дисульфидными связями. Структурно-антигенные различия Н-цепей позволили разделить все известные Ig на 5 классов: IgG, IgA, IgM, IgD, IgE соответственно известным классам тяжелых Н-цепей (γ, α, μ, δ, ε).
Типы Ig:
– IgM – синтез их начинается уже в первые 2-3 дня после рождения под влиянием естественной антигенной стимуляции. Он отвечает за первичный иммунный ответ. Располагается в основном в кровеносном русле, в небольшом количестве в секретах. К IgM-антителам принадлежат изогемагглютинины, холодовые агглютинины, РФ, высокоавидные бактерицидные антитела. IgM не проходит через плаценту, поэтому групповые и резус-изогемагглютинины не попадают от матери ребенку.
– IgG – отвечают за вторичный иммунный ответ. Синтез их начинается на 1-4-ом месяце рождения и к 3-м годам достигает уровня синтеза взрослого. В-лимфоциты и плазмоциты, синтезирующие IgG, находятся в селезенке и л/узлах. В больших количествах находятся в сыворотке, легких, ЖКТ, печени. Молекулы IgG легко проходят через плаценту, создавая иммунитет у плода.
– IgA – в значительном количестве находится в секретах и на поверхности барьеров. Выполняет функцию местной защиты всех слизистых оболочек. В-лимфоциты и плазмоциты, синтезирующие IgА, расположены в лимфатической ткани под слизистыми оболочками. В тканях его больше, чем в крови более чем в 6 раз.
– IgE – увеличивается при аллергических состояниях, паразитозах и вирусных инфекциях. Эти иммуноглобулины фиксируются на поверхности тучных клеток и базофилов, имеющих специальный рецептор. В таком виде они взаимодействуют с АГ, вызывая дегрануляцию тучных клеток и базофилов и выход из них субстанции анафилаксии. Способность их запускать реакцию ГНТ определяет их название – “реагины”.
Антитела, синтезируемые антителопродуцирующими В-лимфоцитами и плазматическими клетками, составляют первую гуморальную систему иммунной защиты организма.
Кроме специфической гуморальной защиты Ig-ны участвуют в клеточных реакциях, прикрепляясь к рецепторам лимфоцитов, макрофагов, тучных клеток, базофилов и др.
В-лимфоциты также участвуют в выработке медиаторов (вторая гуморальная система иммунной защиты), синтезируя ряд лимфокинов: стимулятор В-клеток, митогенный фактор В-клеток, супрессорный фактор В-клеток КМ, супрессорный фактор более зрелых В-лимфоцитов, фактор торможения миграции макрофагов и др.
В-лимфоциты-супрессоры – это строго специфичные к антигену клетки. Эффект супрессии проявляется только к однородным по гистосовместимости клеткам и направлен против хелперов, киллеров и активированных макрофагов. В-супрессоры расположены главным образом в КМ и селезенке, при активации они пролиферируют и продуцируют антитела.
В-лимфоциты иммунологической памяти имеют на мембране комплексы АГ-АТ. Они активизируются при вторичном иммунном ответе и пролиферируют с образованием плазматических клеток, синтезирующих Ig того же класса, что и клетка иммунологической памяти.
Цитотоксические В-лимфоциты (киллеры) отличаются от других В-лимфоцитов отсутствием поверхностных Ig. Цитотоксическая функция В-киллеров – антителозависимая и связана с прикреплением к В-лимфоцитам цитотоксических антител.
В-киллеры находятся в конкурентных отношениях с блокирующими АТ-ами, т.е. не дающими достаточного цитотоксического эффекта. Соединяясь с АГ клетки-мишени, блокирующие АТ делают ее недоступной для действия киллеров всех видов. В-киллеры, присоединяя к своей поверхности большое количество цитотоксических АТ, способны повреждать клетку-мишень. Направленность специфического иммунитета в каждом конкретном случае зависит от соотношения между содержанием В-киллеров и блокирующих АТ.
Ни Т ни В-лимфоидные клетки.Лимфоидные клетки, не имеющие Т- и В-маркеров, представляют собой отдельную субпопуляцию. Несмотря на немногочисленное представительство этой субпопуляции в периферической крови (не более 5-10 % от общего числа лимфоцитов), все входящие в нее группы клеток имеют большое значение для гемопоэза и иммунного ответа.
Date: 2016-08-31; view: 2632; Нарушение авторских прав
Источник
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 4 апреля 2020; проверки требуют 12 правок.
T-лимфоциты, или Т-клетки (от лат. thymus «тимус») — лимфоциты, развивающиеся у млекопитающих в тимусе из предшественников — претимоцитов, поступающих в него из красного костного мозга. В тимусе T-лимфоциты дифференцируются, приобретая Т-клеточные рецепторы (ТКР, англ. TCR) и различные корецепторы (поверхностные маркеры)[1]. Играют важную роль в приобретённом иммунном ответе. Обеспечивают распознавание и уничтожение клеток, несущих чужеродные антигены, усиливают действие моноцитов, NK-клеток, а также принимают участие в переключении изотипов иммуноглобулинов (в начале иммунного ответа B-клетки синтезируют IgM, позже переключаются на продукцию IgG, IgE, IgA).
Типы Т-лимфоцитов[править | править код]
Т-клеточные рецепторы являются основными поверхностными белковыми комплексами Т-лимфоцитов, ответственными за распознавание процессированных антигенов, связанных с молекулами главного комплекса гистосовместимости (ГКГ, англ. major histocompatibility complex (MHC)) на поверхности антигенпредставляющих клеток[2]. Т-клеточный рецептор связан с другим полипептидным мембранным комплексом, CD3. В функции комплекса CD3 входит передача сигналов в клетку, а также стабилизация Т-клеточного рецептора на поверхности мембраны. Т-клеточный рецептор может ассоциироваться с другими поверхностными белками, его корецепторами. В зависимости от корецептора и выполняемых функций различают два основных типа Т-клеток.
Т-хелперы[править | править код]
Антигенраспознающий рецепторный комплекс Т-хелперов
Т-хелперы (от англ. helper — помощник) — Т-лимфоциты, главной функцией которых является усиление адаптивного иммунного ответа. Активируют Т–киллеры, B-лимфоциты, моноциты, NK–клетки при прямом контакте, а также гуморально, выделяя цитокины. Основным признаком Т–хелперов служит наличие на поверхности клетки молекулы корецептора CD4. Т-хелперы распознают антигены при взаимодействии их Т-клеточного рецептора с антигеном, связанным с молекулами главного комплекса гистосовместимости II класса (англ. major histocompatibility complex II (MHC-II)).
Т-киллеры[править | править код]
Т-киллеры (от англ. killer «убийца»), цитотоксические T-лимфоциты, CTL — Т-лимфоциты, главной функцией которых является уничтожение повреждённых клеток собственного организма. Мишени Т-киллеров — это клетки, поражённые внутриклеточными паразитами (к которым относятся вирусы и некоторые виды бактерий), опухолевые клетки. Т-киллеры являются главным компонентом антивирусного иммунитета. Основным признаком Т-киллеров служит наличие на поверхности клетки молекулы корецептора CD8. Т-киллеры распознают антигены при взаимодействии их Т-клеточного рецептора с антигеном, связанным с молекулами главного комплекса гистосовместимости I класса (англ. major histocompatibility complex I (MHC-I)).
Т-хелперы и Т-киллеры образуют группу эффекторных Т-лимфоцитов, непосредственно ответственных за иммунный ответ. В то же время существует другая группа клеток, регуляторные Т-лимфоциты, функция которых заключается в регулировании активности эффекторных Т-лимфоцитов. Модулируя силу и продолжительность иммунного ответа через регуляцию активности Т-эффекторных клеток, регуляторные Т-клетки поддерживают толерантность к собственным антигенам организма и предотвращают развитие аутоиммунных заболеваний. Существуют несколько механизмов супрессии: прямой, при непосредственном контакте между клетками, и дистантный, осуществляющийся на расстоянии — например, через растворимые цитокины.
γδ Т-лимфоциты[править | править код]
Т-лимфоциты представляют собой небольшую популяцию клеток с видоизменённым Т-клеточным рецептором[3]. В отличие от большинства других Т-клеток, рецептор которых образован и субъединицами, Т-клеточный рецептор -лимфоцитов образован и субъединицами. Данные субъединицы не взаимодействуют с пептидными антигенами, презентированными белками ГКГ. Предполагается, что Т-лимфоциты участвуют в узнавании липидных антигенов.
Т-супрессоры[править | править код]
Т-лимфоциты, обеспечивающие центральную регуляцию иммунного ответа.
Дифференциация в тимусе[править | править код]
Стадии дифференциации Т-лимфоцитов
Все Т-клетки берут своё начало от гемопоэтических стволовых клеток красного костного мозга, которые мигрируют в тимус и дифференциируются в незрелые тимоциты[4]. Тимус создаёт микросреду, необходимую для развития полностью функционального репертуара Т-клеток, который является ГКГ-ограниченным и толерантным к самому себе.
Дифференциация тимоцитов разделяется на разные стадии в зависимости от экспрессии различных поверхностных маркеров (антигенов). На самой ранней стадии тимоциты не экспрессируют корецепторы CD4 и CD8 и поэтому классифицируются как двойные негативные (англ. double negative (DN)) (CD4-CD8-). На следующей стадии тимоциты экспрессируют оба корецептора и называются двойными позитивными (англ. double positive (DP)) (СD4+CD8+). Наконец на финальной стадии происходит селекция клеток, которые экспрессируют только один из корецепторов (англ. single positive (SP)): или (CD4+), или (CD8+).
Раннюю стадию можно разделить на несколько подстадий. Так, на подстадии DN1 (англ. double negative 1) тимоциты имеют следующую комбинацию маркеров: CD44+CD25-CD117+. Клетки с данной комбинацией маркеров ещё называют ранними лимфоидными предшественниками (англ. early lymphoid progenitors (ELP)). Прогрессируя в своей дифференциации, ELP активно делятся и окончательно теряют способность трансформироваться в другие типы клеток (например, В-лимфоциты или миелоидные клетки). Переходя на подстадию DN2 (англ. double negative 2), тимоциты экспрессируют CD44+CD25+CD117+ и становятся ранними Т-клеточными предшественниками (англ. early T-cell progenitors (ETP)). В течение DN3 подстадии (англ. double negative 3) ETP клетки имеют комбинацию CD44-CD25+ и вступают в процесс β-селекции.
β-селекция[править | править код]
Гены Т-клеточного рецептора состоят из повторяющихся сегментов, принадлежащих к трём классам: V (англ. variable), D (англ. diversity) и J (англ. joining). В процессе соматической рекомбинации генные сегменты, по одному из каждого класса, соединяются вместе (V(D)J-рекомбинация). Случайное объединение последовательностей сегментов V(D)J приводит к появлению уникальных последовательностей вариабельных доменов каждой из цепей рецептора. Случайный характер образования последовательностей вариабельных доменов позволяет генерировать Т-клетки, способные распознавать большое количество различных антигенов, и, как следствие, обеспечивать более эффективную защиту против быстро эволюционирующих патогенов. Однако этот же механизм зачастую приводит к образованию нефункциональных субъединиц Т-клеточного рецептора. Гены, кодирующие β-субъединицу рецептора, первыми подвергаются рекомбинации в DN3-клетках. Чтобы исключить возможность образования нефункционального пептида, β-субъединица образует комплекс с инвариабельной α-субъединицей пре-T-клеточного рецептора, формируя т. н. пре-T-клеточный рецептор (пре-ТКР)[5]. Клетки, неспособные образовывать функциональный пре-ТКР, погибают в результате апоптоза. Тимоциты, успешно прошедшие β-селекцию, переходят на подстадию DN4 (CD44-CD25-) и подвергаются процессу позитивной селекции.
Позитивная селекция[править | править код]
Клетки, экспрессирующие на своей поверхности пре-ТКР, все ещё не являются иммунокомпетентными, так как не способны связываться с молекулами главного комплекса гистосовместимости. Для узнавания молекул ГКГ T-клеточным рецептором необходимо наличие корецепторов CD4 и CD8 на поверхности тимоцитов. Образование комплекса между пре-ТКР и корецептором CD3 приводит к ингибированию перестроек генов β-субъединицы и в то же время вызывает активацию экспрессии генов CD4 и CD8. Таким образом тимоциты становятся двойными позитивными (DP) (CD4+CD8+). DP-тимоциты активно мигрируют в корковое вещество тимуса, где происходит их взаимодействие с клетками кортикального эпителия, экспрессирующими белки обоих классов ГКГ (MHC-I и MHC-II). Клетки, неспособные взаимодействовать с белками ГКГ кортикального эпителия, подвергаются апоптозу, в то время как клетки, успешно осуществившие такое взаимодействие, начинают активно делиться.
Негативная селекция[править | править код]
Тимоциты, прошедшие позитивную селекцию, начинают мигрировать к кортикомедуллярной границе тимуса. Попадая в медуллу, тимоциты взаимодействуют с собственными антигенами организма, презентированными в комплексе с белками ГКГ на медуллярных тимических эпителиальных клетках (мТЭК). Тимоциты, активно взаимодействующие с собственными антигенами, подвергаются апоптозу. Негативная селекция предотвращает появление самоактивирующихся Т-клеток, способных вызывать аутоиммунные заболевания, являясь важным элементом иммунологической толерантности организма.
Активация[править | править код]
Механизм действия Т-хелперов и Т-киллеров
Т-лимфоциты, успешно прошедшие позитивную и негативную селекцию в тимусе, попавшие на периферию организма, но не имевшие контакта с антигеном, называются наивными Т-клетками (англ. Naive T cells). Основной функцией наивных Т-клеток является реакция на патогены, прежде не известные иммунной системе организма. После того как наивные Т-клетки распознают антиген, они становятся активированными. Активированные клетки начинают активно делиться, образуя клон. Некоторые из клеток этого клона превращаются в эффекторные Т-клетки, которые выполняют функции, специфичные для данного типа лимфоцита (например, выделяют цитокины в случае Т-хелперов или же лизируют поражённые клетки в случае Т-киллеров). Другая часть активированных клеток трансформируется в Т-клетки памяти. Клетки памяти сохраняются в неактивной форме после первичного контакта с антигеном до тех пор, пока не наступает повторное взаимодействие с тем же антигеном. Таким образом, Т-клетки памяти хранят информацию о ранее действовавших антигенах и обеспечивают вторичный иммунный ответ, осуществляющийся в более короткие сроки, чем первичный.
Взаимодействие Т-клеточного рецептора и корецепторов (CD4, CD8) с главным комплексом гистосовместимости важно для успешной активации наивных Т-клеток, однако его самого по себе недостаточно для дифференциации в эффекторные клетки. Для последующей пролиферации активированных клеток необходимо взаимодействие т. н. костимулирующих молекул. Для Т-хелперов такими молекулами являются рецептор CD28 на поверхности Т-клетки и иммуноглобулин B7 на поверхности антигенпрезентирующей клетки.
Примечания[править | править код]
- ↑ Murphy K., Travers P., Walport M. Janeway’s Immunobiology. — New York: Garland Science, 2011. — 888 p. — ISBN 0-8153-4123-7. Архивная копия от 20 октября 2014 на Wayback Machine
- ↑ Alberts B., Johnson A., Lewis J., Raff M., Roberts K., Walter P. Molecular Biology of the Cell. — New York: Garland Science, 2002. — 1367 p. — ISBN 0-8153-3218-1.
- ↑ Holtmeier W., Kabelitz D. Gammadelta T cells link innate and adaptive immune responses // Chemical immunology and allergy. — 2005. — Т. 86. — С. 151–83. — ISBN 978-3-8055-7862-2. — doi:10.1159/000086659. — PMID 15976493.
- ↑ Schwarz B. A., Bhandoola A. Trafficking from the bone marrow to the thymus: a prerequisite for thymopoiesis (англ.) // Immunol. Rev.. — 2006. — Vol. 209. — P. 47–57. — doi:10.1111/j.0105-2896.2006.00350.x. — PMID 16448533.
- ↑ Sleckman B. P. Lymphocyte antigen receptor gene assembly: multiple layers of regulation (англ.) // Immunol Res. — 2005. — Vol. 32. — P. 153-8. Архивировано 27 января 2008 года.
Источник