Японская классификация регионарных лимфатических узлов желудка
Международная классификация рака желудка. Лимфатическая система желудка.

Японское общество эндоскопистов и гастроэнтерологов классифицировало ранний рак желудка на три гипа: тип I— выступающий; тип II— поверхностный; тип III — «углубленный». Тип II подразделяется на три формы: А- приподнятый; В — плоский, С — поверхностно-углубленный. Диагностика раннего рака желудка основана на рентгенологическом исследовании с двойным контрастированием и гастроскопии с биопсией.
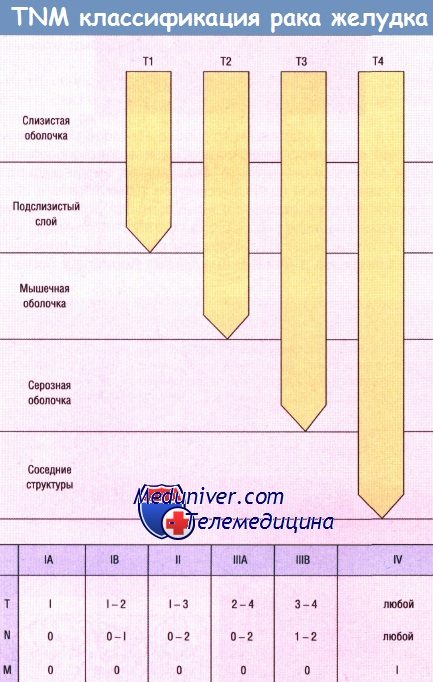
Установление классификации рака желудка и определение стадии его развития имеет большое практическое значение. Оно позволяет выбрать наиболее адекватный метод лечения для каждого больного и оценить результаты различных хирургических операций, сравнить статистические данные, полученные в различных хирургических центрах. Классификация по TNM была предложена Американским объединенным комитетом по изучению стадий рака и результатов его лечения (American Joint Comittee for Cancer Staging and Results Reporting of Cancer) в 1970 году и модифицирована в 1977. Буква Т обозначает первичную опухоль:
Т1: опухоль ограничена слизистой оболочкой и подслизистой основой.
Т2: опухоль проникает в мышечную оболочку без поражения серозной оболочки.
Т3: опухоль прорастает серозную оболочку без инвазии в соседние структуры.
Т4: опухоль прорастает через серозную оболочку и распространяется на соседние структуры.
Буква N обозначает наличие или отсутствие метастазов в регионарных лимфатических узлах:
Nx: недостаточно данных для оценки регионарных лимфоузлов.
N0: нет признаков метастатического поражения регионарных лимфатических узлов.
N1 имеются метастазы в лимфатических узлах не далее 3 см от края первичной опухоли, которые могут быть удалены при субтотальной резекции и гастрэктомии.
N2: имеются метастазы в лимфатических узлах на расстоянии более 3 см от края первичной опухоли, которые также удаляются при резекции и гастрэктомии, включая лимфатические узлы по ходу левой желудочной артерии, селезеночной артерии, чревного ствола и общей печеночной артерии. Буква R обозначает наличие остаточного опухолевого поражения:
R0: после резекции желудка данных о наличии опухолевого поражения нет.
R1 после резекции желудка имеются микроскопические признаки опухоли.
R2: после резекции желудка имеются макроскопические признаки опухоли.
Буква М обозначает наличие или отсутствие отдаленных метастазов:
М0: недостаточно данных для определения отдаленных метастазов.
М1 : имеются отдаленные метастазы.
Лимфатический отток от желудка описан был ранее. Расширению наших знаний о лимфогенном метастазировании рака желудка способствовали многочисленные исследования, многие из которых выполнены японскими учеными.
В желудке различают три лимфатических барьера: Первый лимфатический барьер образуется следующими группами лимфатических узлов: 1 — правые паракардиальные узлы; 2 — лимфатические узлы малой кривизны желудка, сопровождающие левую желудочную (венечную) артерию и правую желудочную (пилорическую) артерию; 3 — лимфатические узлы большой кривизны, сопровождающие левую желудочно-сальниковую артерию; 4 — лимфатические узлы, расположенные под привратником; 5 — лимфатические узлы, расположенные над привратником; 6 — лимфатические узлы, расположенные за привратником. Все эти лимфатические узлы удаляются при субтотальной резекции желудка или гастрэктомии. Второй лимфатический барьер образуется следующими лимфатическими узлами: 7 — передние, верхние передние и нижние панкреатодуоденальные лимфатические узлы; 8 — нижние диафрагмальные лимфатические узлы; 9 — лимфатические узлы, сопровождающие чревный ствол; 10 — лимфатические узлы, сопровождающие общую печеночную артерию; 11 — лимфатические узлы, расположенные вблизи желчного пузыря: 12 — лимфатические узлы, расположенные в области ворот селезенки; 13 — лимфатические узлы, расположенные над поджелудочной железой. Третий лимфатический барьер образуется следующими лимфатическими узлами: 14 — лимфатические узлы, расположенные под поджелудочной железой: 15 — лимфатические узлы, сопровождающие верхнюю брыжеечную артерию; 16 — лимфатические узлы, расположенные латерально от брюшной аорты; 17 — лимфатические узлы, расположенные спереди от брюшной аорты; 18 — лимфатические узлы, сопровождающие верхнюю полую вену. При выполнении и описании гистологического исследования различных групп лимфатических узлов их следует обозначать соответственно локализации, а не номеру, как делают некоторые авторы, гак как в этом случае хирургу приходится запоминать и номера, соответствующие локализации этих групп лимфатических узлов, что сложнее, чем просто запомнить их местонахождение. В классификации по TNM это означает: N0 лимфатические узлы не поражены. N1 поражен первый лимфатический барьер. N2 поражен второй лимфатический барьер. N3 поражен третий лимфатический барьер.
При резекциях желудка по поводу рака, по принятой в странах Запада методике, удаляют лимфатические узлы барьеров N. и N2, а иногда и некоторые группы лимфатических узлов барьера N3. Хирургическая резекция трех лимфатических барьеров желудка является трудной задачей и связана с высоким риском развития осложнений и летальности, хотя имеются и противоположные мнения. Расширенная лимфаденэктомия применяется только в исключительных случаях, так как не доказано, что она приводит к повышению выживаемости.
– Также рекомендуем “Объем резекции желудка. Стадия опухоли желудка и объем резекции.”
Оглавление темы “Лечение рака желудка. Операции при раке желудка.”:
1. Классификация рака желудка. Ранний рак желудка.
2. Международная классификация рака желудка. Лимфатическая система желудка.
3. Объем резекции желудка. Стадия опухоли желудка и объем резекции.
4. Распространенность рака желудка. Определение объема поражения при раке желудка.
5. Радикальная субтотальная резекция желудка. Техника субтотальной резекции желудка.
6. Создание анастомоза при субтотальной резекции желудка. Методика анастомозирования культи желудка.
7. Тотальная радикальная гастрэктомия. Ключевые моменты тотальной гастрэктомии.
8. Восстановление пищеварительного тракта после гастрэктомии. Эзофагоеюностомия.
9. Эзофагоеюностомия по Roux-en-Yc использованием ручных швов. Техника эзофагоеюностомии после резекции желудка.
10. Терминолатеральный эзофагоеюноанастомоз. Техника наложения терминального эзофагоеюноанастомоза.
Источник
No.100 Поверхностные лимфатические узлы шеи
- No.100spf – Поверхностные цервикальные лимфоузлы: лимфоузлы расположенные вдоль внешних яремных вен и передних яремных вен под поверхностной цервикальной фасцией.
- No.100sm – Подчелюстные лимфатические узлы: лимфатические узлы, расположенные вокруг подчелюстных желез и околоушных желез и кпереди от челюстно-подъязычной мышцы.
- No.100tr – Шейные претрахеальные лимфатические узлы: лимфатические узлы, расположенные в пре-трахеальной жировой ткани, простирающейся сверху от подъязычной кости, книзу в левой плечеголовной вены, включая претиреоидные лимфоузлы и прегортанные лимфатические узлы.
- No.100ac – лимфатические узлы добавочного нерва: лимфатические узлы, расположенные вдоль добавочного нерва(ы), и кпереди от трапециевидной мышцы.
No.101 Шейные параэзофагеальные лимфатические узлы
- Лимфатические узлы, расположенные вокруг пищевода (цервикальная часть), в том числе лимфатические узлы, расположенные вдоль возвратного нерва гортани и паратрахеальных (цервикальная часть) лимфатических узлов. Боковая граница-медиальная граница сонного влагалища. Необходимо проводить различие между левыми и правыми лимфатическими узлами.
No.102 Глубокие шейные лимфатические узлы.
- Лимфатические узлы, расположенные вокруг внутренней яремной вены и общей сонной артерии.
- No.102up – Верхние глубокие цервикальные лимфоузлы: лимфоузлы, каудальной границей является двубрюшная мышца, верхней границей бифуркация сонной артерии.
- No.102mid – Средние глубокие шейные лимфатические узлы: лимфатические узлы, верхней границей является бифуркация сонной артерии, нижней границей перстневидный хрящ.
No.103 Окологлоточные лимфатические узлы
- Лимфатические узлы, расположенные медиально от каротидного влагалища, каудальной границей которых является верхняя часть двубрюшной мышцы, снизу нижняя граница перстневидного хряща. Постфарингеальные и парафарингеальные лимфатические узлы включены.
No.104 Надключичные лимфатические узлы
- Лимфатические узлы расположены в надключичных ямках. Границы: сверху – нижняя граница перстневидного хряща, снизу – ключица.
- Необходимо проводить различие между левыми и правыми лимфатическими узлами.
No.105 Верхнегрудные параэзофагеальные лимфатические узлы.
- Лимфатические узлы расположены вокруг пищевода (верхней грудной части). Лимфатические узлы, расположенные вдоль дуги непарной вены и правой бронхиальной артерии входят также входят в данную группу.
No.106 Паратрахеальные лимфатические узлы.
- Лимфатические узлы расположены вдоль передней и боковых стенок грудной трахеи.
- No.106rec – лимфатические узлы, расположенные вдоль возвратных гортанных нервов в средостении.
- No.106recL – лимфатические узлы, расположенные вдоль левого возвратного гортанного нерва.
- No.106recR – лимфатические узлы, расположенные вдоль правого возвратного гортанного нерва.
No.106pre Препаратрахеальные лимфатические узлы.
Лимфатические узлы вдоль передней стенки грудной части трахеи, и кпереди от правого блуждающего нерва.
No.106tb Трахеобронхиальные лимфатические узлы.
Лимфатические узлы расположены под трахеобронхиальным углом.
No.106tbL – Левые паратрахеальные лимфатические узлы.
No.106tbR – Правые паратрахеальные лимфатические узлы.
No.107 Бифуркационные лимфатические узлы. Располагаются от бифуркации трахеи до бифуркаций главных бронхов.
No.108 Среднегрудные параэзофагеальные лимфатические узлы. Проксимальная порция узлов, располагающихся сбоку и спереди от пищевода от бифуркации трахеи до середины расстояния между бифуркацией трахеи и пищеводно-желудочным переходом.
No.109 Лимфоузлы ворот легких. Располагаются в воротах легких дистальнее бифуркаций главных бронхов.
No.110 Нижнегрудные параэзофагеальные лимфатические узлы. Дистальная порция узлов, располагающихся сбоку и спереди от пищевода каудально от середины расстояния между бифуркацией трахеи и пищеводно- желудочным переходом.
No.111 Верхние диафрагмальные лимфатические узлы. В радиусе 5 см. по диафрагме от пищеводного отверстия.
No.112 Задние медиастинальные лимфатические узлы. Располагаются позади пищевода в заднем средостении.
- No.112aoA – Передние грудные парааортальные лимфатические узлы: лимфатические узлы, расположенные вдоль нисходящей аорты, лимфатические узлы, существующие на той же стороне пищевода (на том же уровне). Также к данной группе относятся лимфатические узлы вдоль грудного протока.
- No.112aoP – Задние грудные парааортальные лимфатические узлы. Лимфатические узлы, расположенные вокруг нисходящей части аорты, лимфатические узлы, существующие на контрлатеральной стороне пищевода.
- No.112pul – Лимфатические узлы легочной связки: лимфатические узлы, расположенные вдоль легочной связки, в том числе лимфатические узлы, прилегающие к перикарду и нижней легочной вене. Необходимо проводить различие между левыми и правыми лимфатическими узлами.
No.113 – Лимфатические узлы артериальной связки (лимфатических узлов Botallo)
- Лимфатические узлы расположены на левой стороне артериальной связки.
No.114 – передние медиастинальные лимфатические узлы.
- Лимфатические узлы, расположенные кпереди от верхней полой вены, в том числе лимфатические узлы, брахиоцефального венозного угла и лимфатические узлы вокруг вилочковой железы.
Источник
РАННИЙ РАК ЖЕЛУДКА (рТ1): ФАКТОРЫ ПРОГНОЗА,
ЗАКОНОМЕРНОСТИ ЛИМФОГЕННОГО МЕТАСТАЗИРОВАНИЯ, РЕЗУЛЬТАТЫ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ
В.Ю. Скоропад, Б.А. Бердов
Медицинский Радиологический Научный Центр РАМН, Обнинск
Определение раннего рака желудка было впервые дано Японским обществом гастроэнтерологической эндоскопии в 1962 г. К нему были отнесены опухоли, ограниченные пределами слизистого или подслизистого слоев стенки желудка вне зависимости от наличия метастазов в регионарные лимфатические узлы. Основаниями для выделения раннего рака желудка (рТ1) в противовес местно-распространенному (рТ2-4) явились полученные японскими исследователями исключительно благоприятные отдаленные результаты хирургического лечения этой категории больных. Концепция «раннего рака желудка» существует в неизменном виде уже более 40 лет и поддерживается большинством исследователей. В то же время, ряд авторов предлагает свою трактовку понятия раннего рака желудка, суживающую данную категорию больных за счет ограничений по глубине инвазии, размеру опухолевого поражения и наличию метастазов в регионарные лимфатические узлы.
Отдаленные результаты хирургического лечения раннего рака желудка, по данным различных авторов, варьируют весьма широко: 5-летняя выживаемость колеблется от 64% до 100%, 10-летняя выживаемость – от 62% до 98%. Причины столь значительных различий связаны, в первую очередь, с неоднородностью групп, то есть различным в каждой авторской серии соотношением больных в зависимости от глубины опухолевой инвазии, состояния регионарных лимфатических узлов и других клинико-морфологических факторов. Насколько часто встречается ранний рак желудка и является ли эта проблема действительно актуальной? Если в 50–80-е годы ХХ века в США, Австралии и Европейских странах доля раннего рака желудка среди радикально оперированных больных измерялась несколькими процентами, то к началу ХХI века она вплотную приблизилась или даже превысила 20%.
Частота метастазирования в лимфатические узлы при раннем раке желудка варьирует весьма широко – от 5,5% до 43%, но по данным абсолютного большинства авторов находится в пределах 10-20% . Это означает, что более чем у 80% больных объем операции – гастрэктомия и субтотальная резекция желудка со стандартной либо расширенной лимфаденэктомией – превышает достаточный с точки зрения достижения радикальности. У больных ранним раком желудка без метастазов в регионарные лимфатические узлы адекватным лечением может быть выполнение органосберегающих операций либо эндоскопических вмешательств.
Пристальное внимание к концепции раннего рака желудка связано также с попыткой достижения второй важнейшей цели лечения онкологических больных – более высокого качества жизни. В связи с этим выбор адекватного метода лечения является предметом активной дискуссии в мировой литературе.
Мы располагаем опытом хирургического лечения 920 больных раком желудка, среди них у 149 (16,2%) больных опухоль была ограниченна пределами слизистого или подслизистого слоев стенки желудка (Т1 в соответствии с 5-ым изданием классификации TNM и 2-ым английским изданием Японской классификации рака желудка).
Гастрэктомия была выполнена у 23 (15%) больных, дистальная субтотальная резекция желудка – у 98 (66%) больных, проксимальная субтотальная резекция желудка – у 3 (2%) больных. Во всех эти случаях единым блоком с желудком удалялись оба сальника, а также клетчатка вдоль левой желудочной артерии. У 21 (14%) больного была выполнена дистальная резекция желудка с неполным удалением перигастральных лимфатических узлов. Такой объем оперативного вмешательства использовали при наличии небольшого размера поверхностных опухолей пилорического отдела желудка.
Мы наблюдали статистически значимый рост частоты раннего рака желудка среди радикально оперированных больных с 7,7% в 70-е годы до 22,2% в 90-е годы и в настоящее время. Среди 149 больных было 87 мужчин и 62 женщины. Возраст больных колебался от 29 до 78 лет, составив в среднем 55 лет. Преобладающей локализацией опухоли были нижняя (61%) и средняя (26%) трети желудка. У половины больных опухоли имели размеры до 2 см, в том числе у 34 (23%) пациентов – менее 1 см. В то же время, у каждого десятого больного максимальный размер новообразования превышал 6 см, а у 9 (6%) больных – превышал 10 см. Среди макроскопических форм роста возвышающиеся и плоские опухоли встречались с одинаковой частотой (24% и 23%); углубленные или изъязвленные – почти в два раза чаще (44%). Инфильтративный рост (4 тип по классификации Borrmann) имел место у 14 больных и наблюдался статистически значимо чаще при прорастании опухолью подслизистого слоя: 13% и 3% соответственно (р=0,0456). Изучение морфологического строения показало, что в 56% наблюдений опухоли были представлены высоко- и умеренно дифференцированной аденокарциномой; в 44% – низкодифференцированной аденокарциномой, перстневидно-клеточным и недифференцированным раком. Мультицентрический рост опухоли является одним из основных аргументов противников выполнения экономных резекций и эндоскопического лечения раннего рака желудка. По данным различных авторов два и более очага опухолевого поражения наблюдаются у 4-17% больных (в среднем – у 7-8%), причем, как правило, в пределах одной анатомической области. В нашем исследовании у 5 (3%) больных были выявлены две опухоли в одном (4 случая) и различных (1 случай) отделах желудка.
Среди 149 больных в 60 (40%) случаях опухоль располагалась на уровне слизистого слоя стенки желудка, а в 89 (60%) случаях – прорастала подслизистый слой. Среди больных с инвазией только слизистой оболочки ни в одном случае не были обнаружены метастазы в лимфатические узлы; при прорастании опухолью подслизистого слоя регионарные метастазы были выявлены у 18 (20%) больных. Частота метастатического поражения регионарных лимфатических узлов при раннем раке желудка (рТ1) по данным различных авторов варьирует от 5,5% до 43%; при прорастании слизистого слоя – от 0% до 5%, при прорастании подслизистого слоя – от 9,6% до 26%. Количество пораженных лимфатических узлов в нашем исследовании варьировало от 1 до 7, и в среднем составило 2,7. Метастазы обнаруживали в следующих группах лимфатических узлов: малого сальника (11 больных), большого сальника (4), вдоль левой желудочной артерии (4), надпривратниковых (1), подпривратниковых (1). Таким образом, у большинства больных (п=14, 78%) метастазы локализовались только в перигастральных лимфатических узлах (N1 в соответствии с Японской классификацией рака желудка); в 4 случаях – в лимфатических узлах второго коллектора (N2). По данным различных авторов, метастазы в перигастральные лимфатические узлы обнаруживаются в 75-80% случаев и более; во втором лимфатическом коллекторе – в 20-25%; в более отдаленных (N3-4) – в единичных наблюдениях.
Локализация первичной опухоли оказывала существенное влияние на риск развития лимфогенных метастазов. Так, при локализации опухоли в нижней трети желудка метастазы в регионарные лимфатические узлы были обнаружены у 12% больных, а при локализации в средней, верхней третях и при тотальном поражении желудка – в 31% (различие статистически значимо, р=0,03). Наиболее часто метастазы имели место при тотальном поражении желудка – у 3 из 6 больных (50%). Локализация опухоли влияла и на количество пораженных лимфатических узлов. Так, если при локализации опухоли в нижней трети желудка наличие двух и более пораженных лимфатических узлов имело место у 2 из 7 больных (29%), то при локализации опухоли в более проксимально расположенных отделах – у 7 из 11 больных (64%). Многофакторный анализ с использованием метода логистической регрессии определил локализацию опухоли как независимый прогностический фактор лимфогенного метастазирования. Частота лимфогенного метастазирования закономерно росла с увеличением размера опухоли. В тех случаях, когда диаметр опухоли не превышал 2 см, метастазы в лимфатические узлы определялись у 11% больных; при размере опухоли от 2 до 4 см – у 18% больных; при размерах более 4 см – у 33% больных. Различие между группами «4 см» статистически значимо (р=0,05). При минимальном размере опухоли (≤1 см) метастаз в лимфатическом узле был обнаружен лишь в одном наблюдении. Закономерности метастатического поражения лимфатических узлов второго коллектора (зоны чревного ствола и его ветвей) в мировой литературе освещены явно недостаточно. В основном это объясняется тем, что их поражение наблюдается лишь у 1-3,5% больных ранним раком желудка, в том числе в 3-7% случаев при прорастании первичной опухолью подслизистого слоя и в единичных случаях при внутрислизистых опухолях. По данным Tsujitani и соавт., метастазы в лимфатические узлы второго эшелона имели место у 15 из 890 (1,7%) больных и только в тех случаях, когда опухоли были более 2 см в диаметре и имели углубленный характер роста. В наших наблюдениях метастазы в лимфатические узлы второго коллектора лимфооттока имели место у 4 из 156 (2,6%) больных ранним раком желудка, в том числе у 4,3% – при прорастании подслизистой оболочки. Однако какой-либо закономерности в их развитии проследить не удалось – размеры первичной опухоли варьировали от 0,8 до 6,5 см; тип роста был как приподнятый, так и углубленный; степень дифференцировки – G1 и G3.
Из 148 оперированных и выписанных из стационара больных умерли 47; 26 больных умерли от причин, не связанных с основным заболеванием; 5 больных умерли от метахронных злокачественных новообразований (рака легкого, рака яичников, рака ободочной кишки, рака мочевого пузыря и острого лейкоза). У 7 больных причина смерти не известна; 14 больных умерли от рецидива рака желудка; у большинства из них (12 больных) имели место гематогенные метастазы. Локо-регионарный рецидив был выявлен у 6 больных и только в 2 случаях – изолированный (оба больных были радикально оперированы, произведена экстирпация культи желудка). Длительность безрецидивного периода варьировала значительно: от 2-6 месяцев (4 больных) до 109-112 месяцев (2 больных).
Показатели общей 5-, 10- и 15-летней выживаемости всей исследуемой группы больных составили 78%, 64% and 48% соответственно; медиана выживаемости – 15 лет. Скорректированная по причине смерти выживаемость была статистически значимо выше (χ2=8,196; df=l; р=0,0042). Выявлены два фактора, статистически значимо снижающих оба вида выживаемости: прорастание опухолью подслизистого слоя стенки желудка и метастатическое поражение регионарных лимфатических узлов. По данным различных авторов, 5-летняя выживаемость при прорастании опухолью слизистого слоя составляет 91-94%, подслизистого слоя – 78-83%, при отсутствии метастазов в регионарные лимфатические узлы – 85-100%, при наличии метастазов в регионарные лимфатические узлы – 64-81%. Поскольку метастазы в лимфатические узлы наблюдались только при поражении опухолью подслизистого слоя, мы сравнили выживаемость больных в зависимости от глубины инвазии опухолью стенки желудка при отсутствии регионарных метастазов. Оказалось, что статистически значимые различия (в пользу опухолей в пределах слизистого слоя) сохраняются по критерию общей выживаемости (χ2=8,834; df=l; р=0,003) и отсутствуют по критерию скорректированной выживаемости (χ2=2,775; df=1; р=0,0958).
Нами не выявлено статистически значимых отличий в результатах лечения в зависимости от локализации, морфологического строения, размера и макроскопического типа роста опухоли, а также вида оперативного вмешательства. При прорастании опухоли в пределах слизистого слоя только один больной умер от морфологически подтвержденного рецидива – множественных гематогенных и перитонеальных метастазов через 112 месяцев после оперативного лечения. Принимая во внимание очень низкую вероятность лимфогенного метастазирования и хорошие отдаленные результаты (15-летняя общая выживаемость – 80%, скорректированная выживаемость – 93%) мы считаем, что субтотальная резекция с ограниченной (D1) лимфаденэктомией является адекватным хирургическим вмешательством. Определенные подгруппы больных (небольшие по размеру опухоли при отсутствии мультицентрического роста) могут рассматриваться как кандидаты для более консервативного лечения – выполнения сегментарных операций, а также эндоскопического удаления опухоли. Преимущество органосберегающего лечения очевидно – улучшение качества жизни, более полная медицинская, социальная и трудовая реабилитация больных.
Отдаленные результаты лечения больных при прорастании опухоли в подслизистый слой были значительно хуже, и связано это, в первую очередь, с метастатическим поражением лимфатических узлов. 5 из 18 (28%) больных, имевших регионарные метастазы, умерли от рецидива заболевания. Принимая во внимание больший размер, чаще выявляемую мультицентричность поражения, более высокую частоту лимфогенного метастазирования, включая поражение лимфатических узлов второго и даже третьего коллектора, мы считаем, что лечение опухолей с распространением на подслизистый слой должно быть таким же, как и более распространенных форм рака желудка. Небольшой размер и экзофитный рост опухоли не могут быть основанием для ограничения объема вмешательства, поскольку напрямую не коррелируют с глубиной инвазии и наличием метастазов в лимфатические узлы. Однако, остается неясным, способно ли расширение объема оперативного вмешательства улучшить отдаленные результаты лечения, поскольку причиной смерти большинства больных были отдаленные метастазы. Более того, мы наблюдали 5 больных, умерших от множественных гематогенных метастазов в течение первого года (через 2,3,4, 6 и 10 месяцев) после операции. Полученные нами данные о преобладании гематогенного пути метастазирования раннего рака желудка, а также о высокой частоте развития рецидивов после хирургического лечения опухолей с инвазией подслизистого слоя и наличием метастазов в регионарные лимфатические узлы соответствуют данным других исследователей. Это означает, что даже ранние опухоли желудка могут иметь высокую биологическую агрессивность, и отдаленные метастазы могут быть уже к моменту выполнения операции. Частота развития рецидивов у больных раком желудка рТ1N+ в нашем исследовании (5 из 18 больных) соответствует аналогичному показателю в работах Abe S. и соавт. и Kitamura К. и соавт., хотя японские авторы рутинно использовали расширенную лимфодиссекцию. В двух крупных европейских рандомизированных исследованиях также не было показано преимуществ расширенной (D2) лимфаденэктомии по сравнению с ограниченной (D1) при опухолях Т1.
В заключение следует отметить, что практически все аспекты проблемы раннего рака желудка (определение, клинико-морфологические характеристики, выбор адекватного метода лечения и его результаты, факторы прогноза) продолжают оставаться предметом полемики. Полученные нами данные убедительно демонстрируют, что так называемый “ранний”, “поверхностный”, “начальный” или “малый” рак желудка с распространением только в пределах слизистого или подслизистого слоев представляет собой весьма разнородную группу опухолей. Они значительно отличаются по морфологической форме, особенностям роста в пределах стенки желудка, потенции давать лимфогенные и гематогенные метастазы, и, соответственно, по прогнозу. Так, опухоли с поражением подслизистого слоя, по сравнению с расположенными только в пределах слизистого слоя, статистически значимо больше по размеру, чаще имеют низкую степень дифференцировки, мультицентрический рост, и, главное, значительно чаще метастазируют в регионарные лимфатические узлы. Очевидно, что закономерности лимфогенного метастазирования являются краеугольным камнем в дискуссии о выборе адекватного лечения раннего рака желудка. Опухоли, расположенные на уровне слизистой оболочки стенки желудка, наиболее полно отвечают понятию раннего рака, поскольку практически не метастазируют в лимфатические узлы. Поэтому органосохраняющее лечение у данной категории больных может рассматриваться как адекватное с онкологических позиций. При прорастании опухолью подслизистого слоя, частота лимфогенных метастазов достигает 20-25%, а с учетом наличия микрометастазов повышается еще более. Дальнейший прогресс в лечении больных ранним раком желудка связан с индивидуализацией объема оперативного вмешательства на пораженном органе и лимфатическом аппарате. В последние годы появились позитивные результаты исследований, посвященных применению концепции сторожевых лимфатических узлов у больных раком желудка, что впервые открывает возможность индивидуальной оценки состояния регионарных лимфатических узлов. Проведенные исследования показали, что общая диагностическая точность оценки статуса регионарных лимфатических узлов на основании биопсии сторожевых лимфатических узлов весьма высока и составляет 90-98%. Интраоперационное (в том числе во время лапароскопического вмешательства) морфологическое исследование сторожевых лимфатических узлов может позволить обоснованно отобрать группу больных ранним раком желудка, у которых отсутствуют регионарные метастазы, для выполнения органосберегающих оперативных вмешательств. По нашему мнению, в настоящее время методом оперативного лечения рака желудка с распространением на подслизистый слой должна быть гастрэктомия либо дистальная субтотальная резекция желудка с модифицированной D2 лимфодиссекцией – удалением лимфатических узлов вдоль чревной, левой желудочной, общей печеночной и проксимальной части селезеночной артерии, и сохранением селезенки и поджелудочной железы.
Copyright © Российское общество клинической онкологии (RUSSCO)
Полное или частичное использование материалов возможно только с разрешения администрации портала.
Источник