Ифт лимфоцитов периферической крови что это
Метод определения
Иммунофенотипирование (проточная цитофлюориметрия, безотмывочная технология)
Исследуемый материал
Цельная кровь (с ЭДТА)
Синонимы: Иммунофенотипирование; клеточный иммунитет; субпопуляции лимфоцитов. Immunophenotyping; Human Immune System; Human Leukocyte Differentiation Antigens.
Краткое описание анализа крови «Фенотипирование лимфоцитов (основные субпопуляции) – CD3, CD4, CD8, CD19, CD16,56»
В профиль входят следующие показатели:
- Лимфоциты, абсолютное значение,
- Т-лимфоциты (CD3+),
- Т-хелперы (CD3+CD4+),
- Т-цитотоксические лимфоциты (CD3+CD8+),
- Иммунорегуляторный индекс (CD3+CD4+/CD3+CD8+),
- В-лимфоциты (СD19+), ЕК-клетки (CD3-CD16+CD56+),
- Т-ЕК-клетки (CD3+CD16+CD56+).
Какие параметры оцениваются в исследовании «Фенотипирование лимфоцитов (основные субпопуляции) – CD3, CD4, CD8, CD19, CD16,56»
Лимфоциты экспрессируют ряд поверхностных и цитоплазматических антигенов, уникальных для своей субпопуляции и стадии развития. Физиологическая роль их может быть различной. Эти структуры являются мишенями при иммунофенотипировании лимфоцитов как антигенные маркёры различных субпопуляций, присутствие которых определяют с помощью меченых моноклональных антител. Поверхностные антигенные структуры на клетках, выявляемые моноклональными антителами, назвали кластерами дифференциации (CD, clusters of differentiation). Кластерам дифференциации в целях стандартизации присвоены определённые номера. Используя флюорохром-меченые моноклональные антитела, связывающиеся с определёнными CD, можно произвести подсчёт содержания лимфоцитов, относящихся к различным по функции или стадии развития субпопуляциям. Это позволяет понять природу некоторых заболеваний, оценить состояние пациента, следить за течением и прогнозировать дальнейшее развитие заболевания.
Основные субпопуляции лимфоцитов
Т-лимфоциты – лимфоциты, созревание которых происходит в тимусе (отсюда их название). Они участвуют в обеспечении клеточного иммунного ответа и контролируют работу В-лимфоцитов, ответственных за образование антител, т. е. за гуморальный иммунный ответ.
Т-хелперы (от англ. «to help» – помогать) – разновидность Т-лимфоцитов, несут на своей поверхности структуры, способствующие распознаванию антигенов, презентированных вспомогательными клетками, участвуют в регуляции иммунного ответа, вырабатывая различные цитокины.
Цитотоксические Т-клетки – распознают фрагменты антигена на поверхности клеток-мишеней, ориентируют свои гранулы по направлению к мишени и высвобождают их содержимое в области контакта с ней. При этом некоторые цитокины являются сигналом гибели (по типу апоптоза) для клеток-мишеней.
В-лимфоциты (от лат. «bursa» – сумка, по названию сумки Фабрициуса, в которой созревают эти лимфоциты у птиц) – проходят развитие в лимфоузлах и других периферических органах лимфоидной системы. На поверхности эти клетки несут иммуноглобулины, функционирующие как рецепторы к антигенам. В ответ на взаимодействие с антигеном В-лимфоциты отвечают делением и дифференциацией в плазматические клетки, вырабатывающие антитела, посредством которых обеспечивается гуморальный иммунитет.
ЕК-клетки (естественные киллерные клетки, или натуральные киллеры) – клетки с естественной, неиммунной цитотоксической активностью к неопластически изменённым клеткам-мишеням. ЕК-клетки не относятся ни к зрелым Т- или В-лимфоцитам, ни к моноцитам.
Т-ЕК (ЕКТ)-клетки – это клетки с естественной неиммунной киллерной активностью, имеющие признаки Т-лимфоцитов.
Кластеры дифференциации антигенов
CD3 – поверхностный маркёр, специфичный для всех клеток субпопуляции Т-лимфоцитов. По функциям относится к семейству белков, формирующих комплекс мембранной передачи сигнала, связанный с Т-клеточным рецептором.
CD4 – характерен для хелперных Т-клеток; представлен также на моноцитах, макрофагах, дендритных клетках. Он связывается с молекулами MHC класса II, экспрессированными на антигенпрезентирующих клетках, облегчая распознавание пептидных антигенов.
CD8 – характерен для супрессорных и/или цитотоксических Т-клеток, ЕК-клеток, большей части тимоцитов. Это рецептор Т-клеточной активации, который облегчает распознавание клеточно-связанных антигенов MHC класса I (major histocompatibility complex – главный комплекс гистосовместимости).
CD16 – используется вместе с CD56 преимущественно для идентификации ЕК-клеток. Представлен также на макрофагах, тучных клетках, нейтрофилах, некоторых Т-клетках. Это компонент рецепторов, связанных с IgG, опосредующих фагоцитоз, продукцию цитокинов и антителозависимую клеточную цитотоксичность.
CD19 – присутствует на B-клетках, их предшественниках, фолликулярных дендритных клетках, считается самым ранним маркёром B-клеточной дифференциации. Регулирует развитие, дифференциацию и активацию B-клеток.
CD56 – прототипный маркёр ЕК-клеток. Помимо ЕК-клеток присутствует на эмбриональных, мышечных, нервных, эпителиальных клетках, некоторых активированных Т-клетках. CD56-позитивны такие гематологические опухоли, как ЕК-клеточная или Т-клеточная лимфома, анапластическая крупноклеточная лимфома, плазмоклеточная миелома (плазмоклеточная лейкемия CD56-негативна). Это молекулы адгезии клеточной поверхности, которые облегчают гомофильную адгезию и участвуют в контактном ингибировании роста, ЕК-клеточной цитотоксичности, развитии нервных клеток.
Литература
- Зурочка А.В., Хайдуков С.В. и др. – Проточная цитометрия в медицине и биологии. – Екатеринбург: РИО УрО РАН, 2013. – 552 с.
- Клиническая иммунология и аллергология / Ред. Лолор-младший Г., Фишер Т, Д. Адельман Д../: Пер. с англ. – М.: Практика, 2000. – 806 с.
- Клиническая лабораторная диагностика. Национальное руководство. Том 2./Ред. Долгов В.В., Меньшиков В.В./ – М., ГЭОТАР-Медиа, 2012 – 808 с.
- Практическое руководство по детским болезням. Том 8 Иммунология детского возраста. /Ред. А.Ю.Щербина, Е.Д.Пашанов/ – Москва: МЕДПРАКТИКА, 2006 – 432 с.
- Ройт А., Бростофф Д., Дейл Д. Иммунология. – М.: Мир, 2000 — 592 с
- Ярилин А. А. Иммунология. – М.: ГЭОТАР-Медиа. 2010 – 752 с.
- Leach М., Drummond М., Doig A. Practical Flow Cytometry in Haematology Diagnosis Hardcover. – WILEY-BLACKWELL, 2013.
- Tietz Clinical guide to laboratory tests. 4-th ed. Ed. Wu A.N.B. – USA: W.B Sounders Company, 2006 – 1798 p.
Источник
[20-077]
Фенотипирование лимфоцитов (основные субпопуляции) – CD3, CD4, CD8, CD19, CD56
4035 руб.
Исследование включает в себя определение абсолютных и относительных значений субпопуляционного состава лимфоцитов (CD3, CD4, CD8, CD19, CD56). Рекомендуется к назначению для контроля показателей клеточного звена иммунной системы в динамике после комплексного иммунологического обследования.
Синонимы русские
Иммунофенотипирование, клеточный иммунитет, многоцветный клеточный анализ методом проточной цитометрии, субпопуляции лимфоцитов.
Синонимы английские
Human Immune System, Immunophenotyping, Multicolor Flow Cytometry Cell Analysis, Human Leukocyte Differentiation Antigens.
Метод исследования
Проточная цитометрия.
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь в течение 24 часов до исследования.
- Детям в возрасте до 1 года не принимать пищу в течение 30-40 минут до исследования.
- Детям в возрасте от 1 до 5 лет не принимать пищу в течение 2-3 часов до исследования.
- Не принимать пищу в течение 12 часов до исследования, можно пить чистую негазированную воду.
- Полностью исключить (по согласованию с врачом) прием лекарственных препаратов в течение 24 часов перед исследованием.
- Исключить физическое и эмоциональное перенапряжение в течение 24 часов до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Оценка клеточного состава (иммунофенотипирование) лимфоцитов крови человека – основной компонент в оценке иммунного статуса – выполняется методом проточной цитофлуориметрии.
Иммунофенотипирование – характеристика клеток при помощи моноклональных антител или каких-либо других зондов, позволяющих судить об их типе и функциональном состоянии по наличию того или иного набора клеточных маркеров.
Иммунофенотипирование лейкоцитов заключается в обнаружении на их поверхности маркеров дифференциации, или CD антигенов. Лейкоциты экспрессируют ряд поверхностных и цитоплазматических антигенов, уникальных для своей субпопуляции и стадии развития. CD антигены (англ. cluster of differentiation antigens) – это антигены на поверхности клеток, маркеры, отличающие одни типы клеток от других. Дифференциации этих антигенов изучены и стандартизованы, им присвоены определенные номера. CD могут быть распознаны с помощью соответствующих моноклональных антител. Используя флюоресцентно-меченые моноклональные антитела, связывающиеся с определенными CD, можно с помощью метода проточной цитометрии произвести подсчёт содержания лимфоцитов, относящихся к различным по функции или стадии развития субпопуляциям.
В основе проточной цитофлуориметрии лежит проведение фотометрических и флюоресцентных измерений отдельных клеток, пересекающих одна за другой вместе с потоком жидкости луч монохроматического света, обычно света лазера.
Метод позволяет не только определить количественное соотношение основных популяций лимфоцитов:
- Т-лимфоциты (CD3+CD19-);
- Т-хелперы/индукторы (CD3+CD4+CD45+);
- Т-цитотоксические лимфоциты (Т-ЦТЛ) (CD3+CD8+CD45+);
- истинные “натуральные киллеры” (NK-клетки) (CD3-CD56+CD45+);
- В-лимфоциты (CD19+CD3-);
– но и оценить малые клеточные популяции, а также изучить их функциональную активность:
- Т-лимфоциты, экспрессирующие маркеры NK-клеток(Т-NK-клетки) (CD3+CD56+CD45+);
- NK-клетки, экспрессирующие α-цепь антигена CD8 (CD3-СD8+CD45+).
Когда назначается исследование?
Рекомендовано для комплексного обследования пациентов, входящих в группу риска по четырем основным иммунопатологическим синдромам.
С инфекционным синдромом:
- частые ОРВИ, хронические инфекции ЛОР-органов (гнойные синуситы, отиты, периодически встречающиеся лимфадениты, пневмонии с тенденцией к рецидивированию, бронхоплевропневмонии);
- бактериальные инфекции кожи и подкожной клетчатки (пиодермии, фурункулез, абсцессы, флегмоны, септические гранулемы, рецидивирующий парапроктит у взрослых);
- урогенитальные инфекции;
- грибковые поражения кожи и слизистых оболочек, кандидоз, паразитарные инвазии;
- рецидивирующий герпес различной локализации;
- гастроэнтеропатия с хронической диареей неясной этиологии, дисбактериозом;
- длительный субфебрилитет, лихорадка неясной этиологии;
- генерализованные инфекции: сепсис, гнойные менингиты.
С аллергическим (атопическим) синдромом:
- атопический дерматит;
- нейродермит;
- экзема с инфекционным компонентом;
- тяжелая атопическая бронхиальная астма, поллиноз, хронический астматический бронхит.
С аутоиммунным синдромом:
- ревматоидный артрит;
- рассеянный склероз;
- диффузные заболевания соединительной ткани (системная красная волчанка, склеродермия, дерматомиозит);
- аутоиммунный тиреоидит;
- неспецифический язвенный колит.
С иммунопролиферативным синдромом:
- опухолевые процессы в иммунной системе (лимфомы, болезнь Ходжкина, острый и хронический лимфолейкоз, саркома Капоши).
Что означают результаты?
Изменения различных клеточных популяций лимфоцитов в сторону повышения или понижения развиваются при различных патологических процессах в организме, таких как инфекции, аутоиммунные и онкологические заболевания, иммунодефициты, в постоперационном периоде, при трансплантации органов.
Ниже представлена таблица с клиническими ситуациями, которые могут приводить к изменениям в субпопуляционном составе лимфоцитов.
Субпопуляция лимфоцитов | Повышение показателя | Снижение показателя |
T-лимфоциты (CD3+CD19-) |
|
|
Т-хелперы (CD3+CD4+CD45+) |
|
|
Т-цитотоксические лимфоциты (CD3+CD8+CD45+) |
|
|
В-лимфоциты (CD19+CD3-) |
|
|
“Натуральные киллеры” (CD3-CD56+CD45+), (CD3-CD16+CD45+) |
|
|
Т-“натуральные киллеры”, НК-Т (CD3+CD56+CD45+) |
| Не имеет диагностического значения. |
В совокупности с клиническими данными, симптоматикой, другими методами лабораторных исследований вышеуказанные изменения являются диагностическим признаком возникновения этих патологических процессов в организме человека.
Важные замечания
- Результаты данного исследования необходимо сопоставлять с клиническими данными и показателями других лабораторных анализов.
- Следует отметить, что оценка показателей в динамике существенно повышает клиническую значимость исследования.
Литература
- Хаитов, Р.М. Аллергология и иммунология : национальное руководство / под ред. Р.М. Хаитова, Н.И. Ильиной. – М. : ГЭОТАР-Медиа, 2009. – 656 с.
- Хаитов, Р.М. Руководство по клинической иммунологии. Диагностика заболеваний иммунной системы : руководство для врачей / Р.М. Хаитов, Б.В. Пинегин, А.А. Ярилин. – М. : ГЭОТАР-Медиа, 2009. – 352 с.
- Зуева Е.Е. Иммунная система, иммунограмма : рекомендации по назначению и применению в лечебно диагностическом процессе /Е.Е Зуева, Е.Б. Русанова, А.В. Куртова, А.П. Рыжак, М.В. горчакова, О.В. Галкина – СПб. – Тверь: ООО «издательство «Триада», 2008. – 60 с.
- Кетлинский, С.А. Иммунология для врача / С.А. Кетлинский, Н.М. Калинина. СПб. : Гиппократ, 1998. – 156 с. Ярилин, А.А. Иммунология : учебник / А.А. Ярилин. – М. : ГЭОТАР-Медиа, 2010. – 752 с.
- Хаитов, Р.М. Иммунология : атлас / Р.М. Хаитов, А.А. Ярилин, Б.В. Пинегин.М. : ГЭОТАР-Медиа, 2011. – 624 с.
- Хаитов, Р.М. Иммунология : учебник / Р.М. Хаитов. – М. : ГЭОТАР-Медиа, 2009. – 320 с.
- Хаитов, Р.М. Оценка иммунного статуса человека в норме и при патологии / Р.М. Хаитов, Б.В. Пинегин // Иммунология. – 2001. – N4. – С. 4–6.
- Whiteside, T.L. Role of Human Natural Killer Cells in Health and disease / T.L. Whiteside, R.B. Herberman // Clinical and Diagnostic Laboratory Immunology. – 1994. – Vol. 1, №2. – P. 125–133.
- Ginadi, L. Differential expression of T-cell antigens in normal peripheral blood lymphocytes : a quantitative analysis by flow cytometry / L. Ginadi, N. Farahat, E. Matutes [et al.] // J. Clin. Pathol. – 1996. – Vol. 49, № 1. – P. 539–544.
- Merser, J.C. Natural killer T-cells : rapid responders controlling immunity and disease / J.C. Merser, M.J. Ragin, A. August // International J. Biochemistry & Cell Biology. – 2005. – № 37. – P. 1337–1343.
- Никитин, В.Ю. Маркеры активации на Т-хелперах и цитотокси ческих лимфоцитахна различных стадиях хронического вирусного гепатита С / В.Ю. Никитин, И.А. Сухина, В.Н. Цыган [и др.] // Вестн. Рос. Воен.-мед. акад. – 2007. – Т. 17, № 1. – С. 65–71.
- Boettler, T. T cells with CD4+CD25+ regulatory phenotype suppress in vitro proliferation of virus-specific CD8+ T cells during chronic hepatitis C virus infection / T. Boettler, H.C. Spangenberg, C. Neumann-Haefelin [et al.] // J. Virology. − 2005. − Vol. 79, N 12. −P. 7860–7867.
- Ormandy, L.A. Increased Populations of Regulatory T Cells in Peripheral Blood of Patients with Hepatocellular Carcinoma / L.A. Ormandy, T. Hillemann, H. Wedemeyer [et al.] // J. Cancer Res. − 2005. − Vol. 65, N 6. − P. 2457–2464.
- Sakaguchi, S. Naturally arising FoxP3-expressing CD4+CD25+ regulatory T cells in immunological tolerance to self- and non-self / S. Sakaguchi // Nature Immunol. − 2005. −Vol. 6, N 4. − P. 345–352.
- Romagnani, S. Regulation of the T cell response / S. Romagnani // Clin. Exp. Allergy. – 2006. − Vol. 36. − P. 1357–1366.
- Хайдуков С.В., Основные и малые популяции лимфоцитов периферической крови человека и их нормативные значения (метод многоцветного цитометрического анализа) /Хайдуков С.В., Зурочка А.В., Тотолян А.А., Черешнев В.А. // Мед. иммунология. – 2009. -Т. 11 (2-3). – С. 227-238.
Источник
Диагностика хронического лимфолейкоза (ХЛЛ) – иммунофенотип клеток
Диагноз хронического лимфолейкоза (ХЛЛ) может быть установлен при абсолютном количестве лимфоцитов в крови более 5•109/л, наличии в костно-мозговом пунктате не менее 30 % лимфоцитов и иммунологическом подтверждении клонового В-клеточного характера лимфоцитоза.
В подавляющем большинстве случаев предположение о наличии у больного хроническим лимфолейкозом (ХЛЛ) возникает в связи с изменениями картины крови: обнаружение абсолютного и относительного лимфоцитоза. Международное рабочее совещание в 1989 г. установило среди критериев для постановки диагноза хронического лимфолейкоза наличие абсолютного лимфоцитоза в крови не менее 10 • 109/л, однако позже это положение было пересмотрено. В настоящее время для предположения о заболевании ХЛЛ считается достаточным наличие абсолютного лимфоцитоза 5•109/л.
Иногда на протяжении 2—3 лет при числе лейкоцитов, лишь незначительно превышающем норму или даже соответствующем нормальному показателю, наблюдается постепенно нарастающий лимфоцитоз — 50—60—70 %. Эти изменения лейкоцитарной формулы еще не являются оснаванием для постановки диагноза хронического лимфолейкоза без дополнительных исследований: пункции костного мозга и иммунологического исследования крови и костно-мозгового пунктата. Тем не менее такой пациент должен быть под пристальным наблюдением врача: обязательны осмотр и анализы крови каждые 3—4 мес, поскольку, как правило, такие изменения крови являются проявлением начала хронического лимфолейкоза.
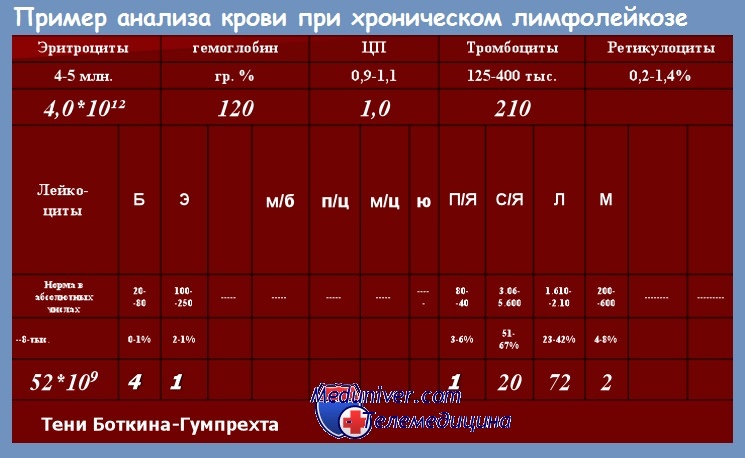
В крови среди ядерных элементов обнаруживается преобладание зрелых лимфоцитов — клеток малого размера, округлых, с плотным ядром и узким ободком светлой или слегка базофильной цитоплазмы. В мазках крови обычно определяется то или иное количество клеток Гумпрехта—Боткина — полуразрушенных размытых ядер лимфоцитов. Их появление связано с повышенной ломкостью мембраны лимфоцитов при хроническом лимфолейкозе.
Количество клеток Гумпрехта — Боткина, как правило, больше у больных с высоким лейкоцитозом. Клетки, или, как их нередко называют, тени Гумпрехта — Боткина, образуются при приготовлении мазка, их наличие и количество не имеют прогностического значения.
Количество лейкоцитов при хроническом лимфолейкозе может быть различным, в большинстве случаев при установлении диагноза хронического лимфолейкоза оно составляет 20—50•109/л, но нередко при первом обращении к врачу уже имеется гиперлейкоцитоз (100—500 • 109/л), свидетельствующий о длительном недиагностированном периоде заболевания. Мы наблюдали больного, у которого при первом обращении к врачу по поводу длительно существующих увеличенных лимфатических узлов количество лейкоцитов оказалось 1200•109/л.
При подсчете лейкоцитарной формулы содержание лимфоцитов обычно составляет 50—70 %, при высоком лейкоцитозе иногда достигает 95—99 %. Наряду со зрелыми лимфоцитами в крови обычно в очень небольшом количестве (как правило, не более 1—3 %) удается обнаружить пролимфоциты — более крупные клетки с отчетливой нуклеолой в ядре. Постепенное увеличение содержания пролимфоцитов в течение болезни, так же как их постоянное присутствие в количестве 10 % и более, является плохим прогностическим признаком.

Е. Matutes и соавт. на большом клиническом материале показали, что выживаемость больных хроническим лимфолейкозом прямо коррелирует с числом циркулирующих пролимфоцитов и значительно снижается уже при числе пролимфоцитов более 5 %.
На основании изучения морфологической картины крови почти 550 больных ХЛЛ Е. Matutes и соавт. выделили примерно 15 % больных с необычной морфологией клеток. Они предложили считать таких больных страдающими атипичным ХЛЛ, отметив два его подтипа: один с повышенным более 10 % количеством пролимфоцитов и второй — с лимфоплазмоцитоидной дифференцировкой лимфоцитов и/или наличием лимфоцитов с расщепленным (cleaved) ядром. Во втором случае одновременно имеются обычные лимфоциты, характерные для хронического лимфолейкоза, и переходные формы — более крупные лимфоциты с выраженной базофилией цитоплазмы или с намечающейся расщелиной ядра.
Течение болезни в этом случае обычно не отличается от характерного для типичного хронического лимфолейкоза, однако нередко при обоих указанных вариантах имеется трисомия хромосомы 12. При обоих подтипах: повышенном количестве пролимфоцитов и лимфоплазмоцитоидной морфологии лимфоцитов — течение болезни у больных с трисомией хромосомы 12 более агрессивное.
Костно-мозговой пунктат при хроническом лимфолейкозе обычно гиперклеточный, инфильтрация лимфоцитами чаще всего имеет диффузный характер, хотя иногда встречаются случаи нодулярной инфильтрации. В большинстве случаев процентное содержание лимфоцитов значительно превышает необходимые для установления диагноза 30 %, нередко достигая 90—95 %.

Лимфоциты в костном мозге морфологически не отличаются от лимфоцитов крови, но обычно имеется 3—5 % пролимфоцитов даже в тех случаях, когда они не обнаруживаются в крови.
При морфологическом исследовании лимфатического узла обнаруживают стирание нормального рисунка и мономорфную инфильтрацию лимфоцитами, морфологически сходными с лимфоцитами крови и костного мозга, иногда имеющими несколько большие размеры. В небольшом количестве встречаются пролимфоциты и клетки, названные параиммунобластами: клетки среднего размера с дисперсным хроматином и круглыми или овальными ядрышками. В селезенке преобладает инфильтрация белой пульпы, хотя красная пульпа обычно тоже оказывается в той или иной степени инфильтрированной малыми лимфоцитами.
Несмотря на характерную картину, результаты морфологического исследования не могут считаться достаточными для установления диагноза хронического лимфолейкоза (ХЛЛ), поскольку аналогичная морфологическая картина крови и костного мозга нередко наблюдается при фолликулярной и мантийно-клеточной лимфомах с поражением костного мозга. Согласно современным критериям, диагноз хронического лимфолейкоза может считаться установленным только после иммунологического исследования, подтверждающего диагноз. Патологические лимфоциты при хроническом лимфолейкозе имеют абсолютно характерный иммунофенотип.
Они экспрессируют антигены CD19, CD5, CD23, отмечается слабая экспрессия на поверхности клеток иммуноглобулинов (экспрессируются IgM, нередко одновременно с IgD) с одной L-цепью, определяется слабая экспрессия антигенов CD20 и CD22, у ряда больных экспрессируется молекула FMC-7. Антиген CD79b, или Igb, являющийся частью В-клеточного рецептора, либо не экспрессируется, либо экспрессируется очень слабо в подавляющем большинстве случаев.
Характерный иммунофенотип опухолевых клеток позволяет отличить В-ХЛЛ от других лимфопролиферативных заболеваний.
Е. Matutes и соавт. предложили числовую систему, помогающую при дифференциальной диагностике В-ХЛЛ и других лимфопролиферативных заболеваний. По этой системе каждый иммунологический признак, характерный для В-ХЛЛ, расценивается как 1 балл, его противоположное значение — как 0.
Иммунофенотип опухолевых клеток при различных лимфопролиферативных заболеваниях
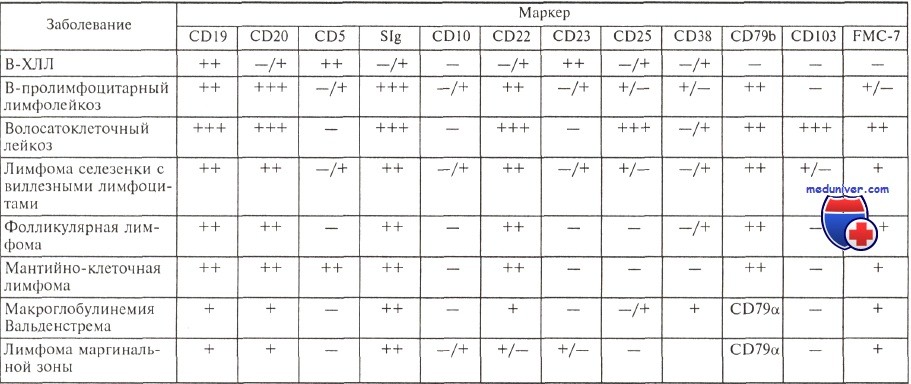
Система выглядит следующим образом: поверхностные иммуноглобулины слабая экспрессия — 1, сильная — 0; CD5+ -1, CD5-0; CD23+ -1, CD23-0; CD22 — слабая экспрессия — 1, сильная — 0; CD79b — отсутствует — 1, экспрессируется — 0; FMC-7— отсутствует — 1, экспрессируется — 0. Оценив по этой системе сумму полученных баллов у 298 больных хроническим лимфолейкозом и 166 больных другими зрелоклеточными лимфопролиферативными заболеваниями, авторы показали, что у 96,8 % больных хроническим лимфолейкозом сумма полученных баллов составляет 3—5, в то время как более чем у 94 % больных другими лимфопролиферативными заболеваниями она равна 1—2 баллам.
Иногда возникают трудности в дифференциальной диагностике хронического лимфолейкоза и так называемого монокло-нового В-лимфоцитоза неопределенного значения (MLUS — monoclonal lymphocytosis of undetermined significance), названного так по аналогии с моноклоновыми гаммапатиями неопределенного значения (MGUS). Термин был впервые введен еще в конце 80-х годов прошлого века для отличия непрогрессирующего моноклонового лимфоцитоза без признаков ХЛЛ от индолентного ХЛЛ с признаками заболевания. В настоящее время чаще употребляется термин CLUS (clonal lymphocytosis of undetermined significance).
При CLUS обычно на протяжении многих лет сохраняются умеренный и стабильный лейкоцитоз и лимфоцитоз (меньше необходимых для диагноза ХЛЛ 5•109/л), нормальные показатели эритро- и тромбоцитопоэза, отсутствует увеличение лимфатических узлов и селезенки.
В наблюдениях С. Wang и соавт. клиническая картина и лабораторные показатели при CLUS оставались неизменными на протяжении 3—10 лет. Клоновая природа лимфоцитоза была подтверждена рестрикцией L-цепи экспрессируемых на поверхности лимфоцитов иммуноглобулинов. Никаких хромосомных аберраций на протяжении всего времени наблюдения выявлено не было. У всех пациентов исследование иммунофенотипа на протяжении всего времени наблюдения обнаруживало экспрессию лимфоцитами антигенов CD19, CD20 и слабую экспрессию поверхностных иммуноглобулинов, однако неизменно выявляло отсутствие экспрессии CD5 и CD23. Таким образом, данные наблюдения не отвечают всем признакам В-ХЛЛ. Однако в большинстве случаев иммунофенотип при CLUS не отличается от типичного иммунофенотипа В-ХЛЛ. A. Rowstron на основании анализа нескольких сотен наблюдений раннего стабильного хронического лимфолейкоза и сравнения их с CLUS указывает, что частота прогрессирования в этих случаях одинакова и не превышает 10 %.
Известно, что истинный хронический лимфолейкоз, имеющий все необходимые для установления диагноза черты, также может годами не проявлять признаков прогрессирования. В подобных случаях имеется характерный для данного заболевания иммунофенотип, а при длительном наблюдении (в одном нашем наблюдении спустя 22 года со времени постановки диагноза) во многих случаях появляются черты прогрессирующего хронического лимфолейкоза. В других наблюдениях клиническая картина сохраняется неизменной на протяжении всей жизни больного.
Мы наблюдали больную в течение 29 лет, которая не получала никакого лечения, поскольку все это время у нее была стабильная гематологическая и клиническая картина: отсутствие увеличенных лимфатических узлов и селезенки, количество лейкоцитов 15—20•109/л, лимфоцитов 65—70 %. Это наблюдение похоже на наблюдения Т. Han и соавт., описавших 10 больных с лейкоцитозом более 10 • 109/л и моноклоновым В-клеточным лимфоцитозом, у которых в течение 6—24 лет не было признаков прогрессирования и которые не нуждались в терапии.
Возможно, эти наблюдения являются отражением возрастного изменения В-клеточного репертуара. Почти 10 лет назад было обнаружено, что у мышей с возрастом постепенно суживается разнообразие клонов В-клеток (В-клеточный репертуар) и одновременно происходит увеличение размеров (амплификация) отдельных клонов. N. Chiorazzi и М. Ferrarini указывают, что у здоровых людей старше 50 лет наличие таких клонов В-лимфоцитов является обычным. Возможно, отдельные клоны, возникшие под влиянием длительной стимуляции определенным антигеном, могут приобретать значительные размеры и определяться при рутинном иммунологическом исследовании.
Обнаруженная недавно в половине исследованных методом FISH случаев CLUS делеция 13ql4, являющаяся самой частой генетической аберрацией при ХЛЛ, подтверждает мнение о том, что CLUS следует расценивать как раннюю стадию хронического лимфолейкоза доброкачественного течения. В то же время P. Ghia и соавт., обследовав 500 здоровых людей старше 65 лет, обнаружили у части из них клоны клеток с иммунофенотипом, характерным для различных лимфопролиферативных заболеваний, иногда у одного и того же больного. Авторы полагают, что это, скорее всего, является не ранней стадией болезни, а отражением постепенно суживающегося с возрастом В-клеточного репертуара.
В 1982 г. описан постоянный поликлоновый В-лимфоцитоз у курящих женщин средних лет. У некоторых из них были частые респираторные заболевания. Это редкий феномен, и со времени первой публикации появилось не более 90 подобных описаний. Исследования с помощью ПЦР показали, что во всех изученных случаях имеется реаранжировка BCL-2/IgH, которая, однако, не всегда сопровождалась повышенной экспрессией BCL-2.
У некоторых курящих женщин с поликлоновым В-лимфоцитозом обнаружены незначительное увеличение размеров селезенки и поликлоновая гамма-патия, которые, как и лимфоцитоз, иногда исчезали после прекращения курения.
Несколько случаев поликлонового В-лимфоцитоза описаны у некурящих. С помощью ПЦР у некоторых пациентов в крови был обнаружен вирус Эпштейна—Барр. Неясно, играет ли этот вирус роль в развитии синдрома поликлонового В-лимфоцитоза.
Очевидно, в настоящее время подобные случаи не являются трудными для дифференциальной диагностики с хроническим лимфолейкозом (ХЛЛ), поскольку поликлоновый характер лимфоцитоза обнаруживается при иммунофенотипировании. Трудности для трактовки представляет описанный недавно случай поликлонового В-клеточного лимфоцитоза с комплексными хромосомными аберрациями — трисомией хромосом 3, 15 и 18, инверсией хромосомы 18, t(13;14) в отдельных клетках у длительно курящей женщины. Гематологическая картина остается стабильной на протяжении нескольких лет наблюдения, но отмечаются часто повторяющиеся инфекции верхних дыхательных путей. Необходимо длительное наблюдение для выяснения вопроса о том, не являются ли имеющиеся хромосомные аберрации отражением начала лимфопролиферативного заболевания.
При некоторых хронических инфекциях (туберкулез, сифилис), иногда при неинфекционных заболеваниях (тиреотоксикоз, болезнь Аддисона) наблюдается постоянный Т-клеточный лимфоцитоз, чаще всего при нормальном количестве лейкоцитов. Его также нетрудно дифференцировать от хронического лимфолейкоза (ХЛЛ) на основании данных иммунологического исследования.
– Также рекомендуем “Патогенез хронического лимфолейкоза (ХЛЛ) – экспрессия антигенов”
Оглавление темы “Хронический лимфолейкоз (ХЛЛ)”:
- Зрелоклеточные Т-лимфомы: периферическая Т-клеточная лимфома неспецифицированная
- Первичные лимфомы центральной нервной системы – клиника, диагностика, лечение
- Первичные кожные лимфомы – классификация
- Грибовидный микоз (ГМ) – классификация, диагностика, лечение, прогноз
- Хронический лимфолейкоз (ХЛЛ) – эпидемиология, история изучения
- Диагностика хронического лимфолейкоза (ХЛЛ) – иммунофенотип клеток
- Патогенез хронического лимфолейкоза (ХЛЛ) – экспрессия антигенов
- Влияние мутации IgVH и BCL-6 на течение и прогноз хронического лимфолейкоза (ХЛЛ)
- Влияние экспрессии Zap-70 и CD38 на течение и прогноз хронического лимфолейкоза (ХЛЛ)
- Влияние хромосомных мутаций (кариотипа) на течение и прогноз хронического лимфолейкоза (ХЛЛ)
Источник