Что такое дегенеративные лимфоциты
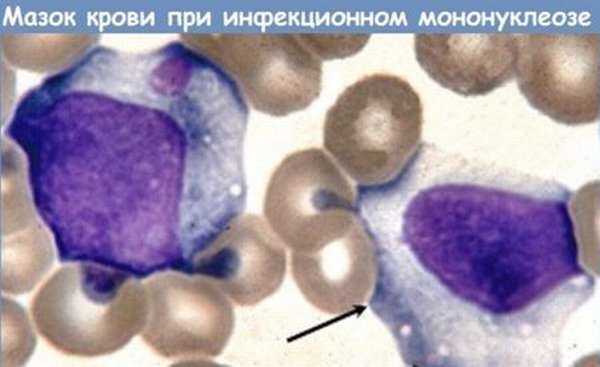
Многие пациенты начинают интересоваться вопросом, что такое атипичные лимфоциты? после сдачи анализов в лаборатории. Само слово «атипичные» не вызывает положительных ассоциаций, поэтому у пациента появляется повод для волнений. Но паниковать не нужно. Такое заключение слышат многие взрослые и дети, но, как правило, ничего угрожающего оно не несет.
Внешние отличия атипичных лейкоцитарных клеток
Лейкоциты – главные агенты иммунитета. Они представляют собой многочисленный класс клеток, отличающихся друг от друга по строению и функциям. Особенность лейкоцитов состоит в том, что они происходят от разных типов клеток-предшественников, следствием этого становится их высокая полиморфность.
В процессе дифференцированного созревания лейкоциты разных видов приобретают характерные морфологические признаки и выходят в кровь. Пребывают они в кровотоке недолго, до двух дней, затем попадают в ткани. Поэтому при исследовании крови на уровень лейкоцитарных клеток микроскопии подвергаются только те клетки, которые на момент анализа находились в русле крови.
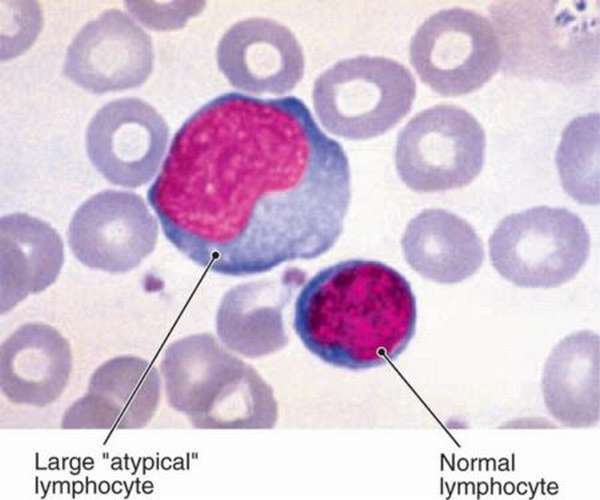
Во время анализа оценивается численность каждой популяции лейкоцитарной группы (гранулоцитов и агранулоцитов) и их морфологические признаки. В организме здорового человека морфологически лейкоциты не отличаются от стандартных форм и размеров. Но при определенных условиях (аллергии, инфекции, опухоли) в крови обнаруживаются атипичные лейкоциты с патологическими морфологическими признаками.
В микроскопе опытный лаборант сразу определит атипичные клетки по таким признакам:
- Нестандартная форма. Нормальные лимфоциты округлые. Атипичность клетки проявляется в рваном контуре или многогранной форме.
- Увеличенный или уменьшенный размер. Обычный размер лимфоцита – около 12 мкм. Атипичные формы могут достигать размеров моноцитов (до 30 мкм).
- Видоизменённое ядро. При оценке морфологии клетки смотрят на соотношение размеров ядра с объемом цитоплазмы. Незрелые нейтрофилы не имеют сегментированного ядра, а ядро атипичного лимфоцита, наоборот, может состоять из нескольких сегментов. Атипичные лимфоциты имеют увеличенную плазму, их называют плазматизированными. Базофильность плазмы говорит о молодости этих клеток.
- Нетипичное окрашивание клетки красителями, зернистость цитоплазмы. При обработке атипичных лимфоцитов эозиновым красителем они окрашиваются в синий цвет. Ядра становятся фиолетовыми. Нормальные лимфоциты после подкрашивания становятся жемчужными, сероватыми или желтоватыми.
Причины появления атипичных клеточных форм
Из основных факторов, которые становятся причиной появления лейкоцитарных клеток нетипичной формы, можно выделить четыре группы:
- Вирусные и бактериальные инфекции,
- Интоксикация организма,
- Ионизирующее излучение,
- Рак и генетические патологии.
Во всех этих случаях появление атипичных форм клеток сопутствует лейкоцитозу (усиленной выработке всех или отдельных популяций клеток), которое диагностируется по анализу крови со сдвигом влево (с преобладанием молодых незрелых форм клеток).
Характер механизма появления атипичных лимфоцитов может быть реактивным, инфекционным или злокачественным. Причем диагностика в первых двух случаях основывается на совокупности сопутствующих симптомов (недавние физические нагрузки, повышенная температура, другие характерные клинические признаки инфекционного заболевания). Эти механизмы наиболее распространенные. Третий – злокачественный механизм развивается намного реже и характеризуется появлением определенных типов атипичных клеток.
Важно! Если в крови обнаружены лейкоциты атипичных форм, это, в первую очередь, означает, что иммунная система пребывает в напряженном состоянии.
Виды атипичных лейкоцитарных клеток и причины появления
Реактивный лейкоцитоз возникает вследствие усиленного лейкопоэза. Этот процесс активируется в организме при помощи цитокинов, активных компонентов комплемента, в ответ на появление токсинов. В таких экстремальных условиях не все клетки созревают правильно, и неизбежно появляются атипичные формы реактивных лимфоцитов. В лаборатории атипичные клетки подсчитываются на каждые 100 клеток определенной группы
Дегенеративные изменения
Эта атипичная форма клеток появляется при длительной и интенсивной интоксикации организма. В лейкоцитах накапливаются отложения токсических веществ, и клетка утрачивает способность делиться и выполнять свои функции. Эти вещества могут иметь разную природу (жировые, пигментные). Такие клетки отличаются увеличением количества и размеров вакуолей (вакуолизация), появляется токсогенная зернистость цитоплазмы. Изменения размеров может быть в большую или меньшую (сморщивание) сторону. Такие изменения обычно связаны с тяжелым сепсисом, абсцессами, дистрофией печени.
При дефиците витамина B12 или недостатке фолиевой кислоты в крови обнаруживают гиперсегментированные нейтрофилы. Их ядра могут содержать до 6 сегментов.
Атипичные мононуклеары
Называются клетками Дауни или лимфомоноцитами из-за морфологического сходства атипичных лимфоцитов этого типа с моноцитами. По размерам они крупнее обычных лимфоцитов, имеют моноцитарное ядро. Эти клетки чаще всего обнаруживают в крови.
У абсолютно здорового человека атипичные мононуклеары не встречаются, но они всегда сопутствуют вирусным заболеваниям. Наиболее частая причиной такого состояния – одна из форм вируса герпеса.
Этот тип атипичных лимфоцитов – один из маркеров мононуклеоза. Если иные заболевания (токсоплазмоз, грипп) способны стать причиной появления нетипичных мононуклеаров до 7% от общего количества лимфоцитов, то превышение количества атипичных клеток этого типа 10% говорит о мононуклеозе.
Это заболевание с ярко выраженными катаральными симптомами и сопутствующими положительными результатами по выявлению атипичных мононуклеаров производит на родителей угнетающее впечатление. Но на самом деле оно не несет ничего угрожающего и после выздоровления лейкоциты в крови у ребенка и их морфология самостоятельно приходит в норму.
У детей количество атипичных мононуклеаров (вироцитов) в крови не превышает 1%. Увеличение их количества может быт следствием прививок либо указывать на недавно перенесенное заболевание.

В крови взрослого человека тоже могут быть обнаружены атипичные мононуклеары, так как с возрастом вероятность носительства вируса герпеса повышается, и к старости достигает 98%. Еще патологические клетки могут появляться в результате аллергических реакций.
Важно! Лечение препаратами сыворотки крови тоже может стать причиной усиления лейкопоэза.
При мононуклеозе диагноз ставится по сопутствующим клиническим признакам, наличию плазматизированных мононуклеаров. Механизм их появления носит инфекционный характер, и после выздоровления картина крови нормализуется.
Клетки-тени Боткина-Гумпрехта
Это фрагменты лимфоцитов или других лимфоидных клеток, их остатки, которые появляются в результате лейколиза в процессе приготовления материала для микроскопии. Такое явление говорит о высокой скорости разрушения лимфоцитов и всегда сопутствует хроническому лимфолейкозу, но встречается и при других инфекционных заболеваниях. Под микроскопом видны хроматиновые тяжи, голые или полуразрушенные ядра. Эти фрагменты и называют тельцами Боткина-Гумпрехта.
Клетки Ридера
Это почкообразные клетки с зазубренным контуром ядра. Обнаруживаются при лейкемии, пернициозной анемии, тяжело протекающих инфекциях, отравлениях свинцом или фосфором.
Норма атипичных лимфоцитов, меры по нормализации
Организм взрослого человека постоянно подвергается атакам чужеродных агентов, поэтому тонус иммунной системы может меняться. Атипичные лимфоциты в анализе крови могут появляться в зависимости от текущей нагрузки на иммунитет. Допустимая норма – не выше 6%. Внимания заслуживают показатели выше 7%.
Специфической терапии для нормализации уровня атипичных лейкоцитов нет, так как это явление становится следствием какой-либо патологии. Поэтому лечение направлено непосредственно на борьбу с заболеванием или устранение причины (аллергических факторов, прекращение приема лекарственных препаратов, сывороточных компонентов крови). Для лечения бактериальных инфекций назначают антибиотики, аллергические реакции купируют антигистаминными препаратами.
Болезнь Эпштейн-Барра (вирус герпеса IV типа) у взрослых часто протекает бессимптомно и специфического лечения не имеет. Сама болезнь не несет угроз, зато опасность представляет способность вируса вызывать злокачественные опухоли. При ослабленном иммунитете болезнь носит рецидивирующий характер, который может проявляться синдромом хронической усталости, развиться в лимфогранулематоз, лимфому, рассеянный склероз. Такие состояния требуют длительной терапии по коррекции иммунной системы.
Популярное видео, как работает иммунитет:
Вместе с тем пациентам рекомендуется нормализовать режим и рацион, что благотворно повлияет на потенциал иммунитета.
Загрузка…
Источник
Важным в гематологической диагностики является изучение так называемой базофильной, дегенеративной или токсической зернистости нейтрофилов, а также дегенеративных изменений лейкоцитов.
Изучение дегенеративной зернистости ввела в практику Е.И. Фрейфельд, разработавшая в 1931 году специальные методы окраски зернистости.
Токсическая зернистость – очень тонкий реагент на воспалительные, главным образом гнойные, процессы – местные и общие. Она может служить опорным фактором в дифференциальной диагностики между рядом инфекционных заболеваний, при которых токсическая зернистость не наблюдается, и сепсисом; между туберкулезом легких, обычно не дающим сколько-нибудь выраженной токсической зернистости, и воспалительными и гнойными процессами в легких; между раком и местными воспалениями.
Особенно большое значение токсическая зернистость имеет в диагностике “острого живота” и вообще в гнойной хирургии.
Гнойные процессы (стептостафилококковые, пневмококковые, вызванные анаэробами, и пр.) дают наиболее интенсивную дегенеративную зернистость.
Параллельно с количественным нарастанием и увеличением калибра дегенеративной зернистости констатируется резкое разрежение цитоплазмы – цитологический признак, которому придают большое прогностическое значение. Это не вакуолизация, при которой наблюдаются крупные неравномерные дефекты в лейкоцитах («простреленные лейкоциты»), это равномерное разрежение в цитоплазме лейкоцита, зависящее, очевидно, от коагуляции белка.
Для практических целей и характеристики динамики процесса рекомендуют обозначать дегенеративную зернистость по системе плюсов:
четыре плюса – крупная зернистость с разрежением цитоплазмы во всех лейкоцитах;
три плюса – крупная зернистость с разрежением цитоплазмы не во всех лейкоцитах (в 75 %)
два плюса – средняя зернистость более чем в половине лейкоцитов;
один плюс – пылевидная зернистость.
Дегенеративная зернистость нейтрофилов нередко появляется раньше ядерного сдвига. Ее нарастание при гнойно-септических заболеваниях, крупозной пневмонии и ряде воспалительных заболеваний указывает на прогрессирующую тяжесть заболевания, на возможный неблагоприятный исход. Токсическая зернистость в лейкоцитах появляется в большом количестве при распаде тканей воспалительного инфильтрата, тканей опухоли после лечения лучевой терапии. При крупозной пневмонии после кризиса, когда начинается период рассасывания воспалительного инфильтрата, токсическая зернистость бывает особенно грубой.
Эта зернистость резко выражена при скарлатине, септикопиемиях, перитонитах, флегмонах и прочих гнойных процессах. Однако при ряде тяжелых болезней (столбняк, энцефалит, тифы и др.) дегенеративная зернистость нейтрофилов отсутствует.
При объяснении образования токсическая зернистости следует исходить из простой концепции: патологическая зернистость образуется внутри клетки в результате физико-химического изменения белковой структуры жидкой части цитоплазмы – коагуляции белка под влиянием инфекционного токсического агента и агломерации коагулированного белка вокруг обычных нейтрофильных зерен. Белок лейкоцитов коагулируется (как бы «сваривается») в процессе воспаления тканей, составной частью которых эти лейкоциты являются. Согласно экспериментально-цитологическим исследованиям Э.И.Терентьевой, при действии повреждающих агентов на кровяную клетку уменьшается степень дисперсности ее коллоидов, что выражается в дифференцировке более плотных частей клеточного содержимого и появлении в темном поле (витальная окраска) светящихся структур в клетке; увеличивается вязкость цитоплазмы, прекращается в ней броуновское движение – в клетке развиваются явления паранекроза.
Тельца Князькова-Деле. Помимо токсической дегенеративной зернистости, в лейкоцитах определяются так называемые тельце Князькова-Деле в виде довольно крупных бледно-голубых комочков различной формы. Doehle описал эти тельца при скарлатине (1912), считая их паразитарными включениями. В дальнейшем их паразитарная природа была опровергнута. Тельца имеют известное диагностическое значение, они встречаются на различных стадиях воспалительных и инфекционных заболеваний и даже при легких формах их, когда токсическая зернистость не вполне выражена или совсем отсутствует.
Из других цитоплазматических телец упоминаются тельца или зерна Амато. Эти тельца – небольшие, округлые, овальные или типа запятой образования, красящиеся в бледно – голубой цвет; в них имеются красные и красно-фиолетовые зерна. Amato описал их при скарлатине, но встречаются они и при других инфекциях.
Другим важным признаком дегенеративных изменений в лейкоцитах является вакуолизация цитоплазмы. Вакуолизация обнаруживается реже, токсическая зернистость, но она имеет не меньшее диагностическое значение, указывает на тяжесть заболевания или интоксикации.
Вакуолизация наиболее характерна для тяжелейших форм сепсиса или абсцессов и острой дистрофии печени. При остром сепсисе, вызванном тяжелой анаэробной инфекцией, наряду с большим лейкоцитозом (свыше 50·109/л) наблюдают почти тотальную вакуолизацию всех лейкоцитов (“дырявые”, “простреленные” лейкоциты). Поскольку жировая дегенерация представляет собой глубокую форму клеточной дистрофии, вакуолизация считается в прогностическом отношении более грозным симптомом, чем дегенеративная зернистость, свидетельствующая лишь о белковой дегенерации клетки.
Токсические изменения в моноцитах: вакуолизация цитоплазмы, скучивание гранул или их отсутствие, уменьшение интенсивности окраски ядра – описанны Naegeli.
Анизоцитоз лейкоцитов – один из характерных признаков тяжелого токсикоза при септических заболеваниях, туберкулезе, пернициозной анемии и вообще тяжелых анемиях (при последних чаще преобладают макролейкоциты).
Что касается дегенеративных изменений со стороны ядер, то они более известны: пикноз ядра, разрежение, набухание ядерного хроматина, причем в нейтрофилах чаще отмечается пикноз ядра, в моноцитах – разрежение ядерного хроматина. Иногда в одних клетках наблюдается пикноз, а в других – набухание. Изменение формы ядра лейкоцитов в виде кольца может наблюдаться при тяжелом алкоголизме.
Лейкоциты из очагов воспаления подвергаются большим дегенеративным изменениям. В ядрах нейтрофильных лейкоцитов из гнойных очагов обнаруживается столь значительный пикноз, что иногда ввиду большого сходства их с ядрами лимфоцитов эти клетки ошибочно принимают за лимфоциты.
Такие “псевдолимфоциты” в гное у больных с амебной дизентерией дали основания А.Г.Алексееву говорить о лимфоцитарном характере гноя при амебной дизентерии в отличие от нейтрофильного гноя при бактериальной дизентерии.
К числу дегенеративных признаков относятся и истощение зернистости в нейтрофильных лейкоцитах, происходящих из токсически пораженного костного мозга или из воспалительного гнойного очага.
Сморщивание всей клетки (микроформы лейкоцитов) – один из часто наблюдаемых дегенеративных признаков. Такие умирающие клетки обычно красятся интенсивнее.
Выше мы указали, что несоответствие в развитии ядра и цитоплазмы – яркий дегенеративный признак. Часто в подобных случаях приходится видеть следующее: ядро нейтрофила зрелое, цитоплазма же базофильная, молодая или, напротив, отмечается молодое ядро в созревшей протоплазме.
Наконец к числу известных дегенеративных признаков лейкоцитов относятся лейколиз. Этот феномен наблюдал впервые и экспериментально воспроизвел на лимфоцитах зараженных туберкулезом животных С.С.Боткин (1892г).
На данное явление нельзя смотреть как на результат только механического разможжения клетки. Отрицать здесь участие самой клетки, ее “готовность к разрушению” было бы неправильно. Размазывание мазка нормальной крови, каким бы грубым оно ни было, не приводит к образованию большого количества клеток лейколиза. Напротив, при патологии (лимфолейкоз, лейшманиоз, септические заболевания) эти клетки наблюдаются чаще обычного.
Морфологические и биохимические нарушения обнаруживаются в лейкоцитах периферической крови и костного мозга при ряде наследственных и приобретенных заболеваний, являясь нередко их отличительным признаком, и имеют значение при проведении дифференциального диагноза.
Гиперсегментация нейтрофильных лейкоцитов – наличие более 5 сегментов (обычно 6-7) в ядрах нейтрофилов, может отмечаться у здоровых людей как наследственная (семейная) конституционная особенность, но также характерна для макрополицитов (необычно больших нейтрофилов с ядрами, содержащими от 5 до 10 сегментов) при дефиците витамина В12 и фолиевой кислоты.
Пельгеровская семейная аномалия лейкоцитов – доминантно наследуемое нарушение созревания, характеризующееся уменьшением сегментации ядер гранулоцитов при нормальной зрелой цитоплазме. Наиболее часто зрелые нейтрофилы содержат двухсегментное (в виде пенснэ) или несегментированное (в виде эллипса, боба, земляного ореха, гимнастической гири) ядро, трехсегментное – редко. Иногда форма ядра бывает округлая или вытянутая и напоминает ядра молодых нейтрофилов (палочкоядерных, мета- и миелоцитов), однако отличается от них грубым пикнотичным темноокрашенным хроматином, что учитывают при дифференциации аномалии Пельгера от реактивного сдвига влево нейтрофилов. Обычно отмечается гетерозиготное носительство аномалии с доброкачественным течением. Сходные изменения (“псевдопельгеровская” аномалия) обнаруживаются часто при хроническом миелолейкозе, других миелопролиферативных заболеваниях, малярии, агранулоцитозе, микседеме, множественной миеломе, туберкулезе. В основе аномалии созревания ядер предполагают нарушение метаболизма нуклеиновых кислот, однако природа его не известна.
Наиболее характерной чертой синдрома Чедиака-Хигаси – редкого заболевания детей и подростков с аутосомно-рецессивным типом наследования, является наличие больших цитоплазматических включений (аномальные гранулы) во всех типах клеток крови, за исключением мегакариоцитов, и склонность к гнойным инфекциям. Эти включения в нейтрофилах и моноцитах содержат миелопероксидазу, кислую фосфатазу, а в лимфоцитах – PAS-положительный материал и представляют собой, гигантские меланосомы. Повышенная чувствительность лиц с данным заболеванием к инфекциям связана, как считают, с дисфункцией гранулоцитов. Выявляется снижение способности нейтрофилов к убиванию некоторых бактерий возможно из-за нарушения сопровождающей фагоцитоз дегрануляции и освобождения в фагоцитарную вакуоль лизосомальных ферментов.
При хронической гранулематозной болезни детей предрасположенность к повторным гнойным инфекциям и формированию гранулем в органах обусловлена наследственным метаболическим дефектом гранулоцитов (а также моноцитов и гистиоцитов), состоящем в неспособности клеток во время фагоцитоза к респираторному взрыву (окислению глюкозы в гексозомонофосфатном шунте) и формированию перекиси водорода из-за недостаточности НАДФ·Н-оксидазы. Это ведет к нарушению внутриклеточного убивания бактерий (стафилококки, протей и др.), которые сами не способны генерировать перекись водорода, необходимую для действия миелопероксидазной бактерицидной системы фагоцитов (в тоже время микроорганизмы – стрептококки, пневмококки, сами продуцирующие перекись водорода, убиваются этой системой нормально). Для диагностики заболевания применяют тест восстановления нитросинего тетразолия (НСТ-тест), который оказывается отрицательным в отличии от бактериальных инфекций у лиц без данного дефекта гранулоцитов, когда он бывает повышенно активным.
Источник