Что такое активация апоптоза лимфоцитов
Покоящиеся CD3+Т-лимфоциты для поддержания собственной жизнедеятельности требуют постоянного контакта с комплексами HLA — пептид аутоантигенов на поверхности клеток микроокружения. Кроме этого, выживать Т-лимфоцитам «помогают» цитокины (ИЛ-4, ИЛ-6, ИЛ-7 и ИЛ-12). Благодаря указанным влияниям неактивные лимфоциты характеризуются относительно высоким уровнем экспрессии антиапоптотического белка bcl-2 и низкой экспрессией молекул Fas и рецепторов к фактору некроза опухоли α. Таким образом, покоящиеся Т-клетки являются достаточно резистентными к запрограммированной гибели. Но стоит таким клеткам активироваться, как их готовность к апоптозу возрастает в десятки раз. Дело в том, что после специфической активации (с вовлечением антигенраспознающего рецептора) в цитоплазме Т-лимфоцитов резко снижается экспрессия белка bcl-2, а на мембране появляется значительное количество молекул Fas и рецепторов к ФНО-α. Описанное явление имеет глубокий биологический смысл. Активированная клетка не только приобретает способность к усиленному делению, но и становится более чувствительной к регуляторным влияниям, ограничивающим пролиферацию. С помощью этого механизма в организме поддерживается стабильное количество клеток и обеспечивается профилактика новообразований. Иными словами, любая активированная иммунокомпетентная клетка неминуемо гибнет, поскольку становится очень чувствительной к апоптозу. Реализация запрограммированной гибели осуществляется как с помощью взаимодействия Fas с FasL (мембран-ассоциированным или растворимым, отщепляемым от поверхности клеток-эффекторов металлопротеиназами), так и при действии ФНО-α, уровень которого значительно повышается практически при любом воспалении.
Возникает вопрос: если активированные Т-клетки гибнут, то каким образом осуществляется эффективный иммунный ответ? Дело в том, что при попадании чужеродных патогенов Т-лимфоциты получают дополнительные стимулы, временно отменяющие реализацию запрограммированной гибели. К ним относятся сигналы от факторов роста (например, ИЛ-2), адгезионных молекул и костимуляторов. Как только патоген уничтожается, Т-клетки перестают получать подобные сигналы и погибают путем апоптоза. Именно таким образом восстанавливается нормальное количество лейкоцитов после перенесенной инфекции.
Роль интерлейкина-2 в апоптозе лимфоцитов
Интерлейкин-2 является фактором роста Т-лимфоцитов. Благодаря этой функции цитокин должен усиливать апоптотическую гибель Т-клеток, так как повышает частоту их деления. Фактически же выходит, что при адекватной антигенной нагрузке интерлейкин-2, наоборот, повышает стойкость лимфоцитов к запрограммированной гибели. Сегодня этот феномен объясняют теорией обратной связи в контроле апоптоза Т-клеток. Согласно этой теории интерлейкин-2 стартово повышает чувствительность Т-лимфоцитов к апоптозу. Дальнейшая судьба клетки зависит от уровня антигенного и костимулирующего воздействия. В случае отсутствия антигенной стимуляции уровень секретируемого интерлейкина-2 снижается, в результате чего Т-клетки подвергаются «пассивному» апоптозу, связанному с нехваткой указанного цитокина. Он обеспечивается митохондриальными механизмами запрограммированной гибели. Этот путь является нормальным механизмом ограничения иммунного ответа после гибели патогена. В случае избытка антигенного воздействия имеет место «активный» апоптоз Т-лимфоцитов. Дело в том, что чрезмерная стимуляция антигенраспознающего рецептора сопровождается такой же чрезмерной экспрессией рецепторов апоптоза (молекулы Fas и рецептора к ФНО-а). Поэтому пролиферативное действие ИЛ-2 не в состоянии перекрыть проапоптотические сигналы, поступающие в Т-клетку по указанным рецепторам. Механизм «активного» апоптоза обеспечивает ограничение гиперактивации антигенспецифического клона эффекторных клеток в случае массового представления антигена в организме (например, при аутоиммунных реакциях, негативной селекции Т-клеток тимуса, реакции трансплантат против хозяина). Материал с сайта https://wiki-med.com
Чувствительность лимфоцитов к апоптозу
Чувствительность лимфоцитов разных классов к апоптозу существенно отличается. Так, Т-клетки более чувствительны к апоптозу, нежели В-лимфоциты. Это объясняется следующим образом: активация рецептора антигенного распознавания Т-лимфоцита приводит к резкому повышению чувствительности клетки к запрограммированной гибели; в то же время активация антигенраспознающего рецептора В-клеток обуславливает резистентность этих лимфоцитов к апоптозу. Указанные особенности имеют огромное значение в иммунном ответе. В организме существует большое количество аутореактивных лимфоцитов, способных распознавать собственные антигены. Но аутоиммунные реакции не развиваются, поскольку Т-клетки, активировавшиеся после распознавания аутоантигена, гибнут путем апоптоза. Хотя активированные В-лимфоциты способны выживать после взаимодействия со специфическим аутоантигеном, они не в состоянии развивать иммунный ответ без поддержки со стороны Т-хелперов.
Т-хелперы 1-го типа более чувствительны к апоптозу, нежели Т-хелперы 2-го. Эта особенность также имеет свое объяснение. Поскольку Th 1 способствуют развитию эффекторных механизмов, повреждающих собственные клетки (например, вирус-инфицированные или опухолевые), необходим мощный регуляторный механизм, который ограничивал бы самоповреждение при гиперактивации указанных лимфоцитов.
 На этой странице материал по темам:
На этой странице материал по темам:
характеристика сигналов к апоптозу
где подвергаются апоптощу т и в лимфоциты
активация т-лимфоцитов с развитием апоптоза
апоптоз иммунология
что такое апоптоз зрелых лимфоцитов
Источник
В прогнозе развития острого пиелонефрита и течения системной воспалительной реакции большое значение отведено изучению состояния иммунной системы макроорганизма гуморального и клеточного иммунного ответа [1, 2].
Изучение разных субпопуляций лимфоцитов, провоспалительных и противовоспалительных цитокинов и апоптоза клеток крови может дать важную информацию для определения тактики ведения пациентов с острым пиелонефритом и системным воспалительным ответом [3, 4].
Известно, что сила и качество иммунного ответа макроорганизма зависят от соотношения процессов апоптоза и пролиферации клеток. Возникновение многих тяжелых заболеваний связывают с нарушением программированной клеточной гибели. В последние годы выделяют несколько ее типов: это апоптоз, аутофагическая гибель и запрограммированный некроз. Значительное усиление активационного апоптоза можно охарактеризовать как тенденцию к развитию иммунодефицитного состояния, являющегося следствием воспалительного процесса [5, 6]. В настоящее время считают, что тип дисрегуляции процесса смерти клеток крови предопределяет характер развития воспалительного процесса, его исход и терапевтическую тактику ведения больного [7]. Установлено, что ускорение процесса апоптоза лимфоцитов является основной причиной иммуносупрессии при септическом состоянии [8]. Апоптоз Т-лимфоцитов при септическом шоке превосходит таковой при сепсисе. Этот процесс сопровождается уменьшением синтеза интерлейкина-2 без изменения секреции гамма-интерферона и TNF-альфа. Скорость апоптоза коррелирует с уровнем интерлейкина 6 и экспрессией на лимфоцитах каспазы 9 [9]. Считается, что усиление апоптоза связано с дисбалансом процесса ко-стимуляции Т-клеток, клеточной гипоксией, в результате возникает нарушение функции митохондрий, от которых зависит функция и жизнеспособность клетки [10]. Увеличивается содержание ШБ1-альфа (гипоксия индуцируемый фактор)-ядерного фактора транскрипции, что является отражением провоспалительного профиля и дисфункции лимфоцитов [11]. На основании этих данных можно сделать вывод о том, что необходимо изучение апоптоза лимфоцитов в клеточных культурах без влияния различных факторов макроорганизма. Это позволит оценить их жизнеспособность на фоне различной выраженности воспалительного процесса.
Отсутствие исследований апоптоза лимфоцитов периферической крови больных с острыми формами пиелонефрита послужило причиной к проведению научных исследований в этом направлении [3, 5].
Мы поставили перед собой задачу исследовать апоптоз лимфоцитов в культурах клеток здоровых и больных с различными формами острого пиелонефрита.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование было включено 28 пациентов с острым инфекционнов о спалительным пр оцессом в ерхних мочевых путей. С острым гнойнодеструктивным процессом было 12 больных и с неосложненным пиелонефритом 16 . Контрольную группу составили 14 здоровых доноров. Средний возраст во всех группах составлял 45 ± 5,4 лет. Пациентам, включенным в исследование, проведена оценка апоптоза лимфоцитов в культуре клеток. Выделение лимфоцитов крови проводили по стандартной методике в градиенте плотности фиколл-верографина. Клетки культивировали в среде RPMI 1640 c добавлением 10% эмбриональной телячьей сыворотки, 2 ммоля L-глютамина и бактериостатической концентрации гентамицина(20 мг) в СО2 инкубаторе при 37°С. Процент апоптоза оценивали через 24, 48 и 72 часа инкубации. Все культуры клеток исследовали в 4 вариантах: контрольная культура, культура с ФГА (фитогемагглютинином), дексаметазоном, с ФГА и дексаметазоном. Индуктором апоптоза служил дексаметазон (Sigma США) в концентрации 10-3 моль. В качестве активатора лимфоцитов использовался ФГА (Difco США) в концентрации 10 мкг/мл. Апоптоз оценивали на проточном цитофлюориметре «Coulter EPICS XL» по программе «Simulset», используя двойное окрашивание клеток аннексином Y-FITZ и пропидий йодидом. Такой метод позволяет различать 3 категории клеток:
- связывающих только аннексин (А+П), что соответствует ранней стадии апоптоза, когда не нарушена клеточная мембрана;
- меченые анексином и пропидием (А+П+) поздняя стадия, которая наступает при дефекте клеточной мембраны;
- живые неокрашенные клетки (А-П).
Статистический анализ полученных результатов проводили с помощью компьютерной программы Statistica 5.11.
Анализ апоптоза лимфоцитов в культурах клеток здоровых доноров (ЗД), I группа. В свежевыделенной популяции лимфоцитов апоптоз А+ Псоставлял 5%. В процессе инкубации этот показатель возрастал со скоростью, которая зависела от варианта культивирования. Данные приведены на рисунке 1-А, из которого видно, что в контрольной культуре процентное содержание клеток А+Ппосле небольшого подъема до 11% оставался стабильным до 72 часов.
Добавление в культуру ФГА вызывало в течение 24-48 часов значительный подъем уровня апоптоза, втрое превышающий контроль.
В культурах с дексаметазоном индукция апоптоза была выражена не столь значительно, достигая к 48 часам 15%.
Уровень клеток А+Пзанимал промежуточное значение в культуре, содержащей оба индуктора.
Рисунок 1. Изменение содержания лимфоцитов на ранней стадии апоптоза в культуре клеток.
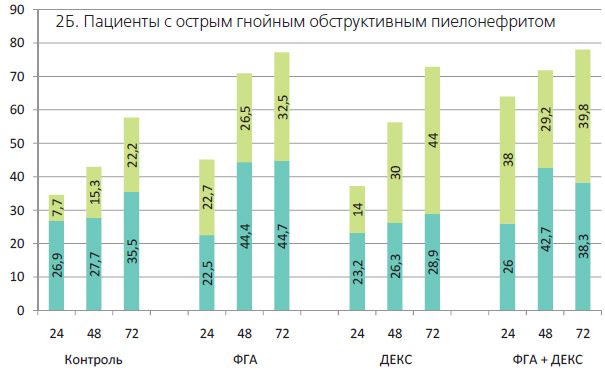
Анализ лимфоцитов в культурах больных гнойно-деструктивным пиелонефритом (ОГП), II группа. Уровень апоптоза свежевыделенных лимфоцитов этой группы больных составлял 18%. В процессе инкубации наблюдался значительный рост количества вступающих в апоптоз клеток в контрольных культурах, т.е. без индукторов апоптоза. В культуре с ФГА наблюдалось очень резкое повышение процентного содержания клеток периферической крови, вступивших в апоптоз, который достигал 50% к концу культивирования.
Добавление дексаметазона не привело к дополнительному росту апоптоза клеток крови по сравнению с лимфоцитами контрольной культуры.
Таблица 1. Соотношение содержания в культурах лимфоцитов поздней и ранней стадии апоптоза (индекс П+/П)
Вид культуры | ЗД | ОГП | ОП | |||
Время | M ± m | 5 | M ± m | 5 | M ± m | 5 |
0 часов | 0,79 + 0,19 | 0,33 | 0.37 + 0,04 | 0,08 | 0,47 + 0,07 | 0,25 | |
КОНТ | ||||||
24ч. | 1,31 + 0,57 | 1,001 | 0,29 + 0,04 | 0,09 | 0,88 + 0,13 | 0,49 |
48ч. | 1,88 + 0,81 | 1,39 | 0,57 + 0,06 | 0,13 | 1,42 + 0,24 | 0,95 |
72ч. | 1,90+0,47 | 0,814 | 0,62 + 0,06 | 0,13 | 1,37 + 0,19 | 0,75 |
ФГА | ||||||
24ч. | 0,76 + 0,31 | 0,53 | 1,01 +0,03 | 0,06 | 0,91 + 0,18 | 0,67 |
48ч. | 0,91 + 0,12 | 0,21 | 0,59 + 0,02 | 0,05 | 1,28 + 0,25 | 0,97 |
72ч. | 0,91 + 0,07 | 0,104 | 0,73 + 0,03 | 0,06 | 0,98 + 0,21 | 0,78 |
ДЕК. | ||||||
24ч. | 3,89 + 0,29 | 0,46 | 0,63 + 0.05 | 0,12 | 0,99 + 0,12 | 0,46 |
48ч. | 2,52 + 0,15 | 0,27 | 1,14 + 0,07 | 0,15 | 1,13 + 0,12 | 0,45 |
72ч. | 3,23 + 0,46 | 0,799 | 0,73 + 0,05 | 0,06 | 0,98 + 0,21 | 0,78 |
ФГА+ДЕК | ||||||
24ч. К | 1,54 + 0,09 | 0,165 | 1,46 + 46 | 0,09 | 1,09 + 0,15 | 0,58 |
48ч. | 1,54 + 0,15 | 0,263 | 0,68 + 0,02 | 0,05 | 1,51 + 0,24 | 0,93 |
72ч. | 1,28 + 0,04 | 0,071 | 1,03 + 0,04 | 0,09 | 1,09 + 0,12 | 0,47 |
Таблица 2. Достоверность различия по непараметрическому критерию Манна-Уитни между коэффициентом накопления некротических клеток разных групп исследуемых пациентов
ЗД и ОГП | ЗД и ОП | ОГП и ОП | |
Контр. | |||
24 час. | 0,025* | 0,51 | 0,012* |
48 час. | 0,025* | 0,441 | 0,016* |
72 час. | 0,023* | 0,109 | 0,02* |
ФГА | |||
24 час. | 0,45 | 0,952 | 0,649 |
48 час. | 0,024* | 0,950 | 0,016* |
72 час. | 0,025* | 0,952 | 0,57 |
ДЕКС. | |||
24 час. | 0,023* | 0,015* | 0,073 |
48 час. | 0,025* | 0,007* | 0,82 |
72 час | 0,024* | 0,02* | 0,106 |
ФГА+ДЕКС. | |||
24 час. | 0,368 | 0,313 | 0,359 |
48 час | 0, 025* | 0,138 | 0,01* |
72 час. | 0,025* | 0,685 | 0,965 |
Культура ФГА + дексаметазон практически не отличалась от культуры с ФГА (рисунок 1Б).
Анализ культур больных острым неосложненным пиелонефритом (ОП), III группа. Данные, приведенные на рисунке 1В, свидетельствуют, что культуры клеток больных этой группы, в частности контрольная и с дексаметазоном, полностью повторяют данные, полученные на клетках здоровых людей. В культурах с добавлением ФГА существенного подъема уровня апоптоза не наблюдалось, по крайней мере, до 48 часов.
Итак, при исследовании крови здоровых доноров и больных пиелонефритом было выявлено:
- гнойные осложнения сопровождались достоверным повышением содержания апоптотических клеток среди свежевыделенных лимфоцитов периферической крови;
- культивирование лимфоцитов выявило существенные отличия в нарастании количества апоптотических клеток, определяемое как условиями культивирования, так и тяжестью заболевания. При гнойных осложнениях уровень их был намного выше, чем у здоровых людей. Это наблюдалось при всех вариантах культивирования. У больных с острым пиелонефритом с неосложненным течением инфекционновоспалительного процесса уровень апоптоза лимфоцитов в культурах достоверно не отличался от нормы.
В литературе можно найти немало сообщений, посвященных изменению чувствительности к апоптозу лимфоцитов в культуре in vitro при различной патологии. Так, в работе Е.Р. Черных [3] исследовали апоптоз периферических Т-лимфоцитов у хирургических больных с гнойно-септическими заболеваниями. Было обнаружено повышение апоптоза как среди свежевыделенных лимфоцитов, так и среди культивированных 24 часа мононуклеарных клеток крови в контрольной культуре без стимуляции апоптоза. То же самое наблюдали и в присутствии анти СД3 моноклональных антител.
В.Д. Шаповалов [2] сообщает о повышении чувствительности к индукции апоптоза лимфоидных клеток при хронических поражениях пародонта.
В отечественной и зарубежной литературе имеются сообщения о повышении апоптогенной готовности лимфоцитов периферической крови больных системной красной волчанкой при культивировании in vitro [4].
P. Meier [5] обнаружил резкую активацию апоптоза в культуре Т лимфоцитов крови больных с хроническом почечной недостаточностью как в присутствии ФГА, так и без стимуляции в контрольных культурах.
Таким образом, данные об изменении чувствительности к апоптозу лимфоцитов, выявляемые при культивировании, при различных заболеваниях подтверждаются многими исследователями.
В работах, посвященных изучению апоптоза в клинической практике, как правило, учитывается только стадия раннего апоптоза А+П, поскольку, используя проточную цитометрию, лишь на этой стадии можно отличить апоптотические клетки от некротических. Известно, что in vivo апоптозные клетки распадаются на апоптозные тельца, минуя фазу повреждения клеточной оболочки, и весь процесс длится не более 3 часов. В культуре процесс дезинтеграции апоптозных клеток длится, видимо, дольше, включает фазу нарушения проницаемости клеточной мембраны, называемую поздней стадией апоптоза А+П+. В культуре таких клеток будет тем больше, чем дольше длится их полный распад. Кроме того, несомненно, что часть лимфоцитов крови в культуре гибнет путем некроза. При этом отек и нарушение проницаемости клеточной оболочки достаточно ранние события, влекущие за собой проникновение в клетку пропидия и анексина, что дает возможность количественно оценивать наличие некротических клеток А+П+. Относительно названия, информативной ценности и источника клеток А+П+ в культуре у исследователей нет единого мнения. В ряде работ эти клетки считают поздней стадией апоптоза. В других называют некротическими, полагая, что дезинтеграция клеток после нарушения целостности клеточной мембраны при апоптозе и некрозе in vitro мало чем отличаются, и оценить вклад того и другого процесса на этой стадии методом проточной цитометрии невозможно.
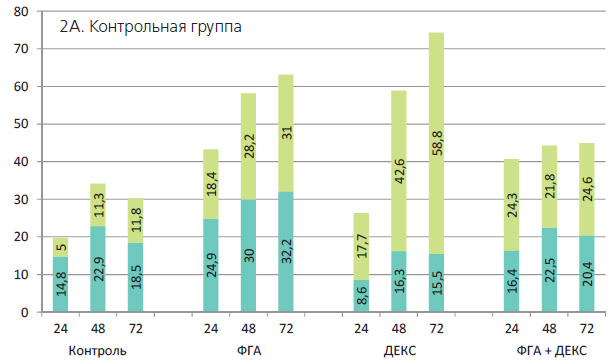

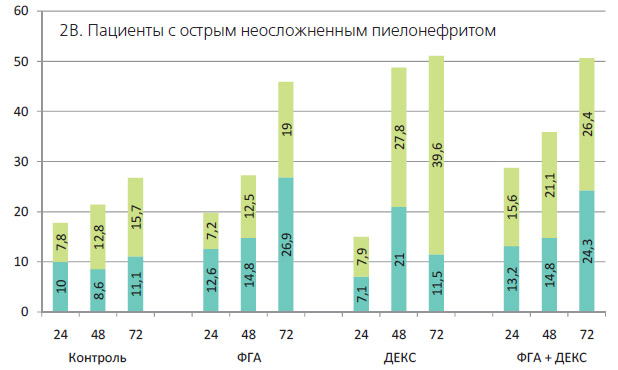
Рисунок 2. Суммарное содержание % лимфоцитов на ранней и поздней стадии апоптоза ( А+Пнижняя часть , А+П+ верхняя часть каждого столбца) в культуре клеток
Учитывая вышесказанное, мы попытались проанализировать накопление в культурах клеток А+П+. Отмечена некая закономерность: часто культуры с низким уровнем клеток А+Пимели высокий процент А+П+ и наоборот (рисунок 2А, 2Б, 2В). Для сравнения и анализа этих данных для всех культур было вычислено соотношение А+П+/ А+П(индекс П+/П) в культуре клеток здоровых людей, культуре клеток больных острым гнойным пиелонефритом и культуре клеток больных острым неосложненным пиелонефритом (таблица 1).
Культуры клеток здоровых людей. Из данных, представленных на рисунке 2А и в таблице 1, видно, что в контрольных культурах здоровых людей уже к окончанию первых суток превалируют клетки на стадии А+П+, (П+/П=1,3), далее их количество продолжает нарастать, превышая фазу А+Пв полтора-два раза (П+/П= 2,0 и 1,6 к 48 и 72 час. инкубации).
При добавлении в культуры ФГА наблюдалась иная ситуация: быстро нарастало количество клеток ранней фазы А+П, к 48 часам их было более 40%, а количество клеток в поздней фазе А+П+ отставало на протяжении всего периода инкубации (П+/Пвезде меньше 1.)
В культурах с дексаметазоном при умеренной активации апоптоза (10-11%) наблюдалось значительное накопление клеток на стадии А+П+, их количество к исходу 72 часов почти вчетверо превышало процентное содержание апоптозных клеток крови в ранней стадии (П+/Пк 24 часам = 2; к 72час. = 3,8.) А в культурах, содержащих и ФГА, и дексаметазон, эти показатели имели промежуточные значения.
Культуры лимфоцитов больных гнойно-деструктиным пиелонефритом. В контрольных культурах лимфоцитов этих больных, как было отмечено выше, во все сроки инкубации уровень раннего апоптоза А+Пбыл повышенным. По сравнению с ним содержание клеток поздней фазы было гораздо ниже: индекс П+/Псоставлял 0,30,6 (рисунок 2Б и таблица 1). В культурах с ФГА наблюдалась аналогичная картина: высокая активация апоптоза (А+Пболее 40 %) в сочетании с умеренным увеличением А+П+; индекс П+/Псоставлял 0,6-0,7.
В культурах с дексаметазоном активация апоптоза клеток крови такая же, как в контрольных культурах больных этой группы, а уровень А+П+ был выше: индекс П+/Пв поздние сроки составлял 1,5. В соответствующей культуре здоровых доноров этот показатель достигал величины 3,8.
Культуры клеток больных острым неосложненным пиелонефритом. Уровень ранней фазы апоптоза (А+П) в целом по всем культурам не отличался от соответствующих значений у здоровых людей (10-11%), но наблюдалась явная тенденция снижения содержания клеток А+П+ и, соответственно, показателя П+/Ппо сравнению с культурами клеток здоровых людей. Из таблицы 2 видно, что это снижение достоверно для культур с дексаметазоном. Подтверждение тому, что добавление дексметазона в культуру лимфоцитов крови здоровых людей вызывает накопление клеток в стадии А+П+, мы обнаружили в работе Vermes (1995). В ней приведены гистограммы с данными обо всех категориях клеток, определяемых при подсчете на проточном цитометре, из которых видно, что в контрольных культурах лимфоцитов здоровых людей через 72 часа апоптоз А+П= 5,5%, а А+П+ = 7,5%, т.е. П+/П= 1,3. При добавлении дексаметазона в культурах того же срока А+П= 7,0, а А+П+ = 18, т.е. П+/П= 2,6 данные близки к нашим.
ЗАКЛЮЧЕНИЕ
При инкубировании лимфоцитов периферической крови здоровых людей и больных пиелонефритом были обнаружены отличия не только по критерию уровня апоптоза клеток стадии А+П, общепринятому в работах такого рода, но и по уровню А+П+.
Оказалось, что содержание в культуре клеток на стадии А+П+ и их соотношение с ранней фазой апоптоза подчиняется определенным закономерностям, которые, по нашим данным, определялись, с одной стороны, индуктором апоптоза, а с другой тяжестью воспалительного процесса обследованных больных.
Ключевые слова: острый пиелонефрит, острый гнойный пиелонефрит, апоптоз лимфоцитов. Keywords: scute pyelonephritis, acute purulent pyelonephritis, lymphocyte apoptosis.
ЛИТЕРАТУРА
- Боровкова И.В., Хватов В.Б., Александрова И.В., Рей С.И., Линский М.Е., Авакумов М.М. Апоптоз мононуклеарных клеток и мертвых лейкоцитов в венозной крови септических больных // Вестник российской академии медицинских наук. 2009. № 8. С. 33-36.
- Шаповалов В.Д. Апоптоз в патогенезе хронических воспалительных заболеваний пародонта // Иммунология. 2001. №.5. С.50-51.
- Черных Е.Р., Норкин М.Н., Леплина О.Ю., Тихонова М.Л., Хонина Н.А., Останин А.Л. Апоптоз и анергия периферических Т-лимфоцитов при гнойно-септической патологии //Медицинская иммунология. 1999. Т.1, № 5. С.45-51.
- Забежинская О.М. Повреждение структуры ДНК лейкоцитов периферической крови у больных системной красной волчанкой и другими аутоиммунными заболеваниями как маркер апоптогенной готовности // Вопросы биол. медицины и фармац. химии. 2002. № 3. С. 24-28.
- Meier P., Dayer E., Blanc E., Wauters J.P. Early T cell activation correlates with expression of apoptosis markers in patients with endstage renal desease //J. Am. Soc. Nephrol. 2002. Vol.13. № 1. P. 204-212.
- Vermes I., Haanen C., Steffens-Nakken H., Reutelingsperger C. A novel assay for apoptosis. Flow cytometric detection of phosphotidylserine expression on early apoptosis cell using fluorescein labeled Annexin Y // J. Immunological methods. 1995, Vol. 184. P. 39-51.
- Вantel H., Shultze-Osthoff K. Cell death in sepsis matter of how, when, where// Critical care. 2009. Vol. 13, № 4. P.173-174.
- Hotchkiss R.S., Coopersmith C.M , Karl I.T. Prevention of lymphocytes apoptosis-a potential treatment of sepsis? // Clin. Inf. Dis. 2005. Vol.15. № 41, Suppl. 7. P 465-464.
- Delogue G., Famulako G., Tellan G., Mandozola M., Antomecci F., Signore M.,Marcellini S., Moretti S. Lymphocyte apoptosis, caspase activation and inflammatory response in septic shock // Infection. 2008. Vol. 36, № 5. P.485-487.
- Roger P.M., Hyvernat H., Breitmayer T.P., Dellamonica J., Bernardin J., Bernard A. Enchanced T-cell apoptosis in human septic shock is associated with alteration of costimulatory pathways // Eur. J.Clin. Inf. Dis. 2010. Vol. 28, № 6. P. 575-578.
- Roguiera T., Andersen M., Dajafarezadeh S. Vitochondrial desfunction during sepsis, impact and possible regulating role of hypoxia inducible factor 1-alfa // Med. Intensive. 2009. Vol. 33. № 8. P.385-392.
- Darzynkiewicz Z., Juan G., Li X., Gorczyca W., Murakami T., Traganos F. Cytometry in Cell Necrobiology: Analysis of Apoptosis and Accidental cell Death (Necrosis) // Cytometry. 1997. Vol. 27, № 1. P.1-20.
Источник