Cd43 на в лимфоциты
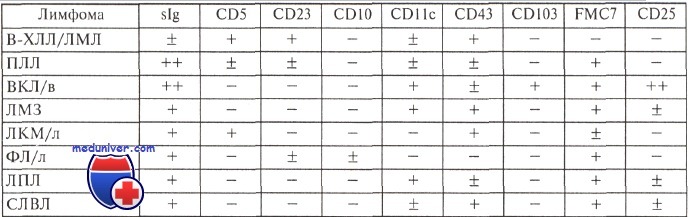
Иммунофенотипические маркеры В-клеточных лимфом с критериями классификации ВОЗ
Иммунофенотипические маркеры вариантов зрелых В-клеточных лимфом, выделяемых в соответствии с критериями классификации ВОЗ:
1. Хронический лимфолеикоз/лимфома из малых лимфоцитов:
CD5+ CD10- CD19+ CD20+/- CD21+ CD22-/+CD23+ CD24+ CD103- FMC-7- cCD38-Иммуноглобулины: sIg(M+/—D) — слабо; cIg обычно отсутствуют
2. В-клеточный пролимфоцитарный лейкоз:
CD5- CD10- CD20+ CD21+ CD22+ CD23-/+ CD24+ CD103- FMC-7+ slg+ cIg- cCD38-Иммуноглобулины: sIg — ярко; cIg обычно отсутствуют
3. Лимфоплазмоцитарная лимфома:
CD5- CD10- CD19+ CD20+ CD21+ CD22+ CD23- CD24+ CD103- FMC-7+ cCD38+ Иммуноглобулины: sIgM+; cIg присутствуют
4. Мантийно-клеточная лимфома:
CD5+ CD 10- CD19+ CD20+ CD21+ CD22+ CD23 CD24+ CD103- FMC-7+ cCD38~ Иммуноглобулины: sIg(M±D), X > к; cIg обычно отсутствуют. BCL-1+
Иммунофенотип периферических мелкоклеточных В-клеточных лимфом

Примечание. При всех лимфомах экспрессированы В-клеточные антигены (CD19, CD20) и HLA-DR.
Обозначения: ПЛЛ — пролимфоцитарный лейкоз; ВКЛ — волосатоклеточный лейкоз; ЛМЗ — лимфома маргинальной зоны; ЛКМ —лимфома из клеток мантии; ФЛ — фолликулярная лимфома; ЛПЛ — лимфоплазмоцитарная лимфома; СЛВЛ —селезеночная лимфома с виллезными лимфоцитами; в — вариант; л — лейкемический компонент.
5. Фолликулярная лимфома:
CD5- CD10+/- CD19+ CD20+ CD21+ CD22+ CD23+/- CD24+ CD103- FMC-7+ cCD38-Иммуноглобулины: sIg(A, G), не всегда; cIg обычно отсутствуют. BCL-2+
6. Лимфома маргинальной зоны селезенки:
CD5- CD10- CD19+ CD20+ CD21- CD22+ CD23- CD24- CD103- FMC-7+ cCD38- BCL-1-Иммуноглобулины: sIg [(M>G>A; cIg присутствуют (-40 %)]
7. Волосатоклеточный лейкоз:
CD5- CD10- CD19+ CD20+ CD21+ CD22+ CD23″ CD24+ CD103+ FMC-7+ cCD38-Иммуноглобулины: sIg(M±D, реже G или A); cIg обычно отсутствуют
8. Плазмоклеточная миелома:
CD5- CD10- CD19- CD20- CD21- CD22- CD23- CD24- CD103- FMC-7- cCD38++ Иммуноглобулины: sIg отсутствуют; cIg присутствуют (G, А, редко D-, Е- и L-цепи)
9. Диффузная крупноклеточная В-лимфома:
CD5- CD10-/+ CD19+ CD20+ CD21+ CD22+ CD23+/_ CD24+ CD103- FMC-7+ cCD38- BCL-6+ BCL2-/+ Иммуноглобулины: мембранные чаще положительные; clg чаще отсутствуют
10. Лимфома Беркитта:
CD5- CD10+ CD19+ CD20+ CD21+/- CD22+ CD23- CD24+ CD103- FMC-7(?) cCD38- BCL-6+ BCL-2-Иммуноглобулины: sIgM+; cIg отсутствуют
Примечание: При всех вариантах В-клеточных лимфом, включая некоторые случаи миеломы, наблюдается экспрессия CD79a. При крупноклеточных В-лимфомах непостоянно обнаруживается CD30 (Ki-1-антиген). Дополнительным маркером лимфомы Беркитта может служить антиген CD77, редко встречающийся при фолликулярно-клеточных лимфомах и отсутствующий при других вариантах. Диагностическая роль экспрессии активационных антигенов CD25, CD38, CD71 еще до конца не установлена.
– Также рекомендуем “Т- и NK-клеточные лимфомы – классификация, диагностика”
Оглавление темы “Иммунодиагностика в онкогематологии”:
- Иммунодиагностика В-клеточного пролимфоцитарного лейкоза
- Иммунодиагностика лимфоплазмоцитарной лимфомы
- Иммунодиагностика мантийно-клеточной лимфомы
- Иммунодиагностика фолликулярной лимфомы
- Иммунодиагностика В-клеточных лимфом маргинальной зоны
- Иммунодиагностика диффузной крупноклеточной В-клеточной лимфомы
- Иммунофенотипические маркеры В-клеточных лимфом с критериями классификации ВОЗ
- Т- и NK-клеточные лимфомы – классификация, диагностика
- Иммунофенотипические маркеры Т-клеточных лимфом и NK-клеточных лимфом с критериями классификации ВОЗ
- Иммунодиагностика периферической неспецифицированной Т-клеточной лимфомы
Источник
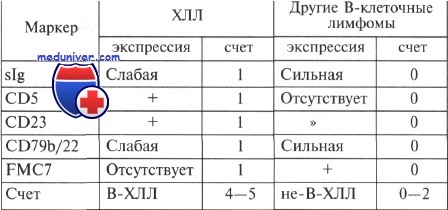
Иммунодиагностика лимфомы из малых лимфоцитов – хронического лимфоцитарного лейкозаОсновное внимание в классификации ВОЗ 2001 г. уделено возможности совершенствования диагностики лимфом и лейкозов из зрелых лимфоидных клеток с применением иммунологических критериев. Эта группа лимфопролиферативных заболеваний является доминирующей у взрослых. Появились новшества, которые сразу были приняты и по достоинству оценены большинством онкогематологов мира. Зрелоклеточные (периферические) лимфомы возникают из иммунокомпетентных (антигензависимых) клеток периферических (вторичных) лимфоидных органов: лимфатических узлов, селезенки, лимфоидной ткани слизистых и т. д. Иммунологический фенотип лимфомы из малых лимфоцитов (ЛМЛ) аналогичен таковому при В-клеточном хроническом лимфолейкозе (В-ХЛЛ). Он достаточно типичен: экспрессия обще-В-клеточных антигенов (CD19), антигенов зрелых В-клеток (CD37), слабая экспрессия CD20, CD22, CD79, CD11с, наличие CD21, CD24, CD43, а главное — коэкспрессия CD5 и CD23. Клетки характеризуются крайне слабыми уровнями моноклональных мембранных IgM или IgM+IgD (в ряде случаев не выявляются), способностью образовывать розетки с эритроцитами мыши. Цитоплазматические иммуноглобулины выявляются в 5 % случаев. На клетках обычно отсутствуют или крайне слабо экспрессированы CD79b (компонент В-клеточного рецепторного комплекса) и маркер зрелых В-клеток FMC-7. До недавнего времени FMC-7 считался одним из ведущих маркеров при дифференциальной иммунологической диагностике периферических мелкоклеточных В-клеточных лимфом. В последнее время убедительно доказано, что исследование FMC-7 дает крайне мало информации, если учитываются уровни экспрессии мембранного маркера CD20; на основании CD20 можно с 96 % точностью предсказать экспрессию FMC-7. Иммунологическая дифференциальная диагностика В-ХЛЛ и других периферических мелкоклеточных В-клеточных лимфом
При лимфоме из малых лимфоцитов – хроническом лимфоцитарном лейкозе вариабельно представлены некоторые активационные антигены CD38, CD25, CD71. В отличие от большинства фолликулярных лимфом не экспрессирован антиген CD10, а в отличие от лимфом из клеток мантии отсутствует ядерный белок циклин D1. Иммунофенотипические признаки ЛМЛ/В-ХЛЛ учитываются в системе счета, при проведении дифференциальной диагностики мелкоклеточных В-клеточных лимфом. Уникальный иммунофенотип позволяет надежно диагностировать В-ХЛЛ. Лимфома из малых лимфоцитов, протекающая без лейкемического компонента, является довольно редкой опухолью. Сведений о ее существовании на сегодняшний день недостаточно. Экспрессия CD23 и отсутствие циклина D1 являются важными признаками, отличающими В-ХЛЛ от мантийно-клеточных лимфом. Описан В-ХЛЛ, который является СD23-негативным или только частично позитивным. В этих случаях для исключения мантийно-клеточной лимфомы целесообразна оценка экспрессии циклина D1. Клетки с фенотипом, соответствующим В-ХЛЛ, в нормальных покоящихся и реагирующих на антигенные воздействия лимфатических узлах крайне редки. Так, например, пропорция CD5+ В-лимфоцитов в фолликулах не превышает 3—5 %, и только часть из них коэкспрессирует CD23. В крови ~ 20— 30 % В-клеток является СD5-позитивными, большинство из них коэкспрессирует CD23. Следует отметить, что из костного мозга зрелые девственные В-клетки выходят, не имея на мембране ни CD5, ни CD23. Следовательно, CD5+ CD23+ В-клетки представляют транзиторную фазу в ряду В-клеточной дифференцировки. Согласно классификации ВОЗ, нормальным клеточным эквивалентом лимфоидных элементов В-ХЛЛ является периферическая рециркулирующая CD5+CD23+IgM+IgD+ «наивная» В-клетка. Клетки с подобным фенотипом присутствуют в крови, первичных фолликулах и зоне мантии фолликулов. Предполагают, что эти клетки представляют подкласс анэргических аутореактивных CD5+ В-клеток. Антительная специфичность мембранных иммуноглобулинов клеток В-ХЛЛ во многих случаях направлена против собственных антигенов; кроме того, эти антитела часто имеют широкую специфичность, что отразилось в названии «перекрестно-реагирующие идиотипы». В значительной части случаев В-ХЛЛ обнаруживаются мутации в генах иммуноглобулинов, что свидетельствует о принадлежности злокачественных В-клеток у больных к пулу периферических IgM+ CD5+ В-клеток памяти. В-ХЛЛ, субстратом которого являются клетки, не прошедшие этап соматических гипермутаций генов V-областей иммуноглобулинов, обычно экспрессируют молекулу CD38, что считается неблагоприятным фактором прогноза. Описан В-ХЛЛ с атипичной морфологией клеток и особенностями иммунофенотипа: отсутствие CD5 или CD23, экспрессия FMC7 или CD11с, высокие уровни мембранных иммуноглобулинов или CD79b. Сведений о подобном атипичном В-ХЛЛ немного. Он нуждается в дальнейшем изучении и может быть верифицирован, вероятно, на основании совокупности клинических и лабораторных данных, включая результаты цитогенетического и молекулярного исследований. Описанные ранее при ХЛЛ транслокации 11;14 и перестройки гена BCL-1 в настоящее время нуждаются в тщательной верификации с позиций дифференциальной диагностики с мантийно-клеточными лимфомами. Для решения этого вопроса необходимы обширные цитогенетические и молекулярные исследования В-ХЛЛ при условии точной морфоиммунологической верификации диагноза. – Вернуться в раздел “гематология” Оглавление темы “Иммунодиагностика в гематологии”:
|
Источник
Исследование включает в себя определение абсолютных и относительных значений субпопуляционного состава Т-лимфоцитов (CD3, CD4, CD8, CD45), количества Т-регуляторных лимфоцитов (T-reg. Cells) соотношения Т – хелперы/Т – цитотоксические клетки и Т-клеток, несущих на своей поверхности маркеры активации CD38, HLA-DR. Рекомендуется к назначению для контроля показателей клеточного звена иммунной системы в динамике после комплексного иммунологического обследования.
Синонимы русские
Иммунофенотипирование, клеточный иммунитет, многоцветный клеточный анализ методом проточной цитометрии, Т-клетки, Т-хелперы, Т-цитотоксические клетки, Т-регуляторных лимфоциты.
Синонимы английские
Human Immune System, Immunophenotyping, Multicolor Flow Cytometry Cell Analysis, Human Leukocyte Differentiation Antigens, Human T cells, T helper cells, Cytotoxic T cells, T-reg Cells, Activation markers.
Метод исследования
Проточная цитометрия.
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Общая информация об исследовании
Оценка клеточного состава (иммунофенотипирование) лимфоцитов крови человека – основной компонент в оценке иммунного статуса – выполняется методом проточной цитофлуориметрии.
Иммунофенотипирование – характеристика клеток при помощи моноклональных антител или каких-либо других зондов, позволяющих судить об их типе и функциональном состоянии по наличию того или иного набора клеточных маркеров.
Иммунофенотипирование лейкоцитов заключается в обнаружении на их поверхности маркеров дифференциации, или CD-антигенов. Лейкоциты экспрессируют ряд поверхностных и цитоплазматических антигенов, уникальных для своей субпопуляции и стадии развития. CD-антигены (англ. cluster of differentiation antigens) – это антигены на поверхности клеток, маркеры, отличающие одни типы клеток от других. Дифференциации этих антигенов изучены и стандартизованы, им присвоены определенные номера. CD могут быть распознаны с помощью соответствующих моноклональных антител. Используя флюоресцентно-меченые моноклональные антитела, связывающиеся с определенными CD, можно с помощью метода проточной цитометрии произвести подсчёт содержания лимфоцитов, относящихся к различным по функции или стадии развития субпопуляциям.
В основе проточной цитофлуориметрии лежит проведение фотометрических и флюоресцентных измерений отдельных клеток, пересекающих одна за другой вместе с потоком жидкости луч монохроматического света, обычно света лазера.
СD3
Этот маркер позволяет идентифицировать зрелые покоящиеся (интактные) Т-клетки и подсчитать общее количество Т-лимфоцитов. Количественная оценка субпопуляции CD3+ лимфоцитов имеет диагностическую значимость в следующих случаях:
– первичные и вторичные иммунодефициты;
– острые вирусные инфекции, включая ВИЧ;
– внутриклеточные бактериальные и паразитарные инфекционные заболевания (например, туберкулез, лепра, лейшманиоз);
– злокачественные новообразования;
– реакции отторжения трансплантатов и болезни “трансплантат против хозяина”;
– лимфопролиферативные расстройства (острый Т-лимфобластный лейкоз).
При сахарном диабете довольно часто наблюдается снижение у больных процентного содержания и абсолютного числа СD3+ лимфоцитов.
СD4
Использование МКА к CD4 антигену дает возможность количественно охарактеризовать особый клон клеток, получивших название Т-хелперов/индукторов. СD4+ клетки в функциональном отношении делятся на два вида хелперных лимфоцитов: Т-хелперы 1-го порядка (Th1-клетки) и 2-го порядка (Th2-клетки). Различные CD4+ Т-клетки продуцируют разные наборы цитокинов. Th1-клетки (их называют еще клетками гиперчувствительности замедленного типа – ГЗТ) – цитокины для клеточного иммунного ответа: интерлейкин 2 (IL-2), IL-3, g-IFN, TNF-a, TNF-b, – среди которых дискриминантным цитокином является g-IFN. Th2 секретируют набор цитокинов, необходимый для гуморального иммунного ответа: IL-3, 4, 5, 6, 10, 13, TNF-b, – среди которых дискриминантным цитокином является IL-4.
Определение количества CD4+ клеток имеет значение в диагностике состояний, связанных с дефектами антителопродукции и реакций клеточноопосредованного иммунитета. Показателю числа CD4+ клеток отводится решающая роль для прогноза течения ВИЧ-инфекции.
Функциональное состояние CD4+ лимфоцитов тестируют по цитокиновому профилю: функциональная полноценность Th1-клеток подтверждается по секреции g-IFN, а Th2-клеток – по секреции IL-4.
СD8
Дифференцировочная молекула CD8 представляет собой гликопротеин, обнаруживаемый на поверхности тимоцитов и Т-лимфоцитов и участвующий в распознавании антигенных пептидов в контексте с молекулами главного комплекса гистосовместимости (MHC) класса I.
Клиническая значимость определения количества СD8+ лимфоцитов:
- вирусные инфекции (при определенной модификации имеется возможность количественной оценки вирусоспецифических цитолитических CD8+ Т-лимфоцитов);
- при ряде заболеваний большое прогностическое значение имеет соотношение между CD4- и CD8-субпопуляциями Т-лимфоцитов (иммунорегуляторный индекс CD4/CD8); например, прогрессирующее снижение иммунорегуляторного индекса у ВИЧ-инфицированных больных может свидетельствовать о переходе в СПИД;
- злокачественные новообразования;
- оценка эффективности проведенной вакцинации (в особенности противовирусными вакцинами).
До недавнего времени приписываемая субпопуляции CD8+ клеток супрессорная активность сейчас практически полностью отвергается. По данным большинства экспериментальных и клинических исследований считается, что существование какой-либо отдельной популяции Т-супрессорных клеток, даже без привязки к CD8-маркеру, маловероятно.
При аутоиммунных тиреоидитах, в частности при диффузном токсическом зобе (ДТЗ), в реакциях клеточного иммунитета отмечается снижение субпопуляции CD8+ лимфоцитов и снижение функциональной активности цитотоксических лимфоцитов.
При сахарном диабете также отмечается уменьшение функциональной активности и количества CD8+ лимфоцитов.
Снижение фракции СD8+ лимфоцитов наблюдается также у больных с первичной хронической недостаточностью коры надпочечников (болезнь Аддисона).
Анти-HLA–DR
Молекула HLA-DR также является маркером активации и принадлежит к МНС II класса. Она представляет собой трансмембранный гликопротеин, состоящий из a- и b-субъединиц, имеющих молекулярный вес 36 и 27 кД. Анти-HLA-DR реагирует только с эпитопом HLA-DR и не имеет перекрестных реакций с молекулами HLA-DQ и HLA-DP. Он экспрессируется на В-лимфоцитах, моноцитах, макрофагах, активированных Т-лимфоцитах.
Имеются данные о том, что молекула HLA-DR экспрессируется примерно на 10 % Т-лимфоцитах ПК, однако при активации клеток митогеном количество и плотность ее экспрессии резко возрастает. Существует предположение, что молекула HLA-DR на Т-клетках может выступать в качестве рецептора, участвующего в трансдукции сигнала активированными Т-лимфоцитами. Это наводит на мысль о ее возможной роли в качестве “профессиональной” АПК, участвующей в поддержании иммунной памяти.
HLA-DR также может присутствовать на клетках эпителия тимуса, на клетках В-лимфоцит-зависимых полей селезенки и лимфатических узлов, В-клеточной лимфомы. Этот антиген имеет коэкспрессию с CD1а антигеном на клетках Лангерганса.
CD25
Антиген CD25 известен как низкоаффинный рецептор ИЛ2, имеющий молекулярную массу 55 кД.
Молекула CD25, ассоциированная с b-цепью (CD122) и общей g-цепью (CD132), формирует высокоаффинный комплекс рецептора ИЛ-2. В процессе воспаления может вырабатываться растворимая форма ИЛ-2R. Маркер CD25 присутствует на субпопуляцях Т- и В-лимфоцитов периферической крови, в том числе на активированных макрофагах, НK. Его экспрессия резко возрастает при активации ФГА и КонА на поверхности CD3-активированных Т-лимфоцитов, на Т-клетках из смешанной культуры лимфоцитов, на инфицированных HTLV Т-лимфоцитах лейкемической линии при Т-лимфоцитарной лейкемии.
Метод позволяет определить количественное соотношение основных популяций Т-лимфоцитов:
- Т-лимфоциты (CD3+CD19-);
- Т-хелперы/индукторы (CD3+CD4+CD45+);
- Т-цитотоксические лимфоциты (Т-ЦТЛ) (CD3+CD8+CD45+);
- соотношение Т-хелперы/ Т-цитотоксические лимфоциты (CD3+CD4+/ CD3+CD8+).
малые клеточные популяции, а также изучить их функциональную активность:
- активированные Т-лимфоциты (CD3+HLA–DR+CD45+);
- регуляторные Т-хелперные клетки (CD4+CD25brigCD45+), выполняющие иммуносупрессорную функцию
- активированные цитотоксические Т-лимфоциты (CD3+CD8brightCD38+) (% от всех Т-лимфоцитов)
- активированные Т-лимфоциты, экспрессирующие a-цепь рецептора ИЛ-2 (CD3+CD25+CD45+).
Когда назначается исследование?
Являясь реальными супрессорами, Т-регуляторные клетки играют ведущую роль во многих иммунологических процессах: регулируют Т-клеточный гомеостаз, предотвращают аутоиммунные заболевания, аллергии, гиперчувствительность, реакцию “трансплантат против хозяина”. Вместе с тем регуляторные Т-клетки снижают противоопухолевый иммунитет и иммунитет к инфекциям.
Особый интерес представляют исследования, связанные с изучением соотношения аутоактивных клонов В-клеток и регуляторных Т-клеток при различной патологии воспалительного генеза. Так, при осложненном течении ряда патологических воспалительных процессов сохранение высокого уровня Т-reg и В1- клеток к 30-м суткам характеризует сохранение напряженности воспалительного процесса и, возможно, начало формирования дефекта функционирования Т-reg клеток, которое впоследствии может привести к хронизации воспаления и к развитию аутоиммунного процесса.
Таким образом, наличие и количественные характеристики этой популяции служат важным диагностическим признаком.
Рекомендовано для комплексного обследования пациентов, входящих в группу риска по четырем основным иммунопатологическим синдромам.
С инфекционным синдромом:
- частые ОРВИ, хронические инфекции ЛОР-органов (гнойные синуситы, отиты, периодически встречающиеся лимфадениты, пневмонии с тенденцией к рецидивированию, бронхоплевропневмонии);
- бактериальные инфекции кожи и подкожной клетчатки (пиодермии, фурункулез, абсцессы, флегмоны, септические гранулемы, рецидивирующий парапроктит у взрослых);
- урогенитальные инфекции;
- грибковые поражения кожи и слизистых оболочек, кандидоз, паразитарные инвазии;
- рецидивирующий герпес различной локализации;
- гастроэнтеропатия с хронической диареей неясной этиологии, дисбактериозом;
- длительный субфебрилитет, лихорадка неясной этиологии;
- генерализованные инфекции (сепсис, гнойные менингиты).
С аллергическим (атопическим) синдромом:
- атопический дерматит;
- нейродермит;
- экзема с инфекционным компонентом;
- тяжелая атопическая бронхиальная астма, поллиноз, хронический астматический бронхит.
С аутоиммунным синдромом:
- ревматоидный артрит;
- рассеянный склероз;
- диффузные заболевания соединительной ткани (системная красная волчанка, склеродермия, дерматомиозит);
- аутоиммунный тиреоидит;
- неспецифический язвенный колит;
С иммунопролиферативным синдромом:
- опухолевые процессы в иммунной системе (лимфомы, болезнь Ходжкина, острый и хронический лимфолейкоз, саркома Капоши).
Что означают результаты?
Изменения различных клеточных популяций лимфоцитов в сторону повышения или понижения развиваются при различных патологических процессах в организме, таких как инфекции, аутоиммунные и онкологические заболевания, иммунодефициты, в постоперационном периоде, при трансплантации органов.
Ниже представлена таблица с клиническими ситуациями, которые могут приводить к изменениям в субпопуляционном составе лимфоцитов.
Субпопуляция лимфоцитов | Повышение показателя | Снижение показателя |
T-лимфоциты (CD3+CD19-) | • Острые и хронические инфекции; • гормональный дисбаланс; • длительный прием лекарственных препаратов (особенно монотерапия); • прием биологически активных добавок; • интенсивные занятия спортом; • беременность; • Т-клеточные лейкозы. | • Некоторые виды инфекций; • иммунодефицитные состояния; • алкогольный цирроз печени; • карцинома печени; • аутоиммунные заболевания; • прием иммуносупрессивных препаратов. |
Т-хелперы (CD3+CD4+CD45+) | • Ряд аутоиммунных заболеваний; • гормональный дисбаланс; • некоторые инфекции; • отдельные Т-клеточные лейкозы; • отравление солями бериллия. | • Иммунодефицитные состояния (основной лабораторный признак вторичного иммунодефицита); • алкогольная болезнь печени; • аутоиммунные заболевания; • прием иммуносупрессивных препаратов или стероидов. |
Т-цитотоксические лимфоциты (CD3+CD8+CD45+) | • Некоторые вирусные инфекции; • ряд Т-клеточных лейкозов; • наркоз; • острая фаза аллергии; • ряд аутоиммунных патологий. | • Некоторые виды аутоиммунных, аллергических заболеваний; • иммуносупрессивная терапия. |
T-reg. (регуляторные Т-клетки (CD4+CD25brightCD45+) | • Различные новообразования; • лимфопролиферативные процессы; • инфекционные заболевания. | • Аутоиммунная патология (сахарный диабет 1-го типа, рассеянный склероз, ревматоидный артрит, аутоиммунный тиреоидит, неспецифический язвенный колит, болезнь Крона, миастения); • аллергические заболевания (бронхиальная астма, атопический дерматит, пищевая аллергия). |
Активированные Т-лимфоциты (CD3+HLA-DR+CD45+) | • Инфекции; • аутоиммунная патология; • аллергия; • онкологические заболевания; • алкогольный цирроз печени; • беременность. | Не имеют диагностического значения. |
В совокупности с клиническими данными, симптоматикой, другими методами лабораторных исследований вышеуказанные изменения являются диагностическим признаком возникновения этих патологических процессов в организме человека.
Важные замечания
- Результаты данного исследования необходимо сопоставлять с клиническими данными и показателями других лабораторных анализов.
- Оценка показателей в динамике существенно повышает клиническую значимость исследования.
Литература
- Хаитов, Р.М. Аллергология и иммунология : национальное руководство / под ред. Р.М. Хаитова, Н.И. Ильиной. – М. : ГЭОТАР-Медиа, 2009. – 656 с.
- Хаитов, Р.М. Руководство по клинической иммунологии. Диагностика заболеваний иммунной системы : руководство для врачей / Р.М. Хаитов, Б.В. Пинегин, А.А. Ярилин. – М. : ГЭОТАР-Медиа, 2009. – 352 с.
- Зуева Е.Е. Иммунная система, иммунограмма : рекомендации по назначению и применению в лечебно диагностическом процессе /Е.Е Зуева, Е.Б. Русанова, А.В. Куртова, А.П. Рыжак, М.В. горчакова, О.В. Галкина – СПб. – Тверь: ООО «издательство «Триада», 2008. – 60 с.
- Кетлинский, С.А. Иммунология для врача / С.А. Кетлинский, Н.М. Калинина. СПб. : Гиппократ, 1998. – 156 с. Ярилин, А.А. Иммунология : учебник / А.А. Ярилин. – М. : ГЭОТАР-Медиа, 2010. – 752 с.
- Хаитов, Р.М. Иммунология : атлас / Р.М. Хаитов, А.А. Ярилин, Б.В. Пинегин.М. : ГЭОТАР-Медиа, 2011. – 624 с.
- Хаитов, Р.М. Иммунология : учебник / Р.М. Хаитов. – М. : ГЭОТАР-Медиа, 2009. – 320 с.
- Хаитов, Р.М. Оценка иммунного статуса человека в норме и при патологии / Р.М. Хаитов, Б.В. Пинегин // Иммунология. – 2001. – N4. – С. 4–6.
- Whiteside, T.L. Role of Human Natural Killer Cells in Health and disease / T.L. Whiteside, R.B. Herberman // Clinical and Diagnostic Laboratory Immunology. – 1994. – Vol. 1, №2. – P. 125–133.
- Ginadi, L. Differential expression of T-cell antigens in normal peripheral blood lymphocytes : a quantitative analysis by flow cytometry / L. Ginadi, N. Farahat, E. Matutes [et al.] // J. Clin. Pathol. – 1996. – Vol. 49, № 1. – P. 539–544.
- Merser, J.C. Natural killer T-cells : rapid responders controlling immunity and disease / J.C. Merser, M.J. Ragin, A. August // International J. Biochemistry & Cell Biology. – 2005. – № 37. – P. 1337–1343.
- Никитин, В.Ю. Маркеры активации на Т-хелперах и цитотокси ческих лимфоцитахна различных стадиях хронического вирусного гепатита С / В.Ю. Никитин, И.А. Сухина, В.Н. Цыган [и др.] // Вестн. Рос. Воен.-мед. акад. – 2007. – Т. 17, № 1. – С. 65–71.
- Boettler, T. T cells with CD4+CD25+ regulatory phenotype suppress in vitro proliferation of virus-specific CD8+ T cells during chronic hepatitis C virus infection / T. Boettler, H.C. Spangenberg, C. Neumann-Haefelin [et al.] // J. Virology. − 2005. − Vol. 79, N 12. −P. 7860–7867.
- Ormandy, L.A. Increased Populations of Regulatory T Cells in Peripheral Blood of Patients with Hepatocellular Carcinoma / L.A. Ormandy, T. Hillemann, H. Wedemeyer [et al.] // J. Cancer Res. − 2005. − Vol. 65, N 6. − P. 2457–2464.
- Sakaguchi, S. Naturally arising FoxP3-expressing CD4+CD25+ regulatory T cells in immunological tolerance to self- and non-self / S. Sakaguchi // Nature Immunol. − 2005. −Vol. 6, N 4. − P. 345–352.
- Romagnani, S. Regulation of the T cell response / S. Romagnani // Clin. Exp. Allergy. –2006. − Vol. 36. − P. 1357–1366.
- Хайдуков С.В., Основные и малые популяции лимфоцитов периферической крови человека и их нормативные значения (метод многоцветного цитометрического анализа) /Хайдуков С.В., Зурочка А.В., Тотолян А.А., Черешнев В.А. // Мед. иммунология. – 2009. -Т. 11 (2-3). – С. 227-238.
Источник