Cd20 b лимфоциты понижены
Первым исследованием всегда является подсчет лейкоцитарной формулы (см. главу «Гематологические исследования»). Оцениваются как относительные, так и абсолютные значения количества клеток периферической крови.
Определение основных популяций (Т-клетки, В-клетки, натуральные киллеры) и субпопуляций Т-лимфоцитов (Т-хелперы, Т-ЦТЛ). Для первичного исследования иммунного статуса и выявления выраженных нарушений иммунной системы ВОЗ рекомендовано определение CD3, CD4, CD8, CD19, CD16+56, соотношение CD4/CD8. Исследование позволяет определить относительное и абсолютное количество основных популяций лимфоцитов: Т-клетки – CD3, В-клетки – CD19, натуральные киллеры (NK) – CD3- CD16++56+, субпопуляции Т лимфоцитов (Т-хелперы CD3+ CD4+, Т-цитотоксические CD3+ CD8+ и их соотношение).
Метод исследования
Иммунофенотипирование лимфоцитов проводится c использованием моноклональных антител к поверхностным дифференцировочным ангинам на клетках иммунной системы, методом проточной лазерной цитофлуорометрии на проточных цитофлуориметрах.
Выбор зоны анализа лимфоцитов производится по дополнительному маркеру CD45, который представлен на поверхности всех лейкоцитов.
Условия взятия и хранения образцов
Венозная кровь, взятая из локтевой вены, утром, строго натощак, в вакуумную систему до указанной на пробирке метки. В качестве антикоагулянта используется К2ЭДТА. После взятия пробирку с образцом медленно переворачивают 8-10 раз для перемешивония крови с антикоагулянтом. Хранение и транспортировка строго при 18–23°С в вертикальном положении не более 24 ч.
Невыполнение этих условий приводит к некорректным результатам.
Интерпретация результатов
Т-лимфоциты (CD3+ клетки). Повышенное количество свидетельствует о гиперактивности иммунитета, наблюдается при острых и хронических лимфолейкозах. Увеличение относительного показателя встречается при некоторых вырусных и бактериальных инфекциях в начале заболевания, обострениях хронических заболеваний.
Снижение абсолютного количества Т-лимфоцитов свидетельствует о недостаточности клеточного иммунитета, а именно о недостаточности клеточно-эффекторного звена иммунитета. Выявляется при воспалениях разнообразной этиологии, злокачественных новообразованиях, после травмы, операций, инфаркта, при курении, приеме цитостатиков. Повышение их числа в динамике заболевания – клинически благоприятный признак.
В-лимфоциты (CD19+ клетки) Снижение наблюдается при физиологических и врожденных гипогаммаглобулинемиях и агаммаглобулинемиях, при новообразованиях иммунной системы, лечении иммунодепрессантами, острой вирусной и хронической бактериальной инфекциях, состоянии после удаления селезенки.
Увеличение отмечается при аутоиммунных заболеваниях, хронических заболеваниях печени, циррозе, муковисцедозе, бронхиальной астме, паразитарных и грибковых инфекциях. Характерно в период реконвалесценции после перенесенных острых и хронических вирусных и бактериальных инфекций. Выраженное увеличение наблюдается при хроническом В-лимфолейкозе.
NK-лимфоциты с фенотипом CD3-CD16++56+ Натуральные киллеры (NK-клетки) – популяция больших гранулярных лимфоцитов. Они способны лизировать клетки-мишени, инфицированные вирусами и другими внутриклеточными антигенами, опухолевые клетки, а также другие клетки аллогенного и ксеногенного происхождения.
Увеличение количества NK-клеток связано с активацией антитрансплантационного иммунитета, в некоторых случаях отмечается при бронхиальной астме, встречается при вирусных заболеваниях, повышается при злокачественных новообразованиях и лейкозах, в периоде реконвалесценции.
Снижение наблюдается при врожденных иммунодефицитах, паразитарных инфекциях, аутоиммунных заболеваниях, облучении, лечении цитостатиками и кортикостероидами, стрессе, дефиците цинка.
Т-лимфоциты хелперы с фенотипом CD3+CD4+ Увеличение абсолютного и относительного количества наблюдается при аутоиммунных заболеваниях, может быть при аллергических реакциях, некоторых инфекционных заболеваниях. Это увеличение свидетельствует о стимуляции иммунной системы на антиген и служит подтверждением гиперреактивных синдромов.
Снижение абсолютного и относительного количества Т-клеток свидетельствует о гипореактивном синдроме с нарушением регуляторного звена иммунитета, является патогномичным признаком для ВИЧ-инфекции; встречается при хронических заболеваниях (бронхитах, пневмониях и т.д.), солидных опухолях.
Т-цитотоксические лимфоциты с фенотипом CD3+ CD8+ Повышение выявляется практически при всех хронических инфекциях, вирусных, бактериальных, протозойных инфекциях. Является характерным для ВИЧ-инфекции. Снижение наблюдается при вирусных гепатитах, герпесе, аутоиммунных заболеваниях.
Соотношение CD4+/CD8+ Исследование соотношения CD4+/CD8+ (CD3, CD4, CD8, CD4/CD8) рекомендовано только для мониторинга ВИЧ-инфекции и контроля эффективности АРВ терапии. Позволяет определить абсолютное и относительное количество Т-лимфоцитов, субпопуляций Т-хелперов, ЦТЛ и их соотношение.
Диапазон значений – 1,2–2,6. Снижение наблюдается при врожденных иммунодефицитах (синдром Ди-Джоржи, Незелофа, Вискотта-Олдрича), при вирусных и бактериальных инфекциях, хронических процессах, воздействии радиации и токсических химических веществ, множественной миеломе, стрессе, снижается с возрастом, при эндокринных заболеваниях, солидных опухолях. Является патогномичным признаком для ВИЧ-инфекции (менее 0,7).
Увеличение значения более 3 – при аутоиммунных заболеваниях, остром Т-лимфобластном лейкозе, тимоме, хроническом Т-лейкозе.
Изменение соотношения может быть связано с количеством хелперов и ЦТЛ у данного пациента. Например, снижение количества CD4+ Т-клеток при острой пневмонии в начале заболевания ведет к снижению индекса, а ЦТЛ при этом могут не измениться.
Для дополнительного исследования и выявления изменений иммунной системы при патологиях требующих оценки наличия острого или хронического воспалительного процесса и степени его активности, рекомендуется включать подсчет количества активированных Т-лимфоцитов с фенотипом CD3+HLA-DR+ и ТNK–клеток с фенотипом CD3+CD16++56+.
Т-активированные лимфоциты с фенотипом CD3+HLA-DR+ Маркер поздней активации, показатель гиперреактивности иммунитета. По экспрессии данного маркера можно судить о выраженности и силе иммунного ответа. Появляется на Т-лимфоцитах после 3-го дня острого заболевания. При благоприятном течении заболевания снижается до нормы. Увеличение экспрессии на Т-лимфоцитах может быть при многих заболеваниях, связанных с хроническим воспалением. Отмечено его повышение у пациентов с гепатитом С, пневмониями, ВИЧ-инфекцией, солидными опухолями, аутоиммунными заболеваниями.
ТNK-лимфоциты с фенотипом CD3+CD16++CD56+ Т-лимфоциты, несущие на своей поверхности маркеры CD16++ CD 56+. Эти клетки имеют свойства как Т-, так и NK-клеток. Исследование рекомендовано как дополнительный маркер при острых и хронических заболеваниях.
Снижение их в периферической крови может наблюдаться при различных органоспецифических заболеваниях и системных аутоиммунных процессах. Увеличение отмечено при воспалительных заболеваниях разной этиологии, опухолевых процессах.
Исследование ранних и поздних маркеров активации Т-лимфоцитов (CD3+CD25+, CD3-CD56+, CD95, CD8+CD38+) дополнительно назначают для оценки изменений ИС при острых и хронических заболеваниях, для диагностики, прогноза, мониторинга течения заболевания и проводимой терапии.
Т-активированные лимфоциты с фенотипом CD3+CD25+, рецeптор к ИЛ2 CD25+ – маркер ранней активации. О функциональном состоянии Т-лимфоцитов (CD3+) свидетельствует количество экспрессирующих рецепторов к ИЛ2 (CD25+). При гиперактивных синдромах количество этих клеток возрастает (острые и хронические лимфолейкозы, тимома, отторжение трансплантата), кроме того, повышение их может свидетельствовать о ранней стадии воспалительного процесса. В периферической крови их можно выявить в первые три дня болезни. Снижение числа этих клеток может наблюдаться при врожденных иммунодефицитах, аутоиммунных процессах, ВИЧ-инфекции, грибковых и бактериальных инфекциях, ионизирующей радиации, старении, отравлении тяжелыми металлами.
Т-цитотоксические лимфоциты с фенотипом CD8+CD38+ Присутствие CD38+ на ЦТЛ лимфоцитах отмечено у пациентов с разными заболеваниями. Информативный показатель при ВИЧ-инфекции, ожоговой болезни. Увеличение числа ЦТЛ с фенотипом CD8+CD38+ наблюдается при хронических воспалительных процессах, онкологических и некоторых эндокринных заболеваниях. При проведении терапии показатель снижается.
Субпопуляция натуральных киллеров с фенотипом CD3- CD56+ Молекула CD56 – адгезивная молекула, широко представленная в нервной ткани. Кроме натуральных киллеров, экспрессируется на многих типах клеток, в том число на Т-лимфоцитах.
Увеличение данного показателя свидетельствуют о расширении активности специфического клона клеток киллеров, которые имеют меньшую цитолитическую активность, чем NK-клетки с фенотипом CD3- CD16+. Количество этой популяции возрастает при гематологических опухолях (ЕК-клеточная или Т-клеточная лимфома, плазмоклеточная миелома, апластическая крупноклеточная лимфома), хронических заболеваниях, некоторых вырусных инфекциях.
Снижение отмечается при первичных иммунодефицитах, вирусных инфекциях, системных хронических заболеваниях, стрессе, лечении цитостатиками и кортикостероидами.
Рецептор CD95+ – один из рецепторов апоптоза. Апоптоз – сложный биологический процесс, необходимый для удаления из организма поврежденных, старых и инфицированных клеток. Рецептор CD95 экспрессируется на всех клетках иммунной системы. Он играет важную роль в контроле функционирования иммунной системы, так как является одним из рецепторов апоптоза. Его экспрессия на клетках определяет готовность клеток к апоптозу.
Снижение доли CD95+-лимфоцитов в крови пациентов свидетельствует о нарушении эффективности последнего этапа выбраковки дефектных и инфицированных собственных клеток, что может привести к рецидиву заболевания, хронизации патологического процесса, развитию аутоиммунных заболеваний и повышению вероятности опухолевой трансформации (к примеру, рака шейки матки при папилломотозной инфекции). Определение экспрессии CD95 имеет прогностическое значение при миело- и лимфопролифератиных заболеваниях.
Повышение интенсивности апоптоза наблюдается при вирусных заболеваниях, септических состояниях, при употреблении наркотических средств.
Активированные лимфоциты CD3+CDHLA-DR+, CD8+CD38+, CD3+CD25+, CD95. Тест отражает функциональное состояние Т-лимфоцитов и рекомендован для контроля за течением заболевания и контроля иммунотерапии при воспалительных заболеваниях разной этиологии.
Источник

CD20 (B1, кластер дифференцировки 20) был открыт в 1980-м году как один из первых маркеров молодых и зрелых В-лимфоцитов. Он представляет собой продукт гена MS4A1 — негликозилированный мембранный белок группы тетраспанинов. Характерной особенностью всех тетраспанинов является наличие четырех схожих трансмембранных участков. В строении CD20 также выделяют две внеклеточные петли, на которых расположены эпитопы взаимодействия с CD20-специфичными антителами [1].
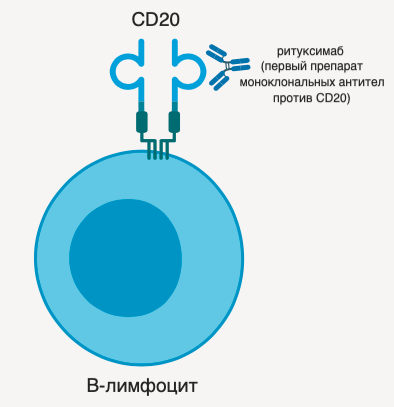 Рисунок 1 ❘ Схема строения CD20, связанного со специфичным антителом.
Рисунок 1 ❘ Схема строения CD20, связанного со специфичным антителом.
На поверхности неизмененных В-лимфоцитов CD20 обнаруживается с самых ранних этапов дифференцировки, начиная с пре-В-клеток. На этапе трансформации В-лимфоцитов в плазматические клетки CD20 утрачивается. Согласно современным представлениям, основная функция CD20 заключается в модификации высвобождения внутриклеточных запасов ионов кальция. Кроме того, с нормальным функционированием и достаточным количеством этого белка тесно связана функция В-клеточного рецептора. По этой причине дефицит корецептора CD20 снижает способность В-лимфоцитов отвечать на антигенную стимуляцию. При этом особую функциональную активность CD20 приобретает после перемещения в липидные рафты — мембранные участки, обогащенные гликосфинголипидами и координирующие работу рецепторных белков [2]. Специальный лиганд для CD20 пока не был обнаружен.
CD20 синтезируется на поверхности не только нормальных, но и неопластически трансформированных В-лимфоцитов, и потому обнаруживается при В-лимфопролиферативных заболеваниях. Этим ограничивается маркерная функция CD20. Посредством его обнаружения можно дифференцировать В- и Т-клеточные лимфомы, однако заболевания внутри В-пролиферативной группы невозможно различить лишь по экспрессии данного рецептора.
На сегодняшний день CD20 является одной из наиболее изученных мишеней воздействия таргетной терапии. Считается, что его использование в качестве терапевтического агента удобно по двум причинам. Во-первых, в случае CD20-положительных опухолей этот рецептор обнаруживается на поверхности В-лимфоцитов в огромном количестве — около ста тысяч молекул на одну клетку. Во-вторых, мембраны стволовых и плазматических клеток не содержат этот белок, что резко снижает количество нежелательных эффектов, связанных с изменениями гемопоэза и иммунореактивности, а также обусловливает высокую чувствительность препаратов [3].
Ритуксимаб был одобрен к применению FDA (Food and Drug Administration, Управление США по санитарному надзору за качеством пищевых продуктов и медикаментов) в 1997 году. Для повышения клинической эффективности в терапии неходжкинских лимфом были разработаны второе и третье поколения аналогов ритуксимаба, а также созданы конъюгаты, используемые для радиоиммунотерапии В-лимфопролиферативных патологий. По мере разработки моноклональных антител, специфичных в отношении CD20, спектр их применения был расширен до терапии рассеянного (множественного) склероза и многих аутоиммунных патологий [3].
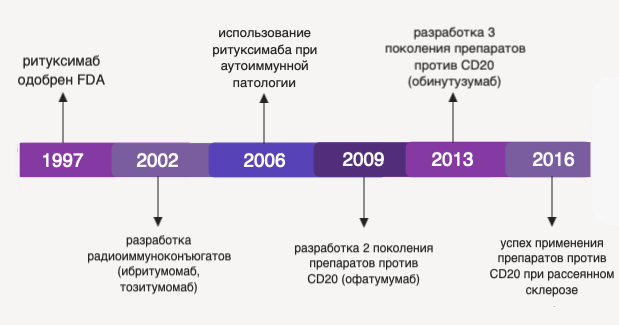 Рисунок 2 ❘ История разработки и внедрения препаратов моноклональных антител против CD20.
Рисунок 2 ❘ История разработки и внедрения препаратов моноклональных антител против CD20.
С 1997 года не был окончательно установлен механизм, обусловливающий клинический эффект ритуксимаба и его аналогов. Однако известно, что действие моноклональных антител, специфичных к CD20, приводит к замедлению пролиферации клеток опухоли, их апоптозу и повышению хемочувствительности. Кроме того, эти препараты призваны модифицировать микроокружение опухоли путем повышения уровня цитотоксичности его клеток [4].
Некоторые ученые называют период с 1997 года по настоящее время “эрой после ритуксимаба”. Это название прижилось в связи с тем, что с 1997 года стремительно растет уровень резистентности опухолей к ритуксимабу и его аналогам. Участились рецидивы опухолей после проведения курсов таргетной терапии, появились группы опухолей, не отвечающих на воздействие известными моноклональными антителами. Среди механизмов резистентности опухоли к действию ритуксимаба наиболее значимы следующие:
- Снижение уровня экспрессии CD20 вплоть до полного ее прекращения;
- Затруднение доступа к опухоли путем модификации микроокружения;
- Изменение активности тирозинкиназ, ассоциированных с CD20;
- Инактивация антител путем изменения клеточного метаболизма [5].
Задачей “эры после ритуксимаба” является разработка новых препаратов и их комбинация с другими терапевтическими агентами. Современными задачами разработки средств, активных в отношении CD20, являются:
- Увеличение чувствительности препаратов;
- Преодоление резистентности опухоли;
- Увеличение скорости гибели опухоли;
- Разработка средств модификации микроокружения опухоли [3].
Как уже было сказано, препараты моноклональных антител против CD20 используются в основном для лечения неходжкинских лимфом. В последнее время эти препараты таргетной терапии нашли применение и в лечении хронического лимфолейкоза [4]. Известно, что в 20–40% случаев лимфомы Ходжкина также являются CD20-положительными. Некоторые исследователи предполагают, что CD20 может играть патофизиологическую роль в развитии лимфомы Ходжкина, однако достоверные подтверждения этому еще не были представлены, и эффекты монотерапии лимфомы Ходжкина препаратами моноклональных антител против CD20 неизвестны [6]. Для охвата большего числа лимфопролиферативных заболеваний разрабатывают также биспецифичные средства, действующие одновременно против CD20 и другого мембранного белка B-лимфоцитов — CD19 [7].
В современных условиях ритуксимаб и его аналоги пока не теряют своей клинической значимости и успешно используются. Однако случаи неэффективности применения таких дорогостоящих средств таргетной терапии заставляют искать новые возможности использования CD20 как терапевтического агента. Возможно, проводимые разработки в будущем решат ключевые вопросы патогенеза и терапии В-лимфопролиферативных заболеваний.
Источники
1. Tetraspanin proteins promote multiple cancer stages. / Martin E. Hemler. // Nat Rev Cancer. – 2014. – Vol. 14. – p. 49-60.
2. Functional role of lipid rafts in CD20 activity? / Janas E, Priest R, Malhotra R. // Biochem Soc Symp. – 2005. – Vol. 72. – p. 165-175.
3. Therapeutic Antibodies: What Have We Learnt from Targeting CD20 and Where Are We Going? / Michael J. E. Marshall, Richard J. Stopforth, Mark S. Cragg. // Front Immunol. – 2017. – Vol. 8. – p. 1245.
4. CD20-based Immunotherapy of B-cell derived Hematologic Malignancies. / Shanehbandi D, Majidi J, Kazemi T [et al.] // Curr Cancer Drug Targets. – 2017. – Vol. 17, №5. – p. 423-444.
5. Rituximab (monoclonal anti-CD20 antibody): mechanisms of action and resistance. / Mitchell R. Smith. // Oncogene. – 2003. – Vol. 22, №47. – p. 7359-7368.
6. CD20 role in pathophysiology of Hodgkin’s disease. / Santos MAO, Lima MM. // Rev Assoc Med Bras. (1992) – 2017. – Vol. 63, №9. – p. 810-813.
7. CD20-CD19 Bispecific CAR T Cells for the Treatment of B-Cell Malignancies. / Martyniszyn A, Krahl AC, Andre MC [et al.] // Hum Gene Ther. – 2017. – Vol. 28, №12. – p. 1147-1157.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
Категория:
Клеточный иммунитет
Единица измерения:
%
Краткое описание
CD20-лимфоциты – клетки гуморального иммунитета, ответственные за синтез АТ (антител). Они образуются в костном мозге из стволовых клеток, где проходят первые этапы дифференцировки. Согласно современным представлениям, развитие В-лимфоцитов проходит стадийно от стволовой клетки к ранним и поздним предшественникам и, наконец, к зрелой клетке. В-лимфоциты преимущественно концентрируются в периферических лимфоидных органах. В периферической крови содержится лишь 15-20% их общего количества.
Подробное описание
Важное значение в оценке гуморального иммунитета имеет соотношение популяций в общем пуле В-лимфоцитов: В-лимфоциты с IgM-рецепторами составляют 3-10%; с IgG-рецепторами – 2-6%, с IgA-рецепторами – 1-3%. С нарушением соотношения В-лимфоцитов связаны многие заболевания. Недостаточность В-клеток ведет к тяжелым иммунодефицитам, а их избыточная активность – к развитию аутоиммунной патологии.
Следует заметить, что количество В-лимфоцитов в периферической крови, достаточно стойкий показатель гомеостаза, мало изменяющийся при различных воздействиях, поэтому отклонение его величины от нормальной может служить одним из важных критериев иммунопатологии.
Референтные значения
Факторы повышения и понижения
| Другие | |
| Иммунный ответ на тимуснезависимые Аг | Повышение |
| Острый период повторной инфекции | Повышение |
| Аутоиммунные заболевания | Повышение |
| Хронические заболевания печени | Повышение |
| ВИЧ-инфекция (начальный период) | Повышение |
| Острые бактериальные, грибковые и паразитарные инфекции | Повышение |
| Недостаточность гуморального иммунитета | Понижение |
| Состояние после удаления селезенки | Понижение |
| Новообразования иммунной системы | Понижение |
| Врожденная гипогаммаглобулинемия или агаммаглобулинемия | Понижение |
| Физиологическая гипогаммаглобулинемия у детей (в возрасте 3-5 мес) | Понижение |
| Иммунодепрессанты | Понижение |
| Цитостатики | Понижение |
Источники и литература
Другие сервисы медицинского портала MedElement
Медицинский портал MedElement – это облачные сервисы, мобильные
приложения и электронные справочники для врачей и пациентов.
Наши проекты могут помочь вам!
Источник