Cd рецепторы на т лимфоцитах что это
Оглавление темы “СD8 лимфоциты. Антиген ( Аг ) представляющие клетки. Классификация антигенов ( Аг ).”:
1. Рецептор Т-клеток. Активация Т-лимфоцитов. Субпопуляции Т-лимфоцитов. СD4+ лимфоциты.
2. СD8 лимфоциты. Т супрессоры. Цитотоксические Т-лимфоциты ( ЦТЛ ). Т-киллеры. Цитотоксический эффект Т-киллеров. Т-клетки памяти.
3. В-лимфоциты. В-клетки. Созревание В-лимфоцитов. Продолжительность жизни B-лимфоцитов. Маркеры В-клеток ( В-лимфоцитов ).
4. Естественные киллеры ( NK-клетки ). Перфорины. Функция естественных киллеров. Задачи NK-клеток.
5. Антиген ( Аг ) представляющие клетки. Иммунные реакции. Классификация имунных реакций. Антигены. Свойства антигенов. Структура антигенов ( Аг ). Валентность Аг.
6. Классификация антигенов ( Аг ). Иммуногены. Гаптены. Непреципитирующие гаптены. Преципитирующие гаптены. Полугаптены. Проантигены.
7. Адъюванты. Адъювант Фройнда. Толерогены. Природа антигенов (Аг). Происхождение антигенов. Молекулярная масса антигенов (Аг).
8. Специфичность антигенов (Аг). Видовые антигены. Групповые антигены (Аг). Гетерогенные антигены (Аг). Антиген Форссмана. Аллоантигены ( изоантигены ).
9. Патологические антигены. Аутоантигены. Врождённые аутоантигены. Приобретённые аутоантигены. Суперантигены.
10. Антигены ( Аг ) микроорганизмов. Антигены бактерий. Капсульные антигены ( К-антигены ( Аг )). Соматические антигены ( O-антигены ( Аг )). Жгутиковые антигены ( H-антигены ( Аг )). Vi-Ar ( Антиген вирулентности ).
Рецептор Т-клеток. Активация Т-лимфоцитов. Субпопуляции Т-лимфоцитов. СD4+ лимфоциты.
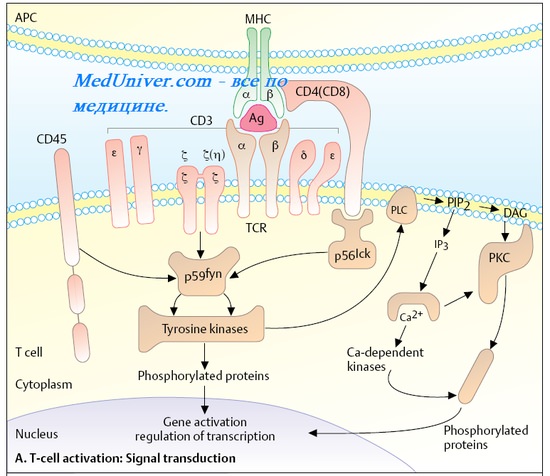
Рецептор Т-клеток. Т-клетки распознают Аг с помощью двух типов мембранных гликопротеинов — Т-клеточных рецепторов и CD3. Т-клеточный рецептор — гетеродимер, содержащий а- и р-цепи (примерно 98% всех Т-клеток) или 5-цепи (около 1,5-2% клеток) с молекулярной массой 40-50 кД. Т-клеточный рецептор входит в суперсемейство Ig-подобных молекул клеточной поверхности, участвующих в реакциях распознавания. Механизмы трансмембранной передачи с рецептора Т-клетки остаются неизвестными; предположительно они обусловлены CD3, нековалентно связанными с рецепторами Т-лимфоцитов.
Активация Т-клеток
Для активации Т-клеток необходимо два сигнала от макрофагов. Первый сигнал — представление Аг, второй— секреция активирующего фактора (ИЛ-1). Последний стимулирует синтез Т-лимфоцитами ИЛ-2, активирующего эти клетки (аутокринная регуляция). Одновременно на мембранах Т-клеток повышается экспрессия рецепторов к ИЛ-2 (CD25).

Субпопуляции Т-лимфоцитов
На основании поверхностных маркёров различают несколько субпопуляций Т-лимфоцитов, выполняющих различные функции. Для дифференцировки Т-клеток применяют набор моноклональных AT, выявляющих поверхностные маркерные CD-Aг [от англ. cluster of differentiation, кластер дифференцировки]. Все зрелые Т-клетки экспрессируют поверхностный CD3-Aг; помимо него субпопуляции Т-лимфоцитов также экспрессируют и другие CD-Aг.
СD4+ лимфоциты
Мембранные молекулы CD4 несут различные популяции клеток, условно разделяемые на регуляторные (хелперы) и эффекторные (Тгзт).
Т-хелперы [от англ. to help, помогать] специфически распознают Аг и взаимодействуют с макрофагами и В-клетками в ходе индукции гуморального иммунного ответа. Отношение CD4+/CD8+-клеток — важный параметр оценки иммунного статуса; в нормальных условиях отношение CD4+/CD8+ приблизительно равно двум и отражает доминирующее влияние на иммунный ответ стимулирующих факторов. При некоторых иммунодефицитных состояниях отношение обратное (менее I, то есть СD8+-клетки доминируют), указывая на преимущественное влияние иммуносупрессорных эффектов; лежит в основе патогенеза многих иммунодефицитов (например, СПИДа).
Аг распознающие Т-лимфоциты «узнают» чужеродный эпитоп вирусного или опухолевого Аг в комплексе с молекулой МНС на плазматической мембране клетки-мишени. Тгзт [Т-эффекторы реакций гиперчувствительности замедленного типа (ГЗТ)] опосредуют реакции ГЗТ.
– Также рекомендуем “СD8 лимфоциты. Т супрессоры. Цитотоксические Т-лимфоциты ( ЦТЛ ). Т-киллеры. Цитотоксический эффект Т-киллеров. Т-клетки памяти.”
Источник
Исследование включает в себя определение абсолютных и относительных значений субпопуляционного состава Т-лимфоцитов (CD3, CD4, CD8, CD45), количества Т-регуляторных лимфоцитов (T-reg. Cells) соотношения Т – хелперы/Т – цитотоксические клетки и Т-клеток, несущих на своей поверхности маркеры активации CD38, HLA-DR. Рекомендуется к назначению для контроля показателей клеточного звена иммунной системы в динамике после комплексного иммунологического обследования.
Синонимы русские
Иммунофенотипирование, клеточный иммунитет, многоцветный клеточный анализ методом проточной цитометрии, Т-клетки, Т-хелперы, Т-цитотоксические клетки, Т-регуляторных лимфоциты.
Синонимы английские
Human Immune System, Immunophenotyping, Multicolor Flow Cytometry Cell Analysis, Human Leukocyte Differentiation Antigens, Human T cells, T helper cells, Cytotoxic T cells, T-reg Cells, Activation markers.
Метод исследования
Проточная цитометрия.
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Общая информация об исследовании
Оценка клеточного состава (иммунофенотипирование) лимфоцитов крови человека – основной компонент в оценке иммунного статуса – выполняется методом проточной цитофлуориметрии.
Иммунофенотипирование – характеристика клеток при помощи моноклональных антител или каких-либо других зондов, позволяющих судить об их типе и функциональном состоянии по наличию того или иного набора клеточных маркеров.
Иммунофенотипирование лейкоцитов заключается в обнаружении на их поверхности маркеров дифференциации, или CD-антигенов. Лейкоциты экспрессируют ряд поверхностных и цитоплазматических антигенов, уникальных для своей субпопуляции и стадии развития. CD-антигены (англ. cluster of differentiation antigens) – это антигены на поверхности клеток, маркеры, отличающие одни типы клеток от других. Дифференциации этих антигенов изучены и стандартизованы, им присвоены определенные номера. CD могут быть распознаны с помощью соответствующих моноклональных антител. Используя флюоресцентно-меченые моноклональные антитела, связывающиеся с определенными CD, можно с помощью метода проточной цитометрии произвести подсчёт содержания лимфоцитов, относящихся к различным по функции или стадии развития субпопуляциям.
В основе проточной цитофлуориметрии лежит проведение фотометрических и флюоресцентных измерений отдельных клеток, пересекающих одна за другой вместе с потоком жидкости луч монохроматического света, обычно света лазера.
СD3
Этот маркер позволяет идентифицировать зрелые покоящиеся (интактные) Т-клетки и подсчитать общее количество Т-лимфоцитов. Количественная оценка субпопуляции CD3+ лимфоцитов имеет диагностическую значимость в следующих случаях:
– первичные и вторичные иммунодефициты;
– острые вирусные инфекции, включая ВИЧ;
– внутриклеточные бактериальные и паразитарные инфекционные заболевания (например, туберкулез, лепра, лейшманиоз);
– злокачественные новообразования;
– реакции отторжения трансплантатов и болезни “трансплантат против хозяина”;
– лимфопролиферативные расстройства (острый Т-лимфобластный лейкоз).
При сахарном диабете довольно часто наблюдается снижение у больных процентного содержания и абсолютного числа СD3+ лимфоцитов.
СD4
Использование МКА к CD4 антигену дает возможность количественно охарактеризовать особый клон клеток, получивших название Т-хелперов/индукторов. СD4+ клетки в функциональном отношении делятся на два вида хелперных лимфоцитов: Т-хелперы 1-го порядка (Th1-клетки) и 2-го порядка (Th2-клетки). Различные CD4+ Т-клетки продуцируют разные наборы цитокинов. Th1-клетки (их называют еще клетками гиперчувствительности замедленного типа – ГЗТ) – цитокины для клеточного иммунного ответа: интерлейкин 2 (IL-2), IL-3, g-IFN, TNF-a, TNF-b, – среди которых дискриминантным цитокином является g-IFN. Th2 секретируют набор цитокинов, необходимый для гуморального иммунного ответа: IL-3, 4, 5, 6, 10, 13, TNF-b, – среди которых дискриминантным цитокином является IL-4.
Определение количества CD4+ клеток имеет значение в диагностике состояний, связанных с дефектами антителопродукции и реакций клеточноопосредованного иммунитета. Показателю числа CD4+ клеток отводится решающая роль для прогноза течения ВИЧ-инфекции.
Функциональное состояние CD4+ лимфоцитов тестируют по цитокиновому профилю: функциональная полноценность Th1-клеток подтверждается по секреции g-IFN, а Th2-клеток – по секреции IL-4.
СD8
Дифференцировочная молекула CD8 представляет собой гликопротеин, обнаруживаемый на поверхности тимоцитов и Т-лимфоцитов и участвующий в распознавании антигенных пептидов в контексте с молекулами главного комплекса гистосовместимости (MHC) класса I.
Клиническая значимость определения количества СD8+ лимфоцитов:
- вирусные инфекции (при определенной модификации имеется возможность количественной оценки вирусоспецифических цитолитических CD8+ Т-лимфоцитов);
- при ряде заболеваний большое прогностическое значение имеет соотношение между CD4- и CD8-субпопуляциями Т-лимфоцитов (иммунорегуляторный индекс CD4/CD8); например, прогрессирующее снижение иммунорегуляторного индекса у ВИЧ-инфицированных больных может свидетельствовать о переходе в СПИД;
- злокачественные новообразования;
- оценка эффективности проведенной вакцинации (в особенности противовирусными вакцинами).
До недавнего времени приписываемая субпопуляции CD8+ клеток супрессорная активность сейчас практически полностью отвергается. По данным большинства экспериментальных и клинических исследований считается, что существование какой-либо отдельной популяции Т-супрессорных клеток, даже без привязки к CD8-маркеру, маловероятно.
При аутоиммунных тиреоидитах, в частности при диффузном токсическом зобе (ДТЗ), в реакциях клеточного иммунитета отмечается снижение субпопуляции CD8+ лимфоцитов и снижение функциональной активности цитотоксических лимфоцитов.
При сахарном диабете также отмечается уменьшение функциональной активности и количества CD8+ лимфоцитов.
Снижение фракции СD8+ лимфоцитов наблюдается также у больных с первичной хронической недостаточностью коры надпочечников (болезнь Аддисона).
Анти-HLA–DR
Молекула HLA-DR также является маркером активации и принадлежит к МНС II класса. Она представляет собой трансмембранный гликопротеин, состоящий из a- и b-субъединиц, имеющих молекулярный вес 36 и 27 кД. Анти-HLA-DR реагирует только с эпитопом HLA-DR и не имеет перекрестных реакций с молекулами HLA-DQ и HLA-DP. Он экспрессируется на В-лимфоцитах, моноцитах, макрофагах, активированных Т-лимфоцитах.
Имеются данные о том, что молекула HLA-DR экспрессируется примерно на 10 % Т-лимфоцитах ПК, однако при активации клеток митогеном количество и плотность ее экспрессии резко возрастает. Существует предположение, что молекула HLA-DR на Т-клетках может выступать в качестве рецептора, участвующего в трансдукции сигнала активированными Т-лимфоцитами. Это наводит на мысль о ее возможной роли в качестве “профессиональной” АПК, участвующей в поддержании иммунной памяти.
HLA-DR также может присутствовать на клетках эпителия тимуса, на клетках В-лимфоцит-зависимых полей селезенки и лимфатических узлов, В-клеточной лимфомы. Этот антиген имеет коэкспрессию с CD1а антигеном на клетках Лангерганса.
CD25
Антиген CD25 известен как низкоаффинный рецептор ИЛ2, имеющий молекулярную массу 55 кД.
Молекула CD25, ассоциированная с b-цепью (CD122) и общей g-цепью (CD132), формирует высокоаффинный комплекс рецептора ИЛ-2. В процессе воспаления может вырабатываться растворимая форма ИЛ-2R. Маркер CD25 присутствует на субпопуляцях Т- и В-лимфоцитов периферической крови, в том числе на активированных макрофагах, НK. Его экспрессия резко возрастает при активации ФГА и КонА на поверхности CD3-активированных Т-лимфоцитов, на Т-клетках из смешанной культуры лимфоцитов, на инфицированных HTLV Т-лимфоцитах лейкемической линии при Т-лимфоцитарной лейкемии.
Метод позволяет определить количественное соотношение основных популяций Т-лимфоцитов:
- Т-лимфоциты (CD3+CD19-);
- Т-хелперы/индукторы (CD3+CD4+CD45+);
- Т-цитотоксические лимфоциты (Т-ЦТЛ) (CD3+CD8+CD45+);
- соотношение Т-хелперы/ Т-цитотоксические лимфоциты (CD3+CD4+/ CD3+CD8+).
малые клеточные популяции, а также изучить их функциональную активность:
- активированные Т-лимфоциты (CD3+HLA–DR+CD45+);
- регуляторные Т-хелперные клетки (CD4+CD25brigCD45+), выполняющие иммуносупрессорную функцию
- активированные цитотоксические Т-лимфоциты (CD3+CD8brightCD38+) (% от всех Т-лимфоцитов)
- активированные Т-лимфоциты, экспрессирующие a-цепь рецептора ИЛ-2 (CD3+CD25+CD45+).
Когда назначается исследование?
Являясь реальными супрессорами, Т-регуляторные клетки играют ведущую роль во многих иммунологических процессах: регулируют Т-клеточный гомеостаз, предотвращают аутоиммунные заболевания, аллергии, гиперчувствительность, реакцию “трансплантат против хозяина”. Вместе с тем регуляторные Т-клетки снижают противоопухолевый иммунитет и иммунитет к инфекциям.
Особый интерес представляют исследования, связанные с изучением соотношения аутоактивных клонов В-клеток и регуляторных Т-клеток при различной патологии воспалительного генеза. Так, при осложненном течении ряда патологических воспалительных процессов сохранение высокого уровня Т-reg и В1- клеток к 30-м суткам характеризует сохранение напряженности воспалительного процесса и, возможно, начало формирования дефекта функционирования Т-reg клеток, которое впоследствии может привести к хронизации воспаления и к развитию аутоиммунного процесса.
Таким образом, наличие и количественные характеристики этой популяции служат важным диагностическим признаком.
Рекомендовано для комплексного обследования пациентов, входящих в группу риска по четырем основным иммунопатологическим синдромам.
С инфекционным синдромом:
- частые ОРВИ, хронические инфекции ЛОР-органов (гнойные синуситы, отиты, периодически встречающиеся лимфадениты, пневмонии с тенденцией к рецидивированию, бронхоплевропневмонии);
- бактериальные инфекции кожи и подкожной клетчатки (пиодермии, фурункулез, абсцессы, флегмоны, септические гранулемы, рецидивирующий парапроктит у взрослых);
- урогенитальные инфекции;
- грибковые поражения кожи и слизистых оболочек, кандидоз, паразитарные инвазии;
- рецидивирующий герпес различной локализации;
- гастроэнтеропатия с хронической диареей неясной этиологии, дисбактериозом;
- длительный субфебрилитет, лихорадка неясной этиологии;
- генерализованные инфекции (сепсис, гнойные менингиты).
С аллергическим (атопическим) синдромом:
- атопический дерматит;
- нейродермит;
- экзема с инфекционным компонентом;
- тяжелая атопическая бронхиальная астма, поллиноз, хронический астматический бронхит.
С аутоиммунным синдромом:
- ревматоидный артрит;
- рассеянный склероз;
- диффузные заболевания соединительной ткани (системная красная волчанка, склеродермия, дерматомиозит);
- аутоиммунный тиреоидит;
- неспецифический язвенный колит;
С иммунопролиферативным синдромом:
- опухолевые процессы в иммунной системе (лимфомы, болезнь Ходжкина, острый и хронический лимфолейкоз, саркома Капоши).
Что означают результаты?
Изменения различных клеточных популяций лимфоцитов в сторону повышения или понижения развиваются при различных патологических процессах в организме, таких как инфекции, аутоиммунные и онкологические заболевания, иммунодефициты, в постоперационном периоде, при трансплантации органов.
Ниже представлена таблица с клиническими ситуациями, которые могут приводить к изменениям в субпопуляционном составе лимфоцитов.
Субпопуляция лимфоцитов | Повышение показателя | Снижение показателя |
T-лимфоциты (CD3+CD19-) | • Острые и хронические инфекции; • гормональный дисбаланс; • длительный прием лекарственных препаратов (особенно монотерапия); • прием биологически активных добавок; • интенсивные занятия спортом; • беременность; • Т-клеточные лейкозы. | • Некоторые виды инфекций; • иммунодефицитные состояния; • алкогольный цирроз печени; • карцинома печени; • аутоиммунные заболевания; • прием иммуносупрессивных препаратов. |
Т-хелперы (CD3+CD4+CD45+) | • Ряд аутоиммунных заболеваний; • гормональный дисбаланс; • некоторые инфекции; • отдельные Т-клеточные лейкозы; • отравление солями бериллия. | • Иммунодефицитные состояния (основной лабораторный признак вторичного иммунодефицита); • алкогольная болезнь печени; • аутоиммунные заболевания; • прием иммуносупрессивных препаратов или стероидов. |
Т-цитотоксические лимфоциты (CD3+CD8+CD45+) | • Некоторые вирусные инфекции; • ряд Т-клеточных лейкозов; • наркоз; • острая фаза аллергии; • ряд аутоиммунных патологий. | • Некоторые виды аутоиммунных, аллергических заболеваний; • иммуносупрессивная терапия. |
T-reg. (регуляторные Т-клетки (CD4+CD25brightCD45+) | • Различные новообразования; • лимфопролиферативные процессы; • инфекционные заболевания. | • Аутоиммунная патология (сахарный диабет 1-го типа, рассеянный склероз, ревматоидный артрит, аутоиммунный тиреоидит, неспецифический язвенный колит, болезнь Крона, миастения); • аллергические заболевания (бронхиальная астма, атопический дерматит, пищевая аллергия). |
Активированные Т-лимфоциты (CD3+HLA-DR+CD45+) | • Инфекции; • аутоиммунная патология; • аллергия; • онкологические заболевания; • алкогольный цирроз печени; • беременность. | Не имеют диагностического значения. |
В совокупности с клиническими данными, симптоматикой, другими методами лабораторных исследований вышеуказанные изменения являются диагностическим признаком возникновения этих патологических процессов в организме человека.
Важные замечания
- Результаты данного исследования необходимо сопоставлять с клиническими данными и показателями других лабораторных анализов.
- Оценка показателей в динамике существенно повышает клиническую значимость исследования.
Литература
- Хаитов, Р.М. Аллергология и иммунология : национальное руководство / под ред. Р.М. Хаитова, Н.И. Ильиной. – М. : ГЭОТАР-Медиа, 2009. – 656 с.
- Хаитов, Р.М. Руководство по клинической иммунологии. Диагностика заболеваний иммунной системы : руководство для врачей / Р.М. Хаитов, Б.В. Пинегин, А.А. Ярилин. – М. : ГЭОТАР-Медиа, 2009. – 352 с.
- Зуева Е.Е. Иммунная система, иммунограмма : рекомендации по назначению и применению в лечебно диагностическом процессе /Е.Е Зуева, Е.Б. Русанова, А.В. Куртова, А.П. Рыжак, М.В. горчакова, О.В. Галкина – СПб. – Тверь: ООО «издательство «Триада», 2008. – 60 с.
- Кетлинский, С.А. Иммунология для врача / С.А. Кетлинский, Н.М. Калинина. СПб. : Гиппократ, 1998. – 156 с. Ярилин, А.А. Иммунология : учебник / А.А. Ярилин. – М. : ГЭОТАР-Медиа, 2010. – 752 с.
- Хаитов, Р.М. Иммунология : атлас / Р.М. Хаитов, А.А. Ярилин, Б.В. Пинегин.М. : ГЭОТАР-Медиа, 2011. – 624 с.
- Хаитов, Р.М. Иммунология : учебник / Р.М. Хаитов. – М. : ГЭОТАР-Медиа, 2009. – 320 с.
- Хаитов, Р.М. Оценка иммунного статуса человека в норме и при патологии / Р.М. Хаитов, Б.В. Пинегин // Иммунология. – 2001. – N4. – С. 4–6.
- Whiteside, T.L. Role of Human Natural Killer Cells in Health and disease / T.L. Whiteside, R.B. Herberman // Clinical and Diagnostic Laboratory Immunology. – 1994. – Vol. 1, №2. – P. 125–133.
- Ginadi, L. Differential expression of T-cell antigens in normal peripheral blood lymphocytes : a quantitative analysis by flow cytometry / L. Ginadi, N. Farahat, E. Matutes [et al.] // J. Clin. Pathol. – 1996. – Vol. 49, № 1. – P. 539–544.
- Merser, J.C. Natural killer T-cells : rapid responders controlling immunity and disease / J.C. Merser, M.J. Ragin, A. August // International J. Biochemistry & Cell Biology. – 2005. – № 37. – P. 1337–1343.
- Никитин, В.Ю. Маркеры активации на Т-хелперах и цитотокси ческих лимфоцитахна различных стадиях хронического вирусного гепатита С / В.Ю. Никитин, И.А. Сухина, В.Н. Цыган [и др.] // Вестн. Рос. Воен.-мед. акад. – 2007. – Т. 17, № 1. – С. 65–71.
- Boettler, T. T cells with CD4+CD25+ regulatory phenotype suppress in vitro proliferation of virus-specific CD8+ T cells during chronic hepatitis C virus infection / T. Boettler, H.C. Spangenberg, C. Neumann-Haefelin [et al.] // J. Virology. − 2005. − Vol. 79, N 12. −P. 7860–7867.
- Ormandy, L.A. Increased Populations of Regulatory T Cells in Peripheral Blood of Patients with Hepatocellular Carcinoma / L.A. Ormandy, T. Hillemann, H. Wedemeyer [et al.] // J. Cancer Res. − 2005. − Vol. 65, N 6. − P. 2457–2464.
- Sakaguchi, S. Naturally arising FoxP3-expressing CD4+CD25+ regulatory T cells in immunological tolerance to self- and non-self / S. Sakaguchi // Nature Immunol. − 2005. −Vol. 6, N 4. − P. 345–352.
- Romagnani, S. Regulation of the T cell response / S. Romagnani // Clin. Exp. Allergy. –2006. − Vol. 36. − P. 1357–1366.
- Хайдуков С.В., Основные и малые популяции лимфоцитов периферической крови человека и их нормативные значения (метод многоцветного цитометрического анализа) /Хайдуков С.В., Зурочка А.В., Тотолян А.А., Черешнев В.А. // Мед. иммунология. – 2009. -Т. 11 (2-3). – С. 227-238.
Источник