Борьба с раковыми клетками осуществляется лимфоцитами

Иммунный ответ на опухолевые клетки – рак
Обнаружение того факта, что иммунная система человека иногда способна распознавать злокачественные клетки как чужеродные, открывает целый ряд возможностей как в попытках модифицировать иммунный ответ на опухоль в терапевтических целях, так и в плане использования данного эффекта в диагностике раковых заболеваний.
Проводимые в настоящее время исследования с использованием антител (обычно моноклональных) к поверхностным антигенам Т-лимфоцитов позволяют определить, какие именно субпопуляции Т-клеток и каким образом могут действовать против человеческих раковых опухолей.
Из кровяного русла, содержимого лимфатических узлов и инфильтрата опухолей можно выделить три различные субпопуляции Т-клеток с цитотоксической, хелперной и супрессорной специализацией. В цитотоксических экспериментах можно разделить действие Т-лимфоцитов и активность ЕК-клеток.
Лизис Т-лимфоцитами опухолевых клеток происходит только тогда, когда имеет место четкая генетическая распознаваемость Т-клеткой конкретной мишени.
Современные технологии позволяют выделить Т-клетки из кровяного русла, лимфоузлов, а лучше всего непосредственно из опухоли, стимулировать их размножение в искусственных условиях, и исследовать полученные клонированные линии для более полного определения их свойств и антигенной специфичности.
Известно, что клетки карцином обычно экспрессируют на своей поверхности антигены I класса главного комплекса гистосовместимости (ГКГ), но никогда II класса. В процессе метаболизма раковой клетки антигены I класса ГКГ связываются с определенными белками, образуют комплексы, которые распознаются специальными антиген-презентирующимими клетками.
После этого антиген-презентируюшие клетки активируют Т-лимфоциты, формируя специфический иммунный ответ на конкретный антиген. В последнее время широкое распространение получили исследования, направленные на поиск специфических опухолевых белков, которых нет в здоровых клетках и которые можно использовать для активации специфического противоопухолевого иммунного ответа.
До тех пор пока не определены специфичные опухолевые антигены и не исследованы механизмы иммунного ответа на них (если он вообще существует), невозможно говорить о наличии эффективной иммунной реакции организма на конкретную опухоль. Тем не менее недавнее обнаружение специфичных для меланомы белков позволило провести первые клинические испытания противоопухолевой вакцины на основе определенных антигенов.
И хотя в испытаниях у небольшой доли больных меланомой наблюдалось клиническое улучшение течения болезни, до сих пор не ясно, насколько широко можно применять предлагаемую методику лечения. На некоторых опухолях в связи с отсутствием известных опухолевых антигенов, способных запустить специфический иммунный ответ, был предпринят ряд попыток спровоцировать иммунные реакции путем модификации мембранных антигенов эпителиальных клеток. Возможность разработать методы иммунизации, направленной на предотвращение рецидивов болезни, может стать очень привлекательным направлением в терапии рака.
Существенным практическим подходом в предотвращении заболевания раком может стать иммунизация групп риска вакцинами против антигенов вирусов гепатита В, ВЭБ и ПВЧ. К сожалению, опухоле-ассоциированые антигены этой группы вирусов в настоящее время недостаточно изучены.
Попытки повышения неспецифического иммунного ответа или применения медиаторов воспаления в терапии раковых опухолей обычно малоэффективны. Лечебные процедуры с использованием цитокинов обсуждены в отдельной статье на сайте. В настоящее время интенсивно исследуются методики наработки in vitro большой массы аутологических лимфокин-активированных клеток (ЛАК) путем стимуляции их ИЛ-2, с последующей реинфузией активированных клеток в кровяное русло пациента.
Цель данной методики состоит в попытке направить большое количество неспецифически активированных цитотоксических лимфоцитов на уничтожение конкретной опухоли. Пока что не существует убедительных доказательств, что данная методика более эффективна, чем терапия чистым лимфокином (ИЛ-2). Удивительно, но большинство эффектов от применения неспецифической стимуляции иммунитета (с помощью БЦЖ, ИЛ-2, интерферонов и ЛАК-клеток) наблюдаются в основном на определенных типах опухолей, а именно на меланоме и почечно-клеточной карциноме. Очевидно, какие-то характерные черты этих двух видов рака делают их чувствительными к медиаторам воспаления.
– Также рекомендуем “Сферы применения моноклональных антител в онкологии”
Оглавление темы “Механизмы роста и развития рака”:
- Клеточные онкогены как причина развития рака
- Мутация генов супрессоров как причина развития рака
- Особенности деления опухолевых клеток – раковый митоз
- Наследственность онкологических заболеваний – рака
- Моноклональность и гетерогенность онкологических заболеваний – рака
- Механизмы роста опухоли – рака
- Степени дифференцировки опухолевых клеток – рака
- Инвазия, ангиогенез и метастазирование опухолевых клеток – рака
- Иммунный ответ на опухолевые клетки – рак
- Сферы применения моноклональных антител в онкологии
Источник
Статья на конкурс «био/мол/текст»: Ученые объединили методы иммунотерапии, цитотерапии и генотерапии для перепрограммирования Т-лимфоцитов в потенциальных «убийц» раковых клеток. Но и этого оказалось недостаточно — следующим шагом стало создание молекулярного «выключателя», с помощью которого можно регулировать время и силу действия активированных Т-клеток. Инновационный метод закладывает основу для резкого сокращения серьезных (а иногда и смертельных) побочных эффектов, вызванных терапией с использованием модифицированных Т-клеток.
Медицина перешла на новый уровень: клетки стали живым лекарством
В последнее время в терапии опухолевых заболеваний особое внимание уделяется адоптивной иммуноцитотерапии (от англ. adoptive — приемный). При этом часть клеток иммунной системы пациента искусственно «натравливают» на опухолевые клетки. Суть метода состоит в том, чтобы отобрать у пациента необходимые иммунные клетки, обработать их — например, иммунными цитокинами (небольшими белками, выполняющими функции регуляторов деления и дифференцировки специфических иммунных клеток), — а затем вернуть в организм уже активированные клетки, которые и будут помогать бороться с опухолями* (рис. 1).
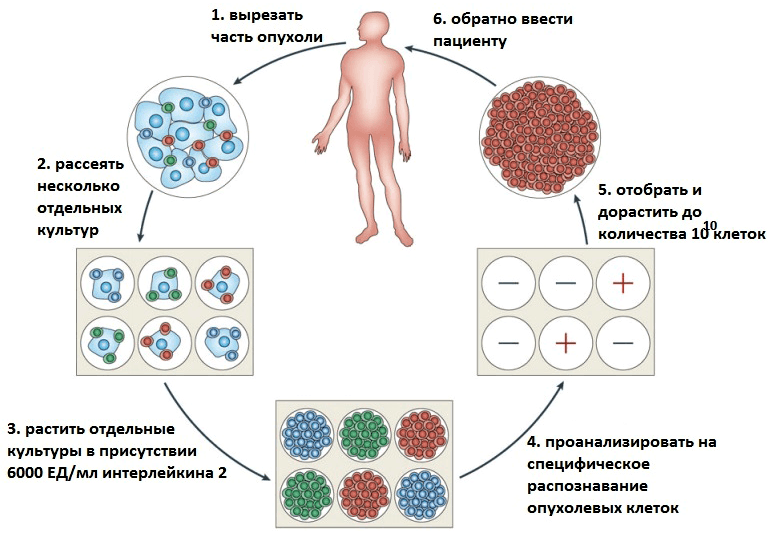
Рисунок 1. Схема получения антиопухолевых Т-клеток для адоптивной иммуноцитотерапии. Рисунок из [3].
Впервые метод адоптивной иммуноцитотерапии был описан еще в 1988 году — у пациентов с метастатической меланомой (то есть раком кожи на четвертой стадии) наблюдалась регрессия заболевания при терапии с помощью их TIL-клеток (лимфоцитов, инфильтрующих опухоль) [2]. В настоящее время терапия метастатической меланомы на основе TIL-клеток является наиболее эффективным способом лечения данного заболевания, поскольку регрессия опухоли наблюдается у половины пациентов [3].
Существует несколько вариантов клеток, которые используются в адоптивной иммунотерапии; из них три используются при терапии опухолевых заболеваний: уже знакомые нам TIL-клетки (лимфоциты, инфильтрующие опухоль), LAC-клетки (лимфокин-активированные киллеры) и CIK-клетки (цитокин-индуцированные киллеры). На самом деле собственные Т-клетки организма тоже стараются бороться с опухолевыми клетками, только зачастую опухолевые клетки им «не по зубам». Не то, чтобы совсем — ведь существует иммунный надзор, осуществляемый Т-клетками и естественными киллерами (NK-клетками), с помощью которых иммунная система старается защититься от опухолей, — однако это вовсе не стопроцентная защита. Однако случается, что иммунный надзор не всегда достаточно силен, чтоб предотвратить развитие опухолей: так, при длительном применении иммунодепрессантов после трансплантаций органов повышается частота развития многих опухолей [4].
Необходима система наведения
Несмотря на сложность получения модифицированных клеток, а также сопутствующий риск возникновения серьезных побочных эффектов, все же главной проблемой метода иммуноцитотерапии является отсутствие способов прицельной доставки вводимых модифицированных иммунных клеток в опухоль. Раковые клетки часто делаются практически «невидимыми» для иммунной системы, и они образуют микросреду, которая подавляет активность и миграцию Т-клеток [5]. Для того, чтобы сбросить мантию-невидимку с опухолевых клеток, Т-лимфоциты надо не только активировать, но и придать им способность прицельно узнавать опухолевые клетки. Т-клетки могут быть перепрограммированы методами генной инженерии путем введения генов, кодирующих рецепторы к опухолевым антигенам (TAA, tumour-associated аntigens) — оснащения собственной «системой наведения». Также можно заодно ввести гены для придания Т-клеткам устойчивости к иммуносупрессии для увеличения выживаемости или облегчения проникновения сконструированных Т-клеток в опухоль. В итоге, могут быть получены высокоактивные «наемные убийцы» раковых клеток [5].
Для получения эффективных «убийц» Т-лимфоциты модифицируют путем оснащения их искусственными химерными антигенными рецепторами (CAR, chimeric antigen receptors). Рецепторы химерные, поскольку одна часть (распознающая) была «позаимствована» у моноклональных антител, а часть, передающая сигнал, — у Т-клеточного рецептора (ТCR). В качестве внеклеточной «распознающей» части обычно служат вариабельные домены тяжелой и легкой цепи иммуноглобулинов необходимой специфичности (scFv), которые образуют специфичный к опухолевым клеткам антиген-связывающий участок [5] (рис. 2).
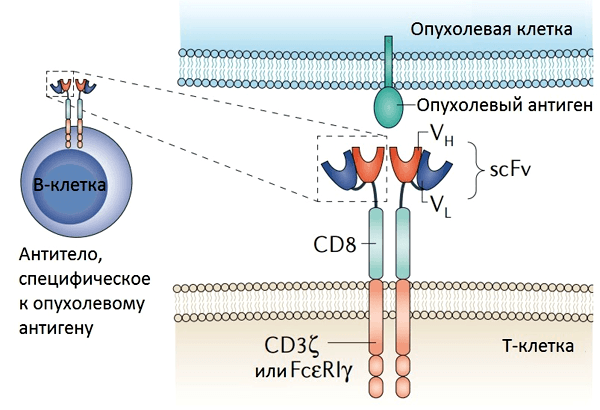
Рисунок 2. Структура химерного антигенного рецептора (CAR). CAR состоит из внеклеточного домена (одноцепочечного вариабельного фрагмента антитела (scFv)), соединенного с помощью цепей и трансмембранных доменов с цитоплазматической сигнальной областью. Гены, кодирующие scFv, получены из В-клеток, продуцирующих антитела, специфичные к опухолевому антигену. CAR существует в виде димера, и распознавание опухоли происходит напрямую (без участия MHC). Рисунок из [5].
Все новое — это хорошо забытое старое. Первые Т-клетки с химерным антигенным рецептором были получены командой ученых под руководством профессора Эсхара (Zelig Eshhar); результаты работы были опубликованы еще в 1989 году [6]. Эсхар понял, что, обладая данной техникой, Т-клетки можно запрограммировать на нацеленную атаку.
Однако с момента обнаружения химерных антигенных рецепторов до внедрения технологии в практику прошло больше 20 лет. За это время были улучшены химерные антигенные рецепторы — были созданы CAR 2-го поколения, в которые был внесен дополнительный сигнальный домен костимулирующей молекулы, который позволил улучшить активацию Т-клеток и их распространение. В CAR 3-го поколения был добавлен еще один сигнальный домен, что в конечном итоге повысило уровни выживания и размножения модифицированных Т-клеток [7] (рис. 3). В конечном итоге были улучшены способность к «выслеживанию» опухолевых клеток, а также уменьшены побочные эффекты.

Рисунок 4. Бутылка с питательной средой для Т-клеток, которые после введения в них нового рецептора выращивают около 10 дней до достижения ими количества в несколько миллиардов. Тогда они могут быть введены в вены пациента. Рисунок из [9].
Первые клинические испытания генетически модифицированных Т-лимфоцитов, несущих химерные антигенные рецепторы, прошли в 2012 году. Они выпали на долю девочки по имени Эмили, больной острой лимфобластной лейкемией. После того, как генетически модифицированные Т-клетки были обратно введены девочке, ее состояние резко ухудшилось, и она провела несколько недель в отделении интенсивной терапии на искусственной вентиляции легких. В какой-то момент жизнь Эмили висела на волоске, но в итоге девочка поправилась, и уже три года в ее организме врачи не находят даже единичных раковых клеток [8].
Побочные эффекты новой терапии
Несмотря на то, что иммуноцитотерапия Т-клетками с CAR является прорывом в области лечения опухолевых заболеваний, есть еще ряд опасностей, которые могут поджидать за углом. Доктор Карл Джун (Carl June) из университета Пенсильвании был одним из первых, кто опубликовал успешные результаты лечения модифицированными Т-клетками, сравнил то, что происходит внутри тела пациента с «серийным убийством» и «массовым убийством». Когда миллиарды Т-клеток, которые были введены в организм, поделятся, то они смогут обнаружить и убить несколько фунтов опухоли. Но в этом тоже немало риска — многие пациенты страдают от синдрома высвобождения цитокинов (цитокинового шторма) — при борьбе Т-клетки с опухолевой клеткой высвобождается большое количество молекул цитокинов, что представляет угрозу для самого организма. Так, семь пациентов умерло вследствие этого синдрома [9].
Побочные эффекты связаны с мощной иммунной активностью модифицированных Т-клеток. Одним из камней преткновения является риск высокой токсичности, не позволяющий ввести подобное лечение на регулярной основе. «Т-клетки — действительно мощные создания», — говорит профессор Венделл Лим (Wendell Lim), заведующий отделом Департамента клеточной и молекулярной фармакологии Калифорнийского университета. — «Будучи активированными, они могут вызвать смерть. Нам необходима система удаленного контроля, которая сохранит силу этих модифицированных Т-клеток, и позволит специфично „общаться“ с ними и управлять Т-клетками, находящимися в организме» [10].
Т-клетки взяли под контроль
Ученые из Калифорнийского университета в Сан-Франциско создали молекулярный «включатель», с помощью которого можно управлять действиями генноинженерных Т-лимфоцитов. Как и обыкновенные Т-клетки, несущие CAR, новые Т-клетки с «включателем» будут взаимодействовать с опухолевыми клетками, но не будут переходить «в атаку», пока не будет введен специальный препарат. Данный препарат является своеобразным «химическим мостиком» внутри Т-клеток: он запускает иммунные реакции, «включает» их, переводя в активное состояние. Когда препарат перестает циркулировать в крови, Т-клетки снова переходят в «выключенное» состояние (рис. 5).
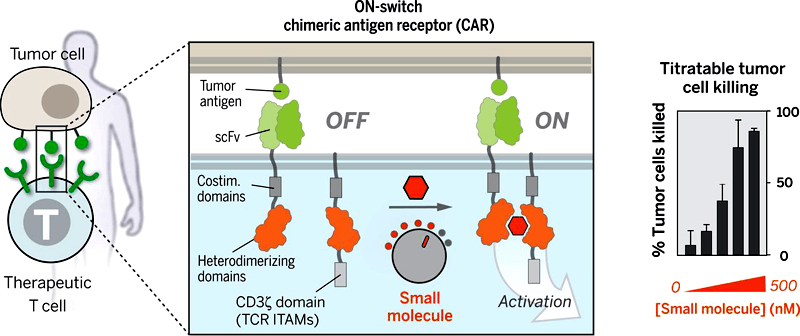
Рисунок 5. Титруемый контроль генноинженерных Т-клеток с помощью включаемого химерного антигенного рецептора. С обычным CAR Т-клетки активируются при соединении с клеткой-мишенью, при этом из-за очень сильного иммунного ответа есть риск высокой токсичности. «Включаемый» CAR требует небольшую стимулирующую молекулу для запуска терапевтической функции. Величину ответа (например, «убийства» клеток-мишеней) можно титровать, тем самым уменьшая токсичность при уменьшении количества небольшой стимулирующей молекулы. Рисунок из [11].
Внедрение «пульта управления» в Т-клетку с химерным антигенным рецептором — это пример простой и эффективной стратегии совмещения собственных и автономных решений клетки (например, обнаружение сигналов болезни) с контролируемыми пользователем из вне. Перегруппировка и расщепление основных частей CAR обеспечивает возможность «включения» и «выключения» химерных антигенных рецепторов. Данная работа также подчеркивает важность разработки оптимизированных биоинертных «пультов управления», таких как небольшие молекулы и свет, вместе с их клеточными компонентами реагирования, в целях повышения точности контролируемой терапии [11].
Таким образом, правильно дозируя препарат, можно управлять уровнем иммунной активности модифицированных Т-клеток. В частности, благодаря данной технологии можно снизить отрицательные последствия синдрома высвобождения цитокинов. Также иногда нормальные клетки экспрессируют небольшие количества белков, которые являются мишенью для Т-клеток с CAR. Поскольку модифицированные Т-клетки вводят в кровяное русло и они проходят через сердце и легкие, ткани этих органов могут быть повреждены прежде, чем Т-клетки достигнут своих намеченных целей в других частях тела. А с новой технологией Т-клетки будут в «выключенном» состоянии, пока не достигнут цели [10].
Иммунотерапия с помощью Т-клеток с CAR успешна против рака крови, но, когда дело доходит до твердых опухолей, которые образуются в толстой кишке, молочных железах, мозге и других тканях, модифицированные Т-клетки до сих пор не показывают высокой эффективности. Возможно, метод дистанционного управления Т-клетками позволит разработать более мощные версии химерных антигенных рецепторов, которые позволят Т-клеткам поражать твердые опухоли, при этом не обладая серьезными побочными эффектами.
- Хороший, плохой, злой, или Как разозлить лимфоциты и уничтожить опухоль;
- Rosenberg S.A., Packard B.S., Aebersold P.M., Solomon D., Topalian S.L., Toy S.T. et al. (1988). Use of tumor-infiltrating lymphocytes and interleukin-2 in the immunotherapy of patients with metastatic melanoma. A preliminary report. N. Engl. J. Med. 319, 1676–1680;
- Rosenberg S.A., Restifo N.P., Yang J.C., Morgan R.A., Dudley M.E. (2008). Adoptive cell transfer: a clinical path to effective cancer immunotherapy. Nat. Rev. Cancer. 8, 299–308;
- Ярилин А.А. Иммунология. М.: ГЭОТАР-Медиа, 2010. — 752 с.;
- Kershaw M.H., Westwood J.A., Darcy P.K. (2013). Gene-engineered T cells for cancer therapy. Nat. Rev. Cancer. 13, 525–541;
- Gross G., Waks T., Eshhar Z. (1989). Expression of immunoglobulin-T-cell receptor chimeric molecules as functional receptors with antibody-type specificity. Proc. Natl. Acad. Sci. USA. 86, 10024–10028;
- Urba W.J. and Longo D.L. (2011). Redirecting T cells. N. Engl. J. Med. 365, 754–757;
- Emily Whitehead Foundation;
- Regalado A. (2015). Biotech’s coming cancer cure. MIT Technology Review;
- Farley P. (2015). ‘Remote control’ of immune cells opens door to safer, more precise cancer therapies. University of California San Francisco;
- Wu C., Roybal K.T., Puchner E.M., Onuffer J., Lim W.A. (2015). Remote control of therapeutic T cells through a small molecule-gated chimeric receptor. Science. 350, aab4077..
Источник
Раковые клетки часто образно называют клетками-бунтарями или клетками с асоциальным поведением. Они «живут для себя», не считаясь с интересами соседей и всего организма: бесконтрольно размножаются, не реагируют на молекулярные сигналы извне, не выполняют полезные функции и могут на свое усмотрение перемещаться в организме. Когда их достаточно много, они образуют злокачественную опухоль, и у человека диагностируют рак.

Чем раковые клетки отличаются от нормальных?
Для того чтобы организм человека правильно работал как единое целое, каждая клетка в нем должна подчиняться общим правилам и обладать некоторыми основополагающими свойствами:
- находиться в отведенном ей месте: это обеспечивается за счет клеточной адгезии, то есть способности клеток «слипаться» между собой;
- размножаться только тогда, когда это необходимо;
- специализироваться на выполнении определенных функций: для этого каждая клетка сознательно себя ограничивает, активирует одни гены и «отключает» другие;
- «чинить» свою ДНК, если в ней произошли «поломки», мутации;
- совершить «самоубийство», если в ней произошли непоправимые патологические изменения, или если она «состарилась».
Во многом эти функции обеспечиваются за счет того, что клетки в организме постоянно «общаются» между собой и реагируют на определенные сигнальные молекулы. Раковая клетка эти сигналы игнорирует. Она начинает жить так, как будто она тут одна и не должна считаться с интересами соседей:
Не перестает размножаться. Сколько бы своих копий ни создала опухолевая клетка, она не останавится. Злокачественная опухоль постоянно растет и распространяется в организме.
Не слипается с соседними клетками. На поверхности «бунтарей» исчезают молекулы, которые удерживают их в нужном месте среди соседей. За счет этого раковая клетка может отрываться от первичной опухоли и путешествовать по организму. Во время этого путешествия она погибает или оседает в каком-нибудь органе, создает свои клоны и образует новый опухолевый очаг — метастаз.
Не специализируются. Раковая клетка не становится специализированной и не выполняет полезные для организма функции. Процесс клеточной специализации называется дифференцировкой. Чем ниже степень дифференцировки, тем агрессивнее ведет себя рак.
Не «ремонтируют» свою ДНК. В итоге в опухолевых клетках накапливается все больше мутаций, они становятся менее дифференцированными и быстрее размножаются. Они не подвержены апоптозу — запрограммированной клеточной смерти.
При предраковых состояниях клетки тоже теряют свойства нормальных. Но они отличаются и от раковых, в первую очередь тем, что не могут распространяться в организме.
Особая разновидность злокачественных опухолей — так называемый «рак на месте» (in situ). Клетки уже являются раковыми, но пока еще не распространились за пределы своей изначальной локализации. Технически карцинома in situ — не рак, но ее принято рассматривать как самую раннюю стадию рака.
Каковы причины появления раковых клеток?
Почему в теле конкретного человека возникли раковые клетки — вопрос во многом риторический.
Каждая живая клетка функционирует и размножается в соответствии с заложенной в ней генетической информацией. При возникновении определенных мутаций эти тонкие механизмы регуляции сбиваются, и может произойти злокачественное перерождение.
Сложно сказать, что именно привело к таким мутациям в каждом конкретном случае. Современным врачам и ученым известны лишь факторы риска, которые повышают вероятность злокачественного перерождения и развития заболевания. Вот основные из них:
- Неблагоприятная экологическая ситуация.
- Курение.
- Чрезмерное употребление алкоголя.
- Профессиональные вредности, контакт с канцерогенными веществами и различными излучениями на производстве.
- Ожирение, избыточная масса тела.
- Ультрафиолетовое излучение солнца и соляриев.
- Малоподвижный образ жизни.
- Возраст: со временем мутации накапливаются, поэтому вероятность возникновения в организме раковых клеток повышена у пожилых людей.
- Нездоровое питание: преобладание в рационе животных жиров, красного и обработанного мяса.
Ни один из этих факторов не приводит со стопроцентной вероятностью к развитию злокачественной опухоли.
Какие бывают типы генов рака?
Не все мутации одинаково опасны. К раку приводят те, которые возникают в определенных генах:
Онкогены активируют размножение клеток. Злокачественное перерождение происходит, когда они становятся слишком активны. В качестве примера можно привести ген, который кодирует белок HER2. Этот белок-рецептор находится на поверхности клетки и заставляет ее размножаться.
Гены-супрессоры опухолей сдерживают размножение клеток, восстанавливают поврежденную ДНК, вызывают апоптоз — запрограммированную клеточную смерть. Примеры таких генов: BRCA1, BRCA2, TP53 (кодирует белок p53 — «страж генома», который запускает апоптоз в поврежденных клетках).
Мутации, которые приводят к раку, могут быть наследственными (возникают в половых клетках) и соматическими (возникают в клетках тела в течение жизни).

Основные характеристики и строение раковых клеток
Раковые клетки обладают тремя основополагающими характеристиками, за счет которых так опасны онкологические заболевания:
- Способность к бесконтрольному размножению.
- Способность к инвазии — прорастанию в окружающие ткани.
- Способность к метастазированию — распространению в организме и образованию новых очагов в различных органах.
Не всякая опухолевая клетка — раковая. Раком или карциномой называют злокачественные опухоли из эпителиальной ткани, которая выстилает кожу, слизистые оболочки внутренних органов, образует железы. Из соединительной ткани (костной, жировой, мышечной, хрящевой, кровеносных сосудов) развиваются саркомы. Злокачественные заболевания органов кроветворения называют лейкозами. Опухоли из клеток иммунной системы — лимфомы и миеломы.
Как выглядят раковые клетки под микроскопом?
Если коротко, то они сильно отличаются от нормальных, тех, что ожидает увидеть патологоанатом, когда рассматривает под микроскопом фрагмент ткани. Раковые клетки имеют более крупные или мелкие размеры, неправильную форму, аномальное ядро. Если нормальные клетки в одной ткани все примерно одинаковых размеров, то раковые зачастую разные. Ядро содержит очень много ДНК, поэтому оно крупнее (его размеры тоже вариабельны), а при окрашивании специальными веществами выглядит более темным.
Из нормальных клеток образуются определенные структуры, например, железы. Раковые клетки располагаются более хаотично. Например, они образуют железы искаженной, неправильной формы или непонятные массы, которые на железы совсем не похожи.
Как развиваются раковые клетки, какие этапы проходят в своем развитии?
Раковые опухоли растут за счет деления клеток, которые входят в их состав. Во время деления злокачественная клетка образует две своих копии, таким образом, рост происходит в геометрической прогрессии. Например, для того чтобы образовалась опухоль размером 1 см, нужно около 30 удвоений. Через 40 удвоений новообразование достигает веса 1 кг, и этот размер считается критическим, смертельным для пациента.
Согласно современным представлениям, за рост злокачественной опухоли отвечают так называемые стволовые опухолевые клетки. Они активно делятся, в то время как другие опухолевые клетки просто существуют. Современные ученые заняты поиском методов лечения, направленных против этих стволовых клеток.
Время удвоения опухолевых клеток бывает разным. Например, при лейкозе это происходит за 4 дня, а при раковых новообразованиях толстой кишки — за 2 года. Проходит много времени, прежде чем опухоль достигнет настолько больших размеров, что станет проявляться какими-либо симптомами. Например, если у онкологического больного появились некоторые жалобы, и после этого он прожил год, вероятно, опухоль в его организме на момент появления жалоб существовала уже около трех лет, просто он об этом не знал.
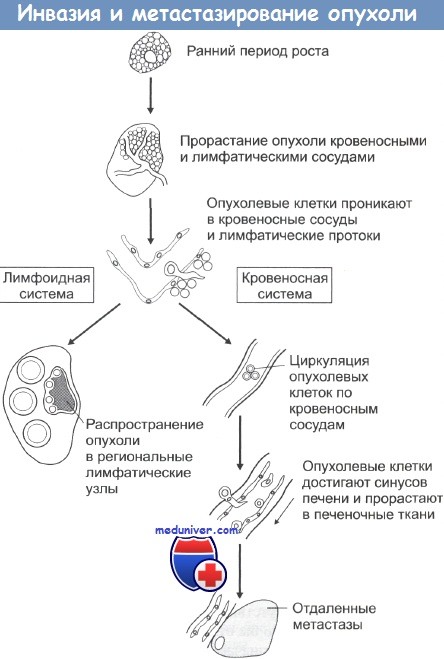
Пока раковая опухоль небольшая, ей вполне хватает кислорода. Но по мере роста она все сильнее испытывает кислородное голодание — гипоксию. Чтобы обеспечить свои потребности, опухолевые клетки вырабатывают вещества, которые стимулируют образование кровеносных сосудов — ангиогенез.
По мере роста опухоли происходит инвазия — распространение раковых клеток в окружающие ткани. Они вырабатывают ферменты, которые разрушают нормальные клетки.
Некоторые из них отрываются от материнской опухоли, проникают в кровеносные и лимфатические сосуды, образуют в них вторичные очаги — метастазы. В этом самая главная опасность злокачественных опухолей. Именно метастатические очаги становятся причиной гибели многих онкологических пациентов.
Ликвидация раковых клеток: что помогает их уничтожить?
С раковыми клетками можно бороться разными способами. Например, удалить их из организма хирургическим путем. Но это возможно лишь в случаях, если опухоль не успела сильно распространиться в организме. Даже если можно выполнить радикальную операцию, никогда нет стопроцентной гарантии того, что в организме не остались микроскопические опухолевые очаги, которые в будущем станут причиной рецидива. Поэтому зачастую хирургические вмешательства дополняют адъювантной и неоадьювантной терапией.
Другие методы лечения:
- Химиопрепараты обладают разными механизмами действия, но все они сводятся к повреждению и уничтожению быстро размножающихся клеток. В первую очередь, конечно же, раковых, но страдают и некоторые нормальные ткани, из-за этого могут возникать серьезные побочные эффекты.
- Лучевая терапия действует аналогично химиопрепаратам, поражая быстро размножающиеся клетки.
- Таргетные препараты воздействуют на молекулы, которые помогают раковым клеткам быстро размножаться, выживать и защищаться от иммунной системы. Например, существуют блокаторы HER2, о котором речь шла выше, ингибиторы VEGF — вещества, с помощью которого опухолевые клетки «выращивают» для себя кровеносные сосуды.
- Иммунотерапия помогает иммунной системе обнаруживать и уничтожать опухолевые клетки.
В Европейской клинике применяются наиболее современные оригинальные препараты для борьбы с раком. У нас есть возможность провести молекулярно-генетический анализ опухолевой ткани, разобраться, из-за каких мутаций клетки стали злокачественными, и назначить наиболее эффективную персонализированную терапию. Свяжитесь с нами, мы знаем, как помочь.
Источник