Биопсия молочной железы и биопсия лимфоузла
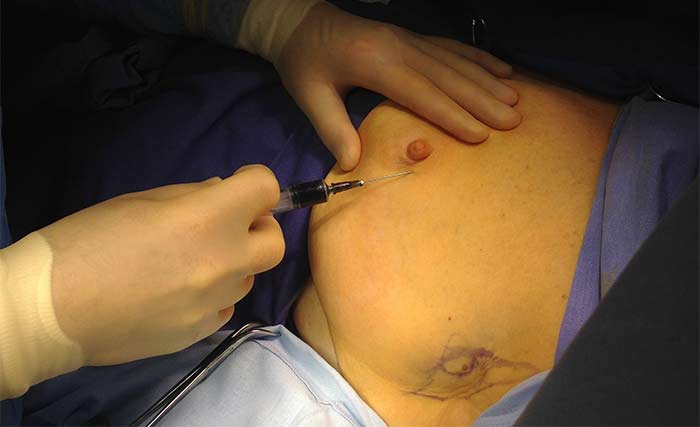
Органосохраняющие операции при раке молочной железы
В последние годы рак молочной железы все чаще удается диагностировать на ранней стадии, когда опухоль еще не начала метастазировать и лимфоузлы не поражены. Для таких пациентов «классическое» удаление органа со всеми лимфатическими узлами совершенно не оправдано и является избыточной, калечащей процедурой.
Ранее стандартной практикой считалось удаление всей ткани молочной железы, лимфоузлов и даже мышц.
Благодаря современным достижениям хирургической онкологии в рутинную практику вошли органосохраняющие операции, позволяющие не только сохранить орган — железу, мышцу, но и лимфоузлы с помощью внедрения метода биопсии сигнальных (сторожевых) лимфатических узлов. Сохранение подмышечных лимфоузлов позволило избежать калечащих осложнений в виде ограничения подвижности руки.
Тысячи пациенток избежали избыточной хирургической агрессии и удаление у них раковой опухоли не привело к удалению груди.
Лимфатическая система молочной железы
Как известно, злокачественные опухоли обладают способностью метастазировать. Молочная железа отличается обилием лимфатических сосудов и разнообразием путей возможного оттока лимфы, которая является одним из главных путей распространения опухолевых клеток.
Долгое время основным способом предотвращения возникновения вторичных опухолей, распространяемых по лимфотоку, считалось удаление ближайших узлов – в подмышечной впадине, под ключицей, под лопаткой.
Как же определить, какие узлы поражены метастазами и их действительно нужно удалять? В одной только подмышечной впадине их может быть от 14 до 45.
Суть методики биопсии сигнальных лимфатических узлов
Биопсия сигнальных лимфатических узлов – один из современных методов ранней диагностики метастазов. Его суть сводится к тому, чтобы определить состояние подмышечных лимфоузлов, найти и провести исследование сторожевого лимфоузла, — являющегося первым на пути лимфооттока.
Если в нем метастазы отсутствуют, то их нет с высокой долей вероятности и во всем региональном коллекторе. В этом случае, дальнейшее вмешательство не требуется.
Методика биопсии сигнальных лимфатических узлов (БСЛУ) признана во всем мире и является стандартом хирургического лечения Европейской Организации по Изучению и Лечению Рака (EORTC).
Показания и противопоказания для проведения биопсии сигнальных узлов
В настоящее время БСЛУ проводят:
- если у пациента диагностируется ранний рак молочной железы
- отсутствуют признаки метастазирования
- для уточнения статуса лимфоузлов перед системным лечением
Противопоказаниями для данной манипуляции принято считать метастатический и воспалительный РМЖ.
Как проходит операция с БСЛУ
Методика биопсии сигнальных лимфатических узлов основана на активном накоплении сигнальными лимфатическими узлами радиоактивных коллоидных частиц, введенных в опухоль.
Как правило, перед операцией выполняется лимфосцинтиграфия — для анатомического определения нахождения сигнального лимфоузла и контроля прохождения радиоизотопа.
Для этого, чтобы найти сторожевой лимфатический узел, в молочную железу вводится радиофармпрепарат, то есть множество частиц, помеченных радиоактивным изотопом. Инъекция радиоизотопа может проводиться за 2-24 часа до операции, на практике ее обычно выполняют накануне.
Сторожевой лимфатический узел выявляется непосредственно во время операции и тогда же принимается решение о дальнейшей тактике лечения.
Меченые частицы двигаются по лимфопутям, скапливаются в первом узле на пути лимфооттока, и указывают врачам, что это и есть сигнальный лимфатическом узел. Его можно увидеть с помощью гамма-камеры, отслеживающей меченые частицы.

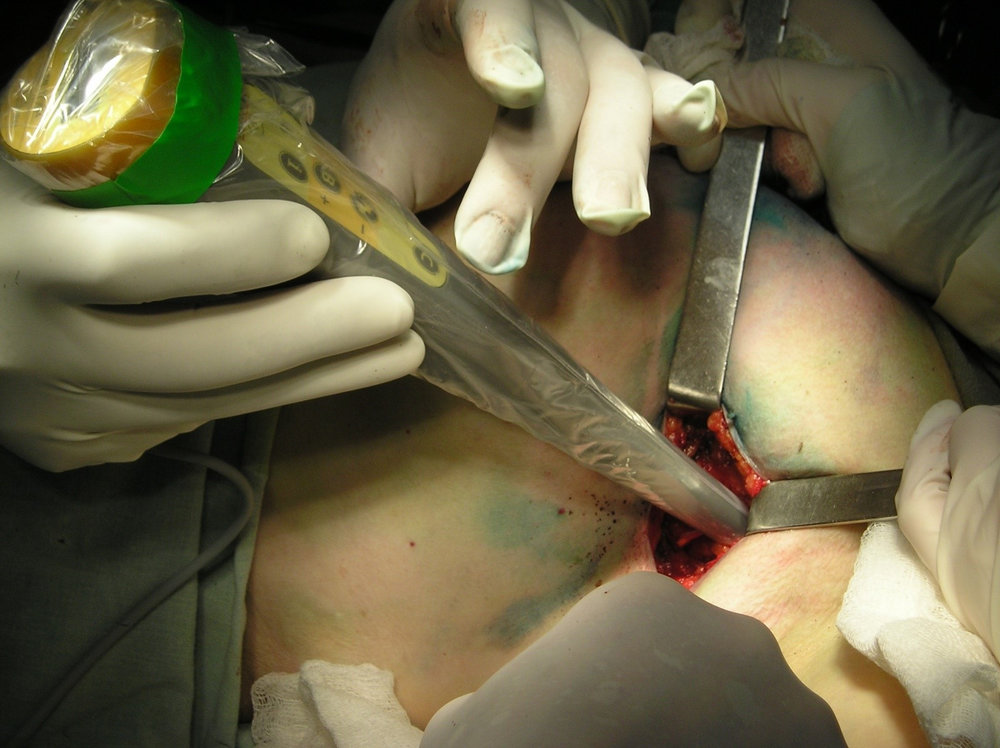
Хирург выполняет удаление этого узла через небольшой разрез на коже при помощи гамма-зонда, то есть минимально травматично для пациента.
Удаленная ткань сразу же передается для исследования морфологу. Информация, которую хирург получает во время операции, дает возможность принять решение о дальнейшем лечении.
Если гистология показывает, что в лимфатическом узле нет метастазов, то рану зашивают, на теле остаются лишь небольшие косметические рубцы.
Если в результате гистологического исследования обнаруживаются злокачественные изменения в лимфоузлах, может понадобиться расширенная операция. Она выполняется сразу же, во время одного наркоза.
Удаленные лимфатические узлы всегда отправляют также и на расширенное гистологическое исследование в лабораторию, как правило эти результаты совпадают со срочным исследованием.
В настоящее время биопсия сигнальных лимфатических узлов относится к числу базовых методов диагностики поражения регионарных лимфатических узлов при РМЖ и рекомендуется экспертами международного противоракового союза в качестве стандартного метода при определении степени распространенности процесса у больных раком молочной железы.
Возможность сохранить молочную железу и лимфоузлы в процессе лечения РМЖ является крупнейшим достижением мировой клинической онкологии.
Для уточнения характера и объема хирургического вмешательства, следует обратиться к своему лечащему врачу, в большинстве случаев при раннем раке молочной железы можно избежать калечащей операции.
Источник
Лимфососудистая инвазия происходит, когда раковые клетки попадают в лимфатические и/или мелкие кровеносные сосуды. Как правило, вначале развивается ингиолимфатическая инвазия, а затем раковые клетки распространяются на лимфатические узлы. В первую очередь поражаются сосуды и узлы, которые дренируют ткань-место развития опухоли.
Считается, что лимфососудистая инвазия указывает на более агрессивную опухоль.
Оценка лимфатических узлов
Если лимфатические узлы в подмышечной области (подмышечные лимфатические узлы) были удалены во время операции, патолог смотрит на них под микроскопом и определяет, содержат ли они рак.
- Отсутствие лимфатических узлов означает, что ни один из подмышечных лимфатических узлов не содержит рака.
- Наличие лимфатических узлов означает, что по крайней мере один подмышечный лимфатический узел содержит рак.
![]() Подмышечные лимфатические узлы
Подмышечные лимфатические узлы
В целом, рак молочной железы с отрицательными лимфатическими узлами имеет лучший прогноз, чем с положительными.
Во время операции по поводу инвазивной опухоли молочной железы (но это может быть и протоковая карцинома in situ (DCIS)) удаляют один лимфатический узел (или несколько – лимфодиссекция) подмышечной области. Или проводится биопсия сторожевого узла. Лимфоузлы, расположенные в подмышечной области – первое место распространения опухолевых клеток, поэтому их проверяют в первую очередь. После этого патологоанатом проверяет, содержат ли они опухолевые клетки:
- отрицательные лимфоузлы, означает, что ни один узел не содержит патологических клеток;
- положительные лимфоузлы означает, что по крайней мере один узел содержит патологические клетки.
Этот показатель влияет как на определение стадии рака, так и на прогноз.
Биопсия сторожевых узлов
Чтобы увидеть, распространилась ли злокачественная опухоль по лимфатической системе, в большинстве случаев проводится процедура, называемая биопсией сторожевых узлов. Исключение составляют воспалительный и метастатический рак молочных желез. Процедура проводится следующим образом:
- До биопсии в железу вводят радиоактивное вещество (называемое индикатором) и/или синий краситель.
- Первые лимфоузлы, поглощающие индикатор или краситель, называются сторожевыми узлами. Это также первое место, куда раковая опухоль, вероятно, распространится.
- Хирург находит сторожевые узлы поглотившие индикатор при помощи специального устройства, называемого гамма-зондом (или поглотившие краситель, окрашивающий лимфоузлы в синий цвет).
- С помощью радиоактивного индикатора/синего красителя обычно идентифицируют 1-5 узлов как сторожевые узлы. Хирург их удаляет, затем отправляет их к патологоанатому.
- Сразу после процедуры, пока длится операция по резекции опухоли, патологоанатом должен проверить узлы на наличие раковых клеток.
- Когда результат отрицательный, проводят ушивание ран, больше ничего не требуется.
- Если результат положительный, проводится диссекция.
- В любом случае всегда лимфоузлы отправляют на расширенное патологическое исследование после операции. Если результаты со срочными не совпадают, принимается решение о повторном вмешательстве, во время которого удаляют дополнительные узлы и снова исследуют.
Поскольку биопсия сторожевого узла по сравнению с диссекцией менее травматичная процедура без риска лимфедемы, ее рекомендуют к использованию.
Сторожевой лимфатический узел
Биопсия сторожевого узла
Результаты биопсии сторожевого узла
Если лимфатический узел отрицательный, то ни один из сторожевых узлов не содержит рака. Это значит, что другие лимфоузлы не поражены и операция по удалению большего количества лимфатических узлов не потребуется.
Если лимфатический узел-положительный (по крайней мере один сторожевой узел) содержит рак, дополнительные лимфатические узлы удаляются с помощью процедуры, называемой подмышечной лимфодиссекцией. Цель данной операции – проверить, сколько лимфатических узлов имеют опухолевые клетки, и уменьшить вероятность распространения в лимфатические узлы.
Некоторые пациентки с 1-2 положительными сторожевыми узлами, которым предстоит лампэктомия и в последующем лучевая терапия могут не нуждаться в подмышечной диссекции. Лучевая терапия всей молочной железы обрабатывает также часть подмышечной области. Большинство пациентов с одним или несколькими положительными сторожевыми узлами, перенесших мастэктомию, нуждаются в подмышечной диссекции.
Лампэктомия
Мастэктомия
Наиболее распространенным методом оценки патологического состояния лимфатических узлов является окрашивание H&E. В прошлом иммуногистохимия иногда использовалась для оценки состояния лимфатических узлов. Однако исследования показали, что небольшие отложения опухолевых клеток, идентифицированные ИГХ, не были полезны в прогнозе. Поэтому иммуногистохимия больше не рекомендуется для оценки состояния лимфатических узлов, за исключением случаев, когда результаты окрашивания H&E являются неопределенными.
Другая информация в отчете о патологии
Следующие элементы включены во все отчеты о патологии, но не влияют на прогноз или лечение.
- Информация о пациенте
В этом разделе отчета содержится основная информация, включая ФИО, номер медицинской карты, дату рождения, возраст и пол, дату биопсии и имя врача, заказавшего отчет (чаще всего хирурга).
Рекомендуется проверить эту информацию, чтобы убедиться, что это правильный отчет о патологии.
2. Полученный (ые) образец (ы) (источник образца/образец представлен)
В этом разделе записывается место молочной железы, откуда был взят образец (ы) биопсии.
Он может просто указывать левую или правую грудь, или может давать более подробную информацию.
Он также включает дату получения ткани патологом.
3. Процедура (описание процедуры)
Это описание типа биопсии, используемой для удаления образца ткани и лимфатических узлов (если лимфатические узлы были удалены).
- Трепан-биопсия или хирургическая (инцизионная или эксцизионная) биопсия опухолевой ткани
- Биопсия сторожевого узла или подмышечная диссекция лимфатических узлов.
4. История болезни (клиническая информация/клинический диагноз/предоперационный диагноз)
История болезни описывает первоначальный диагноз перед биопсией, а иногда и краткое изложение симптомов.
Также отмечается место биопсии опухоли (например, левая или правая железа).
Если у пациента в прошлом был рак и доступны результаты проведенной биопсии, патолог часто просматривает эту ткань, чтобы отличить рецидив прошлой опухоли от новой опухоли.
5. Общее описание (макроскопическое описание)
Первое, что делают патологи при получении биопсии ткани, – это проводят измерения и записывают описание ткани, как она выглядит невооруженным глазом (без микроскопа).
Это общее описание включает размер, вес, цвет, текстуру или другие характеристики ткани и любые другие визуальные примечания.
Если имеется несколько образцов/выборок, для каждого из них часто выделен отдельный раздел с общим описанием. В этих случаях патологоанатом присваивает каждому образцу ткани ссылочный номер или букву, чтобы избежать путаницы.
Общее описание также включает информацию о том, как обрабатывали образец до и после того, как он был доставлен патологу.
6. Подпись патологоанатома
Патологоанатом подписывает и датирует отчет (чаще всего в электронном виде).
Информация, которую иногда можно увидеть в отчете о патологии
Следующие элементы не влияют на прогноз или лечение и могут не отображаться в отчете.
Некоторые из этих тестов проводятся только при определенных диагнозах. Другие обычно не проводятся, потому что не предсказывают прогноз лучше, чем стандартные меры, или потому, что они не являются надежными показателями для всех опухолей.
- Иммуногистохимия (ИГХ) для прогностических маркеров. Помимо тестирования статуса HER2, ИГХ позволяет обнаруживать другие молекулярные маркеры, которые могут дать информацию о прогнозе.
- Скорость распространения (Ki-67, MIB1). Скорость пролиферации – это процент активно делящихся раковых клеток. В целом, чем выше скорость распространения, тем более агрессивной может быть опухоль.
Скорость пролиферации может быть хорошим предиктором прогноза. Но исследование проводится в некоторых медицинских центрах и не относится к стандартным.
Тест Ki-67 – это распространенный способ измерения скорости распространения. Когда клетки растут и делятся (пролиферируют), они производят белки, называемые антигенами пролиферации. Ki-67 – антиген пролиферации.
Типы реакций клеток с маркером Ki67
Гетерогенное распределение реакции с маркером ki67 в опухоли
Краевое распределение реакции с маркером ki67 в опухоли
MIB1 – это антитело, наиболее часто используемое для мечения антигена Ki-67. Чем больше клеток MIB1 прикрепляется к образцу ткани, тем больше вероятность быстрого роста и деления опухолевых клеток.
Результат этого теста указывается как процент Ki-67-положительных клеток (доля раковых клеток в процессе деления). Более высокое значение указывает на более высокую скорость распространения.
Продолжение статьи
- Часть 1. Расшифровка отчета о патологии опухолей молочных желез. Диагноз, степень злокачественности.
- Часть 2. Расшифровка отчета о патологии опухолей молочных желез. Статус гормональных рецепторов, HER2/neu.
- Часть 3. Отчет о патологии опухолей молочных желез. Оценка лимфатических узлов. Другая информация.
Источник
Больным раком молочной железы cT1-4N0M0 необходимо выполнение биопсии сигнального лимфатического узла. Биопсия сигнального лимфатического узла с использованием флуоресцентной лимфографии является современной технологией, имеющей очень высокую частоту нахождения сигнального лимфатического узла. Однако, частота ложноотрицательных ответов при использовании этой технологии адекватно не оценена, что и явилось целью нашего исследования. Было оперировано 99 больных со 100 случаями рака молочной железы cT1-4N0M0. Подмышечный этап операции состоял из биопсии сигнального лимфатического узла с использованием флуоресцентной лимфографии и лимфаденэктомии I–II или I—II—III уровней. Сигнальный лимфатический узел был найден в 98 случаях (98%). В 28 случаях из 98 (28,6%) были обнаружены метастазы в лимфатических узлах. У больных с N+ метастатическое поражение других лимфатических узлов кроме сигнальных присутствовало только в 35,7%. Ложноотрицательный результат наблюдался в 1 случае из 28 (3,6%). Применение флуоресцентной лимфографии с индоцианином зелёным позволяет производить биопсию сигнального лимфатического узла с высокой частотой обнаружения лимфатического узла и низкой частотой ложноотрицательных результатов.
Введение
Биопсия сигнального лимфатического узла (СЛУ) при раке молочной железы (РМЖ) с cN0 является стандартной операцией в странах с развитой медициной и интенсивно осваиваемой онкологами Российской Федерации. Безопасность биопсии СЛУ была доказана в рандомизированных исследованиях, ставших фундаментальными для этого раздела онкомаммологии [7, 20, 21, 25, 15], а также в метаанализе рандомизированных исследований [18]. Ограничение объёма вмешательства на подмышечных лимфатических узлах биопсией СЛУ узла привело к резкому снижению частоты осложнений, связанных с подмышечной лимфаденэктомией и, прежде всего, частоты лимфостаза верхней конечности [22].
К новым технологиям поиска СЛУ относится технология флуоресцентной лимфографии с использованием зелёного индоцианина. Зелёный индоцианин обладает способностью к флуоресценции. Пик поглощаемого излучения имеет длину волны около 780 нм, испускаемое излучение (в инфракрасном спектре) имеет длину волны около 830 нм. Флуоресценция проникает через ткани толщиной не более 10 мм. Флуоресцентная лимфография не уступает радионуклидной технологии по частоте нахождения СЛУ (94-100%), однако адекватность первой почти не оценена по показателю частоты ложноотрицательных заключений [5,12,14,23,24].
Целью нашей работы было изучение возможности биопсии СЛУ методом флуоресцентной лимфографии с оценкой основных диагностических характеристик метода: частоты нахождения СЛУ и частоты ложноотрицательных ответов.
Материалы и методы
Было оперировано 99 больных со 100 случаями рака молочной железы cT1-4N0M0 (T1 — 43, T2 — 55, T3 — 1, T4 — 1). Во всех случаях диагноз инфильтративного рака был подтверждён гистологически. 12 больных получали предоперационную химиотерапию, 8 — предоперационную гормонотерапию. Подмышечный этап операции состоял из биопсии СЛУ с использованием флуоресцентной лимфографии и лимфаденэктомии I–II или I—II—III уровней.
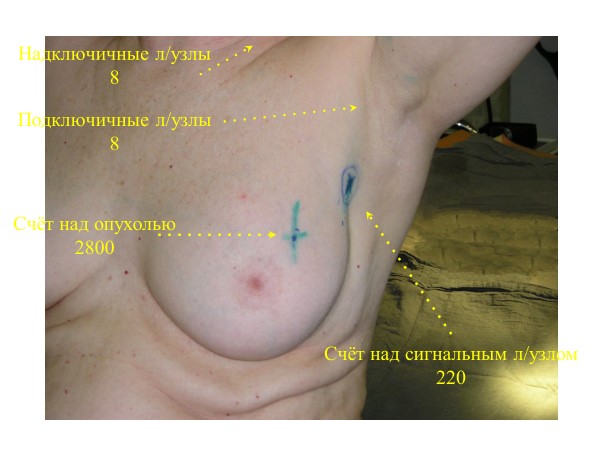
Прибор Photodynamic Eye C9830 (Hamamatsu Photonics K.K) использовался для генерации возбуждающего инфракрасного излучения и регистрации ответной флуоресценции. Флуоресцентное изображение передавалось на экран компьютера. Биопсия СЛУ производилась под наркозом как первый этап операции. Зелёный индоцианин в виде водного раствора (5 мг/мл) в объёме 2 мл вводился внутрикожно и подкожно по наружному краю ареолы молочной железы или над опухолью (рисунок 1).

Рисунок 1. Ведение индоцианина зелёного (0 мин.)
Через 2-5 минут можно было видеть флуоресцентное изображение лимфатического пути, идущего к подмышечной области (рисунок 2). Изображение на экране компьютера было видно в режиме реального времени, что позволяло зарисовывать на коже пациентки изображение лимфатического протока. Изображение лимфатического узла через не рассечённые ткани удавалось увидеть менее, чем в 10%.
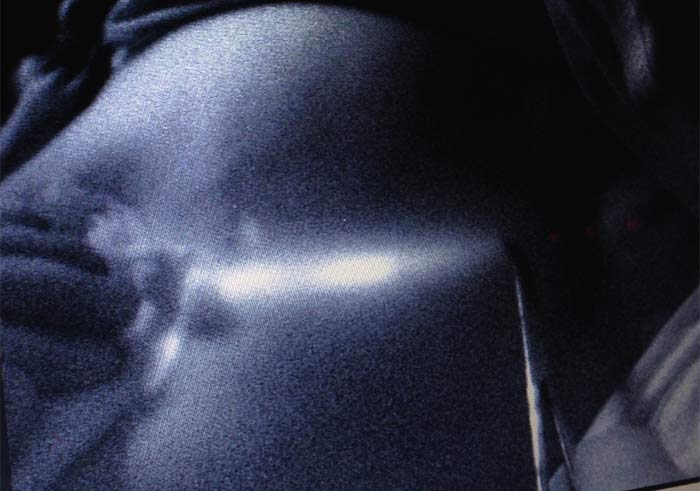
Рисунок 2. Получение изображения доминирующего пути лимфооттока (3 мин.)
Место «обрыва» лимфатического протока, видимого сквозь кожу, являлось ориентиром для поиска сигнального лимфатического узла в глубине тканей подмышечной области. Для этого было необходимо рассечение, как минимум, кожи, подкожной клетчатки и поверхностной фасции (рисунок 3). Технической ошибкой, допущенной дважды, являлась попытка проследить ход флуоресцирующего лимфатического протока в ране. Повреждение протока приводило к излиянию зелёного индоцианина из протока в рану и беспорядочному прокрашиванию тканей. Флуоресцирующий участок тканей в таких случаях был ошибочно принят за СЛУ, и при гистологическом исследовании в этих 2 случаях лимфатический узел не был обнаружен. Для исключения подобной ошибки, нужно было представить локализацию лимфатического узла, в который впадает лимфатический проток, и оперативный доступ к этому СЛУ осуществлять со стороны противоположной впадению лимфатического протока в СЛУ.
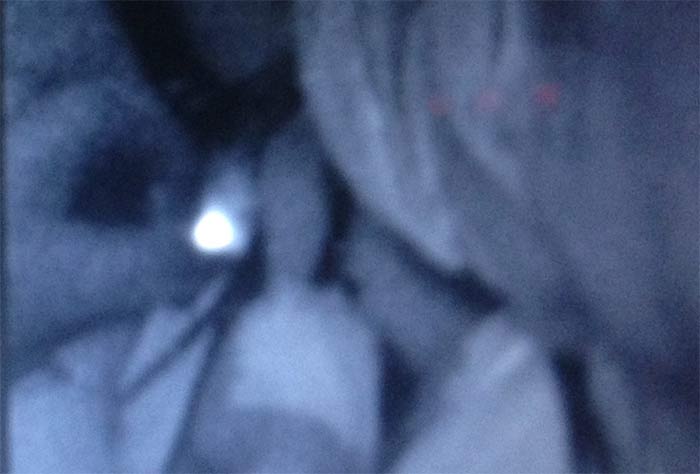
Рисунок 3. Флуоресцирующий узел в ране (6 мин.)
После удаления СЛУ контролировалась его флуоресценция (рисунок 4), в ране контролировалось наличие или отсутствие дополнительных лимфатических узлов как с помощью поиска флуоресценции, так и пальпаторно. И флуоресцирующие и пальпируемые лимфатические узлы расценивались как сигнальные и отправлялись на срочное гистологическое исследование по замороженным срезам с окраской гематоксилином и эозином. На собственно биопсию СЛУ уходило 15-30 минут и ещё такое же время на гистологическое исследование.
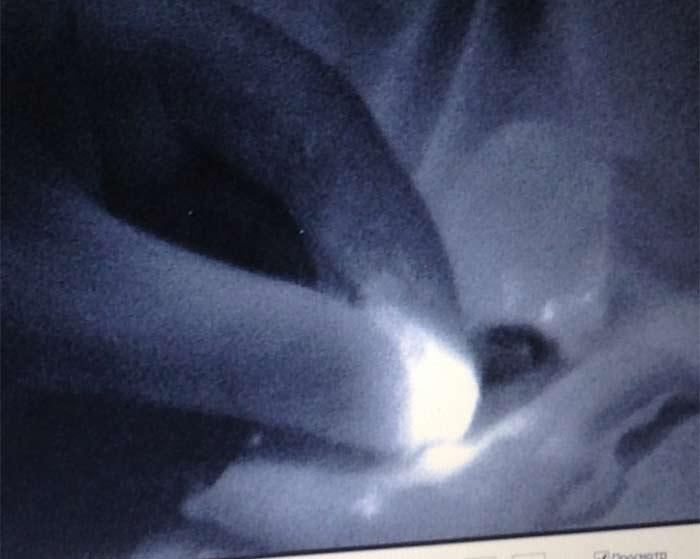
Рисунок 4. Флуоресцирующий узел на препарате (14 мин.)
Результаты
Флуоресцирующий через кожу лимфатический проток был виден во всех 100 случаях, а флуоресцирующий лимфатический узел, — менее, чем в 10%. Обычно последний становился виден в ране после рассечения кожи, подкожной клетчатки, поверхностной и собственной фасций. СЛУ был найден в 98 случаях (98 %). Среднее количество лимфатических узлов, удалённых как сигнальные, = 1,9±0,1 (1-7 узлов). Среднее количество лимфатических узлов, удалённых при лимфаденэктомии, = 10,5±0,5 (5-26 узлов). В 28 случаях из 98 (28,6%) были обнаружены метастазы в лимфатических узлах. У больных с N+ метастатическое поражение других лимфатических узлов кроме сигнальных присутствовало только в 35,7%. По данным интраоперационного гистологического исследования ложноотрицательный результат наблюдался в 3 случаях из 28, по данным планового гистологического исследования — в 1 случае из 28 (3,6%). Чувствительность составила 96,4%, специфичность — 100%, точность — 99,0% (97 правильных заключений из 98). Не наблюдалось аллергических реакций или других побочных эффектов и осложнений при введении индоцианина зелёного.
Обсуждение
Gould E.A. et al. были первыми, кто обосновал и применил на практике хирургическую тактику биопсии СЛУ. У больных раком околоушной слюнной железы лимфатический узел, находящийся в месте слияния передней и задней лицевых вен, по наблюдению авторов являлся сигнальным. Приводятся сведения о 9 больных, оперированных в 1951-1957 гг. СЛУ удалялся и исследовался интраоперационно гистологически. При нахождении в нём метастаза, производилась радикальная шейная диссекция, если СЛУ не был поражён, диссекция не выполнялась. Четверо больных, которым радикальная шейная диссекция не выполнялась, были прослежены от 2 до 8 лет без признаков рецидива [11]. Нахождение и морфологическая оценка состояния СЛУ, — лимфатического узла, первым воспринимающим лимфу от поражённого злокачественной опухолью органа, позволяют оценить вероятность метастатического поражения других лимфатических узлов. В случае отсутствия такого поражения, — с высокой степенью достоверности предвидеть отсутствие метастазов в последующих лимфатических узлах и отказаться от их удаления без ущерба для эффективности противоопухолевого лечения. Такова концепция биопсии СЛУ, изложенная R. Cabanas в 1977 г. Для поиска СЛУ у больных раком полового члена автор применял рентгеновскую лимфографию с использованием контраста, вводимого в лимфатический сосуд полового члена [6].
Применительно к раку молочной железы речь идёт о сохранении подмышечных лимфатических узлов и предотвращении осложнений, связанных с подмышечной лимфаденэктомией: лимфатическим отёком верхней конечности, лимфатическим отёком молочной железы (при органосохраняющих операциях), нарушением кожной чувствительности на плече и в подмышечной области. Первоначально биопсия СЛУ применялась у больных РМЖ сT1-2N0M0, в настоящее время показания к её использованию ставятся значительно шире: она применима в тех случаях, когда по данным клинического обследования (пальпация, УЗИ ± тонкоигольная биопсия) отсутствуют признаки метастатического поражения подмышечных лимфатических узлов исходно, то есть, cN0 (не ограничиваясь T1-2); либо после эффективной предоперационной системной терапии cN1-3→ «N0» [8,9], а также при выполнении мастэктомии по поводу протокового рака in situ [4].
Общепринятая в настоящее время технология поиска СЛУ основана на радионуклидной маркировке лимфатических узлов с использованием радиофармпрепаратов, включающих 99mTc. Средний размер частиц радиофармпрепарата может колебаться от 3 до 400 nm [10], однако использование частиц размером менее 100 нм позволяет более успешно находить СЛУ [2, 3]. Большинство методических вопросов отработано при исследованиях с использованием радионуклидной методики. Показано, что место введения лимфотропного препарата: перитуморальное, подкожное над опухолью, периареолярное, внутрикожное в ареолу, субареолярное не имеют значения, любой из них позволяет осуществить успешный поиск СЛУ. Мультицентричность опухоли, предшествующая эксцизионная биопсия опухоли не мешают выполнению биопсии СЛУ [10]. Адекватность технологии поиска подтверждается высокой частотой обнаружения СЛУ (>90%) и низкой частотой ложноотрицательных заключений (<10%). Частота ложноотрицательных заключений является главной характеристикой метода, она демонстрирует, с какой частотой метастатически поражённые лимфатические узлы остаются не удалёнными у пациентов, которым выполняется только биопсия СЛУ. Первое исследование диагностических возможностей поиска СЛУ в России с использованием радиофармпрепарата и красителя было успешным, частота обнаружения СЛУ составила 91,4%, ложноотрицательные ответы получены в 6,4% [1].
Из новых технологий поиска СЛУ можно отметить появление радиофармпрепарата, содержащего молекулу таргетного действия по отношению к Т-лимфоцитам и дендритным клеткам в лимфатических узлах [99mTc-tilmanocept (Lymphoseek®)]. Такой механизм действия и малый размер частиц (7 нм) позволяет радиофармпрепарату быстро попадать в СЛУ и надолго там задерживаться [19]. Технология с использованием наночастиц супер парамагнитного оксида железа оказалась не хуже по диагностическим возможностям, чем сочетание радиофармпрепарата с красителем [13].
Флуоресцентная лимфография также является относительно новой технологией. Первая публикация по применению индоцианина зелёного для поиска СЛУ без использования эффекта флуоресценции относится к 1999 г. [16]. Успешное обнаружение СЛУ было получено только в 74% из 172 больных РМЖ. Первое использование зелёного индоцианина, основанное на флуоресцентной навигации, также было сделано японскими авторами: Kitai T., Inomoto T., Miwa M., Shikayama T. в 2005 г. СЛУ был обнаружен в 94% [14]. По мнению Ballardini B. et al флуоресцентный метод с индоцианином позволяет находить сигнальный лимфатический узел в 99,6%. Флуоресцентная лимфография с индоцианином зелёным позволяет легко идентифицировать СЛУ с частотой не ниже, чем при использовании радиоактивных препаратов и может использоваться как самостоятельный метод [5]. Флуоресцентная лимфография не уступает радионуклидной технологии по частоте нахождения СЛУ (94-100%) или превосходит её [5,12,14,23,24], однако характеристика флуоресцентной технологии не полна из-за недостатка сведений по показателю частоты ложноотрицательных заключений. Только в одной работе на небольшом количестве больных (серии по 21 и 13 пациенток) показано, что частота ложноотрицательных ответов составила 10% и 8% [17].
Таблица 1: частота ложноотрицательных результатов при биопсии СЛУ
| Источник n | в группах с лимфаден- эктомией | Лимфотропный препарат | Частота нахождения СЛУ в % | Частота ложно- отрицательных результатов в % |
| 1. Canavese G., et al. [7] | 115 | 99mTc + blue dye | 99,1 | 22,9 (8/35) |
| 2. Veronesi U., et al. [20] | 257 | 99mTc | 98,8 | 8,8 (8/91) |
| 3. Zavagno G., et al. [25] | 323 | 99mTc | 94,9 | 16,7 (18/108) |
| 4. Krag D.N., et al. [15] | 2807 | 99mTc + Isosulfan blue | 97,3 | 9,8 (75/766) |
| В объединённой группе 1-4. | 3502 | 99mTc +- | 94,9- 99,1 | 10,9 (109/1000) |
| Наши данные | 100 | Индоцианин зелёный | 98% | 3,6 (1/28) |
В таблице 1 приводятся сведения о частоте ложноотрицательных ответов при биопсии СЛУ в фундаментальных исследованиях по этой проблеме. Усреднённая частота этого показателя составила 10,9%. В нашем исследовании, несмотря на технические неудачи, связанные с освоением метода (2 случая не нахождения СЛУ из 100 были связаны с пересечением лимфатического протока и выходом индоцианина в ткани), частота нахождения СЛУ у больных с cN0 и частота ложноотрицательных ответов оказались на высоком уровне, — 98% и 3,6% соответственно.
Заключение
Флуоресцентный метод поиска СЛУ при РМЖ имеет свои технологические особенности: в большинстве случаев СЛУ не визуализируется через кожу, его нужно искать в ране, ориентируясь на ход лимфатического протока. Выполнение метода поиска от введения препарата до получения СЛУ занимает 15-30 минут. У больных с cN0 метод по своим диагностическим характеристикам идеален, может применяться в самостоятельном варианте. Очевидным преимуществом флуоресцентного метода является отсутствие лучевой нагрузки на пациента и персонал.
Благодарность
Авторы благодарят профессоров G.C. Wishart и J.R. Benson за обучение технологии биопсии СЛУ с использованием флуоресцентной лимфографии.
Cписок авторов
С.М. Портной, А.В. Кузнецов, Н.М. Шакирова, Н.А. Козлов, А.В. Масляев, А.В. Карпов, Е.Б. Кампова-Полевая, М.Г. Мистакопуло, Ю.С. Егоров, О.А. Анурова, Т.А. Шендрикова, А.С.Горностаева, Д.В. Хайленко.
Источники литературы
- Вельшер Л.З., Решетов Д.Н., Габуния З.Р., и др. Сторожевые лимфатические узлы при раке молочной железы. //Маммология. 2007.- № 1, c.23-25.
- Петровский А.В., Афанасьева К.В., Гончаров М.О. и др. Использование различных радиофармпрепаратов при биопсии сторожевых лимфатических узлов у больных раком молочной железы. //Радиационная онкология и ядерная медицина. 2013.- № 1.- c.85-89.
- Криворотько П.В., Канаев С.В., Семиглазов В.Ф. и др. Методологические проблемы биопсии сигнальных лимфатических узлов у больных раком молочной железы. //Вопросы онкологии. 2015.- 61.- 3.- c.418-423.
- Ansari B, Ogston SA, Purdie CA, et al. Meta-analysis of sentinel node biopsy in ductal carcinoma in situ of the breast. //Br. J. Surg. 2008.-95.-547-554.
- Ballardini B, Santoro L, Sangalli C, et al. The indocyanine green method is equivalent to the ⁹⁹mTc-labeled radiotracer method for identifying the sentinel node in breast cancer: a concordance and validation study. //Eur. J. Surg. Oncol. 2013.-39.-1332-1336.
- Cabanas R. An approach for the treatment of penile carcinoma. //Cancer. 1977.-39.-456-466.
- Canavese G, Catturich A, Vecchio C, et al. Sentinel node biopsy compared with complete axillary dissection for staging early breast cancer with clinically negative lymph nodes: results of randomized trial. //Ann. Oncol. 2009.-20.-1001—1007.
- Coates AS, Winer EP, Goldhirsch A, et al. Tailoring therapies—improving the management of early breast cancer: St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2015. //Ann Oncol. 2015.-26.-1533—1546.
- Curigliano G, Burstein HJ, Winer EP, et al. De-escalating and escalating treatments for early-stage breast cancer: the St. Gallen International Expert Consensus Conference on the Primary Therapy of Early Breast Cancer 2017. // Ann Oncol. 2017.-28.-1700—1712.
- Giammarile F, Alazraki N, Aarsvold JN, et al. The EANM and SNMMI practice guideline for lymphoscintigraphy and sentinel node localization in breast cancer. // Eur J Nucl Med Mol Imaging. 2013.-40.-1932—1947.
- Gould EA, Winship T, Philbin PH, Kerr HH. Observations on a «sentinel node» in cancer of the parotid. Cancer. 1960.-13.-77-78.
- Hojo T, Nagao T, Kikuyama M, et al., Evaluation of sentinel node biopsy by combined fluorescent and dye method and lymph flow for breast cancer. // Breast. 2010.-19.-210-213.
- Karakatsanis A, Christiansen PM, Fischer L, et al. The Nordic SentiMag trial: a comparison of super paramagnetic iron oxi de (SPIO) nanoparticles versus Tc(99) and patent blue in the detection of sentinel node (SN) in patients with breast cancer and a meta-analysis of earlier studies. //Breast Cancer Res Treat. 2016.-157.-:281-294.
- Kitai T, Inomoto T, Miwa M, Shikayama T. Fluorescence navigation with indocyanine green for detecting sentinel lymph nodes in breast cancer. //Breast Cancer. 2005.-12.-211—215.
- Krag DN, Anderson SJ, Julian TB, et al. Sentinel-lymph-node resection compared with conventional axillary-lymph-node dissection in clinically node-negative patients with breast cancer: overall survival findings from the NSABP B-32 randomised phase 3 trial. //Lancet Oncol. 2010.-11.-927—933.
- Motomura K, Inaji H, Komoike Y, et al. Sentinel node biopsy guided by indocyanine green dye in breast cancer patients. // Jpn J Clin Oncol. 1999.-29.-604—607.
- Murawa D, Hirche C, Dresel S, Hünerbein M. Sentinel lymph node biopsy in breast cancer guided by indocyanine green fluorescence. //Br J Surg. 2009.-96.-1289-1294.
- Petrelli F, Lonati V, Barni S. Axillary dissection compared to sentinel node biopsy for the treatment of pathologically node-negative breast cancer: a meta-analysis of four randomized trials with long-term follow up. //Oncol Rev. 2012.-6.-e20.
- Vera DR, Wallace AM, Hoh CK. A synthetic macromolecule for sentinel node detection: (99m)Tc-DTPA-mannosyl-dextran. //J Nucl Med. 2001.-42.-951—959.
- Veronesi U, Paganelli G, Viale G, et al. A Randomized Comparison of Sentinel-Node Biopsy with Routine Axillary Dissection in Breast Cancer. //N Engl J Med. 2003.-349.-546-553.
- Veronesi U, Viale G, Paganelli G, et al. Sentinel lymph node biopsy in breast cancer: ten year results of a randomized controlled study. //Ann Surg. 2010.-251.-595—600.
- Wang Z, Wu LC, Chen JQ. Sentinel lymph node biopsy compared with axillary lymph node dissection in early breast cancer: a meta-analysis. //Breast Cancer Res Treat. 2011.-129.-675—689.
- Wishart GC, Loh SW, Jones L, Benson JR. A feasibility study (ICG-10) of indocyanine green (ICG) fluorescence mapping for sentinel lymph node detection in early breast cancer. //Eur J Surg Oncol. 2012.-38.-651-656.
- Xiong L, Gazyakan E, Yang W, et al. Indocyanine green fluorescence-guided sentinel node biopsy: a meta-analysis on detection rate and diagnostic performance. // Eur J Surg Oncol. 2014.-40:843-849.
- Zavagno G, De Salvo GL, Scalco G, et al. A randomized clinical trial on sentinel lymph node biopsy versus axillary lymph node dissection in breast cancer: results of the Sentinella/GIVOM trial. //Ann Surg. 2008.-247.-207-213.
Источник