Биогенные амины в лимфоцитах

Биогенные амины — это самая большая группа медиаторов, которая делится на две подгруппы: катехоламины и индоламины. Они синтезируются в головном мозге из разных аминокислот: первые — из тирозина (рис. 6.2), а вторые — из триптофана.
Биогенные амины найдены в сенсорных и моторных системах, а также в проводящих путях, осуществляющих высшие психические функции. Клетки, содержащие эти медиаторы, собраны в отдельные группы в определенных местах в стволе мозга, а аксоны от них расходятся практически во все отделы мозга. Большинство биогенных аминов действуют через метаботропные рецепторы.
Итак, к катехоламинам относятся норадреналин, адреналин и дофамин, а к индоламинам — серотонин (5-гидрокситриптамин, 5-НТ), кроме того, к моноаминам относят и гистамин, образующийся из аминокислоты гистидина.
Норадреналин (НА). Основной источник адренергических аксонов – голубое пятно и прилежащие участки среднего мозга. Также адренергические нейроны обнаружены в варолиевом мосту, в продолговатом и промежуточном мозге, в ретикулярной формации ствола. Из этих отделов аксоны идут к гипоталамусу, лимбической системе, к коре б.н. и мозжечка, к спинному мозгу. Проекции голубого пятна образуют часть восходящей ретикулярной активирующей системы мозга, направленной из ретикулярной формации в кору б.п. Этот путь регулирует внимание, уровень бодрствования, возбуждение и циркадианные (суточные) ритмы (норадреналин регулирует синтез мелатонина в эпифизе млекопитающих в зависимости от времени суток). Норадреналин как медиатор также участвует в формировании когнитивных и адаптационных процессов.
Рис. 6.2. Синтез катехоламинов
Много норадреналина в ВНС: тела адренергических нейронов лежат в симпатической цепочке, НА выделяется из окончаний симпатических нервов. Наиболее заметные эффекты этот медиатор оказывает при стрессе. Он вызывает общую активацию работы головного мозга, торможение центров сна, повышение двигательной активности, снижение болевой чувствительности, улучшение обучения и памяти, в ряде случаев и положительные эмоции при стрессе (что проявляется в экстремальном спорте, азартных играх).
Существует четыре типа метаботропных рецепторов НА — альфа1, альфа2, бета1, бета2, которые по-разному распределены в нервной и других системах организма. Альфа1-рецепторы расположены в мышце, расширяющей зрачок, на сосудах и сфинктерах желудочно-кишечного тракта (повышают их тонус). Альфа2-рецепторы являются пресинаптическими, их активация приводит к снижению выделения медиатора (как самого НА, так и ацетилхолина). Бета 1-рецепторы находятся в сердце, их активация приводит к повышению частоты сердечных сокращений и увеличению силы сокращения сердечной мышцы. Бета2-рецепторы расположены в бронхах. Воздействие НА на эти рецепторы приводит к расслаблению и расширению бронхов.
Адреналин. В качестве медиатора адреналин редко встречается, он является преимущественно гормоном мозгового слоя надпочечников. Адреналин в большей степени действует на бета-адренорецепторы, а норадреналин — на альфа-адренорецепторы.
Дофамин (ДА). Дофаминэргические нейроны находятся преимущественно в среднем мозге, в так называемой черной субстанции среднего мозга и в гипоталамусе. Существует несколько подтипов рецепторов к дофамину (D1, /22, /23, /24, /25), все они являются метаботропными.
Известны три главных пути распространения аксонов, выделяющих дофамин, на окончаниях.
- 1. Тело нейрона находится в гипоталамусе, оттуда идет короткий аксон в гипофиз. Этот путь входит в гипоталамо-гипофизарную систему регуляции деятельности желез внутренней секреции (эндокринных желез). Здесь дофамин оказывает локальные влияния на нейроэндокринные функции.
- 2. Тела нейронов находятся в черной субстанции, аксоны от них идут к базальным ганглиям (полосатые тела). К этой системе относится около 3/4 всего ДА ЦНС. Эта система участвует в регуляции общего уровня двигательной активности, тонических движений, связана с переживанием положительных эмоций от движений (в танцах, спорте и т.д.). Дефицит ДА в этих структурах приводит к развитию болезни Паркинсона (гибнут ДА-эргические нейроны), и в результате утрачивается контроль базальных ганглиев над ретикулоспинальным путем, что приводит к повышению тонуса скелетных мышц (дрожательные гиперкинезы). Классическое лечение паркинсопических расстройств осуществляется приемом предшественников дофамина — L-ДОФА.
- 3. Тела нейронов лежат в среднем мозге, рядом с черной субстанцией (покрышка среднего мозга). Аксоны от них идут в кору б.п., энто- ринальную кору и далее к гиппокампу. Здесь ДА участвует в регуляции скорости обработки информации, скорости мышления, обеспечивает положительные эмоции в процессе творчества и получения новых знаний. Нарушения (повышенная активация) в этой системе могут привести к развитию шизофрении. Подобные представления возникли после того, как были открыты лекарственные препараты, помогающие при этой психопатологии, — хлорпромазин и галоперидол. Они подавляют активность ДА-эргической системы, блокируя рецепторы ДА.
В последнее время появляются данные об участии в патогенезе шизофрении нейропептидов, тем более что есть тесная связь между эндорфино- вой (см. далее) и дофаминовой системами мозга. Эндорфины оказывают на дофаминэргические синапсы модулирующее действие. Не исключается и участие других пептидов, в частности холецистокинина (при шизофрении наблюдается повышение его содержания в мозге).
Серотонин. В ЦНС серотонинэргические нейроны есть в ядрах шва продолговатого мозга, а также в среднем мозге и варолиевом мосту. Эти нейроны иннервируют кору б.п., гиппокамп, бледный шар, миндалину, гипоталамус. Здесь серотонин оказывает преимущественно тормозное влияние, регулируя поток информации в кору. Также серотонинэргические ядра шва являются важным стволовым центром сна. Самая высокая концентрация серотонина в ЦНС обнаружена в эпифизе. Там он превращается в мелатонин (гормон), который участвует в регуляции цикла «сон — бодрствование», пигментации кожи, влияет на активность половых желез. При раздражении ядер шва животные страдают бессонницей. Много серотонина синтезируется клетками пищеварительного тракта.
Часть функций серотонин выполняет как тканевый гормон, выделяясь из тромбоцитов и вызывая спазм сосудов в результате их повреждения. Иногда этот механизм может нарушаться (реакции запускаются в отсутствии повреждения сосудов), в результате может развиваться мигрень.
Обнаружено семь подтипов рецепторов к серотонину, среди которых есть как ионотропные, так и метаботропные.
Серотонин участвует в регуляции эмоционального поведения, двигательной активности, пищевого поведения, полового поведения, терморегуляции. С нарушениями в серотонинэргической системе связывают развитие алкогольной зависимости, некоторых форм тревожности. Также серотонинэргические нейроны играют важную роль в осуществлении некоторых форм сложного поведения, включая агрессию и формирование социальных отношений в популяции. Серотонин участвует в обеспечении когнитивных функций, модулируя холинэргические нейроны.
Интересным является тот факт, что антагонистом рецепторов серотонина является синтетический галлюциноген — LSD (диэтиламид лизерги- новой кислоты).
Гистамин. Гистамин воздействует на различные периферические ткани и участвует в самых разных процессах, включая аллергические реакции (при высвобождении из тучных клеток), ответ ткани на повреждение, регуляцию желудочной секреции. Гистамин также является медиатором в головном мозге. Тела гистаминовых нейронов компактно сконцентрированы в гипоталамусе, а их аксоны расходятся практически во все отделы ЦНС. По-видимому, гистаминовые нейроны регулируют общую активность мозга: состояния возбуждения и энергетический метаболизм. Механизмы этих влияний непрямые, они опосредованы воздействием на другие нейроны, глиальные клетки (астроциты) и кровеносные сосуды. Известны три типа рецепторов к гистамину — Н1 (обеспечивают аллергические и воспалительные реакции в тканях), Н2 (активируют секрецию желудка), НЗ (присутствуют только в ЦНС).
Инактивируются моноамины в синаптической щели при помощи двух ферментов — моноаминоксидазы (действует на все медиаторы этой группы) и катехол-0-метилтрапсферазы (действует только на катехоламины).
Существует представление, что развитие депрессивных состояний связано с нарушениями в моиоаминовой системе мозга: при недостатке медиаторов группы моноаминов появляются депрессивные расстройства (так называемая моноаминовая гипотеза развития депрессии). Препараты, направленные на лечение депрессий (антидепрессанты), тем или иным образом приводят к повышению содержания моноаминов в головном мозге.
Источник
Образуются
при декарбоксилирование аминокислот
ферментами декорбаксилазами. К биогенным
аминам относят дофамин,норадреналин,адреналин(
синтезируются изначально из аминокислоты
тирозина), серотонин, мелотанин(
синтезируются из триптофана) Многие
амины могут выполнять роль гормонов и
нейромедиаторов
Амины,
образовавшиеся при декарбоксилировании
аминокислот, часто являются биологически
активными веществами. Они выполняют
функцию нейромедиаторов (серотонин,
дофамин, ГАМК и др.), гормонов (норадреналин,
адреналин), регуляторных факторов
местного действия (гистамин, карнозин,
спермин и др.).
Серотонин
может превращаться в гормон мелатонин,
регулирующий суточные и сезонные
изменения метаболизма организма и
участвующий в регуляции репродуктивной
функции.
Амино- | Серии | Триптофан | Тирозин | Глутами- | Гистидин | Орнитин |
Продукты | Этаноламин | Триптамин | γ-амино- | Гистамин | Путресцин | |
Биологичес- | Ацетилхолин | Серотонин | Дофамин | ГАМК | Гистамин | Спермидин |
Формулы | ||||||
Физиологи- | Возбуждаю- | Возбуждающий | Медиатор | Тормозной | Медиатор | Изменяют |
В
организме биогенные амины подвергаются
реакции окислительного дезаминирования
с образованием альдегидов и аммиака.
Процесс осуществляется при участии
моноаминооксидаз.
Схематически
механизм трансдезаминирования можно
представит так:
24)Образование
серотонина и гистамина. Роль аминов
Гистамин
образуется путем декарбоксилирования
гистидина в тучных клетках соединительной
ткани
Гистамин
образует комплекс с белками и сохраняется
в секреторных гранулах тучных клеток.
Секретируется в кровь при повреждении
ткани (удар, ожог, воздействие эндо- и
экзогенных веществ), развитии иммунных
и аллергических реакций. Гистамин
выполняет в организме человека следующие
функции:
стимулирует
секрецию желудочного сока, слюны (т.е.
играет роль пищеварительного гормона);повышает
проницаемость капилляров, вызывает
отёки, снижает АД (но увеличивает
внутричерепное давление, вызывает
головную боль);сокращает
гладкую мускулатуру лёгких, вызывает
удушье;

Схема
А
участвует
в формировании воспалительной реакции
– вызывает расширение сосудов, покраснение
кожи, отёчность ткани;вызывает
аллергическую реакцию;выполняет
роль нейромедиатора;является
медиатором боли.
Серотонин
– нейромедиатор проводящих путей.
Образуется в надпочечниках и ЦНС из
аминокислоты 5-гидрокситриптофана в
результате действия декарбоксилазы
ароматических аминокислот. Этот фермент
обладает широкой специфичностью и
способен также декарбоксилировать
триптофан и ДОФА, образующийся из
тирозина. 5-Гидрокситриптофан синтезируется
из триптофана под действием
фенилаланингидроксилазы с коферментом
Н4БП
(этот фермент обладает специфичностью
к ароматическим аминокислотам и
гидроксидирует также фенилаланин) (см.
схему ниже).
Серотонин
может превращаться в гормон мелатонин,
регулирующий суточные и сезонные
изменения метаболизма организма и
участвующий в регуляции репродуктивной
функции.
Серотонин –
биологически активное вещество широкого
спектра действия. Он стимулирует
сокращение гладкой мускулатуры, оказывает
сосудосуживающий эффект, регулирует
АД, температуру тела, дыхание, обладает
антидепрессантным действием. По некоторым
данным он может принимать участие в
аллергических реакциях, поскольку в
небольших количествах синтезируется
в тучных клетках.
Вопрос
№ 25
Образование
катехоламинов и ГАМК, функции аминов.
В
мозговом веществе надпочечников и
нервной ткани тирозин является
предшественником катехоламинов(
дофамина, норадреналина, адреналина).
При
образовании катехоламинов и меланина
(в меланоцитах) промежуточным продуктом
служит диоксифенилаланин (ДОФА). Однако
гидроксилирование тирозина в клетках
различных типов катализируется различными
ферментами:
–
Тиразиназа ( Cu-зависимый
фермент)
–
Тирозингидроксилаза (1)
–
ДОФА – декарбоксилаза (2)
–
дофамингидроксилаза (3)
–
фенилэтаноламин-N-метилтрансфераза
(4)
дофамин
и норадреналин служат медиаторами в
синаптической передаче нервных импульсов,
а адреналин – гормон широкого спектра
действия, регулирующий энергетический
обмен. Одна из функций катехоламинов –
регуляция деятельности ССС.

В
нервных клетках декарбоксилирование
глутамата (отщепление а-карбоксильной
группы) приводит к образованию
γ-Аминомасляной
кислоты(ГАМК),
которая
служит основным тормозным медиатором
высших отделов мозга. Содержание ГАМК
в головном мозге в десятки раз выше
других нейромедиаторов. Она увеличивает
проницаемость постсинаптическизх
мембран для ионов К+, что вызывает
торможение нервного импульса, повышает
дыхательную активность нервной ткани,
улучшает кровоснабжение головного
мозга.

Функции
аминов:
Амины,
образовавшиеся при декарбоксилировании
аминокислот, часто являются биологически
активными веществами. Они выполняют
функцию нейромедиаторов (серотонин,
дофамин, ГАМК и др.), гормонов (норадреналин,
адреналин), регуляторных факторов
местного действия (гистамин, карнозин,
спермин и др.).
Вопрос
№ 26
Окислительное
дезаминирование и гидроксилирование
биогенных аминов.
Для
осуществления биологической функции
в нервных клетках требуется определённая
концентрация биогенных аминов. Избыточное
накопление их может вызывать различные
патологические отклонения. В связи с
этим большое значение приобретают
механизмы инактивации биогенных аминов.
окислением
ферментами моноаминооксидазами (МАО) с
коферментом FAD – таким путем чаще
происходит инактивация дофамина,
норадреналина, серотонина, ГАМК. При
этом происходит окислительное
дезаминирование
биогенных аминов с образованием
альдегидов, а затем соответствующих
кислот, которые выводятся почками
метилированием
с участием SAM под действием
метилтрансфераз. Таким
образом могут инактивироваться различные
биогенные амины, но чаще всего происходит
инактивация гастамина и адреналина.
Так, инактивация адреналина происходит
путём метилирования гидроксильной
группы в ортоположении (см. схему ниже).
Реакция инактивации гистамина также
преимущественно происходит путём
метилирования
Вопрос
№ 27
Трансметилирование,
метионин и S-аденозилметионин.
Метионин –
незаменимая аминокислота. Она необходима
для синтеза белков организма, участвует
в реакциях дезаминирования, является
источником атома серы для синтеза
цистеина. Метионил-тРНК участвует в
инициации процесса трансляции.
Метильная
группа метионина – мобильный одноуглеродный
фрагмент, используемый для синтеза ряда
соединений. Перенос метильной группы
метионина на соответствующий акцептор
называют реакцией трансметилирования,
имеющей важное метаболическое значение.
Метильная группа в молекуле
метионина прочно связана с атомом серы,
поэтому непосредственным донором этого
одноутлеродного фрагмента служит
активная форма аминокислоты.
Реакция
активация метионина
Активной
формой метионина является S-аденозилметионин
(SAM) – сульфониевая форма аминокислоты,
образующаяся в результате присоединения
метионина к молекуле аденозина. Аденозин
образуется при гидролизе АТФ (см. схему
А).
Эту
реакцию катализирует фермент метионин
аденозилтрансфераза, присутствующий
во всех типах клеток. Структура (-S+-CH3)
в SAM – нестабильная группировка,
определяющая высокую активность
метильной группы (отсюда термин “активный
метионин”). Эта реакция уникальна для
биологических систем, так как, по-видимому,
является единственной известной
реакцией, в результате которой
освобождаются все три фосфатных остатка
АТФ.
Отщепление
метильной группы от SAM и перенос её на
соединение-акцептор катализируют
ферменты метилтрансферазы. SAM в ходе
реакции превращается в S-аденозилгомоцистеин
(SAГ).
Вопрос
№ 28
Синтез
креатина, адреналина, фосфатидилхолина,
их биологическая роль.
Фосфатидилхолины
(лецитины)
– наиболее распространённая группа
глицерофосфолипидов, участвующих в
образовании мембран клеток и липопротеинов,
в составе которых осуществляется
транспорт липидов

Синтез
креатина
Креатин
необходим для образования в мышцах
высокоэнергетического соединения –
кре-атинфосфата. Синтез креатина идёт
в 2 стадии с участием 3 аминокислот:
аргинина, глицина и метионина. В
почках образуется
гуанидинацетат при действии
глицинамидинотрансферазы
Затем
гуанидинацетат транспортируется в
печень, где
происходит реакция его метилирования
Креатин
с кровотоком переносится в
мышцы и клетки мозга, где
из него образуется высокоэнергетическое
соединение – креатинфосфат.
Эта
реакция легко обратима и катализируется
ферментом креатинкиназой. Фермент
локализован в цитозоле и митохондриях
клеток, обладает органоспецифичностью.
В норме активность его в крови очень
мала. Обнаружено три изоферментные
формы креатинкиназы (см. раздел 2).
Креатинфосфат
играет важную роль в обеспечении энергией
работающей мышцы в начальный период. В
результате неферментативного
дефосфорилирования, главным образом в
мышцах, креатинфосфат превращается в
креатинин, выводимый с мочой. Суточное
выделение кре-атинина у каждого
индивидуума постоянно и пропорционально
общей мышечной массе


Вопрос
№ 29 (
ребят..ну эээ….ну в общем как-то так,
если вдруг на меня снизойдет озарение,
то количество инфы возрастет)
Метилирование
чужеродных и лекарственных соединений.
Метилирование —
простой химический процесс, при котором
метильная группа — атом углерода и три
атома водорода — связывается с другими
молекулами.
В
тканях человека, особенно в печени,
происходит метилирование чужеродных
и лекарственных соединений ( амины,
фенолы, тиоловые
соединения и
др.) с образованием N -, О – и S-метиловых
конъюгатов. При этом часто изменяется
биологическая активность веществ.
Так
метилирование диметилсульфатом
используют при синтезе лекарственных
веществ, например, анальгина; в производстве
амидоприна метилирование осуществляют
формальдегидом и восстановительным
агентом – обычно муравьиной кислотой.
Вопрос
№ 30
Роль
серина и глицина в образовании
одноуглеродных групп.
Образование
и использованиеодноуглеродных
фрагментов
Особое
значение реакций катаболизма серина и
глицина заключается в том, что они
сопровождаются образованием одноуглеродного
метиленового фрагмента (-СН2-).
Метиленовая группа в молекуле метилен-
Н4-фолата может превращаться в
другие одноуглеродные группы (фрагменты):
метенильную (-СН=), формильную (-НС=О),
метильную (-СН3) и формиминогруппу
(-CH=NH) (рис. 9-25).
Ещё
один источник формального и
форми-мино-фрагментов – гистидин.
Катаболизм гистидина происходит только
в печени (очень небольшой процент в
коже) в результате следующих реакций
(см. схему на с. 498).
Конечными
продуктами катаболизма гистидина
являются глутамат, NH3 и одноуглеродные
фрагменты – формимино-Н4-фолат
и формил-Н4-фолат.
Все
образующиеся производные Н4-фолата
играют роль промежуточных переносчиков
и служат донорами одноуглеродных
фрагментов при синтезе некоторых
соединений: пуриновых оснований и
тимидиловой кислоты (необходимых для
синтеза ДНК и РНК), регенерации метионина,
синтезе различных формиминопроизводных
(формиминоглицина и т.д.)
Перенос
одноуглеродных фрагментов к акцептору
необходим не только для синтеза ряда
соединений, но и для регенерации
свободного Н4-фолата
в печени.
31.Тетрагидрофолиевая
кислота, роль в синтезе и использовании
одноуглеродных радикалов. Метилирование
гомоцистеина
Ферменты,
коферментами которых служат производные
фолиевой кислоты играют большую роль
в превращениях серина и глицина. Фолиевая
кислота – это витамин В9.
–
Фолиевая кислота

Коферментную
функцию выполняет восстановленная
форма фолата – тгфк(или Н4-фолат):

Фолиевая
кислота в печени
превращается в Н4-фолат в несколько
стадий с участием ферментов фолатредуктазы
и дигидрофолатредуктазы, коферментом
которых служит NADPH.
Особое
значение реакций катаболизма серина и
глицина заключается в том, что они
сопровождаются образованием одноуглеродного
метиленового фрагмента (-СН2-), переносчиком
которого и является тгфк.
(реакции
чисто для наглядности):
Метиленовая
группа в молекуле метилен- Н4-фолата
может превращаться в другие одноуглеродные
группы (фрагменты): метенильную (-СН=),
формильную (-НС=О), метильную (-СН3) и
формиминогруппу (-CH=NH)
Таким
образом главная роль тгфк – перенос
одноуглеродных фрагментов. Они также
могут использоваться в дальнейшем для
синтеза некоторых соединений: пуриновых
оснований и тимидиловой кислоты
(необходимых для синтеза ДНК и РНК).
Собственно
куда именно присоединяется :

Реакции
метилирования играют важную роль в
организме и протекают очень интенсивно.
Это вызывает большой расход метионина,
так как он является незаменимой
аминокислотой (в клетках метионин
синтезироваться не может). Метионин –
незаменимая аминокислота. Активной
формой метионина является S-аденозилметионин
(SAM) – сульфониевая форма аминокислоты,
образующаяся в результате присоединения
метионина к молекуле аденозина.

Отщепление
метильной группы от SAM и перенос её на
соединение-акцептор катализируют
ферменты метилтрансферазы. SAM в ходе
реакции превращается в S-аденозилгомоцистеин
(SAT).
S-аденозилгомоцистеин
при действии гидролазы расщепляется
на аденозин и гомоцистеин.
S-аденозилгомоцистеин
+ Н2О → Аденозин + Гомоцистеин
Гомоцистеин
может снова превращаться в метионин
под действием гомоцистеинметилтранс
феразы. Донором метильной группы в этом
слу чае служит N5-метил-Н4-фолат.
Метилирование
гомоцистеина:
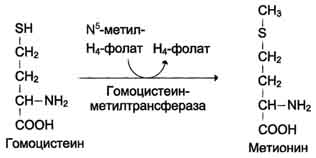
Метионин
– незаменимая аминокислота, однако может
регенерироваться из гомоцистеина.
Следовательно, незаменим именно
гомоцистеин, но единственным его
источником в организме служит метионин.
В пище гомоцистеина крайне мало, поэтому
потребности человека в метиони-не и
гомоцистеине обеспечиваются только
метионином пищи.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник