Антигенраспознающие рецепторы в лимфоцитов
24.10.2015
Строение АГ-распознающего В-клеточного рецептора (BCR — В cell receptor) показано на рис. 4.2.
Ho строению BCR характеризуется как мономерный иммуноглобулин класса IgM, отличающийся от антител этого же класса, являющихся пентамерными молекулами IgM. Отличия мембранного и сывороточного IgM касаются также строения их тяжелых цепей (μ) в С-концевой части молекулы. В остальном эта молекулы не отличаются друг от друга. Единство специфичности и основной структуры молекул является основанием для утверждения о том, что антитела являются растворимой формой рецептора для антигена.
В связи с этим в данном разделе представлены основные сведения о строении мембранного иммуноглобулина В-лимфоцитов.

BCR состоит из двух тяжелых (H) и двух легких (L) цепей, соединенных дисульфидными связями. Мол. масса каждой из легких цепей составляет 22 кД, тяжелых цепей — 70 кД. Каждая из цепей построена из пространственно автономных гомологичных доменов. Тяжелые (4-цепи включают по 5 доменов, из них один вариабельный (Vн) и 4 константные (Сн). Домены нумеруют от N- к С-концу. В соответствии с этим домены тяжелых цепей обозначают как Vн (Vμ), Cн1 (Cμ1), Сн2 (Сμ2), Сн3 (Сμ3), Сн4 (Сμ4). В тяжелых цепях рецептора между доменом Сн4 и трансмембранной областью имеется связывающий участок, состоящий из 12 гидрофильных аминокислотных остатков.
С-концевая часть тяжелых цепей рецептора имеет гидрофобный участок, локализующийся в мембране (трансмембранная область рецептора), за которым следует участок рецептора, погруженный в цитоплазму В-лимфоцита. Этот участок называется цитоплазматическим. Трансмембранная часть BCR в-лимфоциты небольшая, состоит из 26 аминокислотных участков, его цитоплазматическая часть еще меньше — включает трипептид Lys-Val-Lys-COOH.
Легкие цепи BCR включают по 2 домена, один из них вариабельный (VL), другой константный (Cl). Обозначают последовательность доменов легких цепей как VL, СL. Домены цепей Vн, Cн и VL, CL формируют Fab-фрагмент рецептора, два Fab-фрагмента (по два каждого из указанных доменов (см. рис. 4.2)) образуют (Fab)2-фрагмент. Остальные домены двух тяжелых цепей рецептора (Сн2, Сн3, Сн4) входят в состав его Fc-фрагмента. Комбинирование высоковариабельных доменов Vн и VL в составе BCR формирует антигенраспознающую область рецептора, именуемую также активным центром. В соответствии со строением молекулы каждый рецептор содержит два активных центра. В отличие o r TCR, распознающего эпитопы фрагментированного антигена в комплексе с молекулами главного комплекса гистосовместимости классов I (ЦТЛ) или II (Th), BCR способен связывать эпитопы нативного антигена, фрагментация антигена и его ассоциация с молекулами главного комплекса гистосовместимости для связывания BCR не требуется.
Как отмечалось выше, зрелые В-лимфоциты экспрессируют на мембране IgM и IgD, наличие IgD на клеточной поверхности — показатель зрелости В-клетки. Эти иммуноглобулины характеризуются одной и той же антигенной специфичностью, имеют один и тот же тип легких цепей, однако мембранный IgD многих В-клеток характеризуется не формулой H2L2, a HL. Поскольку классы иммуноглобулинов различаются между собой по тяжелым цепям, то мембранные иммуноглобулины В-клеток (IgM и IgD) характеризуются двумя изотипами — μ и δ. В процессе иммунного ответа изотип мембранного Ig меняется. В результате взаимодействия лиганда CD40L (CD154) T-лимфоцита с молекулой CD40 В-клетки T-лимфоцитом продуцируются цитокины, под влиянием которых изменяется изотип мембранного IgM на IgG1 и IgE — под влиянием ИЛ-4, на IgG2 и IgG3 — под влиянием ИНФγ, на IgA и IgG2b — под влиянием ТФРβ.
Легкие цепи рецептора, как и иммуноглобулинов других классов, известны, как отмечалось выше, в виде двух изотипов — к или λ. Соотношение к- и λ-цепей у разных животных разное: у грызунов (мыши, крысы) численность В-клеток с к- и λ-цепями BCR составляет >95 и <5%, у KPC и лошадей — 5 и 95%, у приматов (обезьяны Резус, Бабуины) — 50 и 50%, у человека — 70 и 30%, у плотоядных (кошки, собаки) — 10 и 90% соответственно.
Участки рецептора, располагающиеся над клеточной мембраной, называют внеклеточными участками. Таким образом, BCR, как и многие другие молекулярные структуры клеточной поверхности, имеет в целом три части — внеклеточную, трансмембраннуто и цитоплазматическую. Короткая цитоплазматическая часть BCR (три аминокислотных остатка) не может служить проводником внутриклеточного сигнала, индуцируемого взаимодействием BCR-антиген, поскольку не способна формировать молекулярные структуры, необходимые для взаимодействия с внутриклеточными белками. Эту функцию выполняют полипептидные цепи Igα (CD79a) и Igβ (CD79b), имеющие по одному внеклеточному домену и длинный цитоплазматический хвост. Антигены 79а и 79b имеют мол. массу 47 и 37 кД, соответственно, характеризуются как гликопротеины, относятся к суперсемейству иммуноглобулинов, экспрессируются на поверхности В-лимфоцитов на стадии пре-В одновременно с образованием комплекса μ-цепи и суррогатных легких цепей, т.е. на стадии образования пре-BCR. Домены этих цепей (Igα и Igβ) прочно соединены с тяжелыми цепями рецептора нековалентной связью. Цитоплазматическая часть цепей Igα и Igβ, подобно таковой цепей TCR (цепи ζ, антиген CD3), имеет характерные домены ITAM (Immunoreceptor tyrosine-based activation motif), именуемые тирозинсодержащими активационными последовательностями аминокислот в иммунорецепторах. Начальным этапом проведения активационного сигнала внутрь клетки, индуцированного конформационными изменениями рецептора в результате его взаимодействия с антигеном, является фосфорилирование молекул ITAM протеинтирозинкиназами цитозоля.
Для активации В-лимфоцита существенно-значимой является экспрессия на его мембране корецепторных молекул с сигнальной функцией, включающих CD19, CD21 (рецептор CR2 для компонентов комплемента iC3b, C3d и C3dg) и молекулу TAPA-1 (Target of antiproliferative antibody). Молекула TAPA-1 (CD81) имеет 4 трансмембранных участка, ассоциирована с рецептором, однако функции ее не изучены. Предполагается возможность ее участия во взаимодействии В-клетки с Т-лимфоцитом. Антиген CD 19 определяется на В-клетках на стадии про-В, антиген CD20 — на стадии пре-В, антиген CD21 — на стадии незрелых В-лимфоцитов.
АГ-распознающие рецепторы В-лимфоцитов метят меченными флуорохромом антителами к иммуноглобулинам. С помощью меченых рецепторов показано, что мембрана В-лимфоцита находится в динамическом состоянии, поддерживаемом активным метаболизмом клетки. За 3-6 ч. инкубирования клетки при 37°, но не при 4°С, в среду освобождается 30±5% рецепторов клеточной поверхности, полностью смена иммуноглобулинов на мембране происходит за 8-20 ч. В реакции иммунофлуоресценции установлено, что окрашенные рецепторы располагаются на клеточной мембране диффузно. Затем происходит их перераспределение, в ходе которого диффузное свечение сменяется свечением в форме округлых пятен или пояса. Через 2 мин. свечение локализуется в виде «шапочки» или «колпачка» на одном из полюсов клетки, обычно над областью аппарата Гольджи. Через 5 мин, инкубирования «шапочка» поглощается клеткой путем пиноцитоза, который завершается за 2 ч. Однако повторное окрашивание клетки сопровождается свечением лишь через 8-20 ч., в течение которых иммуноглобулины вновь появляются на клеточной поверхности. За этот период времени пиноцитированные иммуноглобулины подвергаются внутриклеточной деградации. Аналогичные процессы развиваются при взаимодействии рецептор-антиген, являются основой АГ-представляющей функции В-клеток.
- Этапы дифференцировки В-лимфоцитов в костном мозгу
- В-лимфоциты
- Т-клетки памяти (TM)
- Т-Дифференцирующие лимфоциты (Td)
- Т-регуляторные клетки (TReg)
- Т-хелперы (TH)
- Регуляторные Т-лимфоциты
- Цитотоксические Т-лимфоциты (Т-киллеры)
- γδТ-лимфоциты
- αβТ-лимфоциты
Источник
Для активации иммуннокомпетентных
клеток необходимо «узнавание» ими
определенных чужеродных субстанций,
которое делает возможным взаимодействие
иммуннокомпетентных клеток с антигенами
и приводит к запуску специфических
иммунных реакций (гуморальных и
клеточных). «Узнавание» Т- и В-лимфоцитами
антигенов осуществляется с помощью
определенных антигенраспознающих
рецепторов, расположенных на поверхности
этих клеток и характеризующихся
определенными особенностями строения
для разных иммунокомпетентных клеток.
Антигенраспознающие рецепторы в-лимфоцитов
Антигенраспознающие рецепторы
В-лимфоцитов представляют собой
мономерные формы иммуноглобулина М,
встроенные в плазматическую мембрану
В-лимфоцита и окруженные специальными
вспомогательными трансмембранными
белками – IgиIg,
которые принимают участие в передаче
сигнала отIgМ, присоединившего
антиген, внутрь клетки. Кроме того, эти
белки необходимы для нормального выхода
мембранной формыIgМ в
плазматическую мембрану: в отсутствии
этих белков молекулы мембранногоIgМ
остаются внутри клетки.
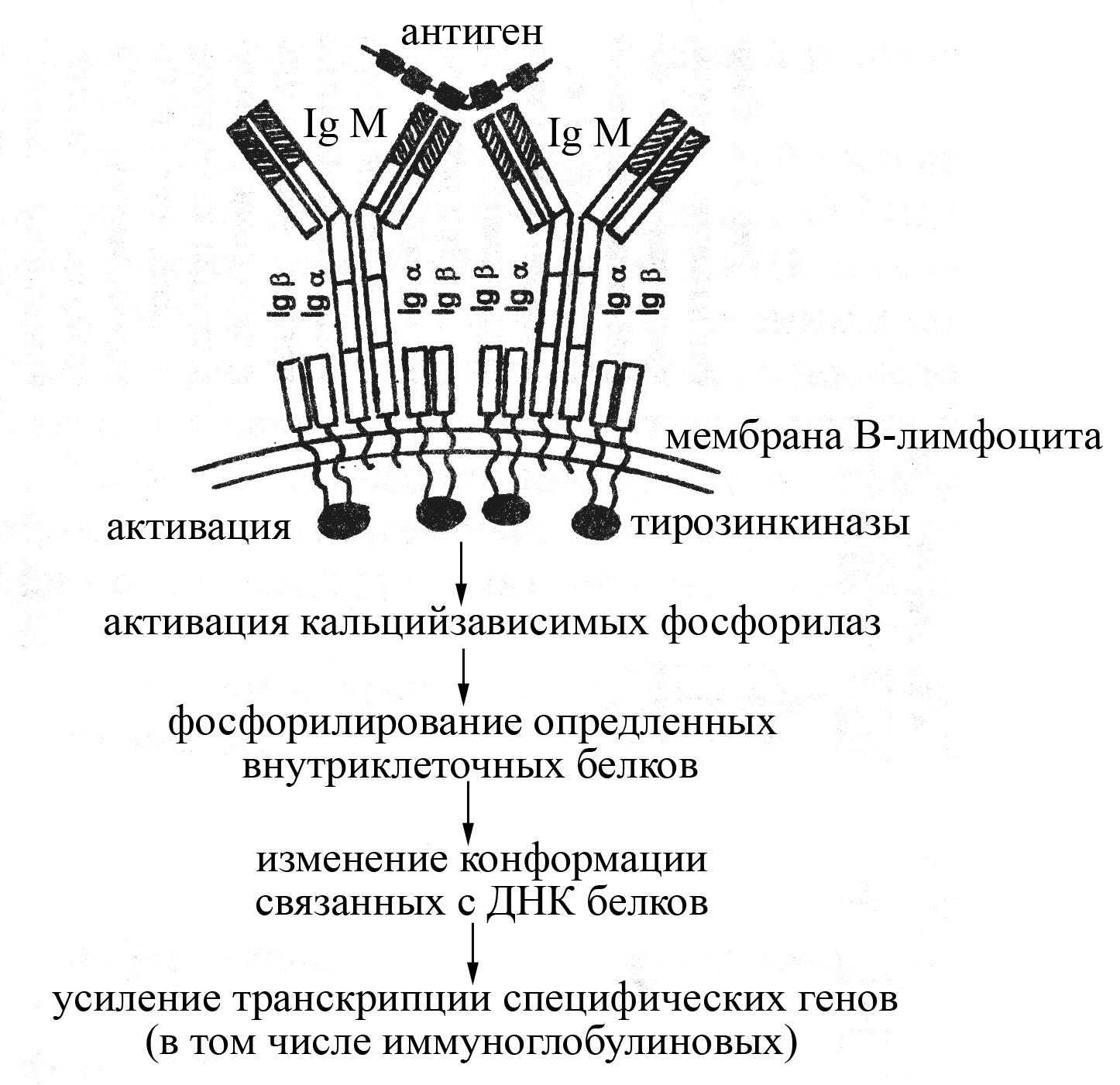
Рис. Схема строения антигенраспознающего
рецептора В-лимфоцитов и механизма их
активации после взаимодействия с
антигеном. Антигенраспознающий рецептор
В-лимфоцитов представлен мембранной
формой IgМ, окруженного
специальными вспомогательными белками
–IgαиIgβ,
принимающими участие в передачи сигнала
отIgМ внутрь клетки
М ембранная
ембранная
форма иммуноглобулина М отличается от
секреторной не только тем, что является
мономерной, но и некоторыми особенностями
строения самого мономераIgМ:
в его состав входит гидрофобный
трансмембранный участок и короткий
гидрофильный цитоплазматический хвост.
В то же время мономерная молекула
секреторной формы иммуноглобулина М
имеет на С-конце углеводные остатки,
увеличивающие растворимость молекулы,
и цистеиновый остаток, необходимый для
полимеризации мономеров в пентамерную
форму с помощьюJ-цепи.
Молекула мембранного иммуноглобулина
М кодируется теми же рекомбинантными
иммуноглобулиновыми локусами, что и
секреторного иммуноглобулина (χ- или-локусом, кодирующим
легкую цепь, и локусом тяжелых цепей).
Некоторые же отличия в строении С-конца
тяжелых цепей секреторного и мембранногоIgМ обусловлены особенностями
считывания информации с генов локуса
тяжелой цепи, лежащих за С-геном.
В частности, за этим геном расположены
короткие гены – Ск и Мк, кодирующие
короткие аминокислотные последовательности
дистальной части тяжелой цепи
соответственно секреторного иммуноглобулина
(ген Ск) и мембранного иммуноглобулина
(ген Мк). При образовании секреторной
формыIgМ, после считывания
информации с С-гена
транскрибируется только ген Ск, кодирующий
концевой участок тяжелой цепи секреторной
формы. При образовании тяжелых цепей
мембранногоIgМ
транскрибируется более длинный участок
генома за С-геном,
включающий гены и Ск и Мк. Затем в
результате процессинга участок мРНК,
комплементарный Ск-гену, вырезается
(подвергается делеции), а остальная
часть длинной мРНК, кодирующей тяжелую
цепь-типа, путем
сплайсинга сшивается с коротким
фрагментом мРНК, комплементарным
Мк-гену, в результате чего возникает
зрелая мРНК, кодирующая мембранную
формуIgМ. Таким образом,
трансляция тяжелой цепи мембранного
иммуноглобулина М представляет собой
более сложный процесс, требующий больших
энергозатрат, чем секреторной формы,
поскольку предполагает считывание
информации с более длинного участка
генома и последующий процессинг и
сплайсинг пре-мРНК, в связи с чем
мембранной формы иммуноглобулина в
В-лимфоцитах образуется гораздо меньше,
чем секреторной. Синтез мембранной
формыIgМ начинается на
заключительных этапах дифференцировки
В-лимфоцитов в красном костном мозге.
Зрелые В-лимфоциты экспрессируют
достаточно большое количество мембранногоIgМ на своей поверхности:
2х105молекул на клетку. Мембранная
форма иммуноглобулина М на поверхности
В-лимфоцитов может непосредственно
взаимодействовать с любыми формами
антигенов: как свободными корпускулярными
(вирусами, бактериями) и молекулярными,
так и связанными с рецепторами
антигенпредставляющих клеток (моноцитов,
макрофагов, дендритных клеток). Но в то
же время молекулы мембранногоIgМ
сохраняют свою специфичность: молекулы
каждого клона В-лимфоцитов проявляют
сродство к строго определенным антигенным
детерминантам, оставаясь равнодушными
к другим.

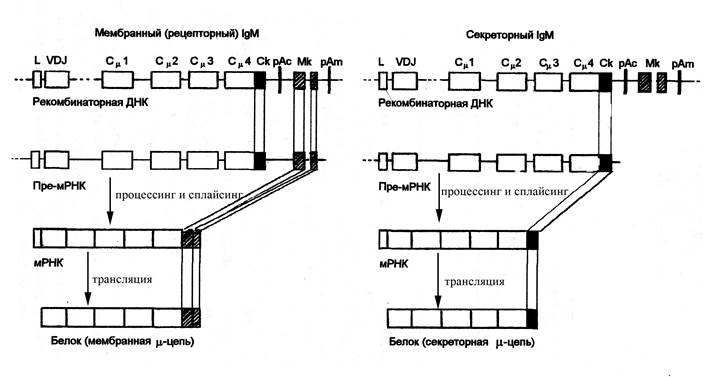
Рис. Схема генетического контроля
синтеза мембранного и секреторного
IgM. При образовании
мембранной или секреторной формIgMпроцесс реорганизации генома В-лимфоцита
характеризуется следующими особенностями.
Рекомбинантная ДНК содержит
последовательность нуклеотидов от
лидерного участка (L) до
терминальной последовательности
полиаденина (рАm–
полиаденин мембранного пути развития)
включительно. В реорганизованный локус
ДНК входят экзон Ск (секреторный
компонент) и два экзона Мк (мембранный
компонент), один из которых контролирует
трансмембранную последовательность,
а второй – цитоплазматическую
последовательность аминокислотных
остатков рецепторного иммуноглобулина.
В том случае, когда образующийся первичный
транскрипт (пре-мРНК) включает экзоны
Мк, синтезируется μ-цепь мембранного
иммуноглобулина. При этом Ск и рАс (рАс
– полиаденин секреторного пути
реорганизации) подвергаются делеции
при сплайсинге пре-мРНК. Если первичный
транскрипт не включает последовательность
Мк и рАm, но сохраняет Ск
и рАс, то в результате последующих
преобразований синтезируется μ-цепь
секреторного иммуноглобулина
Взаимодействие мембранной формы IgМ
В-лимфоцитов с определенным антигеном
сопровождается активацией В-лимфоцитов,
в результате которой В-лимфоциты
превращаются в антителопродуцирующие
клетки (плазматические клетки). Активация
В-лимфоцита может происходить как
самостоятельно после взаимодействия
антигена с рецептором, так и зачастую
с помощью цитокинов, продуцируемых
активированными Т-хелперами. Вместе с
тем сам по себе мембранный иммуноглобулин
М после взаимодействия с антигеном
активировать В-лимфоцит не может,
поскольку имеет очень короткий
цитоплазматический хвост, включающий
всего несколько аминокислотных остатков,
который не способен вступать в реакционные
отношения с внутриклеточными ферментами
и процессами. Для активации же В-лимфоцитов
после присоединения к их антигенраспознающим
рецепторам антигенов служат специальные
вспомогательные низкомолекулярные
белки –IgиIg,
расположенные в непосредственной
близости от мембранногоIgМ
в плазматической мембране В-лимфоцита
и имеющие гораздо более длинные
цитоплазматические концы. Эти белки
после присоединения к мембранномуIgМ
антигенных эпитопов несколько изменяют
свою конформацию, в результате чего
становятся способными взаимодействовать
с внутриклеточными тирозинкиназами,
активируя их. Активированные тирозинкиназы,
в свою очередь, активируют Са2+-зависимые
фосфорилазы, катализирующие фосфорилирование
определенных внутриклеточных белков.
Образующиеся фосфорилированные белки
влияют на конформацию связанных с ДНК
белков таким образом, что усиливают
транскрипцию специфических генов.
Большинство антигенов являются
тимусзависимыми и для активации
В-лимфоцитов требуют участия Т-хелперов.
Тимуснезависимыми антигенами являются,
как правило, полисахариды бактерий,
имеющие множество повторяющихся
одинаковых антигенных эпитопов, которые
перекрестно сшиваются с большим
количеством молекул мембранного IgМ
на поверхности одного В-лимфоцита, что
приводит к активации большого количества
тирозинкиназ внутри В-лимфоцита и
последующей его активации без участия
Т-хелперов.
Соседние файлы в папке immunka
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Антигенраспознающие рецепторы В-лимфоцитов представляют собой мономерные формы иммуноглобулина М, встроенные в плазматическую мембрану В-лимфоцита и окруженные специальными вспомогательными трансмембранными белками – Iga и Igb, которые принимают участие в передаче сигнала от IgМ, присоединившего антиген, внутрь клетки. Кроме того, эти белки необходимы для нормального выхода мембранной формы IgМ в плазматическую мембрану: в отсутствии этих белков молекулы мембранного IgМ остаются внутри клетки.
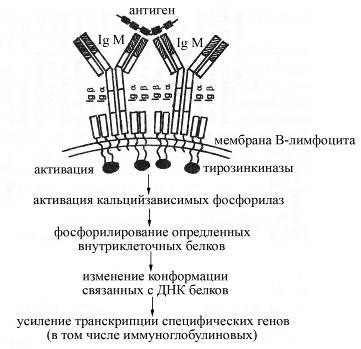
Рис. Схема строения антигенраспознающего рецептора В-лимфоцитов и механизма их активации после взаимодействия с антигеном. Антигенраспознающий рецептор В-лимфоцитов представлен мембранной формой IgМ, окруженного специальными вспомогательными белками – Igα и Igβ, принимающими участие в передачи сигнала от IgМ внутрь клетки
 Мембранная форма иммуноглобулина М отличается от секреторной не только тем, что является мономерной, но и некоторыми особенностями строения самого мономера IgМ: в его состав входит гидрофобный трансмембранный участок и короткий гидрофильный цитоплазматический хвост. В то же время мономерная молекула секреторной формы иммуноглобулина М имеет на С-конце углеводные остатки, увеличивающие растворимость молекулы, и цистеиновый остаток, необходимый для полимеризации мономеров в пентамерную форму с помощью J-цепи. Молекула мембранного иммуноглобулина М кодируется теми же рекомбинантными иммуноглобулиновыми локусами, что и секреторного иммуноглобулина (χ- или l-локусом, кодирующим легкую цепь, и локусом тяжелых цепей). Некоторые же отличия в строении С-конца тяжелых цепей секреторного и мембранного IgМ обусловлены особенностями считывания информации с генов локуса тяжелой цепи, лежащих за Сm-геном. В частности, за этим геном расположены короткие гены – Ск и Мк, кодирующие короткие аминокислотные последовательности дистальной части тяжелой цепи соответственно секреторного иммуноглобулина (ген Ск) и мембранного иммуноглобулина (ген Мк). При образовании секреторной формы IgМ, после считывания информации с Сm-гена транскрибируется только ген Ск, кодирующий концевой участок тяжелой цепи секреторной формы. При образовании тяжелых цепей мембранного IgМ транскрибируется более длинный участок генома за Сm-геном, включающий гены и Ск и Мк. Затем в результате процессинга участок мРНК, комплементарный Ск-гену, вырезается (подвергается делеции), а остальная часть длинной мРНК, кодирующей тяжелую цепь m-типа, путем сплайсинга сшивается с коротким фрагментом мРНК, комплементарным Мк-гену, в результате чего возникает зрелая мРНК, кодирующая мембранную форму IgМ. Таким образом, трансляция тяжелой цепи мембранного иммуноглобулина М представляет собой более сложный процесс, требующий больших энергозатрат, чем секреторной формы, поскольку предполагает считывание информации с более длинного участка генома и последующий процессинг и сплайсинг пре-мРНК, в связи с чем мембранной формы иммуноглобулина в В-лимфоцитах образуется гораздо меньше, чем секреторной. Синтез мембранной формы IgМ начинается на заключительных этапах дифференцировки В-лимфоцитов в красном костном мозге. Зрелые В-лимфоциты экспрессируют достаточно большое количество мембранного IgМ на своей поверхности: 2х105 молекул на клетку. Мембранная форма иммуноглобулина М на поверхности В-лимфоцитов может непосредственно взаимодействовать с любыми формами антигенов: как свободными корпускулярными (вирусами, бактериями) и молекулярными, так и связанными с рецепторами антигенпредставляющих клеток (моноцитов, макрофагов, дендритных клеток). Но в то же время молекулы мембранного IgМ сохраняют свою специфичность: молекулы каждого клона В-лимфоцитов проявляют сродство к строго определенным антигенным детерминантам, оставаясь равнодушными к другим.
Мембранная форма иммуноглобулина М отличается от секреторной не только тем, что является мономерной, но и некоторыми особенностями строения самого мономера IgМ: в его состав входит гидрофобный трансмембранный участок и короткий гидрофильный цитоплазматический хвост. В то же время мономерная молекула секреторной формы иммуноглобулина М имеет на С-конце углеводные остатки, увеличивающие растворимость молекулы, и цистеиновый остаток, необходимый для полимеризации мономеров в пентамерную форму с помощью J-цепи. Молекула мембранного иммуноглобулина М кодируется теми же рекомбинантными иммуноглобулиновыми локусами, что и секреторного иммуноглобулина (χ- или l-локусом, кодирующим легкую цепь, и локусом тяжелых цепей). Некоторые же отличия в строении С-конца тяжелых цепей секреторного и мембранного IgМ обусловлены особенностями считывания информации с генов локуса тяжелой цепи, лежащих за Сm-геном. В частности, за этим геном расположены короткие гены – Ск и Мк, кодирующие короткие аминокислотные последовательности дистальной части тяжелой цепи соответственно секреторного иммуноглобулина (ген Ск) и мембранного иммуноглобулина (ген Мк). При образовании секреторной формы IgМ, после считывания информации с Сm-гена транскрибируется только ген Ск, кодирующий концевой участок тяжелой цепи секреторной формы. При образовании тяжелых цепей мембранного IgМ транскрибируется более длинный участок генома за Сm-геном, включающий гены и Ск и Мк. Затем в результате процессинга участок мРНК, комплементарный Ск-гену, вырезается (подвергается делеции), а остальная часть длинной мРНК, кодирующей тяжелую цепь m-типа, путем сплайсинга сшивается с коротким фрагментом мРНК, комплементарным Мк-гену, в результате чего возникает зрелая мРНК, кодирующая мембранную форму IgМ. Таким образом, трансляция тяжелой цепи мембранного иммуноглобулина М представляет собой более сложный процесс, требующий больших энергозатрат, чем секреторной формы, поскольку предполагает считывание информации с более длинного участка генома и последующий процессинг и сплайсинг пре-мРНК, в связи с чем мембранной формы иммуноглобулина в В-лимфоцитах образуется гораздо меньше, чем секреторной. Синтез мембранной формы IgМ начинается на заключительных этапах дифференцировки В-лимфоцитов в красном костном мозге. Зрелые В-лимфоциты экспрессируют достаточно большое количество мембранного IgМ на своей поверхности: 2х105 молекул на клетку. Мембранная форма иммуноглобулина М на поверхности В-лимфоцитов может непосредственно взаимодействовать с любыми формами антигенов: как свободными корпускулярными (вирусами, бактериями) и молекулярными, так и связанными с рецепторами антигенпредставляющих клеток (моноцитов, макрофагов, дендритных клеток). Но в то же время молекулы мембранного IgМ сохраняют свою специфичность: молекулы каждого клона В-лимфоцитов проявляют сродство к строго определенным антигенным детерминантам, оставаясь равнодушными к другим.
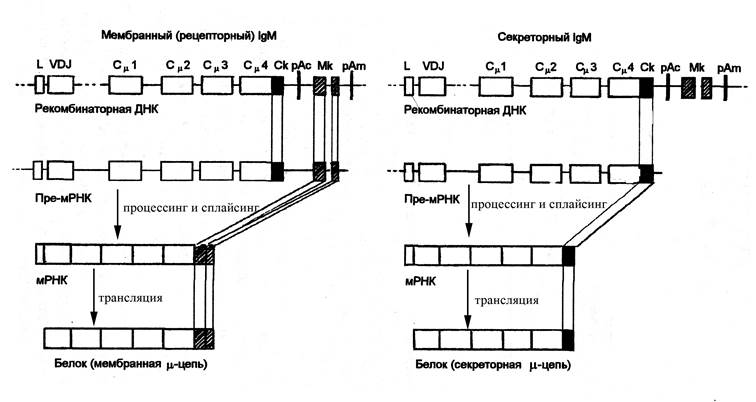
Рис. Схема генетического контроля синтеза мембранного и секреторного IgM. При образовании мембранной или секреторной форм IgM процесс реорганизации генома В-лимфоцита характеризуется следующими особенностями. Рекомбинантная ДНК содержит последовательность нуклеотидов от лидерного участка (L) до терминальной последовательности полиаденина (рАm – полиаденин мембранного пути развития) включительно. В реорганизованный локус ДНК входят экзон Ск (секреторный компонент) и два экзона Мк (мембранный компонент), один из которых контролирует трансмембранную последовательность, а второй – цитоплазматическую последовательность аминокислотных остатков рецепторного иммуноглобулина. В том случае, когда образующийся первичный транскрипт (пре-мРНК) включает экзоны Мк, синтезируется μ-цепь мембранного иммуноглобулина. При этом Ск и рАс (рАс – полиаденин секреторного пути реорганизации) подвергаются делеции при сплайсинге пре-мРНК. Если первичный транскрипт не включает последовательность Мк и рАm, но сохраняет Ск и рАс, то в результате последующих преобразований синтезируется μ-цепь секреторного иммуноглобулина
Взаимодействие мембранной формы IgМ В-лимфоцитов с определенным антигеном сопровождается активацией В-лимфоцитов, в результате которой В-лимфоциты превращаются в антителопродуцирующие клетки (плазматические клетки). Активация В-лимфоцита может происходить как самостоятельно после взаимодействия антигена с рецептором, так и зачастую с помощью цитокинов, продуцируемых активированными Т-хелперами. Вместе с тем сам по себе мембранный иммуноглобулин М после взаимодействия с антигеном активировать В-лимфоцит не может, поскольку имеет очень короткий цитоплазматический хвост, включающий всего несколько аминокислотных остатков, который не способен вступать в реакционные отношения с внутриклеточными ферментами и процессами. Для активации же В-лимфоцитов после присоединения к их антигенраспознающим рецепторам антигенов служат специальные вспомогательные низкомолекулярные белки – Iga и Igb, расположенные в непосредственной близости от мембранного IgМ в плазматической мембране В-лимфоцита и имеющие гораздо более длинные цитоплазматические концы. Эти белки после присоединения к мембранному IgМ антигенных эпитопов несколько изменяют свою конформацию, в результате чего становятся способными взаимодействовать с внутриклеточными тирозинкиназами, активируя их. Активированные тирозинкиназы, в свою очередь, активируют Са2+-зависимые фосфорилазы, катализирующие фосфорилирование определенных внутриклеточных белков. Образующиеся фосфорилированные белки влияют на конформацию связанных с ДНК белков таким образом, что усиливают транскрипцию специфических генов.
Большинство антигенов являются тимусзависимыми и для активации В-лимфоцитов требуют участия Т-хелперов. Тимуснезависимыми антигенами являются, как правило, полисахариды бактерий, имеющие множество повторяющихся одинаковых антигенных эпитопов, которые перекрестно сшиваются с большим количеством молекул мембранного IgМ на поверхности одного В-лимфоцита, что приводит к активации большого количества тирозинкиназ внутри В-лимфоцита и последующей его активации без участия Т-хелперов.
Источник