Антигенный рецептор лимфоцитов в

24.10.2015
Строение АГ-распознающего В-клеточного рецептора (BCR — В cell receptor) показано на рис. 4.2.
Ho строению BCR характеризуется как мономерный иммуноглобулин класса IgM, отличающийся от антител этого же класса, являющихся пентамерными молекулами IgM. Отличия мембранного и сывороточного IgM касаются также строения их тяжелых цепей (μ) в С-концевой части молекулы. В остальном эта молекулы не отличаются друг от друга. Единство специфичности и основной структуры молекул является основанием для утверждения о том, что антитела являются растворимой формой рецептора для антигена.
В связи с этим в данном разделе представлены основные сведения о строении мембранного иммуноглобулина В-лимфоцитов.

BCR состоит из двух тяжелых (H) и двух легких (L) цепей, соединенных дисульфидными связями. Мол. масса каждой из легких цепей составляет 22 кД, тяжелых цепей — 70 кД. Каждая из цепей построена из пространственно автономных гомологичных доменов. Тяжелые (4-цепи включают по 5 доменов, из них один вариабельный (Vн) и 4 константные (Сн). Домены нумеруют от N- к С-концу. В соответствии с этим домены тяжелых цепей обозначают как Vн (Vμ), Cн1 (Cμ1), Сн2 (Сμ2), Сн3 (Сμ3), Сн4 (Сμ4). В тяжелых цепях рецептора между доменом Сн4 и трансмембранной областью имеется связывающий участок, состоящий из 12 гидрофильных аминокислотных остатков.
С-концевая часть тяжелых цепей рецептора имеет гидрофобный участок, локализующийся в мембране (трансмембранная область рецептора), за которым следует участок рецептора, погруженный в цитоплазму В-лимфоцита. Этот участок называется цитоплазматическим. Трансмембранная часть BCR в-лимфоциты небольшая, состоит из 26 аминокислотных участков, его цитоплазматическая часть еще меньше — включает трипептид Lys-Val-Lys-COOH.
Легкие цепи BCR включают по 2 домена, один из них вариабельный (VL), другой константный (Cl). Обозначают последовательность доменов легких цепей как VL, СL. Домены цепей Vн, Cн и VL, CL формируют Fab-фрагмент рецептора, два Fab-фрагмента (по два каждого из указанных доменов (см. рис. 4.2)) образуют (Fab)2-фрагмент. Остальные домены двух тяжелых цепей рецептора (Сн2, Сн3, Сн4) входят в состав его Fc-фрагмента. Комбинирование высоковариабельных доменов Vн и VL в составе BCR формирует антигенраспознающую область рецептора, именуемую также активным центром. В соответствии со строением молекулы каждый рецептор содержит два активных центра. В отличие o r TCR, распознающего эпитопы фрагментированного антигена в комплексе с молекулами главного комплекса гистосовместимости классов I (ЦТЛ) или II (Th), BCR способен связывать эпитопы нативного антигена, фрагментация антигена и его ассоциация с молекулами главного комплекса гистосовместимости для связывания BCR не требуется.
Как отмечалось выше, зрелые В-лимфоциты экспрессируют на мембране IgM и IgD, наличие IgD на клеточной поверхности — показатель зрелости В-клетки. Эти иммуноглобулины характеризуются одной и той же антигенной специфичностью, имеют один и тот же тип легких цепей, однако мембранный IgD многих В-клеток характеризуется не формулой H2L2, a HL. Поскольку классы иммуноглобулинов различаются между собой по тяжелым цепям, то мембранные иммуноглобулины В-клеток (IgM и IgD) характеризуются двумя изотипами — μ и δ. В процессе иммунного ответа изотип мембранного Ig меняется. В результате взаимодействия лиганда CD40L (CD154) T-лимфоцита с молекулой CD40 В-клетки T-лимфоцитом продуцируются цитокины, под влиянием которых изменяется изотип мембранного IgM на IgG1 и IgE — под влиянием ИЛ-4, на IgG2 и IgG3 — под влиянием ИНФγ, на IgA и IgG2b — под влиянием ТФРβ.
Легкие цепи рецептора, как и иммуноглобулинов других классов, известны, как отмечалось выше, в виде двух изотипов — к или λ. Соотношение к- и λ-цепей у разных животных разное: у грызунов (мыши, крысы) численность В-клеток с к- и λ-цепями BCR составляет >95 и <5%, у KPC и лошадей — 5 и 95%, у приматов (обезьяны Резус, Бабуины) — 50 и 50%, у человека — 70 и 30%, у плотоядных (кошки, собаки) — 10 и 90% соответственно.
Участки рецептора, располагающиеся над клеточной мембраной, называют внеклеточными участками. Таким образом, BCR, как и многие другие молекулярные структуры клеточной поверхности, имеет в целом три части — внеклеточную, трансмембраннуто и цитоплазматическую. Короткая цитоплазматическая часть BCR (три аминокислотных остатка) не может служить проводником внутриклеточного сигнала, индуцируемого взаимодействием BCR-антиген, поскольку не способна формировать молекулярные структуры, необходимые для взаимодействия с внутриклеточными белками. Эту функцию выполняют полипептидные цепи Igα (CD79a) и Igβ (CD79b), имеющие по одному внеклеточному домену и длинный цитоплазматический хвост. Антигены 79а и 79b имеют мол. массу 47 и 37 кД, соответственно, характеризуются как гликопротеины, относятся к суперсемейству иммуноглобулинов, экспрессируются на поверхности В-лимфоцитов на стадии пре-В одновременно с образованием комплекса μ-цепи и суррогатных легких цепей, т.е. на стадии образования пре-BCR. Домены этих цепей (Igα и Igβ) прочно соединены с тяжелыми цепями рецептора нековалентной связью. Цитоплазматическая часть цепей Igα и Igβ, подобно таковой цепей TCR (цепи ζ, антиген CD3), имеет характерные домены ITAM (Immunoreceptor tyrosine-based activation motif), именуемые тирозинсодержащими активационными последовательностями аминокислот в иммунорецепторах. Начальным этапом проведения активационного сигнала внутрь клетки, индуцированного конформационными изменениями рецептора в результате его взаимодействия с антигеном, является фосфорилирование молекул ITAM протеинтирозинкиназами цитозоля.
Для активации В-лимфоцита существенно-значимой является экспрессия на его мембране корецепторных молекул с сигнальной функцией, включающих CD19, CD21 (рецептор CR2 для компонентов комплемента iC3b, C3d и C3dg) и молекулу TAPA-1 (Target of antiproliferative antibody). Молекула TAPA-1 (CD81) имеет 4 трансмембранных участка, ассоциирована с рецептором, однако функции ее не изучены. Предполагается возможность ее участия во взаимодействии В-клетки с Т-лимфоцитом. Антиген CD 19 определяется на В-клетках на стадии про-В, антиген CD20 — на стадии пре-В, антиген CD21 — на стадии незрелых В-лимфоцитов.
АГ-распознающие рецепторы В-лимфоцитов метят меченными флуорохромом антителами к иммуноглобулинам. С помощью меченых рецепторов показано, что мембрана В-лимфоцита находится в динамическом состоянии, поддерживаемом активным метаболизмом клетки. За 3-6 ч. инкубирования клетки при 37°, но не при 4°С, в среду освобождается 30±5% рецепторов клеточной поверхности, полностью смена иммуноглобулинов на мембране происходит за 8-20 ч. В реакции иммунофлуоресценции установлено, что окрашенные рецепторы располагаются на клеточной мембране диффузно. Затем происходит их перераспределение, в ходе которого диффузное свечение сменяется свечением в форме округлых пятен или пояса. Через 2 мин. свечение локализуется в виде «шапочки» или «колпачка» на одном из полюсов клетки, обычно над областью аппарата Гольджи. Через 5 мин, инкубирования «шапочка» поглощается клеткой путем пиноцитоза, который завершается за 2 ч. Однако повторное окрашивание клетки сопровождается свечением лишь через 8-20 ч., в течение которых иммуноглобулины вновь появляются на клеточной поверхности. За этот период времени пиноцитированные иммуноглобулины подвергаются внутриклеточной деградации. Аналогичные процессы развиваются при взаимодействии рецептор-антиген, являются основой АГ-представляющей функции В-клеток.
- Этапы дифференцировки В-лимфоцитов в костном мозгу
- В-лимфоциты
- Т-клетки памяти (TM)
- Т-Дифференцирующие лимфоциты (Td)
- Т-регуляторные клетки (TReg)
- Т-хелперы (TH)
- Регуляторные Т-лимфоциты
- Цитотоксические Т-лимфоциты (Т-киллеры)
- γδТ-лимфоциты
- αβТ-лимфоциты
Источник
Распознавание чужеродных агентов компонентами врожденных механизмов резистентности происходит за счет рецепторов шаблонного распознавания, которые специфичны к наиболее типичным микробным структурам, а также рецепторов к опсонинам — молекулам, «приспосабливающими относительно бедный репертуар рецепторов врожденной резистентности к антигенному разнообразию возбудителей. В связи с существенным ограничением рецепторного ресурса врожденные механизмы резистентности однотипно реагируют на разные патогены даже если последние существенно отличаются между собой. Так, например, защитные механизмы против Е. coli и S. typhi, несмотря на существенные различия между этими микроорганизмами, в целом подобны. Наиболее адекватная защита возможна только после распознавания всех антигенных детерминант, которые содержит возбудитель, что позволяет определить оптимальную силу и направленность иммунного ответа относительно данною патогена. Такое высокоспецифическое распознавание осуществляют рецепторы лимфоцитов.
Рекомбинация генетического материала
Процесс формирования рецепторов антигенного распознавания лимфоцитов является проявлением комбинационной изменчивости. При этом нуклеотидные последовательности не формируются de novo, а происходит перегруппировка уже имеющихся фрагментов ДНК. Это явление получило название рекомбинации генетического материала, или реаранжировки генов. Правда, к комбинационным механизмам приобщаются процессы, подобные мутационным изменениям. Речь идет о случайных терминальных последовательностях, которые образуют два Р-фрагмента, и встроенных нуклеотидах, формирующих N-участок. Поэтому новообразованный V-ген не является простой суммой составляющих сегментов.
К собственно механизмам комбинаторики относятся:
- Случайный выбор одной гомологической хромосомы из пары для рекомбинации сегментов V-гена.
- Случайный выбор одного сегмента из каждой группы (V, D, J).
- Случайный выбор рамки считывания участка D-сегментов; установлена возможность по крайней мере трех рамок считывания такого участка, причем в каждом случае полностью изменяется содержание всех сегментов группы (особенность триплетного кода).
- Случайное объединение субъединиц антигенраспознающего рецептора (тяжелой 31 легкой цепей В-лимфоцитов или α- и β-цепей Т-клеток), для любого из которых выполняются первые три механизма комбинаторики.
Следует отметить, что в организме существует много В-лимфоцитов с идентичными тяжелыми целями и Т-клеток с одинаковыми β-цепями. Они являются результатом пролиферации незрелых лимфоцитов с удачными «пробными» рецепторами антигенного распознавания. Тем не менее в иммунной системе каждый лимфоцит обеспечен уникальным антигенраспознающим рецептором, поскольку для его образования нужен другой компонент (соответственно — легкая цепь и α-цепь), который также сформирован случайно. Объединение двух частей рецептора создает комплекс уникальной специфичности.
За счет таких процессов организм приобретает возможность продуцировать огромное количество рецепторов антигенного распознавания, а значит — способен распознать практически любой существующий в природе антиген. Поскольку антигенсвязывающие сайты сгенерированы наугад, они не предназначены для распознавания какого-либо конкретного возбудителя. Более того, большинство из сформированных рецепторов организм никогда не использует, поскольку на протяжении существования к нему не поступают соответствующие по структуре антигены. Тем не менее большое разнообразие антигенраспознающих рецепторов обеспечивает готовность макроорганизма практически к любой антигенной агрессии, что, без сомнения, существенно повышает его шансы на выживание, поскольку поступление патогенов также является до определенной степени случайным явлением.
Рецепторы антигенного распознавания лимфоцитов состоят из двух главных частей — константной (неизменной) и вариабельной, которая является специфической к определенному антигену. Последняя уникальна у каждой клетки. Рекомбинацию претерпевают именно те гены, которые кодируют вариабельные участки рецепторов. Последние формируют антиген связывающие сайты, взаимодействующие непосредственно с эпитопами патогена.
см. Гуморальный иммунитет#Рецепторы В-лимфоцитов
Строение антител
Каркасная зона антител
Несмотря на то, что антитела различаются между собой именно по структуре вариабельного фрагмента, большая часть этого участка идентична у всех иммуноглобулинов. Речь идет о каркасной зоне. Дело в том, что все сегменты V-гена, которые входят в состав одной группы (V, D или J), содержат одинаковые последовательности нуклеотидов, которые и определяют их групповую принадлежность. При трансляции стабильных групповых последовательностей V-гена и формируется каркасная зона вариабельного участка иммуноглобулина. Материал с сайта https://wiki-med.com
Гипервариабельные участки антител
Вместе с тем каждый сегмент группы содержит специфические последовательности нуклеотидов, которые определяют его уникальность. Такие последовательности и обеспечивают формирование изменчивых участков. Поскольку весь фрагмент называется вариабельным, эти участки получили название гипервариабельных (CDR). Всего их 3 — столько же, сколько и составляющих компонентов V-гена. Поэтому каркас делится гипервариабельными участками на 4 фрагмента. Каркасная зона и гипервариабельные образования имеют разное биологическое значение. Именно каркасная часть обеспечивает формирование гидрофильного канала, который находится между вариабельными участками тяжелой и легкой цепей антитела. Образованный канал работает относительно антигенных детерминант патогена подобно капкану и является одинаковым у всех иммуноглобулинов, то есть все антитела имеют общий принцип взаимодействия с патогеном. В этом и состоит биологическое значение каркасных зон. Специфичность связывания антитела (тип распознаваемого антигена) определяется гипервариабельными участками. Поскольку они сформированы случайным образом, каждая В-клетка обеспечена антигенраcпознающим рецептором уникальной специфичности.
Рецепторы Т-лимфоцитов
см. Клеточный иммунитет#Рецепторы Т-лимфоцитов
На этой странице материал по темам:
лимфоциты по налиию рецепторов
реаранжировка генов в лимфоцитов
основные рецепторы в-лимфоцитов
рецепторы т лимфоцитов кратко
механизм возбуждения т рецепторов лимфоцитов
Источник
Оглавление темы “Селезенка. Лимфатические узлы. Стадии иммунного ответа. Формы иммунного ответа. Воспаление. Механизмы, контролирующие иммунную систему.”:
1. Селезенка. Функции селезенки. Лимфатические узлы. Функции лимфатических узлов.
2. Мукозно-ассоциированная лимфоидная ткань. Лимфоидная ткань слизистых оболочек.
3. Стадии иммунного ответа. Формы иммунного ответа. Воспаление. Ранний защитный воспалительный ответ.
4. Представление антигена. Распознавание антигена. Взаимодействие Т-хелперов ( Тh1 ) с антигенпредставляющими клетками.
5. Активация Т- и В-лимфоцитов в иммунном ответе. Активация лимфоцитов. Формы специфического иммунного ответа.
6. Клеточный иммунный ответ. Гуморальный иммунный ответ. Защитные функции иммуноглобулинов ( антител ).
7. Иммуноглобулин G ( IgG ). Иммуноглобулин М ( IgM ). Функции иммуноглобулинов G и М.
8. Иммуноглобулин A ( IgA ). иммуноглобулин Е ( IgE ). Функции иммуноглобулинов А и Е.
9. Формы специфического иммунного ответа. Иммунологическая память как вид имунного ответа.
10. Иммунологическая толерантность. Механизмы, контролирующие иммунную систему. Гормональный контроль имумнной системы.
11. Цитокиновый контроль имунной системы. Местное действие цитокинов. Механизм действия цитокинов на иммунитет.
Представление антигена. Распознавание антигена. Взаимодействие Т-хелперов ( Тh1 ) с антигенпредставляющими клетками.
В случае неэффективности раннего защитного ответа и факторов врожденного иммунитета в организме накапливаются микроорганизмы, содержащие чужеродные антигены. Контакт этих антигенов с клетками иммунной системы приводит к развитию специфического иммунного ответа, который начинается с этапа представления и распознавания антигена.
Растворимые антигены в нативной форме связываются антителами и антигенраспознающими иммуноглобулиновыми рецепторами В-клеток.
Т-лимфоциты своими антигенраспознающими Т-клеточными рецепторами связывают короткие пептидные фрагменты белковых антигенов в комплексах с собственными молекулами главного комплекса гистосовместимости I или II классов на мембранах антигенпредставляющих клеток.
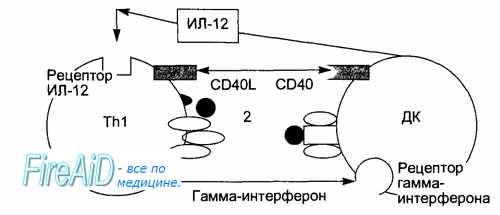
Рис. 8.8. Взаимодействие Т-хелперов (Тh1) с антигенпредставляющими дендритными клетками (ДК) опосредовано цитокинами (ИЛ-12, гамма-интерферон) и кости-мулирующими молекулами (CD40, CD40L).
В центре «иммунологического синапса» находятся: Т-клеточный антиген распознающий рецептор (1) и распознаваемый им комплекс антигенного пептида с молекулой главного комплекса гистосовместимости (2).
Молекулы главного комплекса гистосовместимости на поверхности лейкоцитов человека, получили название «человеческие лейкоцитарные антигены» (Human Leukocyte Antigens — HLA). Молекулы главного комплекса гистосовместимости I класса присутствуют на поверхности всех типов клеток, кроме эритроцитов и клеток трофобласта. Молекулы главного комплекса гистосовместимости II класса находятся на поверхности антигенпредставляющих клеток: дендритных клеток, макрофагов, В-лимфоцитов.
Антигенпредставляющие клетки играют важную роль на начальном (пусковом) этапе специфического иммунного ответа:
1) макрофаги, как правило, представляют антигены бактериального происхождения — продукты захвата и внутриклеточной переработки ими бактерий,
2) В-лимфоциты представляют микробные антигены, антигены токсинов, связанные их поверхностными иммуноглобулиновыми рецепторами,
3) наиболее универсальными антигенпредставляющими клетками являются дендритные клетки, которые необходимы для запуска первичного иммунного ответа, представляют многие, в том числе опухолевые, антигены.
После захвата чужеродного белка — антигена этими клетками и его разложения до коротких пептидов внутри клеток происходит комплексирова-ние отдельных молекул главного комплекса гистосовместимости с конкретными пептидами. Такие комплексы транспортируются на поверхность антигенпредставляющих клеток (рис. 8.8).
При встрече антигенпредставляющей клетки с Т-лимфоцитом, несущим на своей поверхности подходящий по структуре антигенраспознающий рецептор, замыкается лиганд-рецепторная связь, т. е. происходит распознавание антигена.
CD4+ T-лимфоциты способны распознавать антигенные пептиды в комплексах с собственными молекулами главного комплекса гистосовместимости II класса, a CD8+ Т-лимфоциты — в комплексах с собственными молекулами главного комплекса гистосовместимости I класса. Связывание антигена Т-клеточным рецептором служит сигналом усиления пролиферации данного Т-лимфоцита с последующей ускоренной дифференцировкой и активацией его клеток-потомков. В результате формируется клон Т-лим-фоцитов, способных при встрече с тем же антигеном быстро активироваться для участия в удалении патогенного агента.
– Также рекомендуем “Активация Т- и В-лимфоцитов в иммунном ответе. Активация лимфоцитов. Формы специфического иммунного ответа.”
Источник